Характеристика крипт слизистой оболочки толстой кишки при воспалительных заболеваниях кишечника
Автор: Ахриева Х. М., Тертычный А. С., Пачуашвили Н. В., Урусова Л. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 3 т.14, 2024 года.
Бесплатный доступ
Цель: охарактеризовать изменения крипт слизистой оболочки толстой кишки при колитах и оценить их значение в морфологической диагностике колитов при воспалительных заболеваниях кишечника (ВЗК).
Хронический колит, воспалительные заболевания кишечника, взк, морфологическая, диагностика
Короткий адрес: https://sciup.org/143183291
IDR: 143183291 | УДК: 616.341-091.8:616.37-002 | DOI: 10.20340/vmi-rvz.2024.3.MORPH.4
Текст научной статьи Характеристика крипт слизистой оболочки толстой кишки при воспалительных заболеваниях кишечника
К воспалительным заболеваниям кишечника (ВЗК) традиционно относят язвенный колит (ЯК) и болезнь Крона (БК). Эти заболевания с неустановленной этиологией характеризуются хроническими воспалительными изменениями в толстой кишке. При ВЗК в слизистой оболочке толстой кишки, помимо большого количества воспалительных клеток, обнаруживаются крипты с характеристиками, отличными от нормальных [1, 2]. Мы провели анализ таких структурных нарушений с описанием спектра возможных вариантов крипт и частотой их обнаружения в биоптатах у пациентов с ЯК, БК и при других вариантах колитов.
Крипты представляют собой прямые трубчатые структуры, которые лежат абсолютно параллельно друг другу и имеют длину около 0,5 мм. Они не разветвлены и простираются от просвета до мышечной пластинки слизистой оболочки. Однако такая картина может претерпевать изменения в переходных зонах и в участках, получивших название «безымянные канавки», в которых крипты в норме демонстрируют разветвления, напоминающие рисунок клеверного листа. Эпителиальная выстилка представлена цилиндрическим эпителием и содержит большое количество энтероцитов и бокаловидных клеток, а также небольшое количество эндокринных клеток. Клетки Панета могут обнаруживаться в основании крипт в норме в правых отделах ободочной кишки [3].
Визуализация нормального рисунка поверхности слизистой оболочки толстой кишки стала на сегодняшний день более доступной благодаря использованию хромоэндоскопии с высоким разрешением. Оценка структуры крипт также доступна с помощью метода конфокальной лазерной сканирующей эндомикроскопии [4]. Всё это позволяет проводить более детальную характеристику слизистой оболочки у пациентов с ВЗК и способствует раннему обнаружению неопластических и предопухолевых поражений во время выполнения колоноскопии. В случае колита характеристики крипт меняются, и эти изменения нарастают со временем при хронизации воспалительного процесса, что наблюдается при ВЗК.
Цель исследования: охарактеризовать изменения крипт слизистой оболочки толстой кишки при колитах и оценить их значение в морфологической диагностике колитов при воспалительных заболеваниях кишечника.
Материалы и методы
На материале биопсий толстой кишки была проведена оценка морфологических характеристик крипт в колонобиоптатах. Для этого мы отобрали и ретроспективно пересмотрели колонобиоптаты у пациентов с ВЗК (30 пациентов с язвенным колитом (ЯК) и 30 с болезнью Крона (БК)) и у 30 пациентов, у которых диагноз ВЗК не был подтверждён (т.н. са- моограничивающиеся колиты, не относящиеся к ВЗК (не-ВЗК)), и которые самостоятельно или под влиянием терапии разрешились в течение ближайших нескольких недель. В зарубежной литературе такие формы колита получили название «самоогра-ничивающиеся» (self-limited). Считается, что большинство этих случаев имеет инфекционную природу.
Возраст пациентов варьировал от 19 до 53 лет. Во всех случаях диагноз был установлен на основании комплекса клинико-лабораторных и инструментальных методов диагностики. У всех пациентов при проведении колоноскопии были получены множественные биоптаты.
Критериями исключения из исследования явились пациенты с ВЗК в стадии ремиссии и пациенты с неклассифицированным колитом.
Обработка материала биопсий проводилась по общепринятой методике. Гистологические срезы толщиной 3–5 мкм были окрашены гематоксилином и эозином. Все случаи были отсканированы с помощью сканера гистологических препаратов Aperio TC («Leica», Германия») и заново пересмотрены с акцентом на изменения крипт.
Статистическая обработка данных проводилась с использованием программы SPSS 26. Проверка распределения на нормальность проводилась с использованием теста Шапиро – Уилка. Для сравнения номинальных переменных в двух несвязанных совокупностях использовался критерий Хи-квадрат, а при наличии ограничений для его использования – точный критерий Фишера. Критический уровень статистической значимости был принят равным 0,05.
Результаты исследования
У пациентов с ВЗК в эндоскопических биоптатах толстой кишки, помимо повышенного количества клеток воспалительного инфильтрата, обнаруживаются изменения крипт. Хорошо известно, что основополагающими показателями колита являются структурные характеристики слизистой оболочки и выраженность хронического воспаления. Ранее мы уже провели исследование, которое позволило выделить и дать уточнения по параметрам структурных нарушений, что было определено как стадия колита [5].
Изменения крипт практически во всех исследованных колонобиоптатах сопровождались их инфильтрацией сегментоядерными лейкоцитами (рис. 1 и 2). Криптит диагностировали по наличию хотя бы одного нейтрофила в эпителии крипт. Крипт-абсцесс определяли по наличию нейтрофилов в просвете крипт. По мнению большинства экспертов, одного нейтрофила достаточно для определения криптита, хотя в некоторых публикациях указывается, что их должно быть более одного. По крайней мере один нейтрофил должен быть явно интраэпителиальным. Точно также не существует универ- сального критерия по минимальному количеству нейтрофилов в крипт-абсцессе [6]. Определения крипт-абсцесса могут относиться как к скоплению, так и цепочке нейтрофилов. Общие определения «абсцесса» обычно требуют более одного нейтрофила. При пересмотре гистологических препаратов во всех случаях было обнаружено минимум два и более нейтрофила (рис. 3). По умолчанию термины «криптит» и «крипт-абсцесс» без дополнительных уточнений относились к нейтрофильному криптиту и нейтрофильному крипт-абсцессу соответственно. Криптит или крипт-абсцесс, помимо нейтрофилов, могли включать и другие типы воспалительных клеток.
Криптит был обнаружен в подавляющем большинстве изучаемых случаев колита. Крипт-абсцессы были обнаружены в 70% случаев при ЯК, в 60% случаев БК и в 66,7% случаев не-ВЗК колитов.
Атрофия крипт – это уменьшение доли общей площади слизистой оболочки толстой кишки, которую занимают крипты. Атрофию крипт диагностировали по увеличению расстояния между криптами, в результате чего расстояние между криптами превышало один диаметр крипт, и/или по увеличению расстояния между мышечной пластинкой слизистой оболочки и криптами в хорошо ориентированных срезах (рис. 2). Атрофия крипт была обнаружена в 40% случаев колита при ВЗК и в 53,5% случаев при колитах, не связанных с ВЗК. Хотя атрофия крипт включала в себя укорочение крипт и увеличение расстояния между ними, оценка этих особенностей является субъективной. При воспалительном заболевании кишечника атрофия крипт обычно сопровождалась их структурными изменениями.
Деформация крипт в слизистой оболочке толстой кишки характеризовалась потерей параллельной архитектуры крипт, увеличением их ветвления и/или изменением размера и формы крипт (рис. 3–7). Предложения по пороговым значениям для определения деформации крипт включали следующие критерии: минимум 10% крипт, демонстрирующих потерю параллельной архитектуры крипт, увеличение разветвления крипт и/или изменение размера и формы крипт. Деформация крипт в слизистой оболочке толстой кишки также определялась при наличии более двух разветвлённых крипт в правильно ориентированной слизистой оболочке [7]. Стоит отметить несколько исключений. Слизистая оболочка на расстоянии до трёх крипт от лимфоидного скопления ненадежна для оценки архитектуры, поскольку элементы лимфоидной ткани могут деформировать соседние железистые структуры. В норме слизистая оболочка прямой или слепой кишки может иметь незначительную степень деформации или укорочения крипт (рис. 8). Поэтому одиночные ветвящиеся крипты можно считать нормальной находкой в слизистой оболочке толстой кишки.
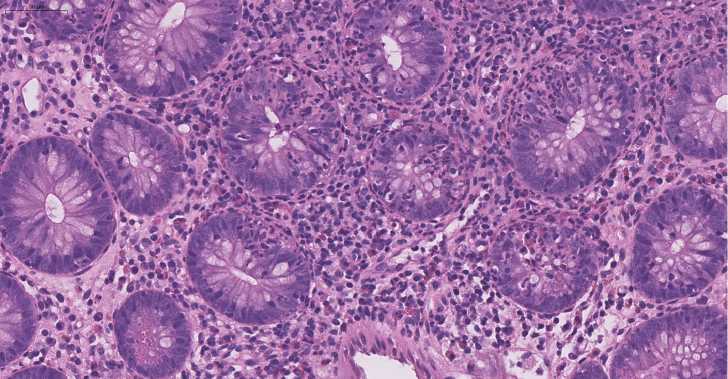
Рисунок 1. Колит не-ВЗК (инфекционный колит). Очаговый криптит. Инфильтрация сегментоядерными нейтрофильными лейкоцитами эпителия крипт. Окраска гематоксилином и эозином, ув. x250
Figure 1. Non-IBD colitis (infectious colitis). Focal cryptitis. Infiltration by segmented neutrophilic leukocytes of the crypt epithelium. Staining with hematoxylin and eosin, х250
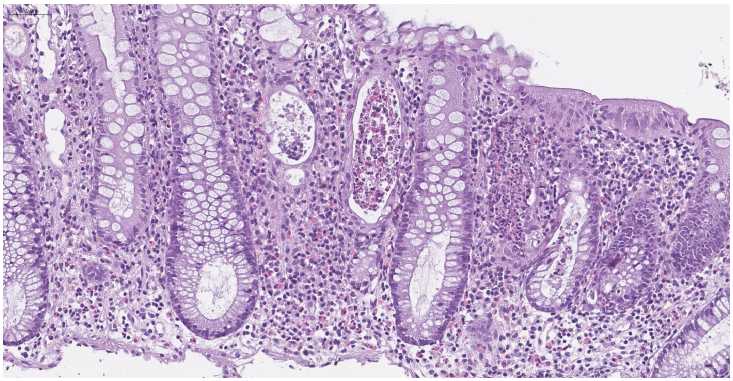
Рисунок 2. Колит не-ВЗК (лекарственный колит). Очаговая атрофия крипт и формирование крипт-абсцессов. В просвете атрофичных крипт обнаруживаются скопления сегментоядерных нейтрофильных лейкоцитов, эозинофилов и некротического детрита. Окраска гематоксилином и эозином, ув. х150
Figure 2. Non-IBD colitis (drug-induced colitis). Focal atrophy of crypts and the formation of crypt abscesses. Clusters of segmented neutrophilic leukocytes, eosinophils and necrotic detritus are found in the lumen of atrophic crypts. Staining with hematoxylin and eosin, x150
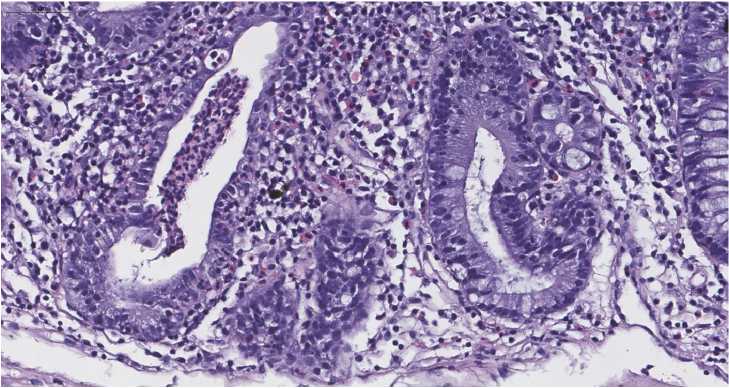
Рисунок 3 . Болезнь Крона. Повреждённые крипты толстой кишки неправильной формы. Одна из крипт содержит в просвете скопление лейкоцитов - крипт-абсцесс. Окраска гематоксилином и эозином, ув. х250
Figure 3. Crohn's disease. Damaged crypts of the large intestine of irregular shape. One of the crypts contains a cluster of leukocytes in the lumen - a crypt abscess. Staining with hematoxylin and eosin, x250
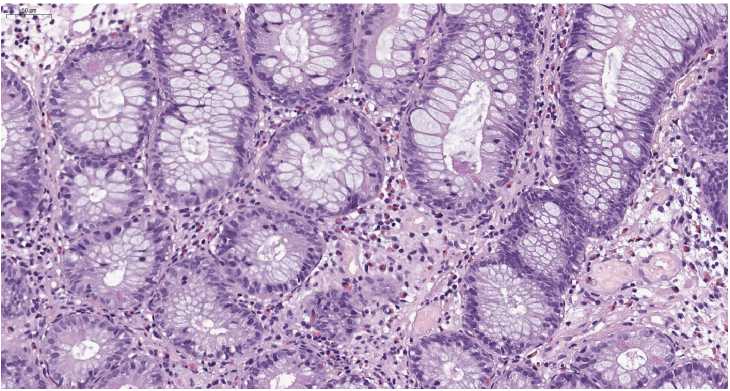
Рисунок 4. Колит не-ВЗК (инфекционный колит). Деформированные крипты, формирующие перетяжки («гусеничные» крипты).
Окраска гематоксилином и эозином, ув. х250
Figure 4. Non-IBD colitis (infectious colitis). Deformed crypts forming constrictions. Staining with hematoxylin and eosin, х250
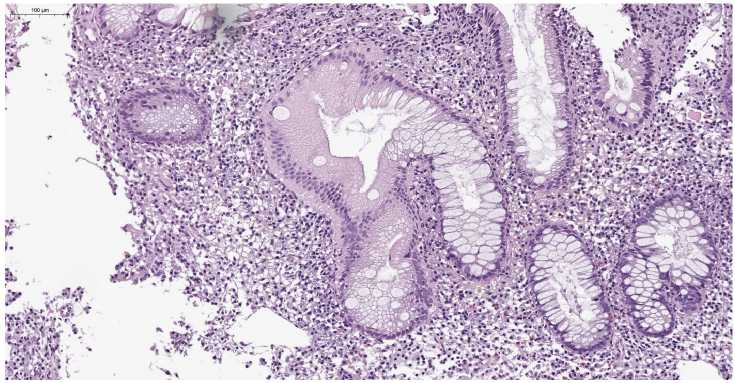
Рисунок 5. Болезнь Крона. Обнаружение деформированных крипт с высоким содержанием бокаловидных клеток. Одна из крипт имеет причудливую форму с клетками с вакуолизированной цитоплазмой и многорядным расположением ядер. Окраска гематоксилином и эозином, ув. х250
Figure 5. Crohn's disease. Detection of deformed cells with a high content of goblet cells. One of the crypts has a bizarre shape with cells with vacuolized cytoplasm and a multi-row arrangement of nuclei. Staining with hematoxylin and eosin, х250
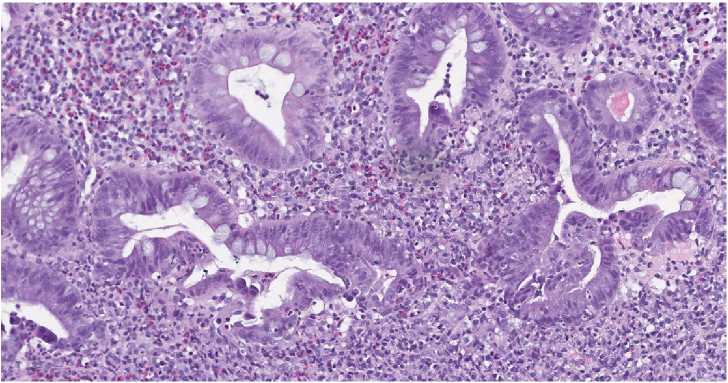
Рисунок 6. Язвенный колит. Повреждённые разветвлённые крипты толстой кишки с воспалительно-деструктивными изменениями. Инфильтрация эпителия полиморфно-ядерными лейкоцитами с очаговым разрушением эпителия на отдельных участках. Окраска гематоксилином и эозином, ув. х250
Figure 6. Ulcerative colitis. Damaged branched crypts of the colon with inflammatory and destructive changes. Infiltration of the epithelium by polymorphonuclear leukocytes with focal destruction of the epithelium in certain areas. Staining with hematoxylin and eosin, х250
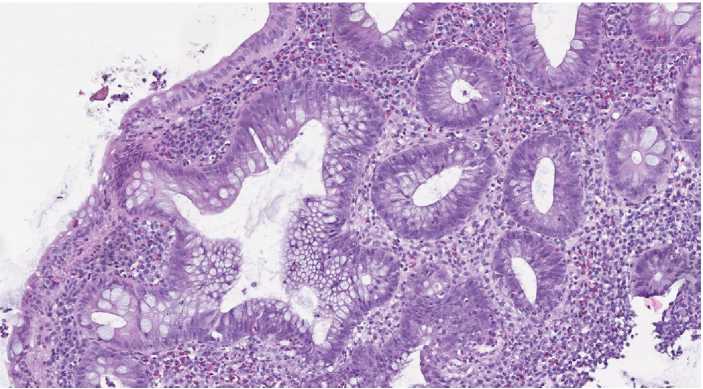
Рисунок 7. Язвенный колит. Повреждённая разветвлённая крипта толстой кишки причудливой формы с наличием регенерирующих крипт, выстланных гиперхромным эпителием. Окраска гематоксилином и эозином, ув. ×250
Figure 7. Ulcerative colitis. A damaged branched crypt of the colon of a bizarre shape with the presence of regenerating crypts lined with hyperchromic epithelium. Staining with hematoxylin and eosin, ×250
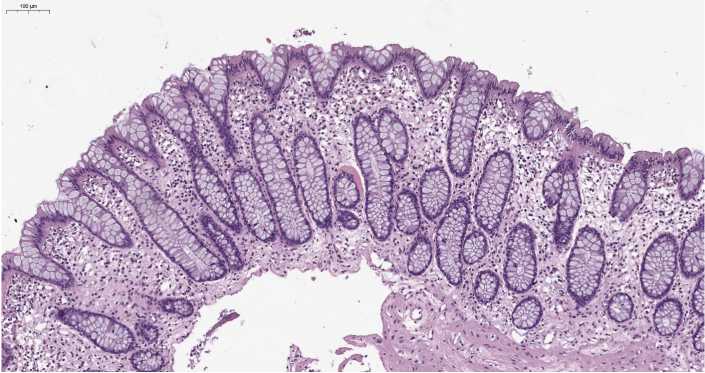
Рисунок 8. Норма. Слизистая оболочка толстой кишки. Окраска гематоксилином и эозином, ув. ×150
Figure 8. Normal colonic mucosa. The mucous membrane of the colon. Staining with hematoxylin and eosin, x1 50
Ворсинчатая/неровная поверхность слизистой оболочки толстой кишки представляла собой неровную волнистую поверхность из-за широких устьев крипт, которые создают впечатление ворсинчатых выпячиваний. Не существует единого определения неровности поверхности (или аналогичных терминов – псевдоворсинчатая поверхность, ворсинчатая поверхность, ворсинчатая слизистая оболочка). Впечатление от ворсинчатой поверхности частично являлось результатом расширения просвета и формы крипт в поверхностных отделах (рис. 4) [8].
В ходе настоящего исследования, в зависимости от отражаемых общепатологических процессов, были выделены следующие варианты крипт, обнаруживаемые при колите: воспалительнодеструктивные, гиперпластические, атрофические, дисрегенераторные и диспластические. Данное деление является условным, так как в ходе развития колита в отдельно взятой крипте эти процессы могут сочетаться. В связи с этим в каждом отдельном случае был определён спектр обнаруженных изменений крипт (табл. 1). Однако можно с уверенно- стью утверждать, что дистрофические и деструктивные изменения в большей степени характерны для острых инфекционных колитов, а дисрегенератор-ные процессы – для ВЗК.
Особое внимание было уделено структурным изменениям крипт, которые в научной литературе получили общее название «поврежденные крипты». Данные изменения характеризовались появлением крипт с почкующимися, ветвящимися, гусеничными и змеевидными формами крипт (табл. 2).
В свою очередь мы также проанализировали изменения в эпителии крипт и смогли классифицировать их на основе преобладающих патологических процессов. В результате были выделены следующие группы изменений: дистрофические, атрофические, регенераторные, метапластические и диспластиче-ские. Важно отметить, что обнаружение метапластических и диспластических изменений должно вызывать настороженность в связи с высокой вероятностью развития колоректальной карциномы у пациентов с ВЗК.
Таблица 1. Характеристика крипт у пациентов с ВЗК
Table 1. Crypt characteristics in patients with inflammatory bowel disease
|
Характеристики крипт |
ЯК (n = 30) |
БК (n = 30) |
не-ВЗК |
(n = 30) |
р |
|||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|||
|
Воспалительнодеструктивные изменения, в т.ч. |
Криптит |
30 |
100,0 |
27 |
90,0 |
25 |
83,3 |
р = 0,09 |
|
Крипт-абсцессы |
21 |
70,0 |
18 |
60,0 |
20 |
66,7 |
р = 0,788 |
|
|
Разрушение крипт |
20 |
66,7 |
15 |
50,0 |
18 |
60,0 |
р = 0,458 |
|
|
Гиперплазия крипт |
11 |
36,7 |
10 |
33,3 |
5 |
16,7 |
р = 0,204 |
|
|
Атрофия крипт |
12 |
40,0 |
6 |
20,0 |
16 |
53,3 |
р = 0,03* |
|
|
Дисрегенераторные изменения крипт |
27 |
90,0 |
19 |
63,3 |
4 |
13,3 |
р < 0,001* |
|
|
Дисплазия |
3 |
10,0 |
1 |
3,3 |
0 |
0 |
р = 0,318 |
|
Примечание: * – различия показателей статистически значимы (p < 0,05).
Таблица 2. Варианты дисрегенераторных изменений крипт и характеристики эпителия крипт у пациентов с ВЗК
Table 2. Variants of dysregenerative crypt changes and epithelial crypt characteristics in patients with inflammatory bowel disease
|
Характеристики |
ЯК (n = |
30) |
БК (n = 30) |
р |
||
|
Абс. |
% |
Абс. |
% |
|||
|
Варианты |
Почкующиеся (неправильно делящиеся) |
25 |
83,3 |
18 |
60,0 |
р = 0,084 |
|
дисрегенераторных |
Ветвящиеся (разветвленные) |
10 |
33,3 |
6 |
20,0 |
р = 0,382 |
|
крипт |
«Гусеничные» |
8 |
26,7 |
7 |
23,3 |
р = 0,998 |
|
«Змеевидные» |
0 |
0 |
8 |
26,7 |
р = 0,002* |
|
|
Варианты |
Дистрофические |
27 |
90,0 |
23 |
76,7 |
р = 0,166 |
|
изменений |
Атрофические |
13 |
43,3 |
7 |
23,3 |
р = 0,171 |
|
эпителия крипт |
Регенерирующий |
27 |
90,0 |
15 |
50,0 |
р = 0,001* |
|
Гиперкриния |
0 |
0 |
18 |
60,0 |
р < 0,001* |
|
|
Панетовская метаплазия |
17 |
56,7 |
10 |
33,3 |
р = 0,119 |
|
|
Дисплазия |
3 |
10,0 |
1 |
3,3 |
р = 0,301 |
|
Примечание: * – различия показателей статистически значимы (p < 0,05).
Обсуждение
В норме крипты расположены параллельно друг другу и простираются от поверхности слизистой оболочки до подлежащей мышечной пластинки слизистой оболочки (расположение в виде «пробирки в штативе»). Оценка архитектурных особенностей крипт, основанная на пространственном распределении, требует биоптата адекватного размера с оптимальной ориентацией, который в идеале также включает мышечную пластинку слизистой оболочки [3, 5].
В раннем детском возрасте возможно появление новых крипт, которое реализуется путём симметричного деления предсуществующих крипт. Образование новых крипт начинается с появления расщелины у их основания; это расщепление продвигается вверх, пока, в конечном итоге, не образуются две одинаковые крипты. В позднем младенчестве и в зрелом возрасте деление крипт становится крайне редким событием; крипты делятся только один или два раза, средняя продолжительность цикла крипты составляет 36 лет [9]. Таким образом, разветвление крипт в толстой кишке взрослых является редкой находкой. Напротив, слизистая оболочка толстой кишки у пациентов с ВЗК, включая ЯК и БК, демонстрирует повышенное количество ветвящихся крипт. Некоторые авторы утверждают, что ветвление можно легко обнаружить в криптах, разрезанных в вертикальной плоскости (т.е. в хорошо ориентированных, вертикально расположенных криптах), но не в криптах, разрезанных в горизонтальной плоскости (т.е. на поперечных срезах крипт) поскольку они «часто создавали округлой формы профили» [10]. Однако повседневная практика показывает, что срезы эндоскопических биопсий случайно разрезаются в лаборатории в горизонтальной плоскости, и эта процедура часто приводит к поперечным разрезам кольцевидных крипт. Совсем недавно Rubio и соавт. сообщили об увеличении количества ветвящихся крипт в эндоскопических биоптатах пациентов с ВЗК [11, 12]. Наличие эпителиальных гребней в кольцевидных поперечных криптах указывает на начало ветвления крипт. Их результаты показали, что количество крипт с асимметричным ветвлением превышает количество крипт с симметричным ветвлением.
Впервые о разветвлении крипт в биоптатах прямой кишки пациентов с ЯК упомянул Morson в 1972 году [13]. Впоследствии Cheng и соавт. обнаружили высокий процент ветвящихся крипт у пациентов с ЯК, утверждая, что ветвление крипт свидетельствует об увеличении репликации крипт [14]. С тех пор в многочисленных обзорах, посвящённых гистологическому описанию ЯК, ветвление крипт упоминается без дальнейших комментариев [15, 16]. Совсем недавно Британское общество гастроэнтерологов определило, что крипты ветвятся, если «две или более разветвлённых крипты» были обнаружены «в хорошо ориентированном биоптате» [17]. Ветвление крипт часто включается в описание деформации крипт при ЯК.
Для оценки степени воспаления слизистой оболочки при ВЗК было предложено несколько гистологических систем оценки; в Кокрановской базе данных перечислено около 30 гистологических индексов оценки только для ЯК [18]. По мнению Lang-Schwarz и соавт., «идеальная гистологическая оценка должна быть способна оценить не только активность заболевания, но и восстановление хронического воспаления до нормы» [19]. Сегодня в основном используется система оценки ЯК по Geboes, основанная на структурных (архитектурных) изменениях, хроническом воспалительном инфильтрате, нейтрофилах и эозинофилах в собственной пластинке, нейтрофилах в эпителии, деструкции крипт, эрозиях или изъязвлениях [20].
Однако ни одна из вышеупомянутых систем классификации не включает гистологическую характеристику повреждённых крипт при ВЗК. В работе Rubio и соавт. было предложено выделять два гистологических фенотипа ветвящихся крипт: крипты с симметричным ветвлением и крипты с асимметричным ветвлением [21]. Количественные исследования показали, что частота биопсий, демонстриру- ющих асимметричное ветвление, была значительно выше, чем частота биопсий, демонстрирующих симметричное ветвление. Поскольку, по мнению авторов, крипты с асимметричным ветвлением не обнаруживаются в нормальной слизистой оболочке толстой кишки в норме, обнаружение крипт с асимметричным ветвлением у взрослых пациентов с ВЗК является диагностическим. Полученные данные позволили предположить, что наличие крипт с асимметричным ветвлением подчёркивает патологические нарушения в слизистой оболочке толстой кишки у взрослых пациентов с ВЗК [22].
Большинство пациентов с ВЗК направляются на проведение эндоскопического исследования по меньшей мере через 6 недель после появления симптомов, признаки хронизации часто уже можно обнаружить в их биоптатах при первичной диагностике [23]. Особенности хронического воспалительного процесса включают структурные нарушения и хронический воспалительный инфильтрат в собственной пластинке слизистой оболочки. Базальный плазмоцитоз, вероятно, является самым ранним признаком хронического воспаления и самым главным и надежным критерием ВЗК. Было продемонстрировано, что этот гистологический признак позволяет достичь практически идеальных показателей воспроизводимости, а также может иметь важное прогностическое значение. Так, на примере изучения биоптатов прямой кишки было показано, что базальный плазмоцитоз является одним из важных независимых предикторов более раннего рецидива у больных ЯК [24]. Ещё одна важная особенность хронического колита – это структурные нарушения, которые, как правило, не наблюдаются до 15 дней болезни. Однако они присутствуют более чем у 75% пациентов через 4 месяца заболевания [25]. Эта морфологическая характеристика также связана с почти идеальными показателями согласия [26]. Некоторые из существующих индексов для оценки активности заболевания ЯК не включают структурные нарушения, поскольку эта характеристика не считается маркером активности заболевания и также считалась маловероятной в качестве проявлений ответа на терапию. Однако это оказалось ошибочным, поскольку полное гистологическое восстановление слизистой оболочки в настоящее время является достижимой целью лечения [27]. Структурные нарушения крипт могут, по сути, быть единственным признаком, позволяющим различать ремиссию и полное излечение (полную гистологическую ремиссию), в отличие от базального плазмоци-тоза, который может уменьшаться раньше на фоне лечения при ремиссии заболевания.
При воспалительном заболевании кишечника структурные изменения и эпителиальная метаплазия являются результатом разрушения и повреждения крипт, связанных с хроническим активным воспалением, и тем самым являются частью хронического воспалительного процесса.
Заключение
Характеристика крипт в биоптатах слизистой оболочки толстой кишки упациентов с ВЗК позволяет выделить следующие варианты изменений крипт, отражающие происходящие при колите воспалительные, деструктивные, регенераторные, гиперпластические, атрофические, метапластические и диспластические изменения крипт.
У пациентов с ВЗК обнаруживаются характерные структурные поражения крипт, которые обозначаются как повреждённые крипты, которые могут быть подразделены на следующие категории: почкующиеся, ветвящиеся, гусеничные, змеевидные.
По преобладающим характеристикам крипт можно дополнительно выделить воспалительнодеструктивные, дисрегенераторные и метапласти-чески-диспластические формы колитов у пациентов с ВЗК. Представленная последовательность патологических процессов в слизистой оболочке толстой кишки во многом отражает путь канцерогенеза, который является грозным осложнением колита у больных ВЗК.
Структурные характеристики крипт являются важным морфологическим критерием, который позволяет с большей достоверностью диагностировать ВЗК и проводить дифференциальный диагноз между язвенным колитом и болезнью Крона. Они должны войти в диагностические алгоритмы и могут стать основой в разработке новых диагностических подходов при изучении колонобиоптатов у пациентов с ВЗК.
Сами по себе структурные изменения крипт не могут быть признаны единственно диагностическими, их нужно обязательно оценивать в комплексе с другим гистологическими параметрами (характеристиками воспаления, обнаружением гранулем) и клинико-лабораторными и эндоскопическими данными. Выделение определённых вариантов поражения крипт может стать основой для персонифицированного подхода в лечении пациентов с ВЗК.
Вариабельность изменений крипт свидетельствует о существовании гетерогенности в группах пациентов с язвенным колитом и болезнью Крона, что может быть использовано в индивидуальном прогнозировании течения заболевания и персонифицированном подходе в выборе тактики лечения у этих пациентов.
Список литературы Характеристика крипт слизистой оболочки толстой кишки при воспалительных заболеваниях кишечника
- Novak G., Parker C.E., Pai R.K., MacDonald J.K., Feagan B.G., Sandborn W.J. et al. Histologic scoring indices for evaluation of disease activity in Crohn's disease. The Cochrane database of systematic reviews. 2017;7(7):CD012351. https://doi.org/10.1002/14651858.CD012351.pub2
- Mosli M.H., Parker C.E., Nelson S.A., Baker K.A., MacDonald J.K., Zou G.Y., et al. Histologic scoring indices for evaluation of disease activity in ulcerative colitis. The Cochrane database of systematic reviews. 2017;5(5):CD011256. https://doi.org/10.1002/14651858.CD011256.pub2
- Magro F., Langner C., Driessen A., Ensari A., Geboes K., Mantzaris G.J. European consensus on the histopathology of inflammatory bowel disease. Journal of Crohn's & colitis. 2013;7(10):827-851. https://doi.org/10.1016/j.crohns.2013.06.001
- Ashton J.J., Beattie R.M. Inflammatory bowel disease: recent developments. Archives of disease in childhood. 2024;109(5):370-376. https://doi.org/10.1136/archdischild-2023-325668
- Ахриева Х.М., Коган Е.А., Тертычный А.С., Раденска-Лоповок С.Г., Зайратьянц О.В., Селиванова Л.С. Новый взгляд на структурную перестройку слизистой оболочки толстой кишки и стадии хронического колита при воспалительных заболеваниях кишечника. Архив патологии. 2021;83(6):14-19. Akhrieva Kh.M., Kogan E.A., Tertychnyi A.S., Radenska-Lopovok S.G., Zayratyants O.V., Selivanova L.S. A new look at colonic mucosal structural rearrangement and the stages of chronic colitis. Archive of Pathology = Arkhiv patologii. 2021;83(6):14-19. (In Russ).
- Pai R.K., Jairath V., Vande Casteele N., Rieder F., Parker C.E., Lauwers G.Y. The emerging role of histologic disease activity assessment in ulcerative colitis. Gastrointestinal endoscopy. 2018;88(6):887-898. https://doi.Org/10.1016/j.gie.2018.08.018
- Тертычный А.С., Ахриева Х.М., Коган Е.А., Зайратьянц О.В., Селиванова Л.С. Современные подходы в морфологической диагностике воспалительных заболеваний кишечника. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(2):73-84. Tertychnyy A.S., Akhriyeva Kh.M., Kogan E.A., Zayratyants O.V., Selivanova L.S. Modern Approaches in the Morphological Diagnosis of Inflammatory Bowel Diseases. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2022;32(2):73-84. (In Russ).
- Rubio C.A., Vieth M., Lang-Schwarz C. Crypts in Asymmetric Branching in Patients With Ulcerative Colitis in Remission. Anticancer research. 2022;42(9):4493-4497. https://doi.org/10.21873/anticanres.15950
- Langner C., Magro F., Driessen A., Ensari A., Mantzaris G.J., Villanacci V., et al. The histopathological approach to inflammatory bowel disease: a practice guide. Virchows Arch. 2014;464(5):511-527. https://doi.org/10.1007/s00428-014-1543-4
- Magro F., Doherty G., Peyrin-Biroulet L., Svrcek M., Borralho P., Walsh A. et al. ECCO Position Paper: Harmonization of the Approach to Ulcerative Colitis Histopathology. Journal of Crohn's & colitis. 2020;14(11):1503-1 511. https://doi.org/10.1093/ecco-jcc/jjaa110
- Rubio C.A., Schmidt P.T. Morphological Classification of Corrupted Colonic Crypts in Ulcerative Colitis. Anticancer research. 2018;38(4):2253-2259. https://doi.org/10.21873/anticanres.12469
- Rubio C.A., Vieth M., Lang-Schwarz C. Novel histological repertoire of crypt-associated anomalies in inflamed colon mucosa. Journal of clinical pathology. 2023;76(8):531-535. https://doi.org/10.1136/jclinpath-2022-208152
- Morson B.C. Ulcerative Colitis in Childhood. Journal of the Royal Society of Medicine, 1973;66:1036-1036.
- Cheng H., Bjerknes M., Amar J., Gardiner G. Crypt production in normal and diseased human colonic epithelium. The Anatomical record. 1986;216(1):44-48. https://doi.org/10.1002/ar.10921 601 08
- Theodossi A., Spiegelhalter D.J., Jass J., Firth J., Dixon M., Levison D.A. et al. Observer variation and discriminatory value of biopsy features in inflammatory bowel disease. Gut. 1994;35(7):961-968. https://doi.org/10.1136/gut.35.7.961
- Pai R.K., Jairath V., Vande Casteele N., Rieder F., Parker C.E., Lauwers G.Y. The emerging role of histologic disease activity assessment in ulcerative colitis. Gastrointestinal endoscopy. 201 8;88(6):887-898. https://doi.org/10.101 6/j.gie.2018.08.018
- Feakins R.M.; British Society of Gastroenterology. Inflammatory bowel disease biopsies: updated British Society of Gastroenterology reporting guidelines. J Clin Pathol. 2013;66(12):1005-1026. https://doi.org/10.1136/jclinpath-2013-201885
- Novak G., Parker C.E., Pai R.K., MacDonald J.K., Feagan B.G., Sandborn W.J., et al. Histologic scoring indices for evaluation of disease activity in Crohn's disease. The Cochrane database of systematic reviews. 2017;7(7):CD012351. https://doi.org/10.1002/14651858.CD012351.pub2
- Lang-Schwarz C., Angeloni M., Agaimy A., Atreya R., Becker C., Dregelies T., et al. Validation of the 'Inflammatory Bowel Disease-Distribution, Chronicity, Activity [IBD-DCA] Score' for Ulcerative Colitis and Crohn's Disease. Journal of Crohn's & colitis. 2021;15:1621-1630. https://doi.org/10.1093/ecco-jcc/jjab055
- Geboes K., Riddell R., Ost A., Jensfelt B., Persson T., Lofberg, R. A reproducible grading scale for histological assessment of inflammation in ulcerative colitis. Gut. 2000;47(3): 404-409. https://doi.org/10.1136/gut.47.3.404
- Rubio C.A., Schmidt P.T., Lang-Schwarz C., Vieth M. Branching crypts in inflammatory bowel disease revisited. Journal of gastroenterology and hepatology. 2022;37(3):440-445. https://doi.org/10.1111/jgh.15734
- Rubio C.A., Schmidt P.T. Crypts in asymmetric fission in endoscopic biopsies from Swedish patients with inflammatory bowel disease. Anticancer researc. 2021; 41: 3511-3517. https://doi.org/10.21873/anticanres.15138
- Bryant R.V., Burger D.C., Delo J., Walsh A.J., Thomas S., von Herbay A., et al. Beyond endoscopic mucosal healing in UC: histological remission better predicts corticosteroid use and hospitalisation over 6 years of follow-up. Gut. 2016;65(3):408-414. https://doi.org/10.! 136/gutjnl-2015-309598
- Park S., Abdi T., Gentry M., Laine L. Histological Disease Activity as a Predictor of Clinical Relapse Among Patients With Ulcerative Colitis: Systematic Review and Meta-Analysis. The American journal of gastroenterology. 2016; 111(12):1692-1701. https://doi.org/10.1038/ajg.2016.418
- Feakins R., Borralho Nunes P., Driessen A., Gordon I.O., Zidar N., Baldin P., et al. Definitions of Histological Abnormalities in Inflammatory Bowel Disease: an ECCO Position Paper. Journal of Crohn's & colitis. 2024;18(2):1 75-191. https://doi.org/10.1093/ecco-jcc/jjad142
- Тертычный А.С., Ахриева Х.М., Маев И.В., Зайратьянц О.В., Селиванова Л.С. Проблемы диагностики гистологической ремиссии у больных с воспалительными заболеваниями кишечника. Архив патологии. 2017;79(3):3-9. Tertychny A.S., Akhrieva Kh.M., Maev I.V., Zairat'yants O.V., Selivanova L.S. Diagnostic problems of histological remission in patients with inflammatory bowel disease. Russian Journal of Archive of Pathology. 2017;79(3):3-9. (In Russ).
- Magro F., Doherty G., Peyrin-Biroulet L., Svrcek M., Borralho P., Walsh A., et al. ECCO Position Paper: Harmonization of the Approach to Ulcerative Colitis Histopathology. Journal of Crohn's & colitis. 2020;14(11):1503-1511. https://doi.org/10.1093/ecco-jcc/jjaa110


