Характеристика микрофлоры пациентов онкологического профиля с постоперационными инфекционными осложнениями
Автор: Правосудова Наталья Александровна, Мельников Виктор Львович, Итяева Людмила Николаевна, Пантелеева Елена Николаевна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2022 года.
Бесплатный доступ
Исследована микрофлора патологического материала пациентов с послеоперационными инфекциями и проведен анализ устойчивости выделенных штаммов к противомикробным препаратам. Оценку биологических свойств и антибактериальную чувствительность выделенных бактериальных штаммов осуществляли по общепринятым методикам, регламентирующим работу микробиологической лаборатории. В исследование были включены 83 пациента отделения абдоминальной онкологии, проходивших хирургическое лечение в 2017-2021 гг. В патологическом материале преобладала грамотрицательная микрофлора (р
Микрофлора, послеоперационные инфекции, устойчивость к противомикробным препаратам
Короткий адрес: https://sciup.org/147239295
IDR: 147239295 | УДК: 579.61 | DOI: 10.17072/1994-9952-2022-4-294-299
Текст научной статьи Характеристика микрофлоры пациентов онкологического профиля с постоперационными инфекционными осложнениями
Инфекции, связанные с оказанием медицинской помощи (ИСМП), – это любые клинически выраженные заболевания микробного происхождения, которые поражают больного в результате его поступления в больницу или обращения за медицинской помощью вне зависимости от появления симптомов заболевания у пациента во время пребывания в стационаре или после его выписки [Тутельян, Акимкин, Марьин, 2019]. Особенно остро проблема ИСМП стоит в отделениях хирургического профиля. В Пензенской обл. в 2020 г. зарегистрировано 837 случаев инфекций, связанных с оказанием медицинской помощи, из них 37.8% – в хирургических стационарах [О состоянии …, 2021].
Бактерии обладают высокой пластичностью и способностью быстро приспосабливаться к различным условиям обитания. В медицинских учреждениях различного профиля возможно формирование определенного микроценоза, представители которого способны вызывать инфекционные осложнения у пациентов. На формирование микроценоза лечебных учреждений влияет микрофлора пациентов, сотрудников лечебных учреждений и объектов окружающей среды. Необходимо учитывать, что в отделениях разной направленности формируется определенный набор микроорганизмов, зависящий от вида хирургического вмешательства [Правосудова и др., 2016; Кудлай и др., 2022]. Кроме того, микрофлора лечебных учреждений постоянно подвергается воздействию антимикробных препаратов. В связи с этим микробный пейзаж отделения, устойчивость бактерий к антимикробным препаратам могут меняться. Мониторинг микрофлоры в отделениях лечебных учреждений является обязательным методом профилактики ИСПМ [Светличная и др., 2014; Захватова и др., 2022].
Цель настоящей работы - анализ микрофлоры пациентов с постоперационными инфекционными осложнениями.
Материал и методы исследований
Работа выполнена на базе отделения абдоминальной онкологии Онкологического диспансера г. Пензы. С 2017 по 2021 г. было зарегистрировано 83 случая послеоперационных осложнений в этом отделении. У пациентов были изучены мазки из ран, брюшной полости, трахеи и дренажей.
Посев клинического материала проводили на плотные питательные среды (кровяной агар, агар Эндо, Сабуро, ЖСА, ЦПХ-агар) и в среды обогащения (глюкозный бульон, полужидкую модифицированную среду СКС-199).
Оценку биологических свойств и антибактериальную чувствительность выделенных бактериальных штаммов осуществляли по общепринятым методикам, регламентирующим работу микробиологической лаборатории [Определение чувствительности …, 2015, 2018]. В процессе идентификации штаммов использованы наборы реагентов «Пластина биохимическая, дифференцирующая энтеробактерии (ПБДЭ)» (ООО «НПО «Диагностические системы», Россия), «Пластина биохимическая, дифференцирующая стафилококки (ПБДС)» (ООО «НПО «Диагностические системы», Россия) и микробиологический анализатор VITEK 2 – compact («bioMérieux», Франция). Определение чувствительности к антибактериальным препаратам диско-диффузионным методом проводили на среде Мюллера–Хинтона с помощью аппарата для определения стандарта мутности бактериальной взвеси (DensiChek plus «bioMérieux», Франция) и дисков с антибиотиками (BIOANALYSE, Турция и Mast Group Ltd., Великобритания).
Статистическую обработку данных выполняли, используя ᵪ2.
Результаты и их обсуждение
Распределение различных групп микроорганизмов в патологическом материале у пациентов отделения абдоминальной онкологии в течение 2017-2021 гг. представлено на рис. 1. В указанный период в патологическом материале преобладала грамотрицательная микрофлора (р<0.05). Повышение числа выделенных штаммов микроорганизмов в 2018 г. связано не только с ростом количества пациентов с постоперационными осложнениями (ПОИ) (см. рис. 1), но и c формированием полиинфекций (таблица).
Количество случаев послеоперационных осложнений и полиинфекций в 2017-2021 гг. [The number of postoperative complication and polyinfection cases in 2017-2021]
|
Показатель |
2017 |
2018 |
2019 |
2020 |
2021 |
|
Количество случаев ПОИ |
18 |
25 |
11 |
7 |
22 |
|
Количество полиинфекций |
5 |
17 |
6 |
3 |
11 |
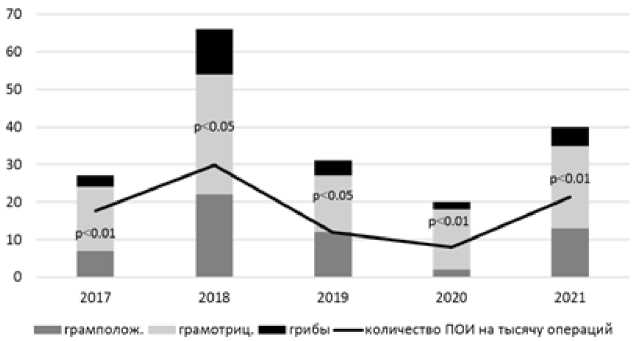
Рис. 1. Распределение микрофлоры (%) в патологическом материале у пациентов отделения абдоминальной онкологии в течение 2017-2021 гг.
[Distribution of microflora in 2017-2021]
В обследованном материале грамотрицательные бактерии были представлены следующими видами: Acinetobacter baumannii , Citrobacter braakii , Enterobacter asburiae , E. cloacae , Escherichia coli , Klebsiella pneumoniae , Pseudomonas aeruginosa , P. putida , Proteus mirabilis , Serratia liquefaciens , Stenotrophomonas maltophilia . В 2017 г. доминировали представители Kl. pneumoniae (35%, р < 0.01) и E. coli (23%, р < 0.01), в 2018 г. – Kl. pneumoniae (47%, р < 0.01) и E. coli (34%, р < 0.01), в 2019 г. – E. coli (40%, р < 0.01) и A. baumannii (20%, р < 0.01), в 2020 г. – E. coli (31%, р < 0.05) и Kl. pneumoniae (25%, р < 0.05), в 2021 г. – E. coli (45,5%, р < 0.01) и A. baumannii (18%, р < 0.01).
Грамположительная микрофлора в 2017-2021 гг. была представлена в основном энтерококками ( E. faecalis , E. faecium и E. gallinarum ) и стафилококками ( S. hominis , S. haemolyticus , S. sciuri , S. epidermidis , S. aureus ) (рис. 2). Кроме того, были выделены Corynebacterium xerosis , Streptococcus parasangunis .
Формирование микробиоценоза в отделении абдоминальной хирургии объясняется тем, что при операциях на брюшной полости представители нормальной микрофлоры кишечника (энтерококки, энтеробактерии) могут выйти за пределы своего обычного ареала. Присутствие Kl. pneumoniae ассоциировано прежде всего с аппаратами искусственной вентиляции легких, и представители данного вида встречаются у пациентов, переведенных в отделение реанимации.
Полученные за пять лет данные позволяют предположить, что в дальнейшем ведущими патогенами у пациентов этого отделения могут стать грамотрицательные микроорганизмы из семейства Enterobacteriaceae .
На формирование микроценозов в лечебных учреждениях влияют различные антибактериальные препараты, которые используются как для лечения, так и для профилактики инфекций. Главной чертой госпитальных штаммов бактерий является множественная резистентность к различным группам антимикробных препаратов [Сухорукова и др., 2019]. В связи с этим нами был проведен анализ чувствитель- ности к антимикробным препаратам у штаммов E. coli, которые выделялись у пациентов этого отделения в течение каждого года.
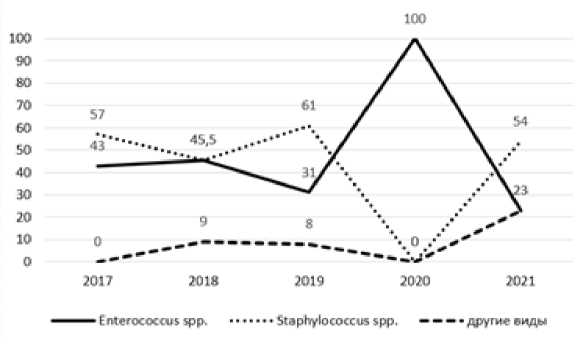
Рис. 2. Распределение грамположительной микрофлоры (%) в патологическом материале у пациентов отделения абдоминальной онкологии в течение 2017-2021 гг.
[Distribution of gram-positive microflora (%) in 2017-2021]
На рисунке 3 представлено количество резистентных штаммов (в %) к определенному антибактериальному препарату. В анализ включены препараты из группы цефалоспоринов (цефтазидим, цефтази-дим/авибактам), пенициллинов (ампициллин, амоксициллин/клавуланат), карбапенемов (меропенем), сульфаниламидов (триметоприм/сульфаметоксазол), тетрациклинов (тайгециклин) и фторхинолонов (ципрофлоксацин).
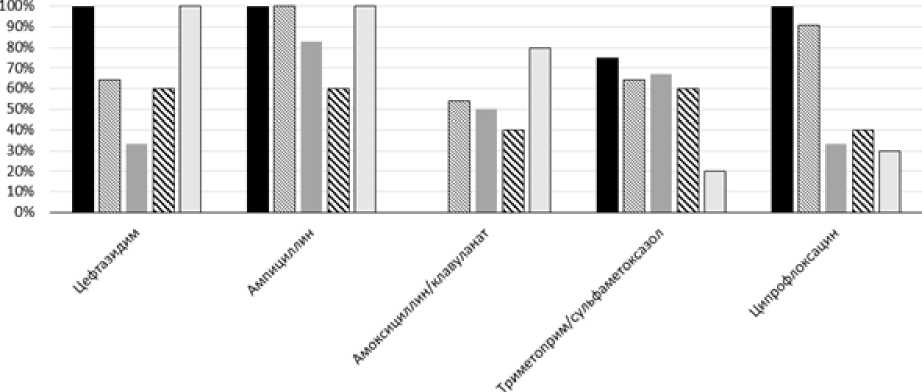
■ 2017 132018 12019 Я2О2О 02021
Рис. 3. Количество (%) выделенных штаммов E. coli , резистентных к антимикробным препаратам [Number (%) of E. coli strains resistant to antimicrobials]
В течение изученного периода сохранялась чувствительность выделенных штаммов E. coli к цефтази-диму/авибактаму, представляющим собой комбинированное антибактериальное средство, сочетающее антибиотик – цефтазидим и ингибитор бета-лактамаз – авибактам. Синтез бета-лактамаз – ферментов, которые разрушают бета-лактамное кольцо антибиотика и инактивируют его, является наиболее часто встречающимся механизмом антибиотикорезистентности [Осипов и др., 2013]. Кроме того, у выделенных штаммов E. coli сохранялась чувствительность к тайгециклину и меропенему. Соответственно, эти препараты рекомендованы для лечения и профилактики постоперационных осложнений в отделении абдоминальной онкологии.
Выводы
-
1. В отделении абдоминальной онкологии в течение 2017-2021 гг. из патологического материала от пациентов с послеоперационными осложнениями преимущественно выделялись грамотрицательные бактерии.
-
2. Представители Kl. pneumoniae , E. coli и A. baumannii являлись ведущими патогенами.
-
3. Выделенные штаммы E. coli были резистентны к воздействию цефтазидима, ампициллина, амокси-циллина/клавуланата, триметоприм/сульфаметоксазола, ципрофлоксацина и чувствительны к тайгецик-лину, меропенему и цефтазидим/авибактаму.
-
4. Для профилактики постоперационных осложнений в отделении абдоминальной онкологии необходимо продолжить микробиологический мониторинг, усилить контроль за грамотрицательной микрофлорой (так как предполагается, что она будет оставаться ведущим этиологическим агентом ПОИ в этом отделении) и использовать для лечения и профилактики послеоперационных осложнений, вызванных E. coli , тайгециклин, меропенем и цефтазидим/авибактам.
Список литературы Характеристика микрофлоры пациентов онкологического профиля с постоперационными инфекционными осложнениями
- Захватова А.С. и др. Микробиологический мониторинг антимикробной резистентности потенциальных возбудителей инфекций кровотока // Инфекция и иммунитет. 2022. №. 1 (12). С. 185-192.
- Кудлай Д.А. и др. Оценка микробиологического пейзажа и уровня антибиотикорезистентности в многопрофильном стационаре // Туберкулёз и болезни лёгких. 2022. № 8(100). С. 43-53.
- О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 г. по Пензенской области: материалы гос. доклада. Пенза, 2021. 243 с.
- Определение чувствительности микроорганизмов к антимикробным препаратам: клинич. рекомендации. Версия-2015-02. 162 с.
- Определение чувствительности микроорганизмов к антимикробным препаратам: клинич. рекомендации EUCAST. Версия-2018-03. 206 с.
- Осипов В.А. и др. Металло-бета-лактамазы грамотрицательных бактерий: растущая проблема в мире и в Беларуси // Медицинские новости. 2013. № 2. С. 84-88.
- Правосудова Н.А. и др. Особенности послеоперационных осложнений в отделении онкоурологии и онкогинекологии // Медицинский альманах. 2016. № 3(43). С. 32-35.
- Светличная Ю.С. и др. Микробиологический мониторинг в системе эпидемиологического надзора за госпитальными инфекциями // Эпидемиология и вакцинопрофилактика. 2014. № 1(74). С. 9-14.
- Сухорукова М.В. и др. Антибиотикорезистентность нозокомиальных штаммов Enterobacterales в стационарах России: результаты многоцентрового эпидемиологического исследования МАРАФОН 2015-2016 // Клиническая микробиология и антимикробная химиотерапия. 2019. Т. 21, № 2. С. 147-159.
- Тутельян А.В., Акимкин В.Г., Марьин Г.Г. От внутрибольничных инфекций до инфекций, связанных с оказанием медицинской помощи: научное развитие проблемы // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2019. Т. 9, № 1. С. 14-22.


