Характеристика морфологических и функциональных изменений в спинном мозге после его пересечения, под воздействием гидрогеля на основе модификации хитозана
Автор: Лебенштейн-гумовски М.В., Боташева В.С., Ковалев Д.А., Шатохин А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 3 (71), 2021 года.
Бесплатный доступ
Проблема травмы спинного мозга и его репаративные способности являются предметом многих исследований и дискуссий в течение долгого времени. Если морфологическая характеристика травмы и восстановления периферического нерва изучены достаточно [1], то само по себе явление спонтанного восстановления функции спинного мозга после его пересечения до недавних пор считалось невозможным, а репарация с применением различных методик - малорезультативной и не протекающей по привычным сценариям восстановления нервной ткани. В данной статье рассмотрен этап исследования влияния хитозана и его модификаций на некоторые морфологические процессы, протекающие в месте травмы спинного мозга.
Травма спинного мозга, хитозан, препарат, пэг
Короткий адрес: https://sciup.org/142230908
IDR: 142230908 | УДК: 616-003.93
Текст научной статьи Характеристика морфологических и функциональных изменений в спинном мозге после его пересечения, под воздействием гидрогеля на основе модификации хитозана
Проблема травмы спинного мозга и его репаративные способности являются предметом многих исследований и дискуссий в течение долгого времени. Если морфологическая характеристика травмы и восстановления периферического нерва изучены достаточно [1], то само по себе явление спонтанного восстановления функции спинного мозга после его пересечения до недавних пор считалось невозможным, а репарация с применением различных методик – малорезультативной и не протекающей по привычным сценариям восстановления нервной ткани.
В данной статье рассмотрен этап исследования влияния хитозана и его модификаций на некоторые морфологические процессы, протекающие в месте травмы спинного мозга.
ЦЕЛЬ РАБОТЫ
Изучить морфологические и функциональные изменения в спинном мозге после его травмы и обработки модифицированным хитозаном.
МЕТОДИКА ИССЛЕДОВАНИЯ
В качестве экспериментальной модели использованы кролики (N = 24) массой от 2 до 3 кг, самцы, которым выполнялся доступ к спинному мозгу на грудном уровне с последующим его пересечением. Операция производилась под инъекционным золетил-ксилазиновым наркозом (1:4), после предварительной премедикации атропином и дроперидолом. С дорсальной поверхности выполнялся доступ к позвоночным дужкам на уровне 8–10-го грудных позвонков, производили удаление трёх рядом лежащих дужек. Выполняли продольное рассечение твердой мозговой оболочки (ТМО), лезвием скальпеля пересекали спинной мозг поперечно, останавливали кровотечение орошением холодным (8 оС) изотоническим раствором натрия хлорида. В опытной группе (n = 12) животным в место травмы вводили гидрогель, содержащий модифицированный хитозан, животным из контрольной группы (n = 12) гидрогель не вводили. На ТМО накладывались швы, область операции обкладывалась гемостатической губкой, рана ушивалась послойно, животные помещались в бокс для послеоперационного выхаживания. В процессе эксперимента и формирования групп умерло 6 животных от осложнений, связанных с наркозом и/или самой операцией. В результате, в статистике эксперимента были учтены только выжившие (n = 24, при изначальном n = 30).
Полученная модель позволила сформировать нижний спастический парапарез с анестезией ниже уровня поражения, с тазовыми нарушениями по типу задержки у кроликов из обеих групп.
В течение всего эксперимента ежедневно фиксировался уровень двигательной активности и чувствительности у животных по модифицированной шкале Basso Beattie Bresnahan (BBB) [2].
Животных выводили из эксперимента по 2 из каждой группы по схеме: 1, 3, 7, 14, 21, 28-й дни после операции соответственно, или при наступлении смерти одного из животных вне сроков. Выполнялась немедленная аутопсия, извлекался позвоночный столб, резецировались дужки на всех уровнях, препарат фиксировался в 4%-м забуференном формалине первые 6 часов, затем перемещался в 10%-й забуференный формалин. После фиксации спинной мозг изымался из позвоночного канала отмывался в проточной воде и выполнялась стандартная проводка в батарее спиртов, заливка в парафин с последующей окраской гематоксилин-эозином. Микроскопия и микрофотографирование с использованием светового микроскопа Zeiss.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На протяжении всего эксперимента у животных из контрольной группы никакой положительной динамики в двигательной активности и чувствительности не отмечалось, и у них сохранялась стойкая нижняя параплегия. Явления задержки тазовых функций разрешались принудительным опорожнением мочевого пузыря, копростаз чаще разрешался самостоятельно. На 3-и сутки умерло 2 животных из контрольной группы и 1 животное из опытной. На аутопсии отмечались переполненный мочевой пузырь с расширенными мочеточниками (явления рефлюкса), острая кишечная непроходимость с частичной ишемией толстого и тонкого кишечника. На 7-е сутки умерло 1 животное из контрольной группы со схожими результатами аутопсии. У животных из опытной группы, начиная с 1-х суток, отмечалась положительная динамика в двигательной активности и чувствительности. Так, у одного животного опытной группы уже на 2-е сутки после операции выявлены активные движения задними лапами в горизонтальной плоскости (слабое подтягивание лап при передвижении). В промежутке между 7-м и 10-м днями эксперимента у 3 из 6 животных опытной группы (50 %) сила отталкивания в задних конечностях была достаточной, чтобы сопротивляться руке экспериментатора при противодействии. К 3-й неделе эксперимента у всех животных, получивших интраоперационно гидрогель, констатированы слабые движения и возвращение температурной чувствительности (тест с горячей пластиной), что расценивается как нижний парапарез. Животные могли самостоятельно передвигаться, задействуя задние лапы, однако совершать прыжок не могли. Тазовые нарушения к этому времени принимали пароксизмальный характер, и после 1–2-дневной задержки наступало самопроизвольное опорожнение мочевого пузыря и толстого кишечника. К 4-й неделе эксперимента у животных сохранялся лёгкий парапарез, однако объём движений значительно увеличился (рис. 1).
Изменение двигательной активности по ВВВ у животных в эксперименте
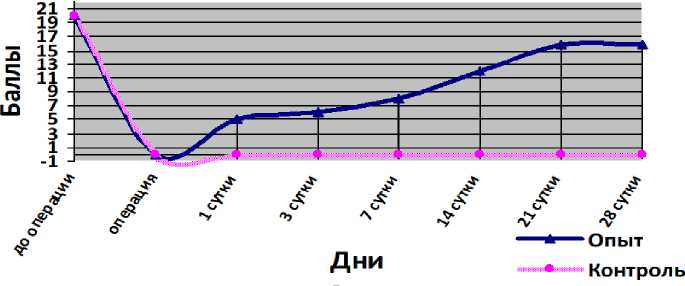
Рис. 1. Диаграмма изменения двигательной активности по ВВВ у животных в эксперименте
Гистологическая картина. На первые сутки в обеих группах визуализировалось место травмы, значительное количество эритроцитов в месте травмы и в подоболочечных пространствах (рис. 2). К 3-м суткам в контрольной группе остается эритроцитарная и макрофагальная инфильтрация места травмы. Некоторые мак- рофаги имеют включения гемосидерина. Более отчетливо визуализируется диастаз, за счёт частичного разрушения миелиновых оболочек. В этой области отмечаются отдельные глыбки миелина, свободнолежащие аморфные некротические массы, глиальные клетки, эритроциты (рис. 3).
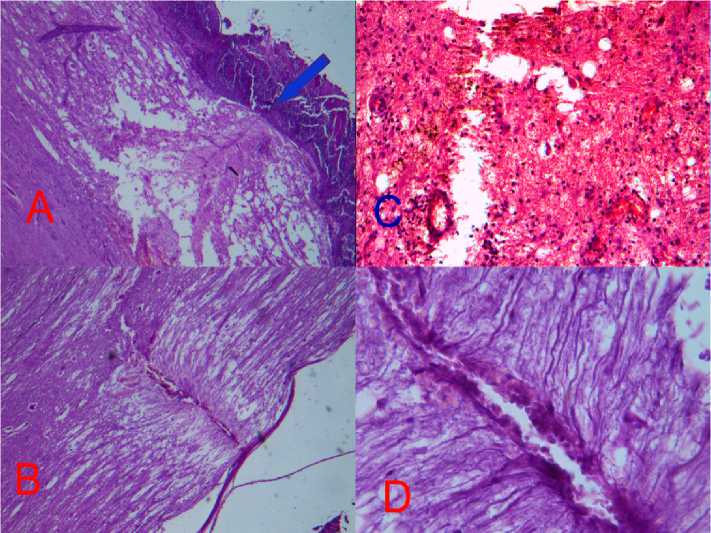
Рис. 2. Спинной мозг после травмы. 1-е сутки. Значительное количество эритроцитов в месте травмы и в подоболочечных пространствах. Окр. гематоксилин-эозином. А, В – ув. ×40, С, D – ув. ×200
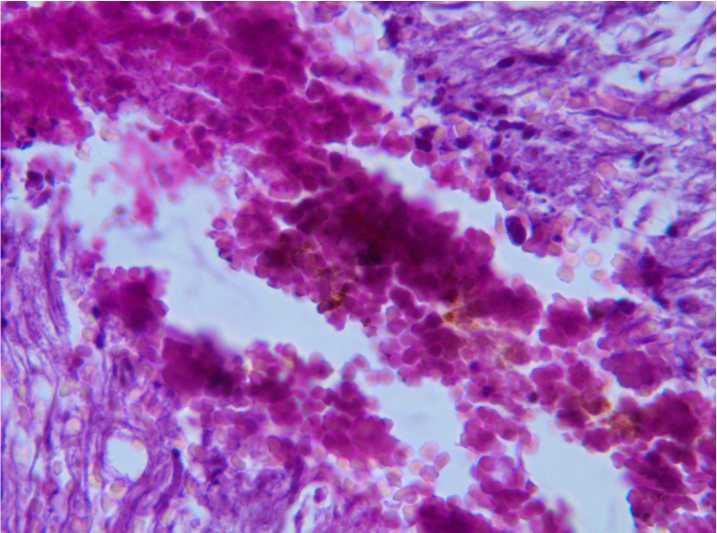
Рис. 3. Спинной мозг. 3-и сутки, контрольная группа.
Эритроцитарная и макрофагальная инфильтрация места травмы. Окр. гематоксилин-эозином. Ув.×400
У животных из опытной группы диастаз спинного мозга не визуализируется, место травмы представляет собой полосу с элементами клеточной инфильтрации, состоящую из увеличенных аксонов и глиальных клеток, имеется некоторое количество пустот по типу микрокист (рис. 4). В сером веществе единичные распадающиеся нейроны, межклеточное и межак- сональное пространство увеличено (рис. 4 В). К 7-м суткам в контрольной группе в месте травмы определяются фибробласты, усиление пролиферации глиальных клеток, проксимальные аксоны ближе к месту травмы утолщены, деформированы (рис. 5 А). В опытной группе картина прежняя, отмечено уменьшение межклеточного отёка (рис. 5 В).
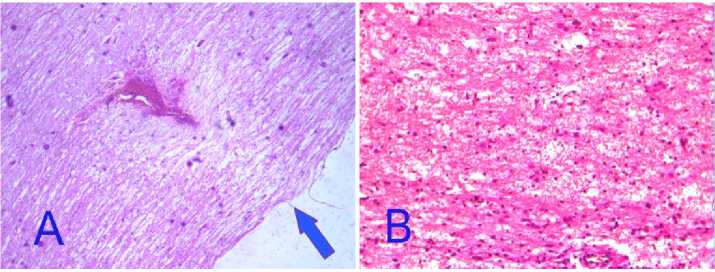
Рис. 4. Спинной мозг. 3-и сутки, опытная группа:
A – диастаз спинного мозга не визуализируется, увеличение аксонов и глиальных клеток. Окр. гематоксилин-эозином, ув. ×40; В – в сером веществе единичные распадающиеся нейроны, межклеточное и межаксональное пространство увеличено.
Окр. гематоксилин-эозином, ув. ×200
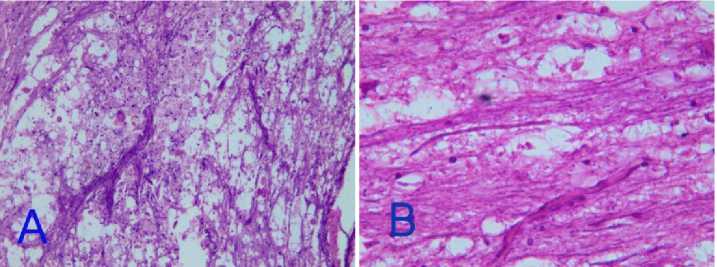
Рис. 5. Спинной мозг. 7-е сутки:
А – в месте травмы у животных контрольной группы усиление пролиферации глиальных клеток, проксимальные аксоны ближе к месту травмы увеличены, деформированы. Окр. гематоксилин-эозином, ув. ×400х
В – в опытной группе картина прежняя, отмечено уменьшение межклеточного отёка. Окр. гематоксилин-эозином, ув.×200
На 14-е сутки у контрольной группы в месте травмы визуализируются соединительнотканные волокна, фибробласты, увеличивается число макрофагов. Усилена пролиферация глии. Ткань со включениями соединительных волокон, множественными мелкими и крупными кистами (рис. 6 А, B). К 3–4-й неделе спинной мозг у животных контрольной группы в месте травмы уже представляет собой сформированный глиозный рубец со множественными крупными кистами и нитями фибрина, с организацией некротических масс. Сформировавшийся рубец прерывает ход аксонов (рис. 6 C).
Некоторые аксоны у границы рубца имеют булавовидные утолщения (рис. 6 С). При этом в опытной группе такой дегенерации нервной ткани не наблюдается, отёк отсутствует, в сером веществе тонкая полоска отсутствия нейронов, за пределами которой некоторые нейроны увеличены, межаксональное пространство несколько увеличено, однако ход аксонов не нарушен, в остальном картина прежняя. В опытной группе у части животных встречались единичные крупные кисты на границе серого и белого вещества, при этом аксоны белого вещества не прерываются, и в целом белое вещество имеет нормальный вид, хотя все же межаксональные пространства остаются расширенными (рис. 6 D–F). У других животных из опытной группы кисты вовсе отсутствовали, как и явления глиальной пролиферации. Белое и серое вещество в месте травмы характеризуется нормальным ходом волокон и расположением клеточных элементов. Аксоны в этом месте утолщены и извиты, а межаксональное пространство расширено. Такое явление наблюда- ется исключительно в месте травмы, поэтому место перерезки легко узнаётся на фоне здоровой ткани в виде полосы ткани с описанными изменениями.
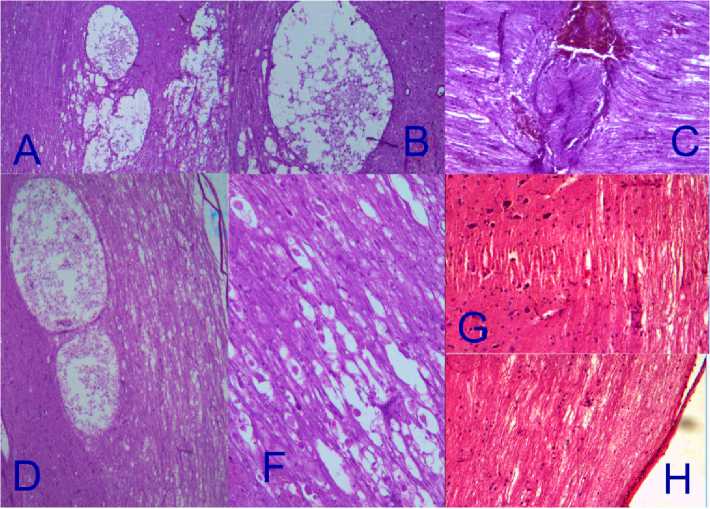
Рис. 6. Спинной мозг:
А–В – спинной мозг. 14-е сутки. Контрольная группа. В месте травмы соединительнотканные волокна, фиброциты, увеличенные макрофаги. Усилена пролиферация глии. Ткань со включениями соединительных волокон, множественными мелкими и крупными кистами. А – окр. гематоксилин-эозином, ув. ×40, B – окр. гематоксилин-эозином, ув. ×200.
С – 3–4 нед. Контрольная группа. Сформированный глиозный рубец прерывает ход аксонов. Некоторые аксоны с булавовидными утолщениями. окр. гематоксилин-эозином, ув. ×200.
D–F – 3–4 нед. Опытная группа. Отёк отсутствует, в сером веществе полоса отсутствия нейронов, за пределами которой некоторые нейроны увеличены, межаксональное пространство увеличено, ход аксонов не нарушен, в остальном картина прежняя. Белое и серое вещество в месте травмы характеризуется нормальным ходом волокон и расположением клеточных элементов. D – окр. гематоксилин-эозином, ув. × 40, F – окр. гематоксилин-эозином, ув. × 400
Механизм репарации спинного мозга мало изучен. Наблюдаемые в данном эксперименте явления подтверждают многочисленные наблюдения восстановления нервной ткани после травмы, под воздействием на нервную ткань различных веществ. Исследования S. Kouhzaei, I. Rad [4], C. Y. Kim, W. K. A. Sikkema, J. Kim [5], и других авторов, которые используют полимерные соединения для решения этой проблемы, показывают лучшие морфологические и клинические результаты, чем исследования со включением различных алло- и аутотрансплантатов, как, например, в эксперименте D. L. Moore, M. G. Blackmore, Y. Hu, et al. [6]. В целом создание буферной среды патогенетически более оправдано, чем включение клеточных матриц. В отличие от периферического нерва, где после травмы клеточное окружение способствует аксональному росту, в спинном мозге в ранний период наблюдается усиленный выброс биоактивных веществ, цитокинов, вторично повреждаю- щих здоровые клетки, и в последующем наблюдаются явления глиозно-фиброзной трансформации, что не только не способствует, но и препятствует аксональному росту, в том числе и из клеток трансплантата. Буферные среды снижают эффект цитотоксичности биоактивных веществ в месте травмы, и, вероятно, способствуют «склеиванию» разрушенных мембран аксонов. Описанный в нескольких исследованиях эффект вызывают несколько групп веществ, которые получили наименование фузогенов или фузоген-герметиков (от англ. fusion – слияние) [3].
В нашем эксперименте рассмотрено действие одного из таких фузогенов, представляющего собой гидрогель на основе модифицированного хитозана. Так как введение гидрогеля происходило до того, как дистальные участки аксонов успели дегенерировать, и до того, как в месте травмы развились явления вторичного повреждения, до возникновения глиального наплыва, то тут, как нам кажется, не идёт речь исключительно о новом аксональном росте, а скорее большей частью о репарации имеющихся аксонов и слиянию проксимальных и дистальных отрезков. Точность сопоставления концов спинного мозга достаточна, чтобы аксоны из одной и той же группы были адекватно соединены от проксимального к дистальному отрезку. Погрешности в сопоставлении компенсируются свойствами нейропластичности.
В пользу этой теории говорит и ранние проявления двигательной активности у опытных животных, и морфологическая картина. Очевидно, что первично повреждённые нейроны в месте травмы не восстанавливаются, поэтому мы можем увидеть безнейронный участок нервной ткани. При этом аксоны, подвергшиеся вероятно «слиянию», имеют несколько гипертрофированный и извитой вид.
ЗАКЛЮЧЕНИЕ
В настоящее время большой интерес представляют исследования восстановления нервной ткани спинного мозга после травмы, с применением различных сред, снижающих развитие вторичного повреждения, препятствующих формированию глиозных трансформаций и обуславливающих аксональную репарацию.
Сам механизм такой репарации изучен крайне мало, однако результаты применения некоторых новых экспериментальных препаратов говорят об их большой клинической эффективности в условиях опыта, что находит и морфологическое подтверждение. Нами изучены морфологические и функциональные изменения после травмы спинного мозга после интраоперационного введения гидрогеля с модифицированным хитозаном. Клиническая характеристика двигательной активности и чувствительности напрямую зависела от факта применения гидрогеля и изменялась с течением времени в положительную сторону. Так, в группе животных, получивших после травмы спинного мозга интраоперационно гидрогель с модифицированным хитозаном, отмечено частичное возвращение функциональной активности спинного мозга, а к концу эксперимента животные могли самостоятельно передвигаться, используя задние конечности, хотя явления парапареза сохранялись. При этом у кроликов из контрольной группы после операции и до конца эксперимента сохранялась нижняя параплегия с утратой чувствительности, без какого-либо клинического прогресса. При этом морфологическая картина спинного мозга соответствует клинической картине в обеих группах. В контрольной группе развиваются активные процессы распада клеток, инфильтрация, поэтапная дегенерация нервной ткани с формированием кист, очагов глиоза и фиброза. В опытной группе явления распада выражены значительно меньше, наблюдается постепенное восстановление нормальной гистологической картины. Таким образом, изучаемый гидрогель с модифицированным хитозаном способствует восстановлению функций спинного мозга и морфологии нервной ткани после травмы. Вероятно, ведущим механизмом в восстановлении ткани спинного мозга, под воздействием препарата модифицированного хитозана, является не аксональный рост, а эффект «слияния» повреждённых аксонов, который требует дальнейшего изучения с применением методов иммунофлуоресценции и иммуногистохимии.
Список литературы Характеристика морфологических и функциональных изменений в спинном мозге после его пересечения, под воздействием гидрогеля на основе модификации хитозана
- Нейрон. Обработка сигналов. Пластичность. Моделирование: Фундаментальное руководство / Ю. И. Александров, К. В. Анохин, Б. Н. Безденежных [и др.]. - Тюмень: Изд-во Тюменского государственного университета. - 2008. - 548 c. -Текст: непосредственный.
- Basso, D. M. / A sensitive and reliable locomotor rating scale for open field testing in rats / D. M. Basso, M. S. Beattie, J. C. Bresnahan. - Text (visual): unmediated // J. Neurotrauma - 1995. - Vol. 12, № 1. - P. 21.
- Canavero, S. HEAVEN: The head anastomosis venture Project outline for the first human head transplantation with spinal linkage (GEMINI) / S. Canavero. - Text (visual): unmediated // Surg Neurol Int. -2013. - № 4. - Р. 335 -342.
- Protective effect of low molecular weight polyethylene glycol on the repair of experimentally damaged neural membranes in rat's spinal cord / S. Kouhzaei, I. Rad, S. Mousavidoust, H. Mobasheri. - Text (visual): unmediated // Neurol Res. -2013. - № 35 (4). - Р. 415 - 423. 10.1179/ 1743132812Y.0000000133 DOI: 10.1179/1743132812Y.0000000133
- Effect of Graphene Nanoribbons (TexasPEG) on locomotor function recovery in a rat model of lumbar spinal cord transection / C. Y. Kim, W. K. A. Sikkema, J. Kim, [et al.]. - Text (visual): unmediated // Neural Regen Res. - 2018 -№ 13 (8). - Р. 1440 - 1446. DOI: 10.4103/1673-5374.235301
- KLF family members regulate intrinsic axon regeneration ability / D. L. Moore, M. G. Blackmore, Y. Hu, [et al.]. - Text (visual): unmediated // Science - 2009 - № 326 (5950). - Р. 298 - 301. DOI: 10.1126/science.1175737


