Характеристика перспективных сортов пшеницы (Triticum aestivum L.), допущенных к возделыванию в Нижневолжском регионе, по устойчивости к возбудителям пиренофорозной и темно-бурой пятнистости
Автор: Конькова Э.А., Лящева С.В., Зеленева Ю.В., Коваленко Н.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 5 т.58, 2023 года.
Бесплатный доступ
Ежегодный мониторинг фитосанитарного состояния посевов пшеницы в Саратовской области показывает активное развитие листовых пятнистостей и накопление их инфекционного потенциала. Pyrenophora tritici-repentis - возбудитель пиренофороза, или желтой пятнистости листьев, одной из опасных болезней пшеницы. Bipolaris sorokiniana - возбудитель темно-бурой пятнистости, потенциально опасного заболевания пшеницы. В настоящей работе в результате комплексной полевой и лабораторной оценки 20 сортов мягкой пшеницы ( Triticum aestivum L.), возделываемых на территории Нижневолжского региона, впервые выявлены образцы, устойчивые к возбудителю пиренофороза, а также среднеустойчивые к возбудителю темно-бурой пятнистости. Результаты идентификации аллелей Tsn1 и tsn1 с использованием молекулярного маркера Xfcp623 показали, что среди изучаемых образцов пшеницы ген Tsn1 преимущественно встречался у озимых сортов. Мы впервые выявили статистически значимые различия между средними значениями показателей, полученных при полевой фитопатологической оценке сортов из разных групп устойчивости (RR, R, MS и S) к P. tritici-repentis . Цель работы - определение устойчивости сортов озимой и яровой мягкой пшеницы ( Triticum aestivum L.), возделываемых на территории Нижневолжского региона, к возбудителям желтой и темно-бурой пятнистостей и идентификация у растений доминантного ( Tsn1 ) и рецессивного ( tsn1 ) аллелей. В работе исследовали 13 сортов озимой мягкой пшеницы (Гостианум 237, Лютесценс 230, Саратовская 8, Губерния, Мироновская 808, Донская безостая, Саратовская 90, Жемчужина Поволжья, Саратовская 17, Калач 60, Подруга, Анастасия, Соседка) и 7 - яровой мягкой пшеницы (Фаворит, Прохоровка, Юго-Восточная 2, Саратовская 70, Саратовская 73, Белянка, Лебедушка). Из них 16 были допущены к использованию в 2022 году. Соседка - перспективный сортообразец озимой мягкой пшеницы; Гостианум 237, Лютесценс 230, Саратовская 8 - селекционные сорта озимой мягкой пшеницы саратовской селекции, полученные в первой половине XX века. Полевые испытания проводили в 2020-2022 годах в селекционном питомнике ФГБНУ Федеральный аграрный научный центр Юго-Востока (г. Саратов). Для оценки сортов пшеницы к местной популяции возбудителя пиренофороза на естественном инфекционном фоне использовали модифицированную и дополненную шкалу Саари-Прескотта (Saari and Prescott). В лабораторных условиях листья растений заражали P. tritici-repentis и B. soro-kiniana . Инокулюм включал смесь нескольких изолятов гриба из коллекции Всероссийского НИИ защиты растений, полученных в 2022 году из растительного инфекционного материала из Саратовской ( P. tritici-repentis , ToxA ), Ленинградской ( B. sorokiniana ) областей и Республики Казахстан ( P. tritici-repentis , ToxB ). Для фитопатологической оценки P. tritici-repentis использовали балльную шкалу, характеризующую степень развития некрозов и хлорозов. При оценке устойчивости пшеницы к темно-бурой пятнистости, вызываемой B. sorokiniana , использовали шкалу, разработанную в ВИЗР. Геномную ДНК из листьев 5-суточных проростков пшеницы выделяли стандартным методом СТАВ/хлороформ. После количественной оценки концентрацию ДНК нормализовали до 30 нг/мкл для последующей ПЦР. Скрининг изолятов на присутствие доминантного или рецессивного аллеля гена ( Tsn1 / tsn1 ) в генотипе сорта проводили методом ПЦР с парами праймеров Xfcp623F/Xfcp623R (ЗАО «Евроген», Россия). Доля сортов, устойчивых к изолятам P. tritici-repentis , способным продуцировать токсины, кодируемые генами TохА и Tох B , составила 40 %, к изоляту с геном TохА - 55 %, с Tох B - 60 %. Доля сортов, показавших среднюю устойчивость к Bipolaris sorokiniana , составила всего 15 %. Наибольший интерес представляют генотипы трех сортов озимой мягкой пшеницы (Гостианум 237, Мироновская 808, Подруга) и пять генотипов яровой мягкой пшеницы (Фаворит, Прохоровка, Саратовская 70, Саратовская 73, Белянка), которые оказались устойчивы к пиренофорозу в лабораторных и трехлетних полевых испытаниях. При молекулярном скр
Пшеница, pyrenophora tritici-repentis, bipolaris sorokiniana, toxa, tsn1, пцр, желтая пятнистость, пиренофороз, темно-бурая пятнистость
Короткий адрес: https://sciup.org/142239855
IDR: 142239855 | УДК: 633.11:632.4:577.2 | DOI: 10.15389/agrobiology.2023.5.852rus
Текст научной статьи Характеристика перспективных сортов пшеницы (Triticum aestivum L.), допущенных к возделыванию в Нижневолжском регионе, по устойчивости к возбудителям пиренофорозной и темно-бурой пятнистости
* Работа выполнена при поддержке Российского научного фонда, проект ¹ 19-76-30005.
Вредоносные заболевания занимают особое место среди факторов, лимитирующих урожай зерновых культур в Саратовской области. Ежегодный мониторинг фитосанитарного состояния посевов пшеницы в регионе показывает активное развитие листовых пятнистостей и накопление их инфекционного потенциала. Одно из широко распространенных по области заболеваний пшеницы — желтая пятнистость листьев, или пиренофороз.
Желтая пятнистость (пиренофороз) листьев — экономически значимое заболевание пшеницы во всем мире (1, 2). Возбудителем болезни служит аскомицетный гриб Pyrenophora tritici-repentis (Died.) Drechsler, известный способностью синтезировать некротрофные эффекторы (necrotrophic effectors, NEs), в том числе специфичные к хозяину токсины (host selective toxins, HSTs), которые функционируют как факторы патогенности. У вида P. tritici-repentis описаны три некротрофных эффектора — PtrToxA, PtrToxB и PtrToxC. PtrToxA и PtrToxB — это белки, PtrToxC представляет собой низкомолекулярное соединение небелковой природы (3-5).
Взаимоотношения в патосистеме мягкая пшеница— P. tritici-repentis осуществляются по типу ген-на-ген в зеркальном отражении, то есть каждый индивидуальный токсин узнается продуктом одного локуса восприимчивого хозяина, что выражается в восприимчивости растения и проявлении болезни (6-8). Уникальность этой патосистемы состоит в том, что ген ToxA , детерминирующий основной фактор патогенности (токсин PtrToxA), привнесен в геном P. tritici-repentis горизонтальным переносом из другого патогена пшеницы — гриба Parastagonospora nodorum (9, 10).
Еще одно потенциально опасное заболевание, зафиксированное в регионе, — темно-бурая пятнистость пшеницы, хотя до настоящего времени Саратовская область не входила в эпифитотийно опасную зону по его распространению. В благоприятные для патогена годы наблюдалось незначительное поражение (не более 10 %) некоторых сортов. Однако в связи с различными факторами (изменение климата, несоблюдение севооборота, перенасыщение монокультурой и т.д.) можно предположить, что массовое распространение этого возбудителя в регионе лишь вопрос времени. Если во время колошения непрерывно в течение 5-6 сут идет дождь с последующим повышением дневной температуры до 20-30 ° С, эпифитотия темно -бурой пятнистости на пшенице может развиваться очень быстро (11).
Темно-бурую листовую пятнистость злаков вызывает анаморфный гриб Bipolaris sorokiniana (Sacc. in Sorokin) Shoem., в половой стадии — Cochliobolus sativus (S. Ito & Kurib.) Drechsler ex Dastur. Заболевание поражает ячмень, пшеницу, рожь, тритикале и несколько дикорастущих трав (12). Значение этого заболевания возрастает в странах Северной и Южной Америки, а также в Европе (13). Оно широко распространено во многих регионах Российской Федерации: в Северно-Западном и Северокавказском регионах, в Татарстане, Приамурье (14-16). Возбудитель — гемибио-троф, то есть, помимо паразитического существования, он способен к сапрофитному обитанию. В семенах, почве и на растительных остатках гриб сохраняет жизнеспособность до 5-7 лет. Потери урожая могут составлять 20-40 %. Вид B. sorokiniana полиморфный, он вызывает также гельминто-спориозную корневую гниль и в комплексе с другими патогенами — черный зародыш семян (17).
Устойчивость пшеницы к возбудителю B. sorokiniana генетически детерминирована. Известно, что наличие гена Sb1 в генотипе повышает количественную (неполную) устойчивость к темно-бурой пятнистости. Сегмент хромосомы, в котором находится ген Sb1, содержит также ген устойчивости к бурой ржавчине Lr34, широко используемый в создании сортов пшеницы (11).
M. Lillemo с соавт. (18) указывают на наличие гена устойчивости к B. sorokiniana , не аллельного Sb1 , который сцеплен с геном устойчивости к бурой ржавчине Lr46 . Есть сведения о наличии двух и более генов устойчивости к B. sorokiniana и эффективности их пирамидирования. Выявлено, что образцы пшеницы с эректоидными и полупоникающими листьями меньше поражаются темно-бурой пятнистостью, чем образцы с опущенными или поникающими (19).
Наиболее рациональным методом защиты пшеницы от листовых пятнистостей служит возделывание и использование устойчивых сортов. В связи с широким распространением и вредоносностью этих заболеваний, многие научные работы посвящены поиску образцов зерновых культур, устойчивых к указанным патогенам (20-22). Однако в большинстве случаев выявленных устойчивых образцов пшеницы недостаточно.
В настоящей работе в результате комплексной полевой и лабораторной оценки 20 сортов мягкой пшеницы ( Triticum aestivum L.), возделываемых на территории Нижневолжского региона, впервые выявлены образцы, устойчивые к возбудителю пиренофороза, а также среднеустойчивые к возбудителю темно-бурой пятнистости. Результаты идентификации аллелей Tsn1 / tsn1 с использованием молекулярного маркера Xfcp623 показали, что среди изучаемых образцов пшеницы ген Tsn1 преимущественно встречался в озимых сортах. Впервые выявлены статистически значимые различия между средними значениями показателей полевой фитопатологической оценки сортов, входящих в разные группы устойчивости к P. tritici-repentis (RR, R, MS и S).
Цель работы — оценка устойчивости сортов озимой и яровой мягкой пшеницы ( Triticum aestivum L.), возделываемых на территории Нижневолжского региона, к возбудителям желтой и темно-бурой пятнистостей и идентификация у растений доминантного/рецессивного аллеля гена Tsn1 .
Методика. Исследовали 13 сортов озимой мягкой пшеницы (Гости-анум 237, Лютесценс 230, Саратовская 8, Губерния, Мироновская 808, Донская безостая, Саратовская 90, Жемчужина Поволжья, Саратовская 17, Калач 60, Подруга, Анастасия, Соседка) и 7 яровой мягкой пшеницы (Фаворит, Прохоровка, Юго-Восточная 2, Саратовская 70, Саратовская 73, Белянка, Лебедушка). Из них 16 были допущены к использованию в 2022 году (23). Соседка — перспективный сортообразец озимой мягкой пшеницы; Гостианум 237, Лютесценс 230, Саратовская 8 — селекционные сорта озимой мягкой пшеницы саратовской селекции, полученные в первой половине XX века.
В лабораторных условиях листья растений заражали P. tritici-repentis и B. sorokiniana. Инокулюм включал смесь нескольких изолятов гриба из коллекции Всероссийского НИИ защиты растений, полученных в 2022 году из растительного инфекционного материала из Саратовской (P. tritici-repentis, ToxA), Ленинградской (B. sorokiniana) областей и Республики Казахстан (P. tritici-repentis, ToxB).
Для фитопатологической оценки P. tritici-repentis использовали балльную шкалу, характеризующую степень развития некрозов и хлорозов (25): 1/0 (хлороз/некроз), 1/1 — устойчивость (R), 1/2, 2/1, 2/2 — умеренная устойчивость (MR), 2/3, 2/4 — умеренная восприимчивость (MS), 3/2, 3/3, 3/4 — восприимчивость (S), 4/3, 4/4, 4/5, 5/4, 5/5 — высокая восприимчивость (HS). При оценке устойчивости пшеницы к темно-бурой пятнистости, вызываемой B. sorokiniana , использовали шкалу, разработанную в ВИЗР: 1 — листья зеленые, с точечными пятнами темно-бурого цвета (устойчивые образцы, R); 2 — листья зеленые, пятна размером до 1 мм (средне устойчивые, MR); 3 — темно-бурые пятна до 2 мм, сливающиеся (умеренно восприимчивые, MS); 4 — листья хлоротичные, темно-бурые пятна достигают 3 мм (восприимчивые, S); 5 — листья хлоротичные, пятна более 3 мм, мацерация тканей (высоковосприимчивые, HS) (26).
Геномную ДНК из листьев 5-суточных проростков пшеницы выделяли стандартным методом СТАВ/хлороформ (27). Качество проб ДНК проверяли в 1 % агарозном геле. Вторичный контроль на чистоту и качество выполняли на спектрофотометре SmartSpecTMPlus («Bio-Rad», США). После количественной оценки концентрацию ДНК нормализовали до 30 нг/мкл для последующей ПЦР. Количество ДНК соответствовало протоколу ПЦР для идентификации гена Tsn1 (28-30) .
Реакционная смесь для амплификации геномной ДНК (финальный объем 25 мкл) содержала 2,5 мкл 10½ ПЦР-буфера («Биолабмикс», Россия), 0,5 мкл смеси dNTP (10 мM) («TransGen Biotech Co., Ltd.», Китай), 0,5 мкл каждого праймера (25 мкM) (ЗАО «Евроген», Россия), 0,15 мкл Taq ДНК-полимеразы (5 ед/мкл, «Диалат ЛТД», Россия), 1 мкл геномной ДНК и 19,85 мкл diH 2 O. ПЦР проводили в амплификаторе С1000 Touch Thermal Cycler («Bio-Rad», США).
Амплифицированные фрагменты разделяли электрофорезом в 1,5 % агарозном геле в 1½ ТВЕ буфере (pH 8,2), гель окрашивали бромистым этидием («Биоламбикс», Россия). Для приготовления агарозного геля к 3 г агарозы («Helicon», США) добавляли 200 мл 1½ ТБЕ буфера и нагревали до полного растворения агарозы, затем охлаждали и добавляли 1,8 мкл бромистого этидия. Для приготовления 1 л 10½ ТВЕ буфера использовали 108 г Трис-HCl («Helicon», США), 55 г борной кислоты («Helicon», США), 9,3 г EDTA («Helicon», США) и diH 2 O. Для получения 1½ ТВЕ буфера 100 мл 10½ ТВЕ буфера доводили до 1 л diH 2 O. Размер фрагментов оценивали с использованием ДНК маркера Step100 plus («Биолабмикс», Россия).
Скрининг изолятов на присутствие доминантного или рецессивного аллелей гена Tsn1 / tsn1 проводили методом ПЦР с парами праймеров Xfcp623F/Xfcp623R (ЗАО «Евроген», Россия). Условия ПЦР: 3 мин при 94 ° С; 30 с при 94 ° С, 30 с при 60 ° С, 1 мин при 72 ° С (45 циклов); 5 мин при 72 ° С. Праймер Xfcp623F имел нуклеотидную последовательность 5 ' - CTATTCGTAATCGTGCCTTCCG-3 ' , праймер Xfcp623R — 5 ' -CCTTCTCT-CTCACCGCTATCTCATC-3 ' . Размер ампликона составлял 380 п.н. (28-30).
Присутствие продукта амплификации маркера указывало на наличие доминантного аллеля Tsn1 (восприимчивость к белку-токсину гриба Ptr ToxA), отсутствие — на наличие рецессивного аллеля tsn1 (устойчивость к
Ptr ToxA).
Статистическую обработку данных проводили с использованием компьютерной программы Statistica 12 («StatSoft, Inc.», США). Рассчитывали среднее поражение листовой пластины пиренофорозом при полевой оценке ( M ) и стандартное отклонение (±SD). Для разделения изученных сортов пшеницы по устойчивости/восприимчивости к пиренофорозу использовали t -критерий Стьюдента с поправкой Бонферрони. Этот критерий применяли для проверки значимости различия между фитопатологическими оценками сортов пшеницы (31).
Результаты. Как известно, климатические условия существенно влияют на развитие биологических систем. Повышение температуры и проявление засухи из-за изменения климата приводят к быстрому старению листьев, увеличивается распространение листовых пятнистостей (32). Метеоусловия вегетационных периодов 2020-2022 годов в регионе оказали благоприятное влияние на развитие возбудителя желтой пятнистости листьев пшеницы. Наибольшая степень поражения пшеницы пиренофорозом наблюдалась в 2022 году (более 40 % на восприимчивых сортах).
-
1. Характеристика сортов пшеницы ( Triticum aestivum L.), возделываемых на территории Нижневолжского региона, по устойчивости к возбудителям желтой и темно-бурой пятнистостей
-
2. Результаты дисперсионного анализа апостериорных сравнений сортов пшеницы ( Triticum aestivum L.) в зависимости от поражения Pyrenophora tritici-repentis в полевых условиях, полученные с использованием t -критерия Стьюдента с поправкой Бонферрони (селекционный питомник ФГБНУ Федеральный аграрный научный центр Юго-Востока, г. Саратов, 2020-2022 годы)
Сорт
ГЧ
Д
Я
2 П
и о
rt я
и
д Я
к rt W
и о д о
&
§
rt
о
§ W
д о ЕТ
и о
rt я
и
и о к
д S
й
и О
Я и
^
2 я о К
S
3
о и
s
о и
е
W и О я о X о я к
сч
У о
о
6
S
и о
rt я
и
и о
rt я
и
1 и
X
5
п
Гостианум 237
0*
0*
0,52
0,28
0,28
0*
0*
0*
0*
0,79
0*
0,28
0,53
0,13
0*
0,04*
0,28
0*
0*
Лютесценс 230
0,18
0*
0*
0*
0*
0*
0*
0,65
0*
0,18
0*
0*
0*
1
0*
0*
0,04*
0,37
Саратовская 8
0*
0*
0,01*
0*
0*
0*
0,04*
0*
0,01*
0,01*
0*
0,03*
0,04*
0,08
0,01*
0,65
0,03*
Губерния
0,65
0,65
0*
0*
0*
0*
0,37
0*
0,65
1
0,37
0*
0,04*
0,65
0,01*
0*
Мироновская 808
1
0*
0*
0*
0*
0,18
0*
1
0,65
0,65
0*
0,37
1
0,03*
0*
Донская безостая
0*
0*
0*
0*
0,18
0*
1
0,65
0,65
0*
0,04*
1
0,03*
0*
Саратовская 90
0,08
0,08
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
Жемчужина Поволжья
1
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
Саратовская 17
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
0*
Калач 60
0*
0,08
0*
0*
0*
0,65
0,01*
0*
0,04*
0,18
Подруга
0*
0,18
0,37
0,08
0*
0,03*
0,18
0*
0*
Анастасия
0*
0*
0*
0,18
0*
0*
0*
0,65
Соседка
0,65
0,65
0*
0,04*
1
0,03*
0*
Фаворит
0,37
0*
0,04*
0,65
0,01*
0*
Прохоровка
0*
0,04*
0,65
0,04*
0*
Юго-Восточная 2
0*
0*
0,04*
0,37
Саратовская 70
0,04*
0,18
0*
Саратовская 73
0,03*
0*
Белянка
0,01*
* Отмечены разности, значимые на уровне p ≤ 0,05.
|
Сорт (аллель) |
Полевая оценка ( Pyreno-phora tritici-repentis ), % |
Лабораторная оценка, балл (фенотип) |
|||
|
P. tritici-repentis |
Bipolaris sorokiniana |
||||
|
M ±SD ( n = 90) |
фенотип устойчивости |
TохА |
TохВ |
||
|
Пшеница мягкая озимая |
|||||
|
Гостианум 237 ( tsn1 ) |
4,3±1,15 |
RR |
2/1 (MR) |
2/2 (MR) |
4 (S) |
|
Лютесценс 230 ( Tsn1 ) |
23,3±5,77 |
MS |
1/2 (MR) |
1/1 (R) |
2 (MR) |
|
Саратовская 8 ( Tsn1 ) |
18,3±2,89 |
R |
1/1 (R) |
1/1 (R) |
3 (MS) |
|
Губерния* ( Tsn1 ) |
6,7±2,89 |
RR |
3/2 (S) |
3/2 (S) |
2 (MR) |
|
Мироновская 808* ( tsn1 ) |
8,3±5,77 |
RR |
3/2 (S) |
1/1 (R) |
2+,3 (MS) |
|
Донская безостая* ( Tsn1 ) |
8,3±2,89 |
RR |
3/2 (S) |
1/1 (R) |
3 (MS) |
|
Саратовская 90* ( Tsn1 ) |
48,3±2,89 |
S |
1/1 (R) |
3/3 (S) |
3 (MS) |
|
Жемчужина Поволжья* ( Tsn1 ) |
41,7±5,77 |
S |
3/3 (S) |
3/3 (S) |
4 (S) |
|
Саратовская 17* ( Tsn1 ) |
41,7±5,77 |
S |
1/1 (R) |
3/3 (S) |
4 (S) |
|
Калач 60* ( Tsn1 ) |
21,7±7,64 |
MS |
1/1 (R) |
1/1 (R) |
2+,3 (MS) |
|
Подруга* ( tsn1 ) |
3,3±2,89 |
RR |
3/3 (S) |
3/3 (S) |
3 (MS) |
|
Анастасия* ( Tsn1 ) |
28,3±2,89 |
MS |
1/1 (R) |
3/3 (S) |
3 (MS) |
|
Соседка ( Tsn1 ) |
8,3±5,77 |
RR |
1/0 (R) |
1/1 (R) |
3 (MS) |
|
Пшеница мягкая яровая |
|||||
|
Фаворит* ( tsn1 ) |
6,7±2,89 |
RR |
1/1(R) |
1/1 (R) |
4 (S) |
|
Прохоровка* ( tsn1 ) |
10,0±5,00 |
RR |
3/3 (S) |
1/1 (R) |
4 (S) |
|
Юго-Восточная 2* ( tsn1 ) |
23,33±5,77 |
MS |
3/3 (S) |
3/3 (S) |
4 (S) |
|
Саратовская 70* ( tsn1 ) |
11,7±2,89 |
R |
3/3 (S) |
2/2 (MR) |
4 (S) |
|
Саратовская 73* ( tsn1 ) |
8,3±2,89 |
RR |
1/1 (R) |
2/2 (MR) |
3 (MS) |
|
Белянка* ( tsn1 ) |
16,7±5,77 |
R |
1/1 (R) |
1/1 (R) |
2 (MR) |
|
Лебедушка* ( Tsn1 ) |
26,7±2,89 |
MS |
3/3 (S) |
3/3 (S) |
3 (MS) |
Пр и м еч ани е. RR — высокая устойчивость, R — устойчивость, MR — умеренная устойчивость, MS — умеренная восприимчивость, S — восприимчивость. Полевые испытания проводили в 2020-2022 годах в селекционном питомнике ФГБНУ Федеральный аграрный научный центр Юго-Востока (г. Саратов). Звездочкой отмечены сорта, допущенные к возделыванию на территории Нижневолжского региона РФ (8-й регион) (13).
По данным, полученным в 2020-2022 годах в селекционном питомнике ФГБНУ ФАНЦ Юго-Востока, изученные сортообразцы мягкой озимой и яровой пшеницы характеризовались разной устойчивостью к местной популяции возбудителя P. tritici-repentis (табл. 1). Степень поражения сортов Гостианум 237, Губерния, Мироновская 808, Донская безостая, Подруга, Соседка, Фаворит, Прохоровка и Саратовская 73 не превышала 8 %, поэтому они вошли в группу высокоустойчивых (RR). Сорта Саратовская 8, Саратовская 70 и Белянка оказались устойчивыми (R) со средней степенью поражения не более 18 %.
Умеренную восприимчивость (MS) показали Лютесценс 230, Калач 60, Анастасия, Юго-Восточная 2 и Лебедушка. Остальные сорта оказались восприимчивыми к поражению пиренофорозом в полевых условиях (см. табл. 1).
Для установления достоверности различий между сортами пшеницы, ранжированными по группам устойчивости (RR, R, MS, S) к пире-нофорозу, мы использовали t -критерий Стьюдента с поправкой Бонфер-рони (табл. 2). Были обнаружены статистически значимые различия между средними значениями показателей полевой фитопатологической оценки сортов по устойчивости к P. tritici-repentis у образцов, входящих в разные группы — RR, R, MS и S (см. табл. 2) . При этом различий между сортами, входящими в одну группу, не выявили. Исключением были сорта Лютесценс 230 (MS) и Саратовская 8 (R) (средняя степень поражения пирено-форозом соответственно 23 и 18 %), а также сорта Мироновская 808 (RR) и Саратовская 70 (R) (8 и 12 %). Между этими парами сортов не удалось выявить статистически значимых различий (р > 0,05).
Л.А. Михайлова с соавт. (25) в результате анализа свыше 1000 образцов из коллекции ВИР определили, что частота устойчивых форм среди образцов озимой пшеницы выше, чем среди яровых. Скрининг по устойчивости к желтой пятнистости 209 сортов озимой и 136 сортов яровой пшеницы, включенных в Государственный реестр селекционных достижений РФ до 2010 года, показал, что около 40 % сортов озимой пшеницы и 16 % яровой характеризовались разной степенью устойчивости к P. tritici-repentis , остальные сортообразцы оказались восприимчивыми (25).
В связи с незначительным проявлением темно-бурой пятнистости в естественных условиях Нижневолжского региона сделать объективную полевую оценку на устойчивость сортообразцов пшеницы не удалось. Однако в условиях изменения климата, последствия которого наблюдаются в регионе ежегодно, вопрос о создании перспективного устойчивого селекционного материала, в том числе к темно-бурой пятнистости, несомненно, актуален. Особую значимость эта проблема приобретает сейчас, когда патоген под влиянием различных факторов (биологические особенности, антропогенное воздействие и т.п.) расширяет ареал распространения.
Несмотря на внушительное число сортов пшеницы, допущенных к использованию в различных регионах России, высокоустойчивых к темнобурой пятнистости сортообразцов, вероятно, недостаточно. Например, в Республике Татарстан при сильном развитии темно-бурой пятнистости большинство сортов яровой пшеницы оказались восприимчивы к поражению (11). В Приамурье в условиях эпифитотии темно-бурой пятнистости выявлены образцы пшеницы с разной степенью устойчивости, а устойчивых к B. sorokiniana сортов ячменя обнаружено не было (16). В исследованиях А.В. Сидорова с соавт. (14) среди изученных образцов яровой мягкой пшеницы из мировой коллекции Всероссийского НИИ растениеводства им. Н.И Вавилова не было идентифицировано высокоустойчивых к темнобурой листовой пятнистости.
В результате проведенных нами лабораторных испытаний была дана оценка устойчивости сортов к возбудителям пиренофорозной и темно-бурой пятнистостей. При инокуляции образцов высокую устойчивость к обоим изолятам P. tritici-repentis (ТохА и Тох B) отмечали у сортов Саратовская 8, Калач 60, Соседка, Фаворит, Белянка. К изоляту, несущему ген ТохА, высокую устойчивость показали сортообразцы Саратовская 90, Саратовская 17, Анастасия, Саратовская 73, к изоляту с геном Тох B — Лю- тесценс 230, Мироновская 808, Донская безостая, Прохоровка. Умеренную устойчивость к обоим изолятам P. tritici-repentis показали Гостианум 237, Лютесценс 230, к изоляту с геном TохB — Саратовская 70, Саратовская 73. Общая доля сортов, устойчивых к изолятам P. tritici-repentis, продуцирующим токсины TохА и TохB, составила 40 %, к изоляту с геном TохА — 55 %, с Tох B — 60 %. Восприимчивыми к обоим изолятам оказались образцы Губерния, Жемчужина Поволжья, Подруга, Юго-Восточная 2 и Лебедушка.
Н.М. Коваленко с соавт. (1) при скрининге 70 сортов мягкой пшеницы, впервые включенных в Государственный реестр селекционных достижений РФ в 2018-2020 годах, выявили, что доля сортов, устойчивых в фазу проростков к изолятам, продуцирующим токсины ToxA и ToxB, составила 13 %, к изоляту, образующему ToxA, — 21 %, ToxB — 43 %.
Наличие доноров устойчивости среди российских сортов пшеницы создает возможность для успешной селекции на иммунитет к желтой пятнистости. Это особенно актуально в современных условиях, когда распространение заболеваний по зернопроизводящим регионам России стало практически повсеместным, а потери урожая зерна могут составлять более 50 %.
В наших исследованиях при искусственном заражении сортообраз-цов пшеницы возбудителем B. sorokiniana высоустойчивых образцов выявлено не было. Однако среднюю устойчивость (MR) продемонстрировали три сорта — Лютесценс 230, Губерния и Белянка. Остальные образцы оказались восприимчивыми. Общая доля сортов, устойчивых к B. sorokiniana , составила 15 %.
Кроме полевой и лабораторной оценки на устойчивость сортов к возбудителю P. tritici-repentis был проведен скрининг сортообразцов на присутствие доминантного ( Tsn1 ) или рецессивного ( tsn1 ) аллеля в генотипе (рис.).
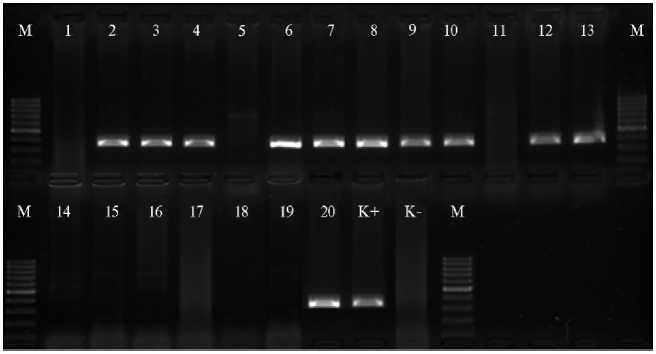
Электрофореграмма продуктов амплификации маркера Xfcp623 у сортов озимой мягкой пшеницы ( Triticum aestivum L.): 1 — Гостианум 237, 2 — Лютесценс 230, 3 — Саратовская 8, 4 — Губерния, 5 — Мироновская 808, 6 — Донская безостая, 7 — Саратовская 90, 8 — Жемчужина Поволжья, 9 — Саратовская 17, 10 — Калач 60, 11 — Подруга, 12 — Анастасия, 13 — Соседка, 14 — Фаворит, 15 — Прохоровка, 16 — Юго-Восточная 2, 17 — Саратовская 70, 18 — Саратовская 73, 19 — Белянка, 20 — Лебедушка. М — ДНК маркер Step100 plus («Биолабмикс», Россия). Положительный контроль (К+) — сорт Glenlea, отрицательный контроль (К-) — линия 6В365. Размер диагностического фрагмента 380 п.н.
Среди 20 изучаемых сортообразцов только 3 сорта озимой (Гостиа-нум 237, Мироновская 808, Подруга) и 6 сортов яровой мягкой пшеницы (Фаворит, Прохоровка, Юго-Восточная 2, Саратовская 70, Саратовская 73, Белянка) несли аллель tsn1, что указывает на их устойчивость к изолятам, продуцирующим PtrToxA, на генетическом уровне.
Результаты идентификации аллелей Tsn1 и tsn1 с использованием молекулярного маркера Xfcp623 показали преимущественное присутствие Tsn1 у озимых сортов пшеницы (рис.).
Согласно данным литературы, одним из факторов сохранения и распространения изолятов с геном ToxA в популяции становится их отбор на сортах с геном восприимчивости Tsn1 (33) . Предполагается, что половая стадия P. tritici-repentis преимущественно наблюдается на озимых сортах и приводит к сохранению гена ToxA (34) .
Из 20 проанализированных патосистем сорт—изолят Tsn1 — ToxA взаимодействие генов почти в половине случаев (45,5 %) осуществлялось по типу ген-на-ген, то есть приводило к поражению сортов с доминантным аллелем Tsn1 изолятами P. tritici-repentis с геном ToxA. В остальных 54,5 % случаях наблюдалась реакция устойчивости. Сорта с рецессивными аллелями tsn1 изолятами ToxA поражались в 54,5 % комбинаций, остальные оставались устойчивыми. По-видимому, это происходило потому, что мы использовали не чистый токсин, а споровый материал гриба, несущего ген ToxA и способного продуцировать кроме PtrToxA пока не идентифицированные токсины (3, 5, 8).
Н.В. Мироненко с соавт. (34) объясняют устойчивость сортов с доминантным аллелем Tsn1 к изолятам P. tritici-repentis с геном ToxA возможным снижением экспрессии гена ToxA под влиянием генетического фона конкретного сорта. Поражение сортов с рецессивными аллелями tsn1 может свидетельствовать либо об отсутствии взаимоотношений между генами по типу ген-на-ген, либо о наличии других генов-эффекторов и генов восприимчивости в патосистеме.
В целом, из 20 исследованных нами сортообразцов озимой и яровой мягкой пшеницы только сорт Белянка характеризовался устойчивостью сразу к двум возбудителям. В полевых условиях он показал устойчивость к P. tritici-repentis , в лабораторных — к изолятам P. tritici-repentis с ToxA и ToxB , а также обладал средней устойчивостью к B. sorokiniana . Кроме того, сорт Белянка несет ген tsn1 , что свидетельствует об устойчивости к P. tritici-re-pentis с ToxA .
Таким образом, в результате скрининга 20 сортов мягкой пшеницы, перспективных и допущенных к возделыванию в Нижневолжском регионе Российской Федерации, выявлены образцы, устойчивые к возбудителю пи-ренофорозной пятнистости, а также среднеустойчивые к возбудителю темнобурой пятнистости. Доля сортов, устойчивых к изолятам Pyrenophora tritici-repentis , продуцирующим токсины PtrTохА и PtrTохB, составила 40 %, к продуцентам PtrTохА — 55 %, PtrTохB — 60 %. Доля сортов, показавших среднюю устойчивость к возбудителю Bipolaris sorokiniana , составила всего 15 %. Наибольший интерес представляют генотипы трех сортов озимой мягкой пшеницы (Гостианум 237, Мироновская 808, Подруга) и 5 генотипов яровой мягкой пшеницы (Фаворит, Прохоровка, Саратовская 70, Саратовская 73, Белянка), которые оказались устойчивы к пиренофорозу в лабораторных и трехлетних полевых испытаниях. При молекулярном скрининге у этих сортов также подтвердилась невосприимчивость к продуцентам PtrToxА, поскольку указанные сорта несли аллель tsn1 , что свидетельствует об их устойчивости к белку-токсину гриба PtrToxA. Указанные сортообразцы рекомендуются к использованию в селекционных программах региона по повышению устойчивости пшеницы к возбудителям желтой и темно-бурой пятнистостей листьев.
Список литературы Характеристика перспективных сортов пшеницы (Triticum aestivum L.), допущенных к возделыванию в Нижневолжском регионе, по устойчивости к возбудителям пиренофорозной и темно-бурой пятнистости
- Коваленко Н.М., Шайдаюк Е.Л., Гультяева Е.И. Характеристика устойчивости районированных сортов мягкой пшеницы к возбудителю желтой пятнистости. Биотехнология и селекция растений, 2022, 5(2): 15-24 (doi: 10.30901/2658-6266-2022-2-o3).
- Bankina B., Bimšteine G., Arhipova I., Kaneps J., Darguža M. Impact of crop rotation and soil tillage on the severity of winter wheat leaf blotches. Rural Sustainability Research, 2021, 45(340): 21-27 (doi: 10.2478/plua-2021-0004).
- Effertz R.J., Meinhardt S.W., Anderson J., Jordahl J.G., Francl L.J. Identification of a chlorosis-inducing toxin from Pyrenophora tritici-repentis and the chromosomal location of an insensitivity locus in wheat. Phytopathology, 2002, 92(5): 527-533 (doi: 10.1094/PHYTO.2002.92.5.527).
- Ramos E.R., Kutcher R., Dallagnol J. Pyrenophora tritici-repentis: a worldwide threat to wheat. In: Wheat [Working Title]. IntechOpen, 2023 (doi: 10.5772/intechopen.110306).
- Corsi B., Percival-Alwyn L., Downie R.C., Venturini L., Iagallo E.M., Mantello C.C., McCor-mick-Barnes Ch., Theen See P., Oliver R.P., Moffat C.S., Cockram J. Genetic analysis of wheat sensitivity to the ToxB fungal effector from Pyrenophora tritici-repentis, the causal agent of tan spot. Theoretical and Applied Genetics, 2020, 133: 935-950 (doi: 10.1007/s00122-019-03517-8).
- Strelkov S., Lamari L. Host parasite interactions in tan spot [Pyrenophora tritici-repentis] of wheat. Canadian Journal of Plant Pathology, 2003, 25(4): 339-349 (doi: 10.1080/07060660309507089).
- Faris J.D., Overlander M.E., Kariyawasam G.K., Carter A., Xu S.S., Liu Z. Identification of a major dominant gene for race-nonspecific tan spot resistance in wild emmer wheat. Theoretical and Applied Genetics, 2020, 133(3): 829-841 (doi: 10.1007/s00122-019-03509-8).
- Gourlie R., McDonald M., Hafez M., Ortega-Polo R., Low K.E., Abbott D.W., Strelkov S. E., Daayf F., Aboukhaddou R. The pangenome of the wheat pathogen Pyrenophora tritici-repentis reveals novel transposons associated with necrotrophic effectors ToxA and ToxB. BMC Biology, 2022, 20(1): 239 (doi: 10.1186/s12915-022-01433-w).
- Friesen T.L., Holmes D.J., Bowden R.L., Faris J.D. ToxA is present in the u.s. Bipolaris sorokin-iana population and is a significant virulence factor on wheat harboring Tsn1. Plant Disease. 2018, 102(12): 2446-2452 (doi: 10.1094/PDIS-03-18-0521-RE).
- Bertagnolli V.V., Ferreira J.R., Liu Z., Rosa A.C., Deuner C.C. Phenotypical and genotypical characterization of Pyrenophora tritici-repentis races in Brazil. European Journal of Plant Pathology, 2019, 154(4): 995-1007 (doi: 10.1007/s10658-019-01720-3).
- Асхадуллин Дан.Ф., Асхадуллин Дам.Ф., Василова Н.З., Жарехина Т.В., Гайфуллина Г.Р., Хусаинова И.И., Багавиева Э.З., Тазутдинова М.Р. Темно-бурая листовая пятнистость на яровой мягкой пшенице в Татарстане. Защита и карантин растений, 2018, 9: 17-19.
- Novakazi F., Afanasenko O., Lashina N., Platz G. J., Snowdon R., Loskutov I., Ordon F. Ge-nome-wide association studies in a barley (Hordeum vulgare) diversity set reveal a limited number of loci for resistance to spot blotch (Bipolaris sorokiniana). Plant Breeding, 2020, 139(3): 521-535 (doi: 10.1111/pbr.12792).
- Gupta P.K., Chand R., Vasistha N.K., Pandey S.P., Kumar U., Mishra V.K., Joshi A.K. Spot blotch disease of wheat: the current status of research on genetics and breeding. Plant Pathology, 2018, 67(3): 508-531 (doi: 10.1111/ppa.12781).
- Сидоров А.В., Захаров В.Г., Тырышкин Л.Г. Полевая устойчивость образцов овса и ячменя к грибным листовым болезням. Известия Санкт-Петербургского государственного аграрного университета, 2018, 53: 76-79 (doi: 10.24411/2078-1318-2018-14076).
- Кремнева О.Ю., Костенко И.А., Пачкин А.А., Данилов Р.Ю., Пономарев А.В., Ким Ю.С. Картирование распространения и развития фитопатогенов на пшенице и ячмене с использованием NextGIS. Зерновое хозяйство России, 2020, 3(69): 61-66 (doi: 10.31367/2079-8725-2020-69-3-61-66).
- Макарова М.А., Карачева Г.С., Ломакина И.В. Источники устойчивости яровых пшеницы и ячменя к грибным болезням в Приамурье. Защита и карантин растений, 2018, 8: 41-43.
- Акулов А.Ю. Биологические особенности Bipolaris sorokiniana (Sacc. in Sorokin) Shoem и дифференцированная диагностика возбудителей корневой гнили и черного зародыша ячменя. Канд. дис. Харьков, 2006: 232.
- Lillemo M., Joshi A.K., Prasad R., Chand R., Singh R. QTL for spot blotch resistance in bread wheat line Saar co'locate to the biotrophic disease resistance loci Lr34 and Lr46. Theoretical and Applied Genetics, 2013, 126(3): 711-719 (doi: 10.1007/s00122-012-2012-6).
- Joshil A.K., Chand R. Variation and inheritance of leaf angle, and its association with spot blotch (Bipolaris sorokiniana) severity in wheat (Triticum aestivum). Euphytica, 2002, 124: 283-291 (doi: 10.1023/A:1015773404694).
- Мироненко Н.В., Коваленко Н.М. Особенности взаимодействия генов Tsn1 и ToxA в па-тосистеме Triticum aestivum — Pyrenophora tritici-repentis. Вестник защиты растений, 2018, 2(96): 12-16.
- Конькова Э.А., Лящева С.В. Желтая пятнистость листьев озимой мягкой пшеницы в Саратовской области. Зерновое хозяйство России, 2020, 3(69): 67-71 (doi: 10.31367/2079-8725-2020-69-3-67-71).
- Kumarbayeva M., Kokhmetova A., Kovalenko N.M., Atishova M., Keishilov Z., Aitymbetova K. Characterization of Pyrenophora tritici-repentis (tan spot of wheat) races in Kazakhstan. Phyto-pathologia Mediterranea, 2022, 61(2): 243-257 (doi: 10.36253/phyto-13178).
- Государственный реестр селекционных достижений, допущенных к использованию. Т.1. «Сорта растений» (официальное издание). М., 2022: 646.
- Коломиец Т.М., Пахолкова Е.В., Дубовая Л.П. Отбор исходного материала для создания сортов пшеницы с длительной устойчивостью к септориозу. М., 2017: 56.
- Михайлова Л.А., Мироненко Н.В., Коваленко Н.М. Желтая пятнистость пшеницы. Методические указания по изучению возбудителя желтой пятнистости Pyrenophora tritici-re-pentis и устойчивости сортов. СПб, 2012: 64.
- Смурова С.Г. Новые источники и доноры устойчивости пшеницы к Cochliobolus sativus Drechs. ex Dastur. Канд. дис. СПб, 2008: 236.
- Doyle J.J., Doyle J.L. Isolation of plant DNA from fresh tissue. Focus, 1990, 12(1): 13-15.
- Röder M.S., Korzun V., Wendehake K., Plaschke J., Tixier M.H., Leroy Ph., Ganal M.W. A mi-crosatellite map of wheat. Genetics, 1998, 149(4): 2007-2023 (doi: 10.1093/genetics/149.4.2007).
- Zhang Z., Friesen T.L., Simons K.J., Xu S.S., Faris J.D. Development, identification, and vali-dation of markers for marker-assisted selection against the Stagonospora nodorum toxin sensitivity genes Tsn1 and Snn2 in wheat. Molecular Breeding, 2009, 23: 35-49 (doi: 10.1007/s11032-008-9211-5).
- Faris J.D., Zhang Z., Lu H.J., Lu S.W., Reddy L., Cloutier S., Fellers J.P., Meinhardt S.W., Rasmussen J.B., Xu S.S., Oliver R.P., Simons K.J., Friesen T.L. A unique wheat disease re-sistance-like gene governs effector-triggered susceptibility to necrotrophic pathogens. Proceedings of the National Academy of Sciences USA, 2010, 107(30): 13544-13549 (doi: 10.1073/pnas.1004090107).
- Трухачева Н.В. Медицинская статистика: уч. пос. Ростов-на-Дону, 2017.
- Кохметова А.М., Али С., Сапахова З., Атишова М.Н. Идентификация генотипов-носите-лей устойчивости к токсинам пиренофороза PtrToxA и PtrToxB Pyrenophora tritici-repentis в коллекции мягкой пшеницы. Вавиловский журнал генетики и селекции, 2018, 22(8): 978-986 (doi: 10.18699/VJ18.440).
- Мироненко Н.В., Баранова О.А., Коваленко Н.М., Афанасенко О.С., Михайлова Л.А. Селективное влияние сортов пшеницы с геном Тsn1 на формирование популяции возбуди-теля желтой пятнистости Pyrenophora tritici-repentis. Вестник защиты растений, 2017, 3 (93): 23-27.
- Мироненко Н.В., Баранова О.А., Коваленко Н.М. Роль полового процесса в сохранении чужеродной транслокации гена TохА в геноме Pyrenophora tritici-repentis. Микология и фитопатология, 2019, 53(2): 115-123 (doi: 10.1134/S0026364819020077).


