Характеристика приживления и гистоструктуры васкуляризованных кожно-фасциальных лоскутов в условиях применения микроинъекций лиофилизата мозговой ткани
Автор: Щудло Наталья Анатольевна, Варсегова Татьяна Николаевна, Щудло Михаил Моисеевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Цель. Выявление возможного влияния субдермальных инъекций церебролизина на показатели приживления и гистоморфометрические характеристики биологической модели продлённого кожно-фасциального лоскута с осевым кровоснабжением. Материалы и методы. У 29 крыс на основе поверхностной нижней эпигастральной артерии (SIEA) сформирован лоскут, продлённый в краниальную сторону по шаблону площадью 18 см2, и после 90-минутного клипирования бедренной артерии у места отхождения SIEA реплантирован. После операции выполнены субдермальные микроинъекции церебролизина (по 0,1 мл) - четыре в межангиосомной зоне (группа Cer 1) и в количестве шести с равномерным распределением по площади лоскута (группа Сer 2). Группы сравнения (Comp 1 и 2) - аналогичные инъекции физиологического раствора. Негативный контроль - лоскуты без инъекций. Условная норма - контралатеральные участки кожи. Через 12 дней после операции животные эвтаназированы. Методы: компьютерная планиметрия, гистоморфометрия, иммуногистохимия. Результаты. В группах Cer 1 и 2 по сравнению с негативным контролем и плацебо достоверно уменьшены относительные площади дефектов эпидермиса, связанные с частичным некрозом лоскута либо замедленным раневым заживлением (2,15 % и 0,23 % против 13,72 % и 11,33 % соответственно). В Cer 1 отмечена гиповаскуляризация гиподермы, истончение эпидермиса и дермы. В Сer 2 по сравнению с контролем и Cer 1 выявлены наибольшие толщина и капилляризация дермы и гиподермы, а также толщина эпидермиса и численная плотность придатков кожи. Обсуждение. Выраженное уменьшение полиморфноклеточной инфильтрации дермы и гиподермы в опытных группах свидетельствует, что стимулированный субдермальными микроинъекциями церебролизина ангиогенез в дерме протекал на фоне торможения воспалительных реакций и был обусловлен прямым действием на эндотелиальные клетки. Вывод. Для оптимизации приживления кожно-фасциальных лоскутов с осевым кровоснабжением в случаях, когда их площадь превышает территорию кровоснабжающей артерии, целесообразно применение микроинъекций церебролизина, равномерно распределённых по всей площади лоскута, включая его ангиосомную и межангиосомную зоны.
Васкуляризованный кожно-фасциальный лоскут, церебролизин, ангиогенез
Короткий адрес: https://sciup.org/142213595
IDR: 142213595 | УДК: 591.41-003.93:[616.5+616.75]-089.843-092.9 | DOI: 10.18019/1028-4427-2017-23-4-471-475
Текст научной статьи Характеристика приживления и гистоструктуры васкуляризованных кожно-фасциальных лоскутов в условиях применения микроинъекций лиофилизата мозговой ткани
Частичный некроз кожных лоскутов относится к числу существенных проблем реконструктивной хирургии [1]. В случаях применения лоскутов с осевым кровоснабжением основная причина этого осложнения – дефицит кислорода и нутриентов в удалённых от сосудистой ножки участках [2]. Отсутствие эффективной терапии приводит к ухудшению функциональных и эстетических результатов и необходимости повторных опера- ций. Наиболее привлекательной стратегией решения этой проблемы является терапевтический ангиогенез, который может быть индуцирован применением молекулярных регуляторов – факторов роста, контролирующих деление, рост, дифференцировку и метаболизм клеток; наиболее эффективным среди них считается фактор роста сосудистого эндотелия VEGF [3]. В клинике для лечения критической ишемии конечностей применяется
генный препарат VEGF [4], имеющий высокую коммерческую стоимость. Более доступный пептидергический препарат церебролизин (лиофилизат головного мозга свиней) реагирует с антителами к нескольким нейротрофическим факторам, а также инсулиноподобному фактору (IGF) первого и второго типов [5]. Церебролизин снижает вызванный оксидативным стрессом апоптоз в различных тканях [6], IGF-1 усиливает ангиогенез и уменьшает реперфузионные повреждения [7]. Логично предположить, что применение такого препарата позво- лит оптимизировать приживление васкуляризованных кожно-фасциальных лоскутов, в том числе в тех случаях, когда их площадь превышает территорию кровоснабжающей артерии.
Цель исследования – выявление возможного влияния субдермальных инъекций церебролизина на показатели приживления и гистоморфометрические характеристики биологической модели продлённого кожно-фасциального лоскута с осевым кровоснабжением.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на 29 крысах-самцах линии Вистар (вес от 380 до 560 г, возраст 8–12 месяцев) с соблюдением требований Приказа МЗ РФ № 267 от 19.06.2003. Под общим обезболиванием в условиях операционной по шаблону 3 × 6 см проведено формирование и репозиция кожно-фасциального лоскута с осевым типом кровоснабжения на основе a. epigastrica inferior superficialis (SIEA). Скальпелем проведены разрезы: медиальный – на 0,5 см латеральнее белой линии живота, краниальный – по нижнему краю рёберной дуги, каудальный – параллельно краниальному, отступая на 6 см, и латеральный – параллельно медиальному в 3-х см от него. Питающую ножку (SIEA, сопровождающие вены и нервы) выделяли с окружающими тканями. Краниальная часть лоскута относилась к ангиосому a. thoracica lateralis и после формирования лоскута не перфузировалась ею (рис. 1, а). Моделирование релевантной клиническим операциям по пересадке и транспозиции лоскутов полуторачасовой ишемии выполнено путём клипирования питающей артерии в течение 90 минут. Крысы были рандомически распределены на 5 групп: негативный контроль – без терапевтических воздействий на процесс приживления (n = 10), две опытные группы: Сer 1 – через час после операции выполнены 4 субдермальные микроинъекции по 0,1 мл цереброли-зина (рис. 1, б) в межангиосомной зоне лоскута (n = 5), Сer 2 – 6 микроинъекций, равномерно распределённых (рис. 1, в) по площади лоскута (n = 5), а также две груп- пы сравнения (Сomp 1 – n = 4 и Сomp 2 – n = 5) c аналогичными инъекциями физиологического раствора. Через 12 дней после операции крыс эвтаназировали. В масштабированных полноцветных цифровых изображениях кожной поверхности лоскутов методом компьютерной планиметрии определена степень их контракции (% от площади шаблона). Состояние лоскутов оценивали визуально и стереологически – по результатам расчета доли (%) дефектов эпидермиса в площади лоскута методом точко-счетной планиметрии.
Для гистологического исследования иссекали стандартные фрагменты лоскутов опытных и контрольной групп. Условная норма (позитивный контроль) – образцы контралатеральных участков кожи. Парафиновые срезы толщиной 5–7 мкм окрашивали по ван Гизону и гематок-силином-эозином, часть помещали на стёкла с адгезивным покрытием (поли-L-лизин), определяли экспрессию белков ki-67 (маркёра пролиферации) и vWF (маркёра эндотелиоцитов) по протоколу фирмы-производителя с использованием систем визуализации Novolink Polymer (Novocastra, Великобритания). Препараты изучали с помощью стереомикроскопа «AxioScope.A1» с цифровой камерой «AxioCam» (Carl Zeiss MicroImaging GmbH, Германия). Гистоморфометрия выполнена в компьютерной программе «ВидеоТесТ Мастер-Морфология, 4.0», статобработка – в программе Attestat 9.3.1 (разработчик – И.П. Гайдышев) с применением критериев Манна-Уитни и интервального критерия рандомизации.
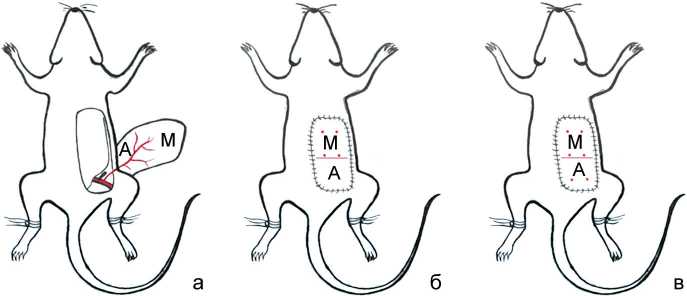
Рис. 1. Схема эксперимента: а – клипирование артерии, питающей продлённый лоскут с осевым кровоснабжением, А – ангиосом-ная, М – межангиосомная части лоскута. Топография субдермальных микроинъекций: б – в группах Сer 1 и Comp 1, в – группах Сer 2 и Сomp 2
РЕЗУЛЬТАТЫ
Примеры исходов реплантации продлённого SIEA-лоскута крыс после полуторачасовой ишемии-реперфузии представлены на рисунке 2.
К 12 суткам после операции полное приживление лоскута и раневое заживление отмечено только у одного животного из 10 в контрольной группе и у трёх из 10 в опытных группах (табл. 1). Частотное распределение дефектов заживления и приживления в контрольной группе и группах сравнения с введением физиологического раствора было сопоставимым. В опытных группах некроз межангиосомной зоны не наблюдался ни у одного животного, что статистически значимо отличает их от групп без фармакологических воздействий (p < 0,001 по критерию Барнарда).
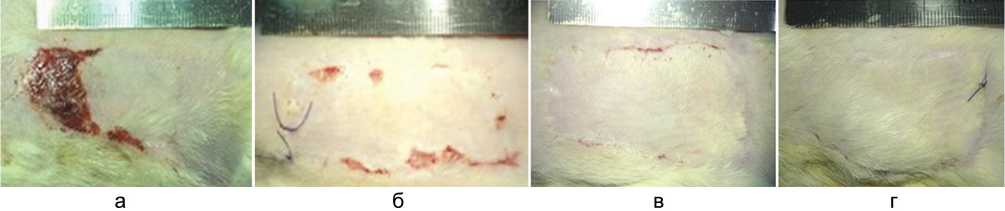
Рис. 2. Варианты исходов реплантации продлённого SIEA-лоскута крыс после полуторачасовой ишемии-реперфузии через 12 суток после операции: а – некроз межангиосомной зоны и краевой некроз; б – краевой некроз лоскута и неполное раневое заживление, в – неполное раневое заживление, г – полное приживление и раневое заживление с восстановлением шерстного покрова лоскута
Таблица 1
Исходы реплантации продлённого лоскута с осевым кровоснабжением через 12 суток после операции
|
Критерий/группа |
Полное приживление и раневое заживление |
Дефекты заживления и приживления |
||
|
Неполное раневое заживление |
+ Краевой некроз |
+ Некроз межангиосомной зоны |
||
|
Control (n = 10) |
1 |
3 |
5 |
1 |
|
Comp 1 + Comp 2 (n = 9) |
0 |
3 |
5 |
2 |
|
Cer 1 + Cer 2 (n = 10) |
3 |
2 |
5 |
0 |
Относительная площадь дефектов эпидермиса в контрольной группе составила 13,72 ± 9,17 %, в группах с физиологическим раствором – 11,33 ± 3,68 %, в Cer 1 – 2,15 ± 0,85 %, в Сer 2 – 0,23 ± 0,17 %; разница опытных групп между собой, а также от контроля и плацебо статистически значима (p < 0,05).
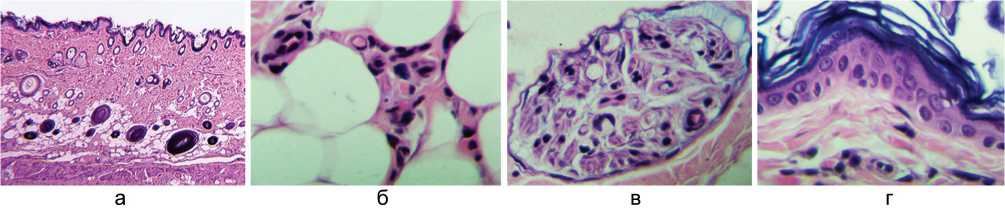
При исследовании гистологических препаратов установлено, что по сравнению с контролем в опытных группах существенно снижена полиморфноклеточная инфильтрация дермы и гиподермы. У животных группы Сer 1 аналогично контролю атрофированы panniculus carnosum и подкожная жировая клетчатка, в некоторых участках выражено также замещение жировой ткани созревающей грануляционной (рис. 3, а). Среди сохранившихся адипоцитов встречаются участки умеренной полиморфноклеточной инфильтрации, в которых повышено содержание тучных клеток (рис. 3, б). Проводниковая часть нервных стволиков в состоянии валлеровской дегенерации (рис. 3, в). Эпидермис на большем протяжении лоскута истончён за счёт уменьшения количества слоёв и вертикального диаметра шиповатых клеток (рис. 3, г). Группа Сer 2 отличается лучшей сохранностью panniculus carnosum, подкожной жировой клетчатки, волосяных фолликулов и сальных желёз (рис. 4, а). В подкожной жировой клетчатке ангиосомной зоны встречаются очаги ангиогенеза (рис. 4, б). Некоторые нервные стволики наряду с дегенерирующими волокнами содержат сохранные и регенерирующие осевые цилиндры (рис. 4, в). Слои эпидермиса хорошо выражены (рис. 4, г).
При гистоморфометрическом исследовании (табл. 2) установлено, что в контрольной группе и в Cer 1 толщина эпидермиса уменьшена на 27,3 и 36,4 % (p < 0,05) соответственно по сравнению с контралатеральными участками кожи, а в группе Сer 2 параметр сопоставим с ними. Толщина дермы значимо увеличена только в группе Сer 2: в межангиосомной зоне на 13,4 %, а в ангиосомной – на 19 %. Все лоскуты отличаются от контралатеральных участков кожи истончением гиподермы: в контроле – на 42,7 %, в группе Сer 1 на 47,2 % в межангиосомной и на 35,6 % в анги-осомной зонах, но в группе Сer 2 только на 10,5 % и на 17,9 % соответственно. Количество сосочков дермы в лоскутах уменьшено по сравнению с контралатеральной кожей на 54,8 % в контроле, в Сer 1 показатель не отличался от контралатеральной кожи в межангиосом-ной зоне, но был уменьшен на 25,1 % в ангиосомной зоне, в Сer 2 он был сопоставим с контралатеральной кожей. Клеточность дермы лоскутов по сравнению с контралатеральными участками кожи была увеличена на 64,2 % в контрольной группе и сопоставима с ними в опытных группах. Численная плотность придатков кожи в контрольной группе уменьшена на 124,7 %, в группе Cer 1 – на 126,2 % в межангиосомной зоне и на 103,3 % в ангиосомной, в группе Cer 2 – на 33,4 % и 57,8 % соответственно.
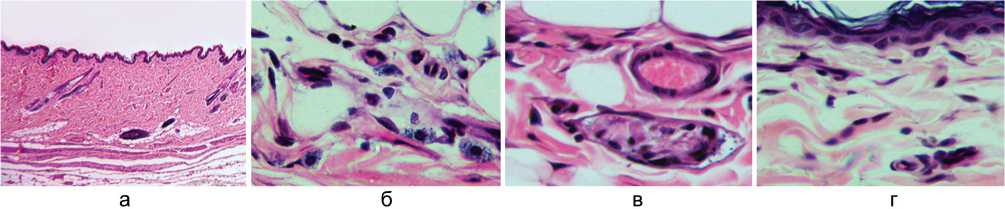
Рис. 3. Фрагменты парафиновых срезов прижившихся лоскутов в группе Сer 1. Увеличение 180× (а) и 500× (б, в, г). Окраска гематоксилином и эозином
- у £ф# •
Рис. 4. Фрагменты парафиновых срезов прижившихся лоскутов в группе Сer 2. Увеличение 180× (а) и 500× (б, в, г). Окраска гематоксилином и эозином
Капилляризация дермы и гиподермы в лоскутах контрольной группы сопоставима с кожей контралатеральных участков, в группе Сеr 1 капилляризация дермы увеличена на 26,1 %, а капилляризация гиподермы уменьшена на 26,1 % в межангиосомной зоне и на 41,4 % в ангиосомной, в группе Cer 2 капилля-ризация дермы увеличена на 112 %, капилляризация гиподермы межангиосомной зоны сопоставима с контралатеральными участками, а в ангиосомной зоне повышена на 11,7 %.
Таблица 2
Гистоморфометрические характеристики кожи лоскутов
|
Группа / параметр |
Контроль |
Cer 1 |
Cer 2 |
Условная норма |
||
|
Зона М |
Зона А |
Зона М |
Зона А |
|||
|
Толщина (мкм) |
||||||
|
эпидермиса |
16,12 ± 0,61 |
13,99 ± 0,86 |
13,86 ± 0,78 |
18,79 ± 1,55 |
20,21 ± 1,16 |
22,14 ± 1,90 |
|
дермы |
543,43 ± 7,38 |
508,20 ± 73,23 |
604,72 ± 57,11 |
593,58 ± 59,25 |
627,96 ± 47,25 |
527,08 ± 19,22 |
|
гиподермы |
200,69 ± 3,40 |
185,17 ± 31,03 |
226,17 ± 44,51 |
314,33 ± 22,85 |
287,74 ± 23,66 |
351,03 ± 42,82 |
|
Количество сосочков дермы |
||||||
|
(в 1 мм длины среза) |
5,89 ± 0,37 |
12,13 ± 0,81 |
9,60 ± 1,34 |
11,28 ± 0,77 |
12,27 ± 0,48 |
12,82 ± 0,40 |
|
Численная плотность (мм2) |
||||||
|
клеток дермы |
2112,25 ± 354,05 |
1317,14 ± 7,88 |
1134,95 ± 46,35 |
1084,13 ± 76,61 |
1228,61 ± 69,04 |
1285,57 ± 110,93 |
|
придатков кожи |
16,69 ± 1,95 |
16,58 ± 1,01 |
18,45 ± 1,55 |
28,12 ± 6,08 |
23,77 ± 3,64 |
37,5 ± 5,70 |
|
капилляров дермы |
34,87 ± 5,13 |
41,03 ± 7,07 |
41,03 ± 3,63 |
69,74 ± 9,54 |
68,72 ± 14,29 |
32,53 ± 2,69 |
|
капилляров гиподермы |
111,33 ± 9,18 |
84,10 ± 6,61 |
66,67 ± 5,38 |
107,69 ± 17,39 |
127,18 ± 13,70 |
113,85 ± 9,24 |
ДИСКУССИЯ
Результаты выполненного исследования свидетельствуют, что обе изученные схемы применения цере-бролизина по сравнению с негативным контролем и плацебо обусловили достоверное уменьшение относительной площади дефектов эпидермиса, связанных с частичным некрозом лоскута либо замедленным раневым заживлением. Антинекротический и регенеративный эффекты были связаны, главным образом, с протективным эффектом в отношении капилляров папиллярного сплетения, о чём свидетельствуют значительно большие (в 1,6–2,1 раза) численные плотности сосочков дермы, чем в группе без фармакологических воздействий.
Известно, что ангиогенные факторы могут обладать как прямым действием на эндотелиальные клетки, так и непрямым – стимулируя воспаление, которое, в свою очередь, усиливает ангиогенез [8]. Выраженное уменьшение полиморфноклеточной инфильтрации дермы и гиподермы в опытных группах приводит к выводу о том, что стимулированный субдермальными микроинъекциями церебролизина ангиогенез в дерме протекал на фоне торможения воспалительных реакций. Четыре микроинъекции церебролизина в не-кровоснабжаемой (межангиосомной) зоне лоскута обусловили гиповаскуляризацию гиподермы и, как следствие, истончение эпидермиса и дермы. Вторая схема, предусматривающая увеличение дозировки препарата с равномерным распределением шести микроинъекций по площади лоскута, обеспечила протективные и ускоряющие раневое заживление эффекты не только в отношении эпидермиса, но и подкожной жировой клетчатки, а также придатков кожи, что, по-видимому, опосредовано более выраженным ангиогенным и ней-рорегенеративным эффектом.
ЗАКЛЮЧЕНИЕ
Для оптимизации приживления кожно-фасциаль- инъекций церебролизина, равномерно распределённых ных лоскутов с осевым кровоснабжением в случаях, по всей площади лоскута, включая его ангиосомную и когда их площадь превышает территорию кровоснаб- межангиосомную зоны.
жающей артерии, целесообразно применение микро-
Список литературы Характеристика приживления и гистоструктуры васкуляризованных кожно-фасциальных лоскутов в условиях применения микроинъекций лиофилизата мозговой ткани
- Lie K.H., Barker A.S., Ashton M.W. A classification system for partial and complete DIEP flap necrosis based on a review of 17,096 DIEP flaps in 693 articles including analysis of 152 total flap failures//Plast. Reconstr. Surg. 2013. Vol. 132, No 6. Р. 1401-1408 DOI: 10.1097/01.prs.0000434402.06564.bd
- Hallock G.G. Physiological studies using laser Doppler flowmetry to compare blood flow to the zones of the free TRAM flap//Ann. Plast. Surg. 2001. Vol. 47, No 3. Р. 229-233.
- VEGF application on rat skin flap survival/S.A. Vourtsis, P.K. Spyriounis, G.D. Agrogiannis, M. Ionac, A.E. Papalois//J. Invest. Surg. 2012. Vol. 25, No 1. Р. 14-19 DOI: 10.3109/08941939.2011.593693
- Бродский И.Н., Деев Р.В. Место ангиогенной терапии в программе лечения пациентов с критической ишемией конечностей//Медицинский альманах. Хирургия. 2013. Т. 5, № 29. С. 156-157.
- Álvarez X.A., Figueroa J., Muresanu D. Peptidergic Drugs for the Treatment of Traumatic Brain Injury//Future Neurology. 2013. Vol. 8, No 2. Р.175-192.
- Cerebrolysin administration reduces oxidative stress-induced apoptosis in lymphocytes from healthy individuals/P. Formichi, E. Radi, C. Battisti, G. Di Maio, D. Muresanu, A. Federico//J. Cell Mol. Med. 2012. Vol. 16, No 11. Р. 2840-2843 DOI: 10.1111/j.1582-4934.2012.01615.x
- Allam M.M. Insulin Like Growth Factor -1(IGF-1) Promotes Angiogenesis and Reverses Ischemia Reperfusion Induced Acute Kidney Injury in Rats: Role of VEGF and TGF-β1//Am. J. Biomed. Sci. 2016. Vol. 8, No 2. Р. 160-168 DOI: 10.5099/aj160200160
- Knighton D.R., Phillips G.D., Fiegel V.D. Wound healing angiogenesis: indirect stimulation by basic fibroblast growth factor//J. Trauma. 1990. Vol. 30, No 12 Suppl. Р. S134-S144.


