Характеристика регуляторных Т-клеток у больных раком яичников
Автор: Курганова Е.В., Тихонова М.А., Лебедева В.А., Ласкавая Е.Г., Коваленко В.Ф., Останин А.А., Черных Е.Р.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 6 (30), 2008 года.
Бесплатный доступ
Охарактеризованы регуляторные Т-клетки (Treg) у 10 больных раком яичника (РЯ) III-IV стадии. Установлено, что по сравнению с периферической кровью в асцитической жидкости больных РЯ повышено количество CD4-CD25-CD4-CD25highTreg. Выявленный факт может свидетельствовать о направленной миграции и накоплении естественных Treg в зоне опухолевого микроокружения. Увеличение CD4-FOXP3- и CD8-FOXP3- регуляторных Т-клеток имеет более генерализованный характер и регистрируется как в периферической крови, так и в асцитической жидкости. Больные РЯ характеризуются выраженным 14-кратным снижением баланса соотношения цитотоксических CD8-Pfn-Т-лимфоцитов и CD4-FOXP3-Treg - 0,4 ± 0,1 против 5,7 ± 2,0 у здоровых женщин (pU
Регуляторные т-клетки, цитотоксические т-лимфоциты, рак яичников
Короткий адрес: https://sciup.org/14054911
IDR: 14054911 | УДК: :
Текст научной статьи Характеристика регуляторных Т-клеток у больных раком яичников
Известно, что опухолевые клетки могут распознаваться и уничтожаться иммунной системой. Однако в условиях клинической манифестации и прогрессии опухоли иммунный ответ оказывается несостоятельным, а эффективность иммунотерапии регистрируется лишь в ограниченных случаях. Одна из причин неадекватного иммунного ответа и низкой эффективности иммунотерапии связана с возрастанием количества регуляторных Т-клеток с супрессорной активностью (Treg) [24].
Популяция регуляторных Т-клеток является достаточно гетерогенной. Наибольший интерес в последние годы привлекают естественные регуляторные СD4+СD25+Т-клетки, которые играют важную роль в поддержании периферической толерантности к собственным антигенам за счет подавления аутореактивных
Т-лимфоцитов [18, 19]. Поскольку опухолевые клетки экспрессируют аутоантигены, рост опухоли сопровождается появлением аутореактивных Т-клеток, что непременно влечет за собой компенсаторное возрастание Treg [1]. Наряду с естественными Treg, имеющими тимическое происхождение, выделяют также индуцированные регуляторные Т-клетки, которые могут генерироваться из СD4+ и СD8+Т-клеток периферической крови [15, 18].
В экспериментальных моделях показано, что опухолевый рост сопровождается увеличением численности регуляторных Т-клеток. Причем их истощение приводит к отторжению или уменьшению массы опухоли у мышей, что демонстрирует ингибирующий эффект Treg на противоопухолевый иммунный ответ [19, 21]. Возрастание уровня регуляторных
СD4+CD25+Т-клеток показано также у больных с различными формами солидных опухолей и гемобластозов. Увеличение этих клеток выявляется как в локальном опухолевом микроокружении, так и в периферической крови, что свидетельствует о генерализованном характере опухоль-индуцированной супрессии [4, 6, 12, 29]. Причем, по данным ряда авторов, количество Treg коррелирует с показателями выживаемости. Поэтому их определение в клинической практике может иметь прогностическое значение [3, 10, 16, 20, 25].
Традиционно Treg оценивают как CD4+CD25+ клетки, поскольку они ко-экспрессируют молекулу СD25. Однако у человека популяция CD4+CD25+ клеток включает не только естественные, но и индуцированные Т reg, а также активированные CD4+Т-лимфоциты [4, 18, 27]. Определенным прогрессом на пути идентификации Treg стало выявление транскрипционного фактора FOXP3. Оказалось, что данный транскрипционный фактор является критическим для развития регуляторных Т-клеток и детерминирует появление у них супрессорной активности [11, 26]. Поэтому экспрессия FOXP3 рассматривается на сегодняшний день в качестве наиболее специфичного маркера Treg [9, 14, 17].
Исследованиями Treg при раке яичников показано, что возрастание CD4+CD25+ клеток выявляется исключительно в зоне опухолевого микроокружения (в асцитической жидкости и среди опухольинфильтрирующих лимфоцитов), но не в периферической крови [7]. Однако популяция CD4+FOXP3+ клеток при раке яичников до сих пор не оценивалась. Отсутствуют данные и о численности регуляторных CD8+FOXP3+ Т-клеток, возрастание которых описано при некоторых других локализациях злокачественных опухолей [13]. Исходя из этого, целью данной работы стало изучение различных субпопуляций регуляторных Т-клеток в периферической крови и асцитической жидкости у больных раком яичников.
Материал и методы
В исследование были включены 10 пациенток, больных раком яичников (РЯ) III–IV стадии. Возраст обследуемых варьировал от 25 до 76 лет (в среднем 56,7 ± 4,5 года). Для иммунологиче- ского исследования у больных перед операцией проводили забор 20 мл периферической крови, во время операции – асцитической жидкости. Все пациентки были обследованы после получения информированного согласия. Контрольную группу составили 20 здоровых женщин, сопоставимых по возрасту.
Мононуклеарные клетки (МНК) выделяли из гепаринизированной венозной крови центрифугированием в градиенте плотности фиколла-верографина. Клетки асцитической жидкости (АЖ) получали путем центрифугирования в течение 10 мин при 1500 об/мин. МНК в концентрации 0,1х106/лунку культивировали в 96-луночных круглодонных планшетах в среде RPMI-1640 (Sigma-Aldrich), дополненной 0,3 мг/мл L-глютамина, 5мМ HEPES-буфера, 100 мкг/мл гентамицина и 10 % инактивированной сыворотки доноров АВ (IV) группы крови при 370С в СО2-инкубаторе. Для стимуляции клеток использовали моноклональные анти-CD3 антитела ICO-90 (анти-CD3, «Медбиоспектр», Москва) в концентрации 1 мкг/мл. Интенсивность пролиферации оценивали через 72 ч по включению 3H-тимидина (1 мкКu/лунку), вносимого за 18 ч до окончания культивирования.
Относительное содержание CD4+CD25+ и CD4+CD25high Т-клеток определяли методом проточной цитофлюориметрии на лазерном клеточном сортере-анализаторе FACSCalibur (Becton Dickinson, США) с использованием фикоэретрин (РЕ)-меченных анти-CD4 ( «Сорбент», Москва) и FITC-меченных анти-CD25 моноклональных антител (BD PharMingen, США). Для оценки экспрессии внутриклеточного транскрипционного белка FOXP3 в CD4+ и CD8+Т-клетках, а также перфорина (Pfr) в CD8+Т-лимфоцитах МНК обрабатывали FITC-меченными aнти-CD4 или анти-CD8-антителами («Сорбент», Москва). Пермеаби-лизацию клеток проводили с использованием 0,2 % раствора Твин-20, после чего клетки культивировали 30 мин с PE-меченными анти-FOXP3-антителами (eBioscience, США) или с РЕ-меченными анти-Pfr-антителами (BD PharMingen, США). Для оценки CD4+FOXP3+CD25+ клеток использовали PerCP-меченные анти-CD4, РЕ-меченные анти-FOXP3 и FITC-меченные анти-CD25-антитела. Математическую обработку полученных результатов проводили с использованием программы «Statistica 6.0».
Результаты и обсуждение
Известно, что увеличение количества/ак-тивности Treg при онкопатологии приводит к развитию иммунной недостаточности, одним из проявлений которой является угнетение пролиферативного потенциала Т-клеток. Оценка уровня анти-CD3-стимулированной пролиферации Т-клеток показала (табл. 1), что у здоровых доноров этот показатель варьировал от 6162 до 68953 имп/мин, составляя в среднем 32700±6990 имп/мин. Интенсивность анти-CD3-стимулированного ответа у больных РЯ была в 1,5 раза ниже (от 686 до 48271 имп/мин). Таким образом, циркулирующие Т-лимфоциты больных характеризовались признаками угнетения функциональной активности, что может быть связано с накоплением Treg.
Таблица 1
Пролиферативная активность Т-клеток доноров и больных РЯ
|
Стимул |
Уровень пролиферации МНК периферической крови (имп/мин) |
|
|
Доноры (n=15) |
Больные (n=10) |
|
|
0 |
270 ± 50 |
240 ± 40 |
|
Анти-CD3 |
32700 ± 6990 |
22110 ± 4570* |
Примечание: * – достоверность различий показателей по сравнению с донорами, рU <0,05 (U – критерий Вилкоксона– Манна–Уитни).
Для анализа Treg в периферической крови на первом этапе была проведена оценка относительного и абсолютного количества Т-клеток с фенотипом CD4+CD25+. У здоровых женщин (рис. 1А) относительное содержание CD4+CD25+ клеток в периферической крови варьировало от 3,0 до 11,0 %, составляя в среднем 5,4 ± 0,5 %, что согласуется с данными литературы [8, 28]. У больных РЯ (рис. 1Б) содержание этих клеток было в 2 раза ниже – 2,7 ± 0,3 % (рU=0,0009) с диапазоном от 1,5 до 4 %. Абсолютное количество CD4+CD25+ клеток в периферической крови больных РЯ составило 46 ± 8 клеток/мкл и было также достоверно меньше, чем у здоровых женщин, – 95 ± 7 клеток/мкл (рU=0,001). В то же время относительное содержание CD4+CD25+ клеток среди лимфоцитов асцитической жидко сти больных (n=5; рис. 1В) в 2 раза превышало содержание таковых в периферической крови.
Известно, что субпопуляция CD4+CD25+ клеток является гетерогенной по интенсивности экспрессии CD25 и функциональной активности. При этом показано, что супрессорной активностью обладают преимущественно CD4 Т-клетки с высокой экспрессией CD25 молекулы – так называемые CD4+CD25high клетки [2].
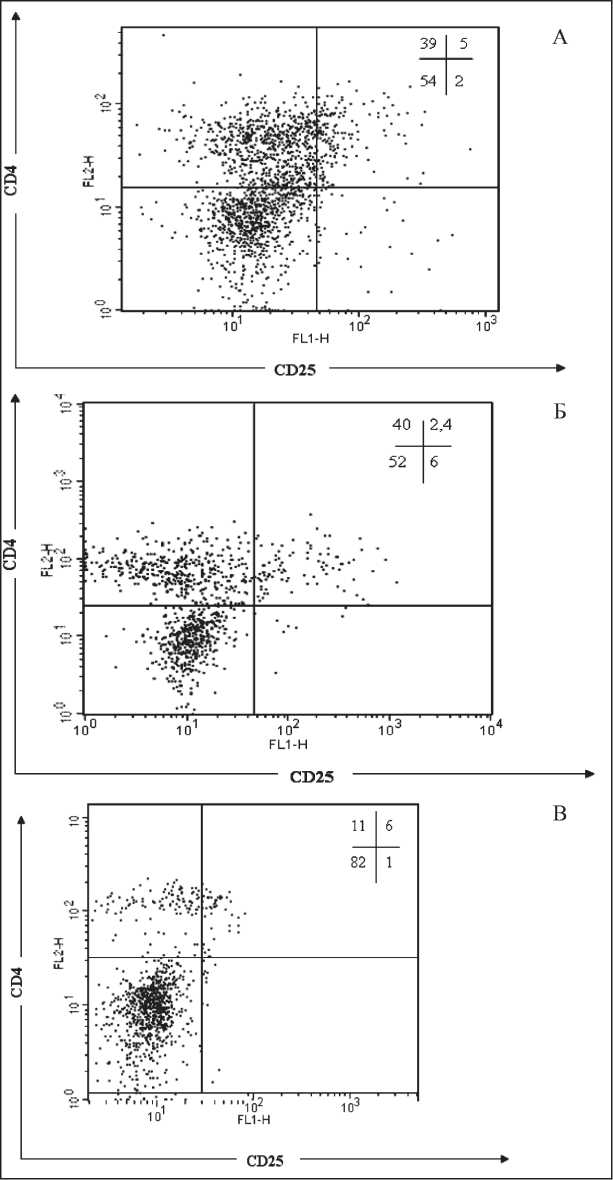
Рис. 1. Индивидуальные значения относительного количества CD4+CD25+ клеток: А – МНК периферической крови донора; Б – МНК периферической крови больной раком яичников;
В – лимфоциты асцитической жидкости этой же пациентки. CD4+CD25+ определяли среди свежевыделенных МНК
Анализ данной субпопуляции при раке яичников ранее не проводился, поэтому параллельно с оценкой CD4+CD25+ Т-клеток, было исследовано относительное содержание CD4 Т-клеток с высокой экспрессией СD25. Относительное количество CD4+CD25high клеток у здоровых доноров (n=15) варьировало от 1 до 2,1 %, в среднем – 1,1 ± 0,1 %. У больных РЯ (n=8) количество CD4+CD25high клеток в периферической крови было достоверно ниже – 0,8 ± 0,3 % (рU=0,02). При этом содержание CD4+CD25high клеток среди лимфоцитов асцитической жидкости почти в 2 раза превышало таковое в периферической крови – 1,4 ± 0,2 % (рU=0,05).
Полученные результаты свидетельствуют о возможном перераспределении популяции CD4+CD25+ у больных РЯ и согласуются с данными Curiel et al., которые впервые продемонстрировали накопление CD4+CD25+ клеток в асцитической жидкости женщин с РЯ [7]. Авторы показали, что направленная миграция CD4+CD25+ клеток в асцитическую жидкость обусловлена взаимодействием хемокина CCL22, продуцируемого опухолевыми клетками и макрофагами, с его рецептором CCR4 на поверхности естественных регуляторных Т-клеток [22]. Выявленное нами более высокое содержание CD4+CD25high клеток в асцитической жидкости по сравнению с периферической кровью является еще одним аргументом в пользу миграции естественных Treg в зону опухолевого микроокружения. Кроме того, данный факт позволяет предполагать, что уменьшение доли CD4+CD25+ Т-клеток периферической крови связано не только с уменьшением в циркуляции активированных Т-лимфоцитов (на фоне опухоль-индуцированной иммуносупрессии), но и естественных регуляторных Т-клеток. С другой стороны, учитывая угнетение пролиферативного потенциала Т-лимфоцитов у больных РЯ, можно полагать, что в циркуляции возрастает число других субпопуляций Treg, в том числе характеризующихся низкой экспрессией или отсутствием на поверхности молекулы CD25. Чтобы проверить это предположение, параллельно с оценкой CD4+CD25+ Т-клеток мы исследовали содержание CD4+Т-клеток с внутриклеточной экспрессией FOXP3, являющегося маркером не только естественных, но и индуцированных Treg.
В периферической крови здоровых доноров (n=20) относительное количество CD4+FOXP3+ клеток варьировало от 1 до 8 %, составляя в среднем 3,3 ± 0,5 % (рис. 2). У больных РЯ (n=10) содержание этих клеток колебалось в пределах от 3 до 16 %, и в среднем более чем в два раза превышало показатель у доноров – 8,5 ± 2,4 % (рU=0,01). Абсолютное количество CD4+FOXP3+ клеток у больных РЯ было также повышенным – 15 ± 57 клеток/мкл против 70 ± 19 клеток/мкл у доноров (рU=0,05). Доля CD4+FOXP3+ клеток среди лимфоцитов асцитической жидкости составила в среднем 6,2 ± 0,9 % (n=5). Таким образом, относительное содержание CD4+FOXP3+ клеток среди лимфоцитов периферической крови и асцитической жидкости больных было сходным и значимо превышало количество этих клеток в периферической крови здоровых женщин.
Увеличение относительного количества CD4+FOXP3+ клеток на фоне снижения доли CD4+CD25+ клеток свидетельствует, что, по-видимому, не все СD4+FOXP3+ клетки несут на своей поверхности молекулу CD25. Действительно, проведенный в отдельной серии экспериментов анализ экспрессии молекулы CD25 в популяции CD4+FOXP3+ клеток периферической крови больных РЯ показал, что лишь небольшая часть этих клеток несла маркер CD25, в то
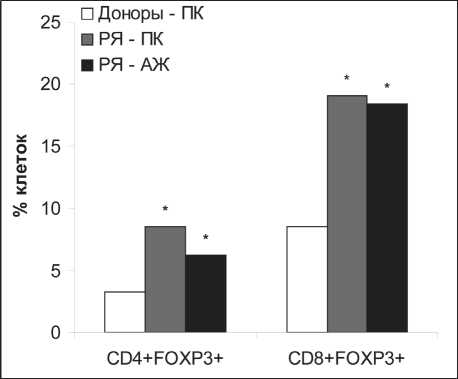
Рис. 2. Относительное количество CD4+FOXP3+ и CD8+FOXP3+ клеток у доноров и больных раком яичников. Примечание: ПК – периферическая кровь, АЖ – асцитическая жидкость, * – различия статистически значимы по сравнению с группой здоровых лиц (рU<0,05)
время как большинство СD4+FOXP3+Т-клеток не экспрессировали CD25 и имели фенотип СD4+FOXP3+CD25- (данные не представлены). Полученные результаты указывают на то, что CD4+CD25+ и CD4+FOXP3+ клетки у больных РЯ являются, по-видимому, различными типами регуляторных Т-клеток. Учитывая, что молекула CD25 является неотъемлемой принадлежностью естественных, но не индуцированных Treg, можно полагать, что у больных РЯ наблюдается увеличение обеих этих субпопуляций. При этом если количество естественных регуляторных CD4+CD25+ Т-клеток возрастает преимущественно в асцитической жидкости (очевидно, за счет их миграции в зону опухолевого микроокружения), то увеличение индуцированных CD4+FOXP3+CD25- Treg регистрируется как в зоне опухолевого роста, так и в циркуляции, то есть имеет более генерализованный характер.
Следует отметить, что, помимо CD4+ Treg, супрессорной способностью обладают и CD8+Т-клетки, экспрессирующие транскрипционный фактор FOXP3+ [5]. Данная популяция клеток является малоизученной и практически не охарактеризованной при онкопатологии. Исследование CD8+FOXP3+ клеток (рис. 2) показало, что в периферической крови относительное количество этих клеток у больных РЯ было повышено более чем в два раза – 19,1 ± 4,4 % против 8,5 ± 1,9 % у доноров (рU=0,04). Такое же количество CD8+FOXP3+ клеток выявлялось среди лимфоцитов асцитической жидкости – 18,4 ± 5,8 %. Увеличение популяции CD8+FOXP3+ было недавно опиисано Y. Kiniwa et al. при раке предстательной железы [13]. Кроме того, S. Wei et al. обнаружили увеличение CD8+Treg, продуцирующих IL-10, в асцитической жидкости больных РЯ [23]. Однако авторы не исследовали экспрессию FOXP3 в указанной популяции клеток.
Изучение регуляторных Т-клеток при онкопатологии представляет особый интерес в том случае, когда данная популяция анализируется в контексте баланса Treg и цитотоксических Т-лимфоцитов (ЦТЛ), играющих важную роль в противоопухолевом ответе [21]. Поскольку одним из механизмов цитотоксической активности ЦТЛ является экспрессия перфорина, была проведена оценка количества CD8+Т-клеток с внутриклеточной экспрессией перфорина. Относительное содержание CD8+Pfr+ клеток в периферической крови здоровых женщин (n=15) и больных РЯ (n=7) было сходным и составляло в среднем 11,1 ± 1,2 % и 11,9 ± 3,8% соответственно. Содержание CD8+Pfr+Т-клеток среди лимфоцитов АЖ было таким же, как в периферической крови – 9,6 ± 2,6 % (n=5). В то же время абсолютное количество CD8+Pfr+ клеток у больных РЯ было достоверно ниже, чем у доноров, – 78 ± 30 и 208 ± 33 клеток/мкл соответственно (PU=0,04). В результате, если у женщин контрольной группы соотношение абсолютного количества ЦТЛ и Treg варьировало от 0,9 до 17, составляя в среднем 5,7 ± 2,0 (n=8), то у больных РЯ этот показатель был снижен в 14 раз – 0,4 ± 0,1 (n=8).
Суммируя полученные данные, можно заключить, что при раке яичников наблюдается увеличение различных субпопуляций Treg. Накопление естественных регуляторных Т-клеток (CD4+CD25+/CD4+CD25high) выявляется преимущественно в зоне опухолевого роста, тогда как увеличение CD4+FOXP3+ и CD8+FOXP3+ регуляторных Т-клеток имеет более генерализованный характер и регистрируется как в периферической крови, так и в асцитической жидкости больных РЯ. При этом отмечается выраженное снижение баланса соотношения ЦТЛ и CD4+FOXP3+ Treg, что может способствовать опухолевому росту.


