Характеристика структурно-функционального состояния сердечно-сосудистой системы у носителей мутации гена HFE
Автор: Лауар М., Мусаев Н.Д., Родюкова И.С., Григорьевская А.С., Маршала С.Н., Семенякин И.В., Резник Е.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Цель. Охарактеризовать состояние сердечно-сосудистой системы (ССС) у пациентов носителей мутаций гена HFE в РФ. Материалы и методы. Проведен ретроспективный анализ медицинской документации 39 пациентов с генетически подтвержденными мутациями в гене HFE. Результаты. Нарушения структурно-функционального состояния ССС выявлены у 20 (51,3%) пациентов с мутациями гена HFE. У 11 (28,21%) пациентов отмечалась артериальная гипертензия, у 3 (7,69%) – инфаркт миокарда в анамнезе, у 2 (5,13%) – острое нарушение мозгового кровообращения. У 5 (12,82%) пациентов диагностирована сердечная недостаточность неишемического генеза. У 14 (35,9%) пациентов отмечены нарушения проводимости: атриовентрикулярная блокада, блокада левой и/или правой ножки пучка Гиса, нарушение внутрижелудочковой проводимости, укорочение интервала PQ, удлинение интервала QT. У 1 (2,56%) пациента - пароксизмальная форма фибрилляции предсердий. Заключение. У половины пациентов с мутациями гена HFE выявлены различные изменения со стороны сердечно-сосудистой системы. В связи с этим пациентам с кардиологической патологией неясной этиологии необходим скрининг для своевременной диагностики гемохроматоза и совместное ведение пациентов с подтвержденным гемохроматозом гематологами, кардиологами и гепатологами для профилактики кардиоваскулярных осложнений.
Гемохроматоз, сердечно-сосудистой системы, сердечная недостаточность, диастолическая дисфункция левого желудочка, нарушения проводимости, аритмии, гипертрофия левого желудочка
Короткий адрес: https://sciup.org/143185098
IDR: 143185098 | УДК: 616.12-008.1+575.224 | DOI: 10.38109/2225-1685-2025-4-74-80
Текст научной статьи Характеристика структурно-функционального состояния сердечно-сосудистой системы у носителей мутации гена HFE
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Не-коммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0). License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Гемохроматоз – это заболевание, характеризующееся системной перегрузкой железом и отложением железа в различных органах, включая сердце. Существует 2 типа гемохроматоза: первичный и вторичный. Первичный гемохроматоз – это наследственное заболевание, вторичный гемохроматоз – это результат длительного приема препаратов железа или частых переливаний крови при анемии или заболевании печени [1].
Первичный гемохроматоз – это наследственное аутосомнорецессивное заболевание, обусловленное снижением уровня регуляторного гормона гепсидина, который контролирует концентрацию железа, или снижением связывания гепсидин-ферропортин. Гепсидин регулирует активность ферропортина, который является единственным известным экспортером клеточного железа. Это приведет к повышению концентрации железа в плазме и накоплению железа в паренхиматозных органах и тканях, таких как сердце и кардиомиоциты, что приведет к развитию фиброза и недостаточности этих органов. Наиболее распространенная форма гемохроматоза вызвана гомозиготными мутациями в гене HFE (Homeostatic Iron Regulator – регулятор гомеостаза железа), в частности, мутацией p.Cys282Tyr, которая встречается более чем у 80% пациентов с данной формой заболевания. Гораздо реже встречаются формы гемохроматоза, связанного с мутациями в других генах: гепсидин противо-микробного пептида ( HAMP ), или гемоювелина ( HJV ), или рецептора трансферрина 2 ( TFR2 ), или ферропортина ( SLC40A1 ), которые предотвращают связывание гепсидин-ферропортин. Как HFE -ассоциированный, так и не- HFE -ассоциированный гемохроматоз приводят к снижению синтеза гепсидина, повышенному поступлению железа из клеток тонкого кишечника и макрофагов селезенки в плазму [2].
Гомозиготность по варианту p.Cys282Tyr в гене HFE встречается при гемохроматозе более чем у 80 % лиц европейского происхождения. Гомозиготность же по мутации p.His63Asp среди пациентов с гомозиготным гемохроматозом, отличным от p.Cys282Tyr, встречается не чаще. Общая распространенность компаунд-гетерозигот p.Cys282Tyr/p.His63Asp среди пациентов с клинически явным гемохроматозом составляет 4,1 % [3]. Однако компаунд-гетерозиготности p.Cys282Tyr/p.His63Asp самой по себе недостаточно, чтобы вызвать гемохроматоз. Только если этот генотип совпадает с дополнительными генетическими или экологическими факторами риска заболевания печени, развивается фенотипический гемохроматоз [4].
В многочисленных исследованиях изучалась частота гемохроматоза и его генетическая причина в различных популяциях. Показано, что распространенность наиболее известных мутаций HFE (а именно p.Cys282Tyr и p.His63Asp), которые могут вызывать гемохроматоз, варьирует в зависимости от этнических групп [5]. Безусловно, наиболее распространенной причиной гемохроматоза является гомозиготность по замене p.Cys282Tyr. Среди людей с диагнозом гемохроматоз в Австралии, Бретани, Франции она составляет 96 %, в то время как в Италии на их долю приходится только 62 %, а в Греции – 39 %.
Гемохроматоз, связанный с мутацией в гене HFE может протекать бессимптомно в течение >30 лет (часто >40 лет у мужчин и >50 лет у женщин). При гемохроматозе, не связанном с HFE , симптомы могут проявиться в возрасте 20–30 лет. В целом симптоматика вариабельна, что объясняет позднюю диагностику [6]. Отложение избыточного количества железа в паренхиматозных тканях приводит к клеточной дисфункции и клиническим проявлениям заболевания. Чаще всего поражаются печень, поджелудочная железа, суставы, кожа, гипофиз и сердце.
Гемохроматоз сердца, или первичная кардиомиопатия с перегрузкой железом, является важной и потенциально предотвратимой причиной сердечной недостаточности. Кардиомиопатия с перегрузкой железом – это систолическая или диастолическая дисфункция сердца, вызванная избыточным отложением железа, проявляющаяся хронической сердечной недостаточностью [7]. По данным литературы, клинические проявления гемохроматоза сердца можно разделить на три группы: аритмии, хроническая сердечная недостаточность (ХСН) из-за систолической дисфункции или диастолической дисфункции [8].
Медиана выживаемости нелеченных больных с гемохроматозом и тяжелой сердечной недостаточностью не превышает года. Однако при раннем и агрессивном лечении выживаемость приближается к таковой у больных с сердечной недостаточностью другой этиологии [8].
В связи с вышеизложенным, цель настоящего исследования: охарактеризовать состояние сердечно-сосудистой системы (ССС) у пациентов носителей мутаций гена HFE в РФ.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки структурно-функционального состояния сердечнососудистой системы проведено ретроспективное исследование данных медицинской документации с января 2021 года до апреля 2024 года у 39 пациентов с генетически подтвержденными мутациями в гене HFE (32 (82,1%) мужчины, 7 (17,9%) женщин). Медиана (здесь и далее в скобках указаны 25-й и 75-й процентили) возраста пациентов с мутациями в гене HFE составила 50 (38; 61) лет. Клинико-инструментальными критериями вовлечения сердечно-сосудистой системы считали наличие утолщения стенки левого желудочка (ЛЖ) и/или дилатации ЛЖ неустановленной этиологии, клапанных аномалий, нарушений ритма сердца и/или проводимости.
Критерии включения в исследование:
-
1. Генетически подтвержденные мутации в гене HFE ,
-
2. Возраст 18 лет и старше.
Критерии невключения:
-
1. Наличие в анамнезе злокачественного новообразования любой системы органов,
-
2. Трансплантация сердца, почек, печени в анамнезе.
Пациенты были набраны из ФГБУ «Национальный медицинский исследовательский центр гематологии» и поликлиники № 212 в городе Москве. Исследование проводилось в ГКБ № 31 им. Акад. Г.М. Савельевой Департамента Здравоохранения Москвы, Москва.
Этническая принадлежность пациентов в нашем исследовании не учитывалась из-за отсутствия информации.
Статистический анализ. Статистический анализ проведен с помощью непараметрических методов программы IBM SPSS Statistics 2017 версия 25. Количественные значения представлены в виде медианы (Ме) и интерквартильного интервала (Q1 и Q3), где Q1 – 25 процентиль, Q3 – 75 процентиль. При анализе нормальности распределения выборки, который определялся с помощью метода Колмогорова-Смирнова и критерия Шапиро-Уилка, все данные имели ненормальное распределение. При сравнительном анализе групп по количественным признакам использовали непараметрический U-критерий Манна-Уитни (р<0,05).
РЕЗУЛЬТАТЫ
Среди наших пациентов у 27 (69,23%) обнаружена гомозиготность по мутации p.His63Asp в гене HFE . Гомозиготность по варианту p.Cys282Tyr в гене HFE встречалась у 9 (23,08%) пациентов, в то время как гетерозиготность по варианту p.His63Asp в гене HFE наблюдалась – у 3 (7,69%) пациентов.
Медиана времени от дебюта симптомов заболевания до постановки диагноза составила 4,3 (1,8; 8,6) года, max – 12 лет. 1 (2,56%) пациент получал хелатор (Деферазирокс), еще 1 (2,56%) – курсы флеботомии, у 37 пациентов информации о получаемой патогенетической терапии в медициской документации не было представлено.
У 11 (28,21%) пациентов в анамнезе имелась артериальная гипертензия (АГ): у 6 (15,38%) пациентов была АГ 1 степени, у 3 (7,69%) – АГ 2 степени и у 2 (5,13%) – АГ 3 степени (табл. 1).
Дислипидемия отмечена у 20 (51,28%) пациентов. Общий холестерин составил 5,5 (4,9; 6,6) ммоль/л, (95% Доверительный интервал (ДИ) 5,17-6,99), холестерин липопротеидов низкой плотности (ЛПНП) – 3,8 (3,2; 4,4) ммоль/л, ДИ (3,41-4,25), у 17 (43,59%) уровень ЛПНП составил более 3 ммоль/л. Сывороточный ферритин (СФ) составил 423,2 (302; 582) мкг/л, ДИ (365,99-510,63).
При физикальном обследовании бронзовая окраска кожи отмечена у 6 (15,38%) пациентов. Жалобы пациентов отражены на рисунке 1.
У 5 (12,82%) пациентов без инфаркта миокарда (ИМ) в анамнезе была указана в диагнозе ХСН. Больные с ХСН были старше пациентов без ХСН: 57 (38; 68) лет и 49 (38; 61) лет соответственно, p=0,035. ХСН I функционального класса по классификации Нью-Йоркской кардиологической ассоциации (NYHA) отмечена – у 2 (5,13%), II класса – у 2 (5,13%), III класса – у 1 (2,56%) пациента.
По результатам эхокардиографии, фракция выброса левого желудочка (ФВ ЛЖ, по Симпсону) составила >50% у 34 (87,18%), от 40% до 50% – у 5 (12,82%) пациентов, ФВ ЛЖ <40% – не было ни у одного пациента. У всех пациентов с умеренно сниженной ФВ ЛЖ в диагнозе была указана ХСН. Диффузный гипокинез миокарда ЛЖ выявлен у 3 (7,69%) пациентов, у всех из них наблюдалось умеренное снижение ФВ ЛЖ. Утолщение стенки ЛЖ отмечено у 9 (23,08%) пациентов без АГ в анамнезе (рис. 2). Обструкции выходного тракта ЛЖ и/или переднего систолического движения передней створки митрального клапана (МК) не выявлено. Утолщение стенки правого желудочка (ПЖ) выявлено у 2 (5,13%) пациентов. У 17 (43,59%) пациентов при эхокардиографии выявлена недостаточность клапанного аппарата: митральная – у 17 (43,59%), трикуспидальная – у 16 (41,03%), легочная – у 11 (28,21%), аортальная – у 7 (17,95% пациентов. Пролапс МК был выявлен у 2 (5,13%) пациентов: передней створки – у 1 (2,56%), задней – у 1 (2,56%) пациента. В эхокардиографическом заключении описана кальцификация и/или утолщение створок аортального клапана – у 13 (33,33%), МК – у 10 (25,64%), трикуспидального клапана – у 4 (10,26%) пациентов.
Неинвазивные признаки легочной гипертензии выявлены у 5 (12,82%) пациентов. Перикардиальный выпот не верифицирован ни у одного пациента.
Диастолическая дисфункция ЛЖ выявлена у 4 (10,26%) пациентов: у всех – 1-го типа (нарушения релаксации).
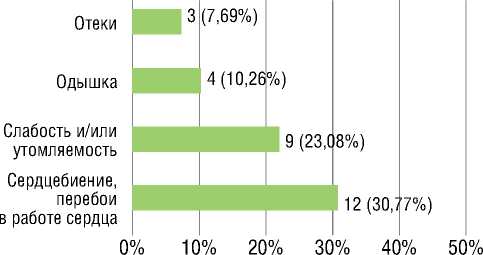
Рисунок 1. Наиболее частые жалобы пациентов с генетически подтвержденными мутациями в гене HFE [собственные данные]
Симметричная гипертрофия 6 (15,4%)

Асимметричная гипертрофия
3 (7,6%)
Рисунок 2. Утолщение стенки ЛЖ у пациентов с генетически подтвержденными мутациями в гене HFE и поражением сердца [собственные данные]
Без гипертрофии 30 (77%)
Септальная 2 (5%)
-
Figure 1. The Most common complaints of patients with genetically confirmed mutations in the HFE gene [own data]
-
Figure 2. Thickening of LV wall in patients with genetically confirmed mutations in the HFE gene and cardiac involvement [own data]
Таблица 1. Сравнительная характеристика мужчин и женщин носителей мутаций в гене HFE [собственные данные]
Table 1. Comparative characteristics of men and women carriers of mutations in the HFE gene [own data]
Показатели
Общая группа (n=39, 100%)
Мужчины (n=32, 82,1%) Женщины (n=7, 17,9%)
Возраст (лет), медиана; 25-й и 75-й процентили
50 (38; 61)
50 (39; 61)
36 (34; 64)
Время от клинической манифестации до диагностики заболевания (годы), медиана; 25-й и 75-й процентили
4,3 (1,8; 8,6)
4,1 (1,6; 7,8)
4,5 (1,9; 8,7)
Нарушения структурно-функционального состояния сердца, n (%)
20 (51,3%)
19 (48,72%)
1 (2,56%)
ХБП, n (%)
15 (38,46%)
13 (33,33%)
2 (5,13%)
АГ, n (%)
11 (28,21%)
6 (15,38%)
5 (12,82%)
СД 2 типа, n (%)
2 (5,13%)
1 (2,56%)
1 (2,56%)
Транзиторная ишемическая атака/инсульт в анамнезе,
n (%) 2 (5,13%)
2 (5,13%)
0 (0)
ИМ в анамнезе, n (%)
3 (7,69%)
2 (5,13%)
1 (2,56%)
Примечание/Notе: АГ – артериальная гипертензия (AH – arterial hypertension), СД – сахарный диабет (DM – diabetes mellitus), ИМ – инфаркт миокарда (MI – myocardial infarction), ХБП – хроническая болезнь почек (CKD – chronic kidney disease).
При анализе ЭКГ, вольтажные признаки гипертрофии левого желудочка (ГЛЖ) (по индексу Соколова-Лайона), выявлены у 8 (20,51%) пациентов, низкоамплитудные комплексы QRS (амплитуда комплекса QRS менее 5 мм во всех отведениях от конечностей и менее 10 мм во всех прекордиальных отведениях) – у 6 (15,38%) пациентов. Среди пациентов без ИМ в анамнезе патологический зубец Q выявлен у 4 (10,26%) пациентов: у 2 (5,13%) – в отведениях от нижней стенки ЛЖ, у 2 (5,13%) – в передне-перегородочной области ЛЖ. Также отмечены нарушения сердечного ритма (рис. 3).
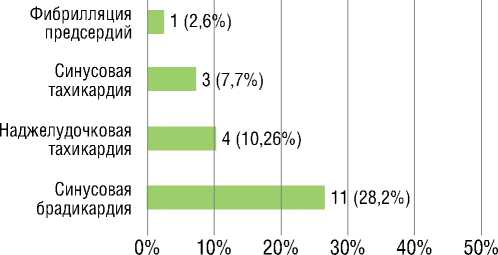
Рисунок 3. Нарушения ритма сердца у пациентов с генетически подтвержденными мутациями в гене HFE и поражением сердца [собственные данные]
-
Figure 3. Heart rhythm abnormalities in patients with genetically confirmed mutations in the HFE gene and cardiac involvement [own data]
Нарушения проводимости выявлены у 14 (35,9%) пациентов, они обобщены в рисунке (рис. 4).
Синдром удлиненного интервала QT
Синдром предвозбуждения желудочков
Нарушение внутрижелудочковой проводимости
Блокада левой ножки пучка Гиса
Блокада правой ножки пучка Гиса
Атриовентрикулярная блокада
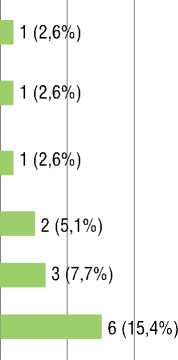
0% 10% 20% 30%
40%
50%
Рисунок 4. Нарушения проводимости у пациентов с генетически подтвержденными мутациями в гене HFE и поражением сердца [собственные данные]
-
Figure 4. Conduction disorders in patients with genetically confirmed mutations in the HFE gene and cardiac involvement [own data]
ОБСУЖДЕНИЕ
По данным литературы, распространенность наиболее известных мутаций гена HFE (а именно p.Cys282Tyr и p.His63Asp), которые могут вызывать гемохроматоз, варьирует в зависимости от этнических групп. Гомозиготность по варианту p.Cys282Tyr в гене HFE встречается при гемохроматозе более,
78 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2025
чем у 80% лиц европейского происхождения. Гомозиготность по мутации p.His63Asp среди пациентов с гемохроматозом, отличным от p.Cys282Tyr, встречается реже. Общая распространенность компаунд-гетерозигот p.Cys282Tyr/p.His63Asp среди пациентов с клинически явным гемохроматозом составляет 4,1% [3].
Среди проанализированных нами пациентов превалировала гомозиготность по мутации p.His63Asp в гене HFE (69,23%), хотя, по данным литературы, у людей европейского происхождения доминирует гомозиготность по варианту p.Cys282Tyr в гене HFE . Это может отражать особенности Российской популяции.
Гемохроматоз встречается как у мужчин, так и у женщин, хотя дебют клинической симптоматики у женщин наблюдается в более позднем возрасте [9]. В нашем исследовании преобладали мужчины в соотношении 4,57:1.
Диагостика гемохроматоза в ряде случаев затруднена. Поражение сердца при гемохроматозе обычно развивается не сразу, протекает бессимтомно и остается недиагностированным в течение длительного времени [10]. В нашем исследовании медиана времени от появления симптомов до постановки диагноза составила 4,3 года, максимум – 12 лет. Ошибочные диагнозы и несвоевременная диагностика могут приводить к прогрессированию необратимых изменений в различных органах, в т.ч. в сердце.
Насыщение трасферрина железом было определено лишь у 12 (30,77%) пациентов, повышенное насыщение трансферрина железом наблюдалось у 6 (15,39%), а гиперферритинемия присутствовала у 22 (56,41%) пациентов. Важно проводить скрининг на гемохроматоз (лабораторные тесты), среди пациентов с патологией внутренних органов неясной этиологии, особенно тех, у кого в анамнезе были гемотрансфузии или прием препаратов железа с целью лечения анемии, включающий определение уровня железо, коэффициент насыщения трансферрина железом (КНТЖ) и СФ. Повышенный КНТЖ является самым ранним биохимическим нарушением при гемохроматозе, отражающим повышенную абсорбцию железа. Также важно тщательно собирать анамнез и информировать врачей об особенностях гемохроматоза. Семейный скрининг важен для тех, у кого подтвержден диагноз первичного гемохроматоза.
По данным литературы, сахарный диабет и/или бронзовая окраска кожи (бронзовый диабет) выявляется не редко у пациентов с первичным гемохроматозом. В ходе нашего исследования, наличие сахарного диабета подтверждено только у 2 (5,13%), а бронзовой окраски кожи – у 6 (15,38%) пациентов.
Описано, что у пациентов с первичным гемохроматозом выявляется дилатация левого предсердия (ЛП) и ПЖ с низкой или нормальной ФВ ЛЖ [11, 12]. Тяжесть систолической дисфункции миокарда пропорциональна количеству отложений железа в миокарде. Увеличение отложений железа в миокарде приводит к утолщению стенки и к снижению податливости ЛЖ, его дилатации и систолической дисфункции [13].
По данным литературы, клинические проявления гемохроматоза сердца можно разделить на три категории: аритмии, ХСН из-за систолической дисфункции и ХСН из-за диастолической дисфункции [8]. В нашем исследовании наблюдалась ещё четвертая категория, а именно нарушение сердечной проводимости, преимущественно с наличием АВ блокады, БЛНПГ, БПНПГ, тахикардии и брадикардии, что может быть следствием нарушения функционирования синоатриального (СА) и/или АВ-узлов и/или электрических путей вследствие накопления в них железа.
Вследствие изменений миокарда, аритмий и нарушений проводимости пациенты с гемохроматозом могут испытывать такие симптомы, как сердцебиение, общая слабость и/или утомляемость, что встречалось у 30,77% и 23,08% наших пациентов соответственно.
Миокард особенно чувствителен к окислительному стрессу, вызванному железом, из-за высокой концентрации митохондрий и низкого содержания антиоксидантов [8]. Железо после переливания крови или после длительных курсов перорального приема с большей вероятностью накапливается в сердце, чем железо, поступающее с пищей. При накоплении в сердце железо откладывается преимущественно в эпикардиальных миоцитах, позже – во всей толще стенки. Перегрузка сердца железом первоначально приводит к увеличению перинуклеарных отложений железа с последующим накоплением в других структурах клетки. Отложение железа более обширно в желудочках, чем в предсердиях. Часто вовлекается проводящая система сердца [13].
Предсердные аритмии могут быть вызваны отложением железа в предсердиях и дилатацией предсердий из-за повышенного давления наполнения желудочков. Особенности аритмий при гемохроматозе еще предстоит изучить, но вполне вероятно, что они вызывают одышку (присутствовавшую у 10,26% пациентов в нашем исследовании), сердцебиение, перебои в работе сердца (у 30,77% из них) и могут быть одним из механизмов, лежащих в основе инсульта и транзиторных ишемических атак при гемохроматозе.
По данным нашего исследования, частота наджелудочковой тахикардии у пациентов с генетически подтвержденными мутациями в гене HFE составила 10,26%, ФП – 2,56%, это означает, что, ФП не была широко распространена у наших пациентов.
ГЛЖ увеличивает конечно-диастолическое давление в левом желудочке и в ЛП, что приводит к его расширению и деформации. Это является предиктором возникновения и рецидива ФП [14]. У большинства пациентов наблюдалась диастолическая дисфункция без ГЛЖ, что позволяет предположить, что прямое накопление железа в сердце может повышать жесткость миокарда ЛЖ и нарушать его релаксацию даже без наличия гипертрофических изменений. Фиброз миокарда, наблюдаемый при гемохроматозе, предрасполагает к желудочковым аритмиям, хорошо известным как наиболее распространенная причина внезапной сердечной смерти (ВСС). У некоторых пациентов могут возникнуть симптомы предобморочного состояния или обморока, связанные с брадиаритмиями, включая синусовую брадикардию, АВ второй степени Мобитц II или даже АВ блокаду третьей степени. Брадикардия у пациентов с перегрузкой железом может возникнуть из-за внешних или внутренних факторов. Например, повышенное содержание железа может повлиять на активность автономной нервной системы, возможно, за счет нарушения нейронной функции или вмешательства в другие элементы барорецепторных рефлекторных путей, внешних по отношению к сердцу [15]. С другой стороны, внутренняя электрическая активность специализированных кардиостимуляторных миоцитов, расположенных в СА узле, также может быть нарушена железом в результате модуляции ряда мембранных токов, обработки Ca2+ или внутриклеточной сигнализации [12]. Брадиаритмия при гемохроматозе, включая дисфункцию СА и/или АВ-узла, встречается чаще, чем тахиаритмия, которая, по оценкам, составляла 10,26% в нашей когорте. В одном исследовании использовалась модель мышей с хронической перегрузкой железом для изучения влияния железа на функцию СА-узла. Инъекция железа в течение 2 недель снижала частоту сердечных сокращений (ЧСС), не оказывая заметного влияния на суточные колебания сна и бодрствования. Средняя ЧСС за 48 часов постепенно снижалась по мере увеличения периода инъекции железа, при этом ЧСС снижалась (P<0,05) с 60,5±12 ударов/мин на исходном уровне до 52,9±14 ударов/мин после 4 недель хронической перегрузки железом. Результаты показывают, что собственная электрическая активность миоцитов, расположенных в СА узле, также может быть нарушена железом в результате модуляции ряда мембранных токов или внутриклеточной сигнализации. Эти изменения объясняют развитие синусовой брадикардии, замедление электропроводности и повышенную восприимчивость к ФП у мышей, а также у пациентов с перегрузкой железом [16]. В нашей когорте частота синусовой брадикардии составила 28,21%. Факторы риска, связанные с брадиаритмией, включают пожилой возраст, дисфункцию ЛП, низкую ЧСС в состоянии покоя, увеличенную продолжительность PR и QRS, использование терапии бета-блокаторами.
Изменения ЭКГ, типичные для гипертрофии миокарда, в частности глубокие отрицательные зубцы T в прекардиальных отведениях, особенно в сочетании с болью в сердце, часто интерпретируются как ИМ, но, несмотря на высокую частоту сте-нокардитических болей в груди как у мужчин, так и у женщин, было относительно мало записей о процедурах коронарной реваскуляризации или инфаркте миокарда. Гемохроматоз не был предложен в качестве фактора риска преждевременной атеросклеротической ишемической болезни сердца.
Пациенты с ГЛЖ часто сообщали о боли в груди, что позволяет предположить, что такие факторы, как повышенная потребность миокарда в кислороде, заболевание мелких сосудов и эндотелиальная дисфункция, которые вызывают микрососу-дистую стенокардию у пациентов с другими причинами ГЛЖ, также важны для гемохроматоза. Аналогично, мы не можем исключить возможность того, что гемохроматоз усугубляет сердечно-сосудистый риск у пациентов с другими предрасполагающими факторами, такими как гиперлипидемия, АГ и курение.
Все клинические проявления гемохроматоза неспецифичны, поэтому для подтверждения диагноза необходимы лабораторные и молекулярно-генетические исследования [17].
ЗАКЛЮЧЕНИЕ
Пациентам с сердечно-сосудистой патологией неизвестной этиологии, в т.ч. утолщением стенки ЛЖ и/или сердечной недстаточностью, нарушениями ритма и проводимости, псев-доинфарктными изменениями ЭКГ, особенно при наличии синусовой брадикардии, необходим скрининг на гемохроматоз. Пациентам с верифицированным гемохроматозом необходимо тщательное обследование сердечно-сосудистой системы для своевременной диагностики отклонений, профилактики и терапии кардиальных осложнений.


