Характеристика стволовых признаков EPCAM-негативных и EPCAM-позитивных опухолевых клеток в первичной опухоли, 2D- и 3D- культурах при раке молочной железы
Автор: Алифанов В.В., Третьякова М.С., Григорьева Е.С., Булдаков М.А., Таширева Л.А., Колегова Е.С., Андрюхова Е.С., Завьялова М.В., Денисов Е.В., Чердынцева Н.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Одним из предикторов неблагоприятного прогноза при раке молочной железы (РМЖ) считается гиперэкспрессия белка EpCAM. Однако значительная доля опухолевых клеток либо слабо экспрессирует, либо вовсе не экспрессирует мембранный EpCAM. Молекулярная характеристика и способность к росту в 2D- и 3D-культурах, косвенно отражающие метастатический потенциал опухолевых клеток без экспрессии EpCAM, исследованы недостаточно. Цель исследования - сравнение фенотипических вариантов стволовых клеток и проявлений эпителиально-мезенхимального перехода (ЭМП) в зависимости от экспрессии EpCAM в первичной опухоли молочной железы и при культивировании в 2D и 3D. материал и методы. В исследование включено 7 пациенток с инвазивной карциномой молочной железы неспецифического типа (люминальный А и люминальный В HER2-негативный подтип). Пациентки не получали неоадъювантной химиотерапии. В первичной опухоли и после 2D- и 3D- культивирования проводилось фенотипирование клеток методом проточной цитофлуориметрии с использованием антител против CD45, EpCAM (CD326), CK7/8, CD44, CD24, N-cadherin (CD325), ALDH и CD133.
Рак молочной железы, epcam, стволовость, эмп, 2d- и 3d-культуры
Короткий адрес: https://sciup.org/140307923
IDR: 140307923 | УДК: 618.19-006.6-091.8 | DOI: 10.21294/1814-4861-2024-23-5-59-72
Текст научной статьи Характеристика стволовых признаков EPCAM-негативных и EPCAM-позитивных опухолевых клеток в первичной опухоли, 2D- и 3D- культурах при раке молочной железы
К настоящему времени одним из предикторов неблагоприятного прогноза при многих видах карцином считается гиперэкспрессия молекулы клеточной адгезии эпителия (Epithelial cell adhesion molecule; EpCAM). При этом молекулярная характеристика, биологические потенции и клиническое значение опухолевых клеток без экспрессии EpCAM исследованы недостаточно. EpCAM является многофункциональным трансмембранным белком, участвующим в регуляции клеточной адгезии, пролиферации, миграции, стволовости и эпителиально-мезенхимального перехода (ЭМП) клеток карциномы [1]. Участвуя в развитии ЭМП, EpCAM взаимодействует с N-cadherin, находясь с ним в обратной корреляционной связи [2]. Прогностическая ценность экспрессии EpCAM зависит от нозологической формы злокачественной опухоли.
При раке молочной железы (РМЖ) высокая экспрессия EpCAM в первичной опухоли связана с плохим прогнозом [1]. Неблагоприятное течение и исход опухолевой болезни во многом ассоциированы с приобретением опухолевыми клетками стволовых свойств и их способностью к ЭМП. Имеются данные, что высокий уровень экспрессии EpCAM коррелирует с признаками стволовости и с приобретением плюрипотентности при репрограммировании соматических клеток [3, 4].
Способность опухолевых клеток к культивированию в двухмерных (2D) и трехмерных (3D) культурах косвенно отражает их метастатический потенциал [5]. Преимущества и недостатки 2D- и 3D-культур анализируются в обзоре M.A.G. Barbosa et al. [6]. Формирование сфероидов/маммосфер считается признаком, указывающим на наличие стволовых свойств [7]. Однако позитивность не-
Таблица 1/table 1
Клинико-патологические характеристики пациенток
Clinical and pathological characteristics of patients
|
Параметры/Parameters |
Пациентки (n=7)/Patients (n=7) |
|
Средний возраст, лет/Average age, age |
60 (53:65) |
|
Менопауза/Menopause |
5 (71,4 %) |
|
T1 |
2 (28,6 %) |
|
T2 Стадия опухоли/Stage of tumor |
5 (71,4 %) |
|
3 (42,9 %) |
|
|
N1 |
4 (56,1 %) |
Размер опухоли, мм/Tumor size, mm
Примечание:таблица составлена авторами.
24,5 (21:26,25)
Note: created by the authors.
которых стволовых маркеров в клетках не всегда коррелирует с их способностью образовывать сфероиды/маммосферы [8–10]. Представляет интерес, насколько отличаются стволовые свойства опухолевых клеток РМЖ, не экспрессирующих EpCAM, от экспрессирующих и как они меняются в 2D- и 3D-культурах.
Цель исследования состояла в сравнении фенотипических вариантов стволовых клеток и проявлений ЭМП в зависимости от экспрессии EpCAM в первичной опухоли молочной железы, 2D- и 3D-культурах.
Материал и методы
В исследование включено 7 пациенток с инвазивной карциномой молочной железы неспецифического типа стадии T1–2N0–1M0, получавших лечение в Научно-исследовательском институте онкологии Томского НИМЦ. У 2/7 пациенток (29 %) определялся люминальный А, у 5/7 (71 %) – люминальный В HER2-негативный молекулярно-биологический подтип опухоли. Больные не получали неоадъювантной химиотерапии. Клинико-патологические характеристики пациенток приведены в табл. 1.
Материалом исследования являлась ткань первичной опухоли, полученная на хирургическом этапе лечения. Образцы первичной опухоли гомогенизировали механическим способом с применением ножниц в течение 3 мин. Далее к образцу опухоли добавляли 3 мл фосфатно-солевого буфера (Phosphate buffered saline; FBS) и центрифугировали на низких оборотах 60 g, 5 мин. Верхний слой гидрофобных частиц (адипоциты, жиры, осколки мембран) удаляли, а оставшийся надосадок отмывали в 2 мл FBS центрифугированием при 300 g 10 мин. Далее осадок ресуспендировали, и одиночные клетки были отфильтрованы с помощью фильтра 70 мкм (BD Pharmingen). Образец центрифугировали 300 g 5 мин, осадок ресуспендировали в 300 мкл среды DMEM. Количество клеток и их жизнеспособность оценивались методом проточной цитофлуориметрии. Для культивирования и последующего фенотипирования использовались образцы с клеточностью не менее 104 и долей живых клеток не менее 98 %. Для фенотипирования отбирали 50 мкл, остальной объем использовали для культивирования.
2D-культивирование проходило в иммунологических планшетах с обработанной поверхностью для улучшения адгезии клеток с добавлением среды EpiCult B (STEMCELL Technologies, Canada). Оценка апоптоза осуществлялась с помощью Аннексина-V и пропидия иодида методом проточной цитофлуорометрии (Annexin V, Alexa Fluor® 350 Conjugate, Thermo Fisher Scientific, USA) на 10–14-й день культивирования клеток в монослое. Оценивались показатели жизнеспособности, в частности доля апоптотических и некротических опухолевых клеток, культивируемых в виде монослоя. Доля живых клеток варьировала в различных образцах, составляя от 95 до 56 %. Количество клеток с признаками некроза не превышало 5 %. После культивирования популяционный состав полученного клеточного монослоя оценивался методом проточной цитофлуориметрии.
При 3D-культивировании клеток использовались иммунологические планшеты, препятствующие адгезии клеток на поверхности. В качестве питательной среды использовалась готовая среда MammoCult (STEMCELL Technologies, Canada), включающая все необходимые компоненты для формирования маммосфер (тумороидов/сферои-дов). Оценка жизнеспособности клеток осуществлялась с помощью флуоресцентного витального красителя Calcein AM (Thermo Fisher Scientific, USA) на 7–9-й день культивирования маммосфер. При 3D-культивировании из 7 образцов первичной опухоли молочной железы маммосферы были получены во всех случаях. В большинстве случаев маммосферы обладали четкой и ровной структурой, имели плотную шарообразную форму и окрашивались витальным красителем Calcein AM (т.е. имели высокую жизнеспособность после культивирования 3D). Размер маммосфер составлял 200 ± 50 мкм. После визуализации маммосферы
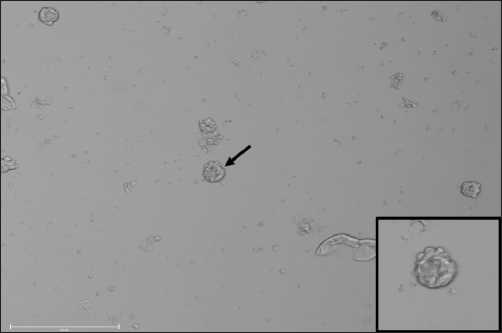
Рис. 1. Микрофотография маммосфер клеток рака молочной железы.
Примечание: рисунок выполнен авторами
Fig. 1. Microphoto of mammospheres of breast cancer cells. Note: created by the authors подвергались дальнейшему фенотипированию (рис. 1).
Экспрессия маркеров в клетках первичной опухоли, 2D- и 3D-культурах оценивалась методом проточной цитофлуориметрии. Методика проведения цитофлуориметрического исследования соответствует методике, описанной в 2022 г. В.М. Перельмутером с соавт. [11]. На поверхностном этапе использовались антитела: APC-Cy7-анти-CD45 (клон HI30, мышиные IgG1, Sony Biotechnology), BV 650-анти-EpCAM (клон 9C4, мышиные IgG2b, Sony Biotechnology), PE-Cy7- анти-N-cadherin (клон 8C11, мышиные IgG1, Sony Biotechnology), BV 510-анти-CD44 (клон G44-26, мышиные IgG2b, BD Horizont), PerCP-Cy5.5-анти-CD24 (клон ML5, мышиные IgG2a, Sony Biotechnology), BV 786-анти-CD133 (клон 293C3, мышиные IgG2b, BD Pharmingen). На внутриклеточном этапе: AF647-анти-CK7/8 (клон CAM5.2, Mouse IgG2a, BD Pharmingen), BV 650-анти-EpCAM (клон 9C4, мышиные IgG2b, Sony Biotechnology) и BV421-anti-Ki67 (клон 16A8, mouse IgG2a, Sony Biotechnology). Для устранения ложноположительных результатов, вызванных с неспецифическим связыванием антител, на поверхностном и внутриклеточном этапах окрашивания образцы инкубировали с раствором, блокирующим свободные Fc-рецепторы (Human TruStain FcX, Sony Biotechnology, USA). Частицы VersaComp Antibody Capture Bead (Beckman Coulter, USA) применяли для настройки компенсации, которая позволяет учитывать только истинноположительный сигнал для каждого флуорофора. Иммунофлуоресценцию анализировали на проточном цитофлуориметре Novocyte 3000 (ACEA Bio-sciences, USA). Логика гейтирования представлена на рис. 2.
Статистическую обработку проводили с помощью GraphPad Prizm9. Для сравнения частот встречаемости использовали точный критерий Фишера. Непараметрический критерий Вилкоксона для зависимых переменных был использован для обнаружения разного количества клеток при культивировании. Различия считались достоверными при значении р<0,05.
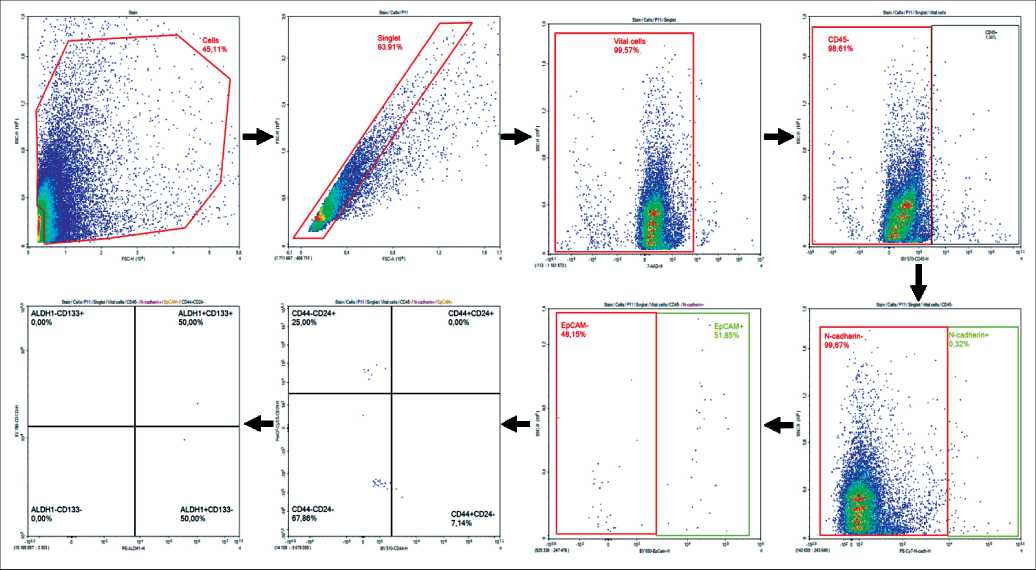
Рис. 2. Логика фенотипирования опухолевых клеток. Примечание: рисунок выполнен авторами Fig. 2. Logic of tumor cell phenotyping. Note: created by the authors
Результаты
В зависимости от сочетания экспрессии маркеров стволовости (CD44, CD24, CD133, ALDH) и ЭМП (EpCAM, CK7/8 и N-cadherin) анализировались 96 фенотипов опухолевых клеток. Определение вариантов коэкспрес-сии трех маркеров стволовости позволило оценить наличие стволовых клеток с фенотипами CD44+CD24-ALDH-CD133-; CD44+CD24-ALDH+CD133-; CD44+CD24-ALDH-CD133+; CD44+CD24-ALDH+CD133+; CD44+CD24+/ CD44-CD24+/-ALDH-CD133+; CD44+CD24+/ CD44-CD24+/-ALDH+CD133- и клеток без признаков стволовости: CD44+CD24+ALDH-CD133-, CD44- CD44-CD24+/- ALDH-CD133-.
Групповая оценка представленности клеток с разными фенотипами стволовости показала, что все варианты обнаруживаются в первичной опухоли, в 2D- и 3D-культурах. Не обнаружено значимых различий по частоте встречаемости всех исследованных фенотипов стволовых клеток между первичной опухолью и 2D-культурой, первичной опухолью и 3D-культурой, а также 2D- и 3D-культурой. В то же время выявлены различия частот встречаемости некоторых фенотипов стволовых клеток как в 2D-, так и 3D-культурах. В 2D-культуре cреди клеток с фенотипом Epcam-CK+N-cadherin стволовые клетки с фенотипом CD44+CD24-ALDH-CD133+ встречаются реже, чем с фенотипом CD44+CD24+/ CD44-CD24+/-ALDH+CD133- (1/7 и 7/7 соответственно, р=0,0047). В 3D-культуре среди клеток с фенотипом Epcam-CK+/-N-cadherin стволовые клетки с фенотипом CD44+CD24-ALDH+CD133 обнаруживались реже (1/7), чем с фенотипами CD44+CD24+/CD44-CD24+/-ALDH+CD133-(5/7, р=0,0210), CD44+CD24+/CD44-CD24+/-CD133+ALDH+ (5/7, р=0,0210) и CD44+CD24+/
CD44-CD24+/-ALDH-CD133+ (6/7, р=0,0291). Среди клеток 3D-культур, экспрессирующих N-cadherin, также наблюдались различия: Epcam-CK+ клетки с фенотипом стволовости CD44+CD24-ALDH-CD133+ встречались реже, чем с фенотипом CD44+CD24+/CD44-CD24+/-CD133+ALDH+ (2/7 и 6/7 соответственно, р=0,0210), а клетки Epcam+ CK+/- с тем же фенотипом стволовости CD44+CD24-ALDH-CD133+ выявлялись реже, чем CD44+CD24+/CD44-CD24+/-ALDH-CD133+ клетки (2/7 и 6/7, р=0,0210).
Общим для указанных различий частот фенотипов стволовых клеток было то, что они касались 2D- и 3D-культур, но не первичной опухоли. Кроме этого, реже всегда встречались фенотипы стволовых клеток с разными вариантами коэкспрессии маркера стволовости CD44+CD24-, а чаще клетки с экспрессией CD133 и/или ALDH без экспрессии CD44+CD24- (рис. 3).
В каждом случае исследовался обобщенный фенотипический состав каждого из трех объектов: первичной опухоли, 2D- и 3D-культур без учета их внутриопухолевой гетерогенности или гетерогенности результатов культивирования одной и той же опухоли. Полученные результаты свидетельствуют о значительной межперсональной фенотипической гетерогенности (рис. 4).
Межперсональная гетерогенность демонстрируется результатами анализа каждого из случаев, который дал возможность оценить фенотипические варианты стволовости в клетках первичной опухоли, 2D- и 3D-культур при различных вариантах экспрессии EpCAM и CK7/8. Клетки со всеми вариантами сочетания экспрессии маркеров стволовости, как и клетки без экспрессии маркеров стволовости, присутствуют в 4 из 7 исследованных случаев как в первичной опухоли, так и в 2D- и 3D-
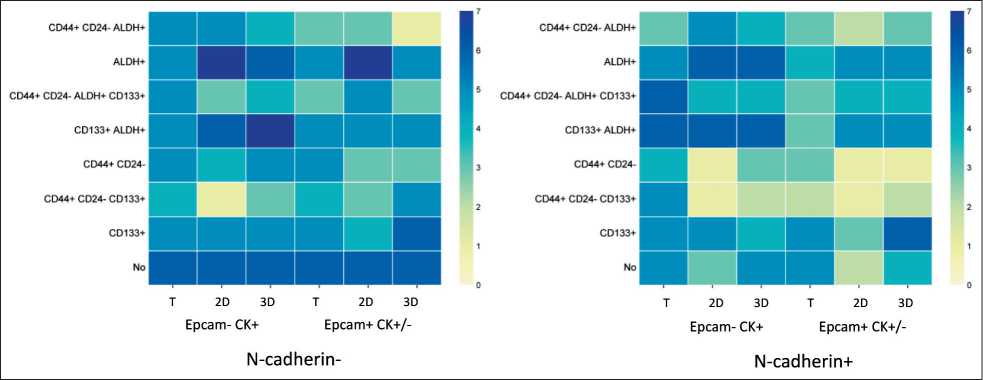
Рис. 3. Частота встречаемости опухолевых клеток с разными вариантами коэкспрессии маркеров стволовости в первичной опухоли (T), 2D- и 3D-культурах в зависимости от мембранной экспрессии EpCAM и N-cadherin.
Примечание: рисунок выполнен авторами
Fig. 3. Frequency of occurrence of tumor cells with different variants of coexpression of stemness markers in the primary tumor (T), 2D and 3D cultures depending on the membrane expression of EpCAM and N-cadherin.
Note: created by the authors

Рис. 4. Фенотипический состав первичной опухоли, 2D- и 3D-культур. Варианты стволовости. Примечания: первичная опухоль – зеленый; 2D – красный; 3D – синий; рисунок выполнен авторами
Fig. 4. Phenotypic composition of the primary tumor, 2D and 3D cultures. Variants of stemness. Notes: primary tumor – green, 2D – red, 3D – blue; created by the authors культурах (случаи 1–4). Исключением был второй случай, в котором в 2D-культуре среди клеток, экспрессирующих N-cadherin, отсутствовали все фенотипические варианты стволовых клеток. В 5-м случае при наличии в первичной опухоли клеток со всеми вариантами коэкспрессии маркеров стволовости в 2D- и 3D-культурах наблюдается потеря некоторых фенотипов стволовых клеток. В 2D-культурах теряются стволовые клетки с экспрессией CD44+CD24-, а также с сочетанием CD44+CD24- и CD133+. В 3D-культуре отсутствовали клетки с экспрессией CD44+CD24- и ALDH+.
Шестой случай характеризовался наличием в первичной опухоли четырех фенотипов стволовых клеток: ALDH+; CD133+; CD133+ALDH+ и CD44+CD24-ALDH+CD133+. В 2D-культуре исчезали клетки с фенотипом CD133+ и CD44+CD24-ALDH+CD133+. В 3D-культуре спектр стволовых клеток отличался от первичной опухоли не только потерей клеток с коэкспрессией CD44+CD24-ALDH+CD133+, но и появлением клеток с фенотипом CD133+.
Седьмой случай отличался от предыдущих появлением в культурах стволовых клеток с фенотипами, отсутствующими в первичной опухоли. В первичной опухоли присутствовал только фенотип стволовых клеток с экспрессией CD133. В 2D- и 3D-культурах появлялись кроме клеток CD133+ все другие фенотипы стволовых клеток: CD44+CD24-; ALDH+; CD133+ALDH+; CD44+CD24-ALDH+ и CD44+CD24-ALDH+CD133+.
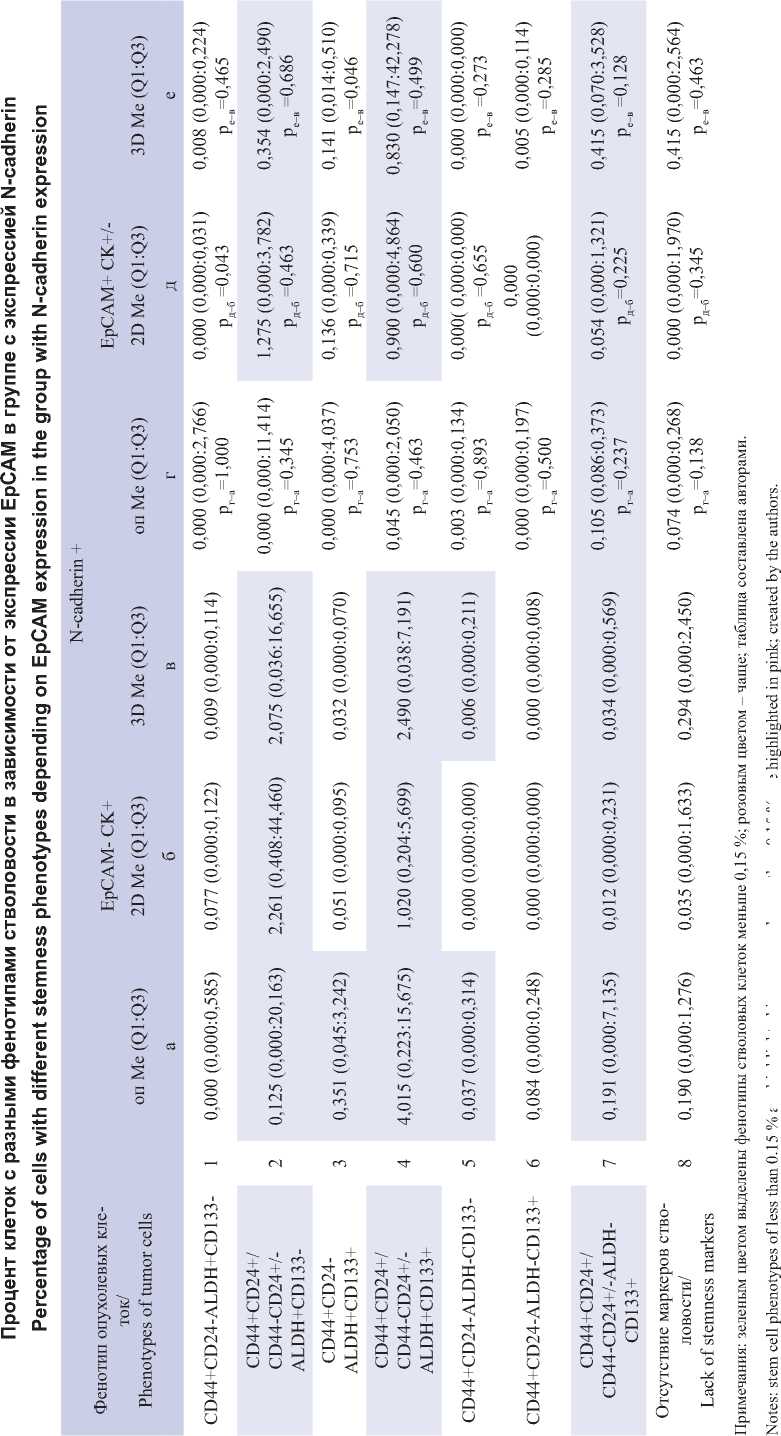
В табл. 2 и 3 приведены результаты статистического сравнения долей различных фенотипов стволовых клеток в первичной опухоли, 2D- и 3D-культурах с учетом экспрессии EpCAM и N-cadherin. Сравнение долей разных фенотипов опухолевых клеток в каждом из трех исследуемых объектов показало, что относительное количество клеток каждого из стволовых фенотипов в основном не различалось в первичной опухоли и в 2D-культурах независимо от экспрессии EpCAM и N-cadherin. Исключением оказались стволовые клетки с фенотипом EpCAM+CD44+CD24-ALDH+CD133-N-cadherin+, относительная доля которых в 2D-культурах была меньше, чем подобных клеток, не экспрессирующих EpCAM (р=0,043). В 3D-культуре было меньше клеток EpCAM+CD44+CD24-ALDH+CD133-N-cad-herin- (р=0,043), но больше клеток EpCAM+ CD44+CD24+/CD44-CD24+/-ALDH-CD133+N-cadherin- (p=0,028) по сравнению с подобными стволовыми клетками в 3D-культурах, не экспрессирующими EpCAM (табл. 2). Кроме этого, среди клеток 3D-культур, экспрессирующих N-cadherin, было больше трижды позитивных стволовых клеток (EpCAM+CD44+CD24-ALDH+CD133+N-cadherin+, p=0,046). Общим для стволовых клеток, которых было меньше в 2D- и 3D-культурах, экспрессирующих EpCAM, в сравнении с EpCAM- клетками, была коэкспрессия с другими маркерами стволовости CD44+CD24-.
Сравнение между собой долей стволовых клеток с разными фенотипами в первичной опухоли, 2D- и 3D-культурах выявило закономерные различия. Они очевидны в 2D- и 3D-культурах, если разделить фенотипы на группы с долями клеток меньше и больше 0,15 %. Оказалось, что среди клеток с долями меньше 0,15 % преобладают фенотипы стволовых клеток с коэкспрессией маркера стволовости CD44+CD24-. Поскольку таких фенотипов было 4, то максимальное число в 2D- и 3D- культурах с долями меньше 0,15 % могло быть 8. Среди фенотипов, доли которых превышали 0,15 %, большинство составляли фенотипы клеток с экспрессией ALDH и/или CD133 (всего 3 фенотипа, максимальное число фенотипов, превышающих 0,15 %, могло быть 6).
Оценка соответствия «малочисленных» фенотипов предположению, что такие клетки должны иметь CD44+CD24-, а «многочисленные» фенотипы иметь маркеры стволовости ALDH и/или CD133 и не иметь сочетания экспрессии CD44+CD24-, дала следующие результаты. Среди клеток, не экспрессирующих N-cadherin, при отсутствии экспрессии EpCAM соотношение «малочисленные»/« многочисленные» фенотипы среди (CD44+CD24-)+ клеток равнялось 7/1, а среди ALDH и/или CD133 клеток – 0/6 (р=0,0047); среди стволовых клеток, экспрессирующих EpCAM, соответственно, 8/0 и 0/6 (р=0,0003). Экспрессия N-cadherin не влияла на отмеченную закономерность: среди EpCAM- стволовых клеток соотношения 8/0 и 2/4 (р=0,0150), среди EpCAM+ клеток – 8/0 и 1/5 (р=0,0030).
Следует отметить, что в первичной опухоли доли указанных двух групп фенотипов стволовости не различаются: среди EpCAM-N-cadherin- стволовых клеток соотношения 2/2 и 0/3, EpCAM+N-cadherin- 4/0 и 2/1; среди EpCAM-N-cadherin+: 3/1 и 1/2, а EpCAM+N-cadherin+: 4/0 и 3/0. Исключением были и стволовые клетки N-cadherin + CD133+ (табл. 3), которые составляли доли, меньшие чем 0,15 % в EpСAM- клетках 2D- и 3D- культур и EpСAM+ клетках первичной опухоли и 2D-культуры.
Обсуждение
Настоящее исследование посвящено сравнению проявлений стволовых свойств опухолевых клеток в зависимости от экспрессии EpCAM при люминальном подтипе РМЖ при культивировании опухолевых клеток в 2D- и 3D-культурах. По имеющимся данным, экспрессия EpCAM ассоциирована с признаками стволовости [3, 4]. Известно, что выраженная экспрессия EpCAM сопряжена при РМЖ с неблагоприятным прогнозом [1]. Значит ли это, что клетки опухоли, не экспрессирующие мембранный EpCAM, существенно отличаются по важным признакам, обеспечивающим агрессивное поведение: стволовости и ЭМП?
Таблица 2/table 2
Процент клеток с разными фенотипами стволовости в зависимости от экспрессии epCaM в группе без экспрессии n-cadherin Percentage of cells with different stemness phenotypes depending on epCaM expression in the group without n-cadherin expression
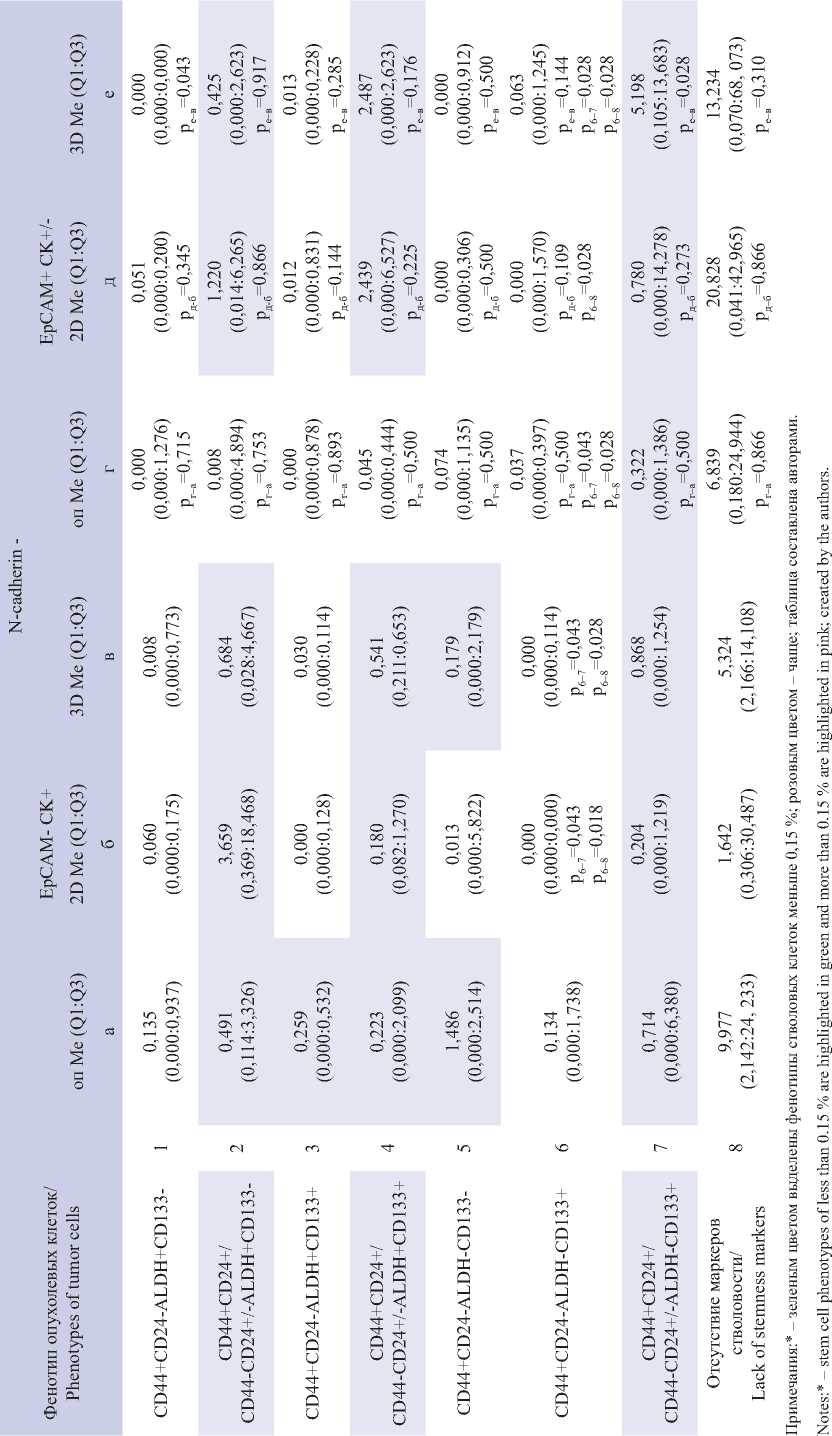
Таблица 3/table 3
are highlighted in green, and more than 0.15 % are
В связи с этим предполагалось выяснить, насколько различны фенотипические варианты стволовых клеток в сфероидах, образующихся в 3D-культурах, в EpCAM- и EpCAM+ клетках. Еще одна задача состояла в сравнении стволовых признаков клеток в 3D-культурах с фенотипами клеток, культивируемых в 2D-культурах, и клеточным составом первичной опухоли. Полученные результаты позволили получить ответы на эти вопросы.
Основные выводы состоят в следующем. Не обнаружено значимых различий по частоте выявления клеток с проявлениями стволовых признаков среди EpCAM- и EpCAM+ клеток опухоли, 2D- и 3D-культур. Как в первичной опухоли, так и в 2D- и 3D-культурах присутствуют все фенотипы стволовых клеток опухоли, различающихся вариантами коэкспрессии CD44, CD24, CD133 и ALDH. Отмечается выраженная внутри- и межопухолевая гетерогенность по фенотипическому составу первичных опухолей, 2D- и 3D-культур. Отсутствовали и различия EpCAM- и EpCAM+ клеток первичной опухоли, 2D- и 3D-культур по проявлениям ЭМП. Что касается связи фенотипа ЭМП стволовых клеток и способности формировать маммосферы, наши результаты показывают, что сфероиды могут формироваться при наличии клеток как с вариантами эпителиального фенотипа ЭМП (ЕрсAM+СК7/8-N-cadherin-; ЕрCAM-СК7/8+N-cadherin-), так и гибридных фенотипов ЭМП (ЕрCAM+СК7/8-N-cadherin+; ЕрCAM-СК7/8+N-cadherin+). Данные литературы свидетельствуют о том, что различия в способности формировать маммосферы в зависимости от фенотипа ЭМП только количественные: гибридные фенотипы ЭМП показали повышенную способность формировать маммосферы [7]. Наши наблюдения свидетельствуют о том, что опухолевые клетки проявляют высокую адаптивность к условиям культивирования в 2D- и 3D-культурах независимо от варианта коэкспрессии маркеров стволовости и проявления ЭМП.
Проявление стволовых свойств в 3D-культурах настолько закономерно, что сам факт формирования сфероидов рассматривается как признак стволовости культивируемых клеток [7]. Однако не всегда отсутствие формирования сфероидов при культивировании в условии 3D-модели является аргументом в пользу отсутствия стволовых свойств опухолевых клеток. Такое утверждение справедливо, поскольку экспрессия стволовых маркеров в клетках опухоли не всегда коррелирует с их способностью образовывать сфероиды/маммосферы [9, 10]. Способность формировать сфероиды зависит от многих факторов: условий культивирования, плотности клеток в момент посева и состава среды, сохранения ими эпителиального фенотипа и, прежде всего, экспрессии Е-cadherin [12]. И наконец, в формировании сфероидов молочных желез в 3D-культуре имеет значение клеточная адгезия, опо- средованная взаимодействием α6β4 с аутокринно продуцируемым ламинином-332 [13].
Наше исследование свидетельствует о том, что во всех случаях в 2D-культурах определялись стволовые клетки с разными фенотипами стволовости. Только в одном случае в 2D-культурах среди клеток, экспрессирующих N-cadherin, отсутствовали стволовые клетки со всеми фенотипами. Такой результат закономерен. Устоявшимся является суждение о том, что условия культивирования опухолевых клеток в 2D-культурах не оптимальны для изучения стволовых свойств опухолевых клеток. Однако возможность культивирования стволовых клеток в 2D-культурах подтверждается результатами работы с BCSC3 и BCSC4 линиями РМЖ. Стволовые клетки этих линий первоначально культивировали в 3D-, а затем в среде 2D для более эффективного размножения клеток [14]. В соответствии с протоколом «Large-Scale Expansion of Human Pluripotent Stem Cells (hPSCs) in 2D Monolayer Culture», 2D-культуры считаются вполне подходящими для культивирования плюрипотентных стволовых клеток человека [15]. По-видимому, адгезия опухолевых клеток к поверхности в условиях 2D-культивирования не препятствует проявлению разнообразных признаков стволовости.
Межперсональная гетерогенность в настоящем исследовании проявилась в том, что в 57 % случаев в 2D- и 3D-культурах обнаруживались все варианты коэкспрессии маркеров стволовости. В остальных наблюдениях в 2D- и 3D-культурах не выявлялись некоторые фенотипы стволовости.
Один из наиболее интересных результатов состоял в том, что при выборе порогового значения 0,15 % все фенотипы стволовости, которые обнаруживались в 2D- и 3D-культурах (но не в первичной опухоли), можно было разделить на две группы: «малочисленные» и относительно «многочисленные». Причем это касалось как частот встречаемости малой части фенотипов, так и долей большей части клеток с соответствующими маркерами ство-ловости. Наименьшие частоты и доли составляли стволовые клетки с фенотипом CD44+CD24- и клетки с коэкспрессией CD44+CD24- с другими маркерами стволовости. Более многочисленными были стволовые клетки, экспрессирующие CD133 и/или ALDH без коэкспрессии с CD44+CD24-. Результат, по-видимому, закономерен. Маркер стволовости CD44+CD24- является наиболее часто определяемым при раке молочной железы [16]. Однако имеются работы, демонстрирующие, что стволовые клетки с фенотипом CD44+CD24-обладают низкой способностью к формированию маммосфер [14]. Полученные результаты дают основание с определенной осторожностью связывать способность опухолевых клеток формировать сфероиды и стволовость, если определялся только один маркер стволовости, поскольку этот феномен может быть обусловлен стволовыми свойствами, ассоциированными с другими коэкспрессируемы-ми маркерами стволовости.
Таким образом, результаты работы демонстрируют, что при культивировании в 2D- и 3D-условиях отсутствие экспрессии EpCAM не препятствует проявлению опухолевыми клетками разнообразных стволовых свойств и признаков ЭМП, а также выраженной межперсональной гетерогенности. Вместе с тем, следует иметь в виду, что для получения более точных количественных характеристик фенотипического состава стволовых клеток, экспрессирующих и не экспрессирующих EpCAM, частот и долей стволовых клеток в 2D- и 3D-культурах, проявлений межперсональной гетерогенности, необходимо проведение дополнительных исследований.
Заключение
Результаты исследования свидетельствуют о том, что опухолевые клетки люминального молекулярно-биологического подтипа РМЖ, не экспрессирующие EpCAM, способны, как и EpCAM-положительные, при культивировании как в 2D-, так и в 3D-культурах проявлять все варианты фенотипов стволовости. В большинстве случаев в одной опухолевой клетке наблюдается коэкспрессия нескольких маркеров стволовости. Частота выявления разных вариантов коэкспрес-сии маркеров стволовости CD44, CD24, CD133 и ALDH и маркера мезенхимного фенотипа ЭМП N-cadherin статистически не различается в первичной опухоли, в 2D- и 3D-культурах. Стволовые клетки с экспрессией CD44+CD24- независимо от коэкспрессии с другими маркерами были самыми малочисленными, в то время как клетки, экспрессирующие ALDH или ALDH, в сочетании с CD133 были наиболее многочисленными. Выраженная межперсональная гетерогенность состава стволовых клеток в 2D- и 3D-культурах является объективной причиной сложностей групповой оценки этой важной характеристики агрессивных свойств опухолевых элементов.
Список литературы Характеристика стволовых признаков EPCAM-негативных и EPCAM-позитивных опухолевых клеток в первичной опухоли, 2D- и 3D- культурах при раке молочной железы
- Gires O., Pan M., Schinke H., Canis M., Baeuerle P.A. Expression and function of epithelial cell adhesion molecule EpCAM: where are we after 40 years? Cancer Metastasis Rev. 2020; 39(3): 969-87. https://doi.org/10.1007/s10555-020-09898-3.
- Winter M.J., Cirulli V., Briaire-de Bruijn I.H., Litvinov S.V. Cadherins are regulated by Ep-CAM via phosphaditylinositol-3 kinase. Mol Cell Biochem. 2007; 302(1-2): 19-26. https://doi.org/10.1007/s11010-007- 9420-y.
- Huang H.P., Chen P.H., Yu C.Y., Chuang C.Y., Stone L., Hsiao W.C., Li C.L., Tsai S.C., Chen K.Y., Chen H.F., Ho H.N., Kuo H.C. Epithelial cell adhesion molecule (EpCAM) complex proteins promote transcription factormediated pluripotency reprogramming. J Biol Chem. 2011; 286(38): 33520-32. https://doi.org/10.1074/jbc.M111.256164.
- Tran K.A., Pietrzak S.J., Zaidan N.Z., Siahpirani A.F., McCalla S.G., Zhou A.S., Iyer G., Roy S., Sridharan R. Defning reprogramming checkpoints from single-cell analyses of induced pluripotency. Cell Reports. 2019; 27(6): 1726-41. https://doi.org/10.1016/j.celrep.2019.04.056.
- Bouchalova P., Bouchal P. Current methods for studying metastatic potential of tumor cells. Cancer Cell Int. 2022; 22(1): 394. https://doi.org/10.1186/s12935-022-02801-w.
- Barbosa M.A.G., Xavier C.P.R., Pereira R.F., Petrikaitė V., Vasconcelos M.H. 3D Cell Culture Models as Recapitulators of the Tumor Microenvironment for the Screening of Anti-Cancer Drugs. Cancers. 2021; 14(1): 190. https://doi.org/10.3390/cancers14010190.
- Grosse-Wilde A., Fouquier d’Hérouël A., McIntosh E., Ertaylan G., Skupin A., Kuestner R.E., del Sol A., Walters K.A., Huang S. Stemness of the hybrid Epithelial/Mesenchymal State in Breast Cancer and Its Association with Poor Survival. PLoS One. 2015; 10(5). https://doi.org/10.1371/journal.pone.0126522.
- Marcato P., Dean C.A., Pan D., Araslanova R., Gillis M., Joshi M., Helyer L., Pan L., Leidal A., Gujar S., Giacomantonio C.A., Lee P.W.K. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 2011; 29(1): 32-45. https://doi.org/10.1002/stem.563.
- Keller P.J., Lin A.F., Arendt L.M., Klebba I., Jones A.D., Rudnick J.A., DiMeo T.A., Gilmore H., Jefferson D.M., Graham R.A., Naber S.P., Schnitt S., Kuperwasser C. Mapping the cellular and molecular heterogeneity of normal and malignant breast tissues and cultured cell lines. Breast Cancer Res. 2010; 12(5). https://doi.org/10.1186/bcr2755.
- Lehmann C., Jobs G., Thomas M., Burtscher H., Kubbies M. Established breast cancer stem cell markers do not correlate with in vivo tumorigenicity of tumor-initiating cells. Int J Oncol. 2012; 41(6): 1932-42. https://doi.org/10.3892/ijo.2012.1654.
- Perel'muter V.M., Grigor'eva E.S., Zav'yalova M.V., Tashireva L.A., Alifanov V.V., Savel'eva O.E., Vtorushin S.V., Choinzonov E.L., Cherdyntseva N.V. Proyavleniya apoptoza v subpopulyatsiyakh tsirkuliruyushchikh opukholevykh kletok s fenotipami, assotsiirovannymi so stvolovost'yu i epitelial'no-mezenkhimal'nym perekhodom, pri kartsinome molochnoi zhelezy. Uspekhi molekulyarnoi onkologii. 2022; 9(4): 96-111. https://doi.org/10.17650/2313-805X-2022-9-4-96-111.
- Manuel I.J., Beloqui I., Garcia-Garcia F., Leis O., VazquezMartin A., Eguiara A., Cuf S., Pavon A., Menendez J.A., Dopazo J., Martin A.G. Mammosphere formation in breast carcinoma cell lines depends upon expression of E-cadherin. PLoS One. 2013; 8(10). https://doi.org/10.1371/journal.pone.0077281.
- Friedland J.C., Lakins J.N., Kazanietz M.G., Chernoff J., Boettiger D., Weaver V.M. α6β4 integrin activates Rac-dependent p21-activated kinase 1 to drive NF-κB-dependent resistance to apoptosis in 3D mammary acini. J Cell Sci. 2007; 120(20): 3700-12. https://doi.org/10.1242/jcs.03484.
- Strietz J., Stepputtis S.S., Follo M., Bronsert P., Stickeler E., Maurer J. Human Primary Breast Cancer Stem Cells Are Characterized by Epithelial-Mesenchymal Plasticity. Int J Mol Sci. 2021; 22(4): 1808. https://doi.org/10.3390/ijms22041808.
- Tohyama S., Fujita J., Fujita C., Yamaguchi M., Kanaami S., Ohno R., Sakamoto K., Kodama M., Kurokawa J., Kanazawa H., Seki T., Kishino Y., Okada M., Nakajima K., Tanosaki S., Someya S., Hirano A., Kawaguchi S., Kobayashi E., Fukuda K. Efcient large-scale 2D culture system for human induced pluripotent stem cells and differentiated cardiomyocytes. Stem cell reports. 2017; 9(5): 1406-14. https://doi.org/10.1016/j.stemcr.2017.08.025.
- Sarrio D., Franklin C.K., Mackay A., Reis-Filho J.S., Isacke C.M. Epithelial and mesenchymal subpopulations within normal basal breast cell lines exhibit distinct stem cell/progenitor properties. Stem Cells. 2012; 30(2): 292-303. https://doi.org/10.1002/stem.791.


