Характеристики иммунного микроокружения нормальной слизистой оболочки перитуморальной области - дополнительный независимый прогностический фактор при раке желудка
Автор: Данилова Наталья Владимировна, Хомяков Владимир Михайлович, Чайка Анна Валентиновна, Михайлов Илья Александрович, Олейникова Нина Александровна, Мальков Павел Георгиевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оценка прогностического значения иммунного микроокружения рака желудка и морфологически нормальной слизистой оболочки перитуморальной области с применением системы автоматического морфометрического анализа на примере CD8+ клеток. Материал и методы. Использованы образцы операционного материала от 130 пациентов с верифицированным диагнозом рака желудка. После проведения иммуногистохимического окрашивания с антителами к CD8 была проведена морфологическая оценка по оригинальной методике: подсчет средней площади CD8+ клеток в трех полях зрения при *20, измеренной с помощью автоматической системы морфометрического анализа LAS X, в центральной части опухоли и участках морфологически нормальной слизистой оболочки перитуморальной области, непосредственно прилежащей к опухолевой ткани. Результаты сопоставлены с основными клинико-морфологическими характеристиками опухолевого процесса и с общей пятилетней выживаемостью пациентов. Результаты и обсуждение. Высокая плотность инфильтрации CD8+ клетками в участках нормальной слизистой оболочки перитуморальной области наблюдалась в группах T4a и T4b по глубине инвазии (n=96, p=0,0089); была ассоциирована с наличием эмболов в лимфатических сосудах (n=96, p=0,0102) и с более продвинутой стадией рака желудка (n=96, p=0,0107). Исследованные случаи были разделены на две группы: до 3300 кв.мкм (лучшая выживаемость пациентов - n=79, p=0,01) и от 3300 кв.мкм и более по средней площади CD8+ клеток в участках нормальной слизистой оболочки перитуморальной области. При проведении многофакторного анализа выживаемости с использованием регрессионной модели Кокса установлено, что средняя площадь CD8+ клеток в нормальной слизистой оболочке перитуморальной области является значимым отрицательным прогностическим фактором (RR=1,537; CI: 1,102-3,105; p0,05). Заключение. Впервые продемонстрирована возможность использования системы автоматического анализа для оценки иммунного микроокружения при раке желудка и установлено, что высокий уровень инфильтрации CD8+ лимфоцитами морфологически нормальной слизистой оболочки перитуморальной области является независимым неблагоприятным прогностическим фактором, в связи с чем рекомендуем обязательный забор биопсийного материала из слизистой оболочки перитуморальной области на предоперационном этапе для морфометрической оценки инфильтрации CD8+ лимфоцитами.
Рак желудка, иммунное микроокружение, морфометрический анализ, иммуногистохимия, cds-позитивные t-лимфоциты, анализ выживаемости, прогностические факторы
Короткий адрес: https://sciup.org/140254417
IDR: 140254417 | УДК: 616.33-006.6:612.017]-037 | DOI: 10.21294/1814-4861-2021-20-1-74-86
Текст научной статьи Характеристики иммунного микроокружения нормальной слизистой оболочки перитуморальной области - дополнительный независимый прогностический фактор при раке желудка
При РЖ одной и той же стадии пациенты имеют различные клинические исходы, что стимулирует поиск новых прогностических факторов и эффективных методов лечения, одними из которых являются характеристики иммунного микроокружения опухолей, в том числе опухоль-инфильтрирующих лимфоцитов (TILs) [4]. С точки зрения иммунологии TILs – специфическая популяция Т-лимфоцитов, которая активируется при презентации дендритными клетками опухолевых антигенов [5]. Опухолевые антигены возникают в результате транскрипции участков ДНК, подвергшихся различным генетическим нарушениям.
В соответствии с рекомендациями Международной рабочей группы по изучению иммунных биомаркеров в онкологии (International Immunooncology Biomarkers Working Group, IIBWG) [12] лучшим для идентификации TILs признается иммуногистохимический метод. Согласно этому консенсусу, репрезентативным для оценки TILs счи- тается фрагмент ткани размером не менее 4–5 мм, более предпочтителен операционный, а не биопсийный материал. Метод тканевых микрочипов, по мнению данной рабочей группы, непригоден для оценки плотности инфильтрации TILs [12]. Однако рекомендованная методика подсчета не учитывает необходимость подсчета TILs во всех участках пе-ритуморальной области, поэтому необходима апробация новых шкал оценки TILs, а также внедрение автоматизированных систем, позволяющих выполнять более точный морфометрический анализ.
Для каждого образца было проведено обзорное окрашивание гематоксилином и эозином; иммуногистохимическое выявление маркера цитотоксических Т-лимфоцитов CD8 (клон C8/144В) с использованием иммуностейнера Autostainer 480S (Thermo Fisher Scientific, USA). Результаты реакций оценивали с использованием микроскопа DM4000B/DFC495 (Leica Microsystems, Germany) и автоматической системы морфометрического анализа LAS X (Leica Microsystems, Germany) с применением сегментации участков изображения выбранного цветового диапазона по шкале RGB. Результат морфометрического анализа фиксировался в виде площади, занятой объектами выделенного цветового диапазона (окрашенными диаминобензидином) в данном поле зрения в квадратных микрометрах (мкм2).
Для морфологической оценки использована оригинальная методика, частично основанная на рекомендациях IIBWG [12]: подсчет средней площади CD8+ клеток в трех полях зрения при ×20 в центральной части опухоли и участках морфологически нормальной слизистой оболочки перитуморальной области, непосредственно прилежащей к опухолевой ткани (находящейся на расстоянии не более одного поля зрения при ×20 от опухолевой ткани).
Статистическая обработка данных проводилась с использованием программного пакета Statistica 10 (StatSoft, Inc., USA). Для статистической обработки результатов использовались: непараметрический U-критерий Манна–Уитни (Mann–Whitney U-test) для попарного сравнения групп, критерий Краскала–Уоллиса (Kruskal–Wallis test) для множественного сравнения, анализ выживаемости по Каплану–Майеру (survival analysis by Kaplan– Meier curve), логранговый критерий (log-rank test), критерий Кокса–Мантела (Cox–Mantel test) и критерий Вилкоксона, обобщенный Геханом (Gehan’s Wilcoxon test), а также многофакторный анализ выживаемости в регрессионной модели пропорциональных рисков Кокса (Cox proportional hazard model).
Результаты и обсуждение
Наибольшее значение медианы средней площади CD8+ клеток при оценке в центральной части опухолей было получено в группе T4a – 2260,8 мкм2, однако близкие значения также были получены в группе T1a/T1b – 2229,2 мкм2 и в группе T3 – 2260,8 мкм2 (табл. 3). Различия между группами по глубине инвазии при оценке инфильтрации в центральной части опухолей оказались статистически не значимыми. Наибольшее значение медианы при оценке инфильтрата в участках морфологически нормальной слизистой оболочки перитуморальной области было получе-
Таблица 3/table 3
Медианы средних площадей, занимаемых cd8+ клетками в 3 полях зрения в мкм2 при Ч20 в зависимости от клинико-морфологических характеристик опухоли
Medians of the average areas occupied by cd8+ cells in three fields of view in square micrometers (Ч20) in the context of the clinical and morphological characteristics of the tumor
|
Клинико-морфологические свойства опухоли/ |
В центральной части опухоли/ |
В участках морфологически нормальной слизистой оболочки перитуморальной области/ |
|
Clinical and morphological properties of the tumor |
In the central part of the tumor |
In areas of morphologically normal mucous membrane of the peritumoral area |
Глубина инвазии/Depth of invasion
(рис. 1а). Известно, что высокая плотность инфильтрации опухолевой ткани цитотоксическими CD8+ Т-лимфоцитами ассоциирована с лучшим прогнозом. Основным путем активации этой популяции клеток является презентация антигена дендритными клетками путем связывания Т-клеточного рецептора (TCR) и CD8 с соответствующими
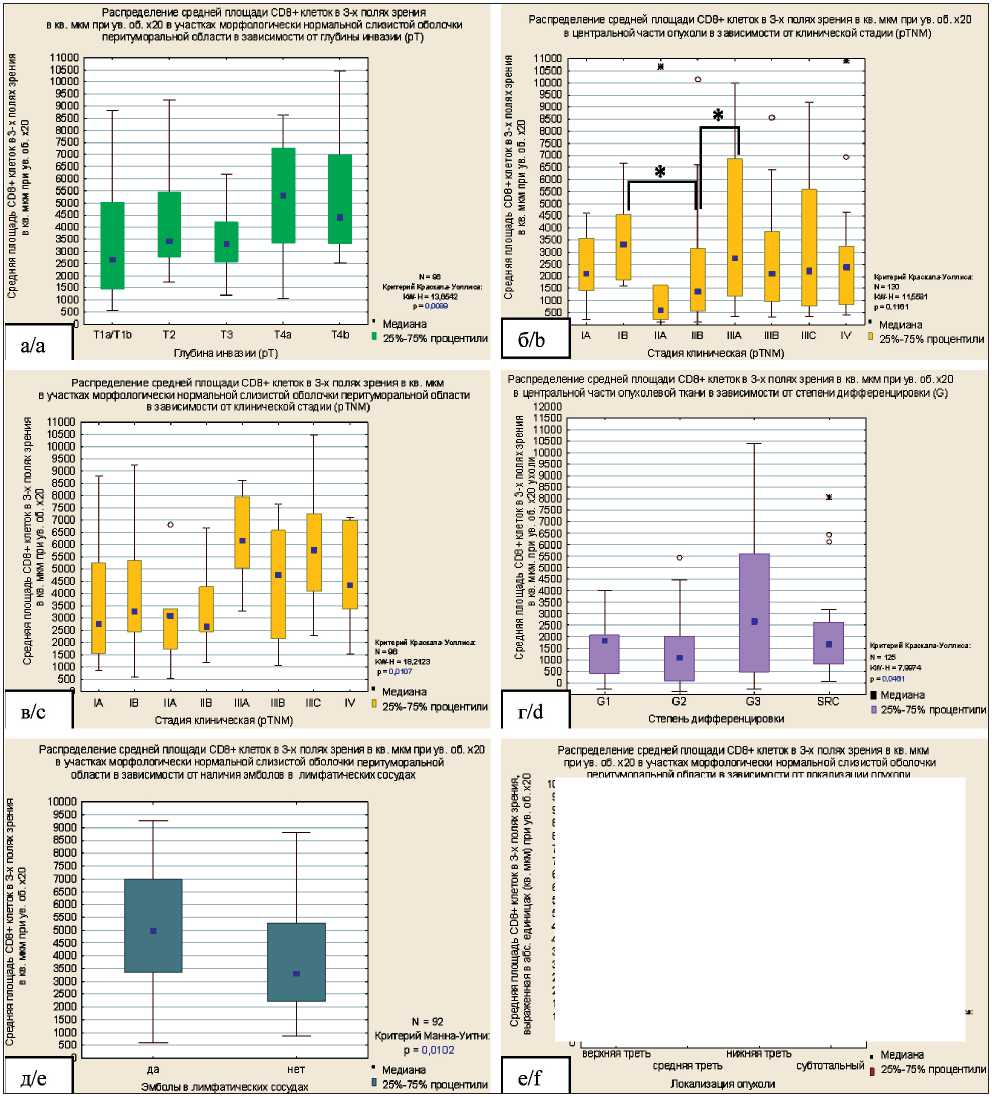
При изучении связи средней площади CD8+ клеток с количеством метастазов в регионарные лимфатические узлы, а также наличием отдаленных метастазов значимых различий не выявлено.
Наибольшее значение медианы средней площади CD8+ клеток при оценке в центральной части опухолей было получено в группе опухолей с наличием эмболов в лимфатических сосудах – 2429,8 мкм2, однако это преобладание не является статистически значимым (табл. 3).
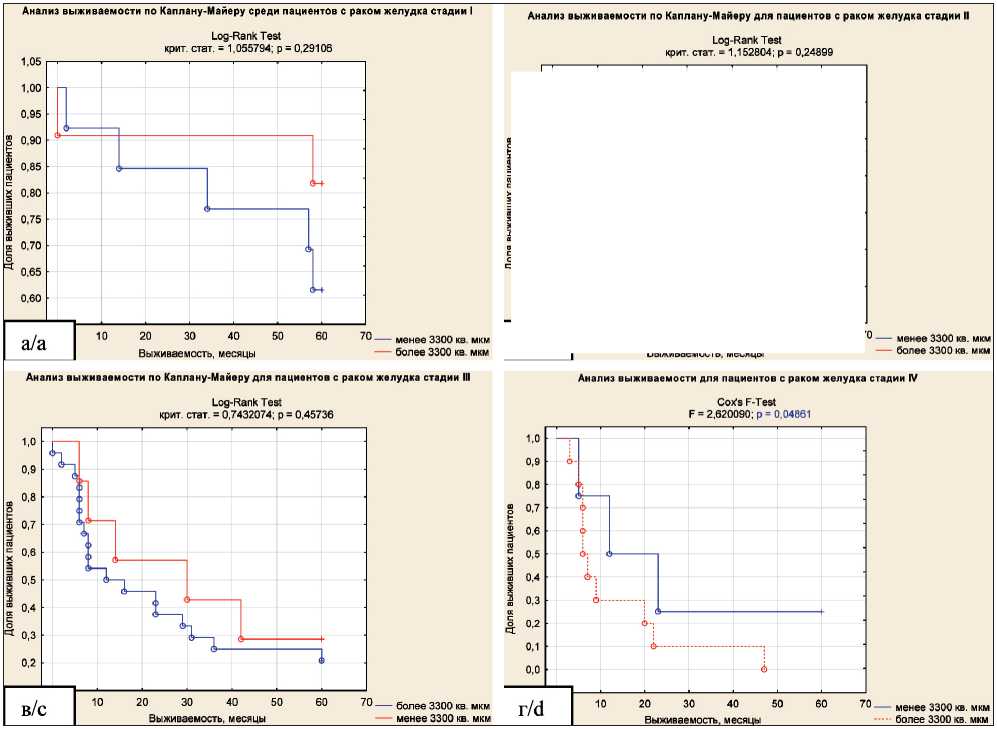
Рис. 2. Распределение средней площади CD8+ клеток в зависимости от показателей общей 5-летней выживаемости по Каплану–Майеру: а – в зависимости от плотности распределения средних площадей CD8+ клеток в центральной части опухолевой ткани;
б – в зависимости от средней площади CD8+ клеток в центральной части опухолевой ткани; в – в зависимости от плотности распределения средних площадей CD8+ клеток в участках морфологически нормальной слизистой оболочки перитуморальной области выживаемости пациентов; г – в зависимости от средней площади CD8+ клеток в участках морфологически нормальной слизистой оболочки перитуморальной области
Fig. 2. Distribution of average area of CD8+ cells by overall five-year survival of patients: a – analysis of the density distribution of average areas of CD8+ cells in the central part of the tumor tissue by survival; b – Kaplan-Meier survival analysis by average area of CD8+ cells in the central part of the tumor tissue; c – analysis of the density distribution of average areas of CD8+ cells in morphologically normal mucous membrane of the peritumoral area by survival; d – Kaplan-Meier survival analysis survival by average area of CD8+ cells in morphologically normal mucous membrane of the peritumoral area
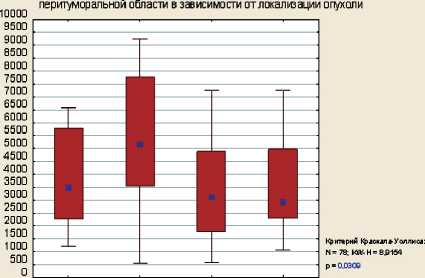
носным и лимфатическим сосудам и способствует метастазированию. Возможная патогенетическая роль CD8+ TILs в прилежащей к инвазивному краю опухоли морфологически не измененной ткани также изучена недостаточно. Известно, что CD4+ лимфоциты способны стимулировать активность CD8+ лимфоцитов путем секреции эффекторных цитокинов [6]. Следовательно, если предположить, что в перитуморальной области CD4+ Т-хелперы 17 типа находятся в активированном состоянии, то весьма вероятно, что они стимулируют миграцию и активность CD8+ лимфоцитов. При изучении связи средней площади CD8+ клеток с наличием эмболов в кровеносных сосудах, степенью дифференцировки и локализацией опухоли значимых различий не получено.
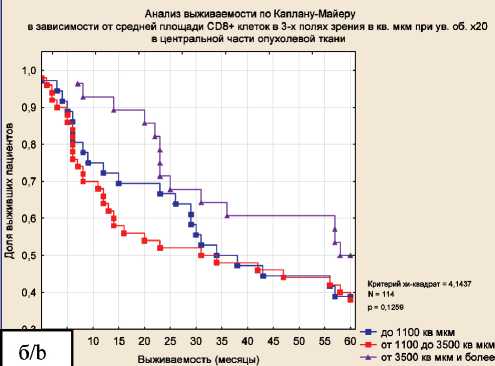
В целях проведения анализа выживаемости выборка была сгруппирована на основании не- скольких пороговых значений средней площади CD8+ клеток в 3 полях зрения при ×20, которые были определены в ходе построения функций выживаемости. Исследованная выборка случаев является цензурированной как слева (отсчет времени проводился от даты операции), так и справа (срок наблюдения ограничивался 60 мес). Исследованные случаи были разделены на три группы по средней площади CD8+ клеток в центральной части опухоли: до 1100 мкм2; от 1100 до 3500 мкм2; от 3500 мкм2 и более. Разделение на группы проводилось эмпирически путем выделения пороговых значений средней площади CD8+ клеток, разделяющих области наибольшего скопления значений на графиках плотности распределения полученных данных (рис. 2а).
Для трех выбранных групп были построены кривые выживаемости Каплана–Майера (рис. 2б).
Таблица 4/table 4
|
Стадия/Stage (n=53) |
Степень дифференцировки/Differentiation degree (n=53) |
||
|
I |
11 |
AC, NOS, G1 |
4 |
|
II |
8 |
AC, NOS, G2 |
12 |
|
III |
24 |
AC, NOS, G3 |
20 |
|
IV |
10 |
SRC |
17 |
Таблица 5/table 5
Сравнение результатов проведения многофакторного анализа общей пятилетней выживаемости пациентов с использование регрессионной модели пропорциональных рисков Кокса comparison of the results of a multivariate analysis of the overall five-year survival of patients using the cox proportional risk regression model
|
Средняя площадь CD8+ клеток в 3 полях зрения (мкм2) при ×20, измеренная методом автоматической сегментации, в центральной части опухоли (до 110 мкм2; 1100–3500 мкм2; более 3500 мкм2)/ The average area of CD8+ cells in 3 fields of view (sq. μm) at magnification about ×20, measured by automatic segmentation, in the central part of the tumor (up to 110 sq. μm; 1100–3500 sq. μm; more than 3500 sq. μm) |
0,803 |
0,574–1,122 |
> 0,05 |
|
Средняя площадь CD8+ клеток в 3 полях зрения (мкм2) при ×20, измеренная методом автоматической сегментации, в морфологически нормальной слизистой оболочке периту-моральной области, непосредственно прилежащей к опухолевой ткани (до 3300 мкм2; более 3300 мкм2)/ |
1,537 |
0,761–3,105 |
< 0,01 |
|
The average area of CD8+ cells in 3 fields of view (sq. μm) at magnification about |
×20, measured by automatic segmentation, in the morphologically normal mucous membrane of the peritumoral region, immediately adjacent to the tumor tissue (up to 3300 sq. μm; more than 3300 sq. μm)
Лучшая пятилетняя выживаемость наблюдалась в группе больных с опухолями со средней площадью CD8+ клеток в 3 полях зрения от 3500 мкм2 и более, однако значимые различия между группами отсутствовали (критерий χ2: n=114, p=0,1260). В зависимости от средней площади CD8+ клеток в участках морфологически нормальной слизистой оболочки перитуморальной области исследованные случаи были разделены на две группы: до 3300 мкм2; от 3300 мкм2 и более. Разделение на группы проводилось на основании анализа плотности и функции распределения полученных данных (рис. 2в). Лучшая пятилетняя выживаемость наблюдалась у группы пациентов, в образцах от которых средняя площадь CD8+ клеток в 3 полях зрения в участках морфологически нормальной слизистой оболочки перитуморальной области не превышала 3300 мкм2 (рис. 2г), причем различие с другой группой характеризовалось высоким уровнем статистической значимости (для n=79: лог-ранговый критерий – p=0,0333; критерий Кокса–Мантела – p=0,0381; критерий Вилкоксона, обобщенный Ге- ханом – p=0,01). Следует обратить внимание, что в группе с высокой (от 3300 мкм2 и более) площадью CD8+ клеток присутствовали опухоли различных pTNM-стадий и дифференцировки (табл. 4).
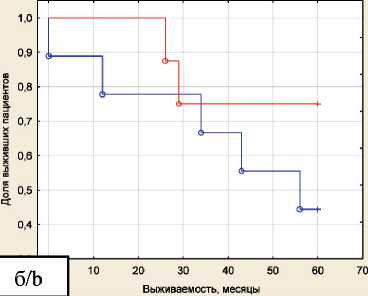
При сравнении выживаемости пациентов в рамках одной клинической стадии выявлено значимое снижение выживаемости пациентов с РЖ IV стадии при высокой средней площади CD8+ клеток (более 3300 мкм2) (рис. 3). Для других стадий значимых различий не получено, что может быть связано с малым числом наблюдений, однако у больных РЖ III стадии прослеживается тенденция к ухудшению выживаемости при высокой средней площади CD8+ клеток в участках морфологически нормальной слизистой оболочки перитуморальной области.
Таким образом, впервые показано, что высокая плотность инфильтрации CD8+ клетками, выраженная в виде средней площади в 3 полях зрения при ×20 и подсчитанная автоматическим методом, достоверно ассоциирована с худшей общей пятилетней выживаемостью пациентов, а так-
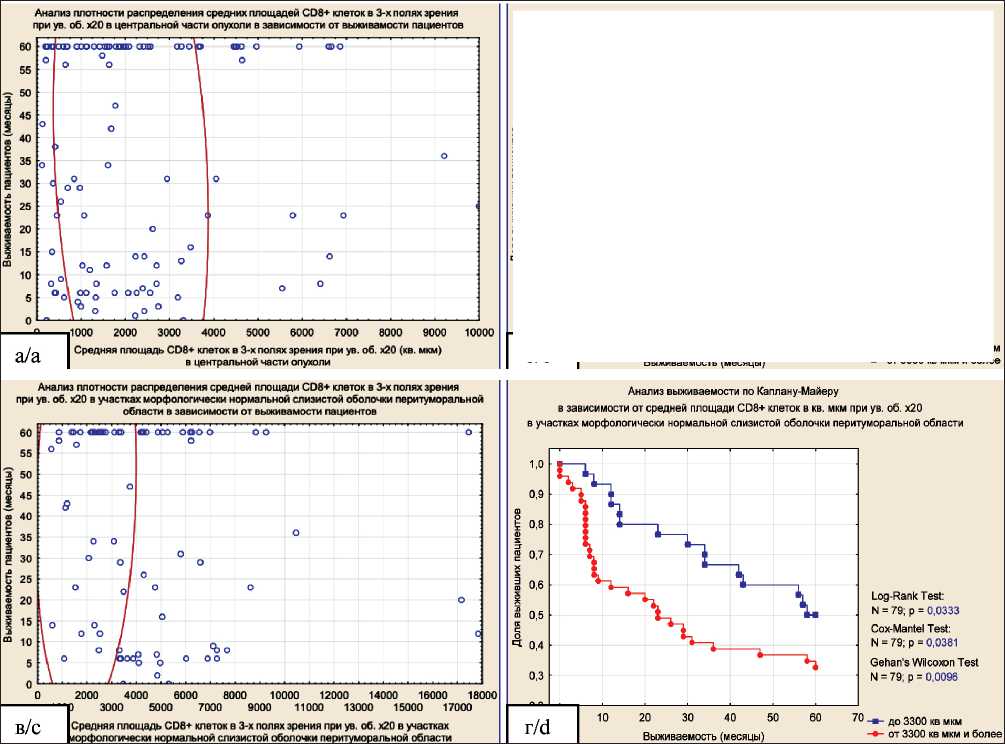
Рис. 3. Общая пятилетняя выживаемость по Каплану–Майеру больных РЖ в зависимости от стадий и средней площади CD8+ клеток в участках морфологически нормальной слизистой оболочки перитуморальной области: а – РЖ I стадии; б – РЖ II стадии; в – РЖ III стадии; г – РЖ IV стадии
Fig. 3. Тhe overall five-year Kaplan-Meier survival of patients with gastric cancer depending on stages and average area of CD8+ cells in morphologically normal mucous membrane of the peritumoral area:
a – gastric cancer I stage; b – gastric cancer II stage; c –gastric cancer III stage; d – gastric cancer IV stage
Список литературы Характеристики иммунного микроокружения нормальной слизистой оболочки перитуморальной области - дополнительный независимый прогностический фактор при раке желудка
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov; 68(6): 394-424. https://doi.org/10.3322/caac.21492.
- Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014 Sep 11; 513(7517): 202-9. https://doi.org/10.1038/nature13480.
- Ajani J.A., Amin M.B., Edge S., Greene F., Byrd D.R., Brookland R.K. AJCC Cancer Staging Manual. 8th ed. Springer, American Joint Committee on Cancer; 2017. 1032 p.
- Jiang W., Liu K., Guo Q., Cheng J., Shen L., Cao Y., Wu J., Shi J., Cao H., Liu B., Tao K., Wang G., Cai K. Tumor-infiltrating immune cells and prognosis in gastric cancer: a systematic review and meta-analysis. Oncotarget. 2017 May 3; 8(37): 62312-62329. https://doi.org/10.18632/oncotarget.17602.
- Zhang D., He W., Wu C., Tan Y., He Y., Xu B., Chen L., Li Q., Jiang J. Scoring System for Tumor-Infiltrating Lymphocytes and Its Prognostic Value for Gastric Cancer. Front Immunol. 2019; 10: 71. https://doi.org/10.3389/fimmu.2019.00071.
- Kumar V., Abbas A.K., Aster J.C. Robbins and Cotran Pathologic Basis of Disease. Philadelphia: Elsevier Saunders. 2015.
- Lu P., Weaver V.M., Werb Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 2012; 196(4): 395-406. https://doi.org/10.1083/jcb.201102147.
- Fridman W.H., Pagès F., Sautès-Fridman C., Galon J. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer. 2012 Mar 15; 12(4): 298-306. https://doi.org/10.1038/nrc3245. PMID:22419253.
- Ma H.Y., Liu X.Z., Liang C.M. Inflammatory microenvironment contributes to epithelial-mesenchymal transition in gastric cancer. World J Gastroenterol. 2016 Aug 7; 22(29): 6619-28. https://doi.org/10.3748/wjg.v22.i29.6619.
- Sawayama H., Ishimoto T., Baba H. Microenvironment in the pathogenesis of gastric cancer metastasis. J Cancer Metastasis Treat. 2018; 4(10). https://doi.org/10.20517/2394-4722.2017.79.
- Liu K., Yang K., Wu B., Chen H., Chen X., Chen X., Jiang L., Ye F., He D., Lu Z., Xue L., Zhang W., Li Q., Zhou Z., Mo X., Hu J.Tumor-Infiltrating Immune Cells Are Associated With Prognosis of Gastric Cancer. Medicine (Baltimore). 2015 Sep; 94(39): e1631. https://doi.org/10.1097/MD.0000000000001631.
- Hendry S., Salgado R., Gevaert T., Russell P.A., John T., Thapa B., Christie M., van de Vijver K., Estrada M.V., Gonzalez-Ericsson P.I., Sanders M., Solomon B., Solinas C., Van den Eynden G.G.G.M., Allory Y., Preusser M., Hainfellner J., Pruneri G., Vingiani A., Demaria S., Symmans F., Nuciforo P., Comerma L., Thompson E.A., Lakhani S., Kim S.-R., Schnitt S., Colpaert C., Sotiriou C., Scherer S.J., Ignatiadis M., Badve S., Pierce R.H., Viale G., Sirtaine N., Penault-Llorca F., Sugie T., Fineberg S., Paik S., Srinivasan A., Richardson A., Wang Y., Chmielik E., Brock J., Johnson D.B., Balko J., Wienert S., Bossuyt V., Michiels S., Ternes N., Burchardi N., Luen S.J., Savas P., Klauschen F., Watson P.H., Nelson B.H., Criscitiello C., O’Toole S., Larsimont D., de Wind R., Curigliano G., Andre F., Lacroix-Triki M., van de Vijver M., Rojo F., Floris G., Bedri S., Sparano J., Rimm D., Nielsen T., Kos Z., Hewitt S., Singh B., Farshid G., Loibl S., Allison K.H., Tung N., Adams S., Willard-Gallo K., Horlings H.M., Gandhi L., Moreira A., Hirsch F., Dieci M.V., Urbanowicz M., Brcic I., Korski K., Gaire F., Koeppen H., Lo A., Giltnane J., Rebelatto M.C., Steele K.E., Zha J., Emancipator K., Juco J.W., Denkert C., Reis-Filho J. Assessing Tumor-infiltrating Lymphocytes in Solid Tumors: A Practical Review for Pathologists and Proposal for a Standardized Method From the International Immunooncology Biomarkers Working Group: Part 1: Assessing the Host Immune Response, TILs in Invas. Adv Anat Pathol. 2017 Sep; 24(5): 235-251. https://doi.org/10.1097/PAP.0000000000000162.
- Mikhailov I., Danilova N., Malkov P., Oleynikova N. CD4+ and CD8+ lymphocytes in the immune microenvironment of gastric cancer: evaluation in Tumour Tissue (TT) and Adjacent Areas of Unchanged Mucosa (AAUM). Virchows Arch. 2019; 475(Suppl 1): S282. https://doi.org/10.1007/s00428-019-02631-8.
- Löffek S., Zigrino P., Angel P., Anwald B., Krieg T., Mauch C. High invasive melanoma cells induce matrix metalloproteinase-1 synthesis in fibroblasts by interleukin-1alpha and basic fibroblast growth factormediated mechanisms. J Invest Dermatol. 2005 Mar; 124(3): 638-43. https://doi.org/10.1111/j.0022-202X.2005.23629.x.
- Wang Y., Wu H., Wu X., Bian Z., Gao Q. Interleukin 17A promotes gastric cancer invasiveness via NF-κB mediated matrix metalloproteinases 2 and 9 expression. PLoS One. 2014; 9(6): e96678. https://doi.org/10.1371/journal.pone.0096678.


