Хелатные комплексы гепарина с биометаллами (медь, цинк)
Автор: Францева Юлия Викторовна, Феофанова Марианна Александровна, Семенов Артем Николаевич
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 14, 2009 года.
Бесплатный доступ
Исследовано комплексообразование высокомолекулярного гепарина с ионами меди (II) и цинка (II) с помощью методов рН-потенциометрического титрования и математического моделирования. Установлено, что ионы меди и цинка образуют ряд комплексов с гепарином, характеризующихся различной устойчивостью. Разница в устойчивости объясняется различным сродством этих ионов к донорным группам мономерного звена гепарина.
Гепарин, комплекс, медь, цинк, хелатные комплексы гепарина
Короткий адрес: https://sciup.org/146116249
IDR: 146116249 | УДК: 541.
Текст научной статьи Хелатные комплексы гепарина с биометаллами (медь, цинк)
Гепарин – биополимер, цепь которого построена из мономерных звеньев, состоящих из сульфатированных остатков α-L – идуроновой кислоты и α-D – глюкозамина, он является природным антикоагулянтом крови прямого действия, широко применяемым в медицине, обладающим фибринолитическим, противогипоксическим, анальгетическим, спазмолитическим и противовоспалительным действием. В живых организмах гепарин синтезируется в виде протеогликана, состоящего из белка серглицин, с которым ковалентно связаны многочисленные линейные полисахаридные цепочки гепарина [12]. Изучение молекулярной структуры гепарина очень важно с точки зрения сопоставления химической структуры этого вещества и его антикоагулянтных и других физиологических свойств. Обладая большим числом донорных групп, несущих отрицательный заряд, гепарин способен взаимодействовать с ионами различных металлов. Особый интерес представляет исследование комплексообразования гепарина с важнейшими биометаллами, так как это позволяет оценить его влияние на баланс ионов в плазме крови. Ионы меди и цинка играют важную роль в регуляции многих функций человеческого организма.
Медь содержится в организме в виде комплексных соединений с белками. Общее содержание меди в теле человека – 100 – 150 мг. Средняя концентрация меди в плазме крови составляет 0,75 – 1,3 мг/л [1]. Медь связывается с белками плазмы и поступает в печень, включаясь в церулоплазмин, откуда высвобождается в плазму крови. Большая часть – 92 – 96 % – прочно связана с белками сыворотки крови – соединение с aльфа 2 -глобулинами (церулоплазмин). Небольшая часть плазменной меди лабильно связана с альбуминами [6]. Физиологическое содержание цинка в плазме –
10 – 20 мкМ, а концентрация свободных, биологически активных катионов составляет порядка 0,2 – 1,0 нМ.
Цинк поступает в плазму крови, где связывается белками и ферментом карбоангидразой. В таком связанном состоянии цинк циркулирует с кровотоком и из плазмы крови попадает внутрь клеток. В сыворотке крови 70% цинка слабо связано с альбумином и другими белками [7].
Цель работы: исследование комплексообразования высокомолекулярного гепарина с ионами биометаллов Ca2+, Mg2+, Cu2+, Zn2+.
Материалы и методы исследования. В качестве исходного препарата, содержащего гепарин, использовали фармакологический раствор его тетранатриевой соли, упакованный во флаконы по 5 мл. Производитель – Московский эндокринный завод. Каждый миллилитр такого раствора содержал 5000 ЕД, или 38,5 мг, соли. Поскольку большинство лигандов способно протонироваться, наиболее распространенным и удобным экспериментальным методом определения исследования процессов комплексообразования в системах M2+ – Na 4 Hep – H 2 O (M2+: Zn2+, Cu2+) явился рН-потенциометрический метод. Для этого готовили серии растворов, содержащих ионы металла и лиганда в разных мольных соотношениях.
Растворы хлоридов меди и цинка готовили растворением навесок солей в бидистилляте с последующей стандартизацией при помощи комплексонометрического титрования. Концентрации растворов были соответственно C Cu2+ = 1,20∙10-3 M, C Zn2+ = 1,12∙10-3 .Квалификация солей – «чистый для анализа» («ч.д.а.»). Раствор фонового электролита (NaCl) – хлорида натрия («ч.д.а.») готовили растворением навески соли в бидистилляте. Бидистиллятом является дважды перекристаллизованная вода. Раствор соляной кислоты готовили из фиксанала и стандартизировали по тетраборнокислому натрию.
Предварительно гепарин переводили в форму кислоты введением 4 молей HCl на каждый моль мономерного звена. Растворы термостатировали и далее титровали стандартным раствором гидроксида натрия, регистрируя величину рН. Измерения рН проводили с помощью иономера И-135 с точностью определения рН, равной ±0,01 ед. Заданную температуру 37°С с точностью до 0,1 поддерживали с помощью термостата UTU - 2/77.
Экспериментальные данные обрабатывали с помощью алгоритма AUTOEQUIL [2], позволяющего в режиме автоматизированного поиска адекватного набора химических равновесий определить значимые комплексные формы и рассчитать величины логарифмов констант образования этих форм. Математическая модель системы составляется с учетом химической специфики и координационных возможностей иона металла и лиганда.
Результаты исследования и их обсуждение. На первом этапе были исследованы химические равновесия в составляющей подсистеме: Na 4 Hep – NaCl – H 2 O. На рис. 1 представлена кривая рН-метрического титрования водного раствора Na 4 Hep. На каждый моль мономерного звена гепарина вводили 4 моля хлороводородной кислоты для перевода гепарина из формы соли в форму кислоты.
Спектр возможных молекулярных форм исследуемой системы Na 4 Hep-H 2 O задан расширенной компонентной матрицей стехиометрических коэффициентов этих форм в термодинамическом базисе H+, Hep4- (табл. 1).
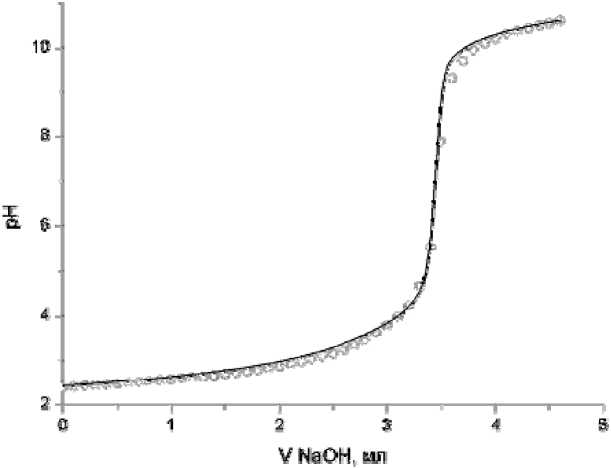
Рис. 1. Кривая титрования водного раствора гепарина + 4 экв. HCl на фоне 0,15 М NaCl при температуре 37ºС, С hep =1,16∙10-3 М, С HCl =0, 0048 М, С NaOH =0,1410 М: точки – эксперимент, линия – расчет
Таблица 1
Молекулярная матрица системы Na 4 Hep-H 2 O, базис H+, Hep4-
|
№ |
Молекулярная форма |
Lg( β i ) |
H+ |
Hep4- |
|
1 |
H+ |
0 |
1 |
0 |
|
2 |
Hep4- |
0 |
0 |
1 |
|
3 |
OH- |
-13, 40 |
-1 |
0 |
|
4 |
HHep3- |
lgβ 1 |
1 |
1 |
|
5 |
H 2 Hep2- |
lgβ 2 |
2 |
1 |
|
6 |
H 3 Hep- |
lgβ 3 |
3 |
1 |
|
7 |
H 4 Hep |
lgβ 4 |
4 |
1 |
В результате моделирования химических равновесий идентифицирована только одна форма HHep3-, отвечающая протонированию карбоксильной группы фрагмента α-L – идуроновой кислоты [8]. Рассчитанное нами значение величины десятичного логарифма константы протонирования было сопоставлено с аналогичными значениями, приведенными в литературе (табл. 2).
Таблица 2
Величины десятичных логарифмов констант протонирования гепарина
|
lgβ |
Источник |
|
3,62±0,11 |
наши данные |
|
4,70±0,20 |
Rabestein et al. [9] |
|
3,66±0,04 |
Карпухин и др. [3] |
|
3,79±0,06 |
Семенов и др. [5] |
|
3,62* |
Katayama et al. [8] |
Примечание. * – Указанная величина соответствует логарифму константы диссоциации α-L – идуроновой кислоты.
Концентрационная диаграмма распределения форм гепарина в растворе в зависимости от величины рН раствора представлена на рис. 2.
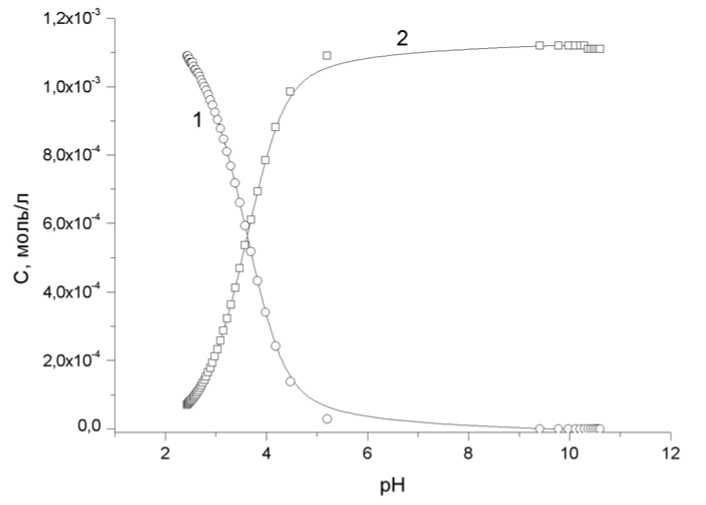
Рис. 2. Концентрационная диаграмма распределения форм гепарина в зависимости от рН в присутствии 0,15 М NaCl при температуре 37ºС, C Hep = 1,16∙10-3 М, 1 – Hhep3-, 2 – Hep4-
На рис. 3 представлены кривые рН-метрического титрования систем
MCl2 – Na4hep – NaCl – HCl – H2O (M: Cu2+, Zn2+) при эквивалентном соотношении между компонентами. Для системы, содержащей ионы меди, гомогенность сохраняется во всем рабочем интервале рН, следовательно, ограничений при применении метода математического моделирования нет. В случае цинксодержащей системы гомогенность раствора нарушалась при достижении критической величины рН, следовательно, в областях существования твердой фазы процедура математического моделирования проведена быть не может, или же должна проводиться с учетом методики [4]. Область рН>8 не информативна, тогда как область рН стабильности плазмы крови 6,8≤pH≤7,4 имеет больший практический интерес. Исходя из этого, было принято решение в случае системы Zn2+ – Na4hep – H2O – HCl проанализировать лишь те участки кривой титрования, на которых титруемый раствор заведомо гомогенен.
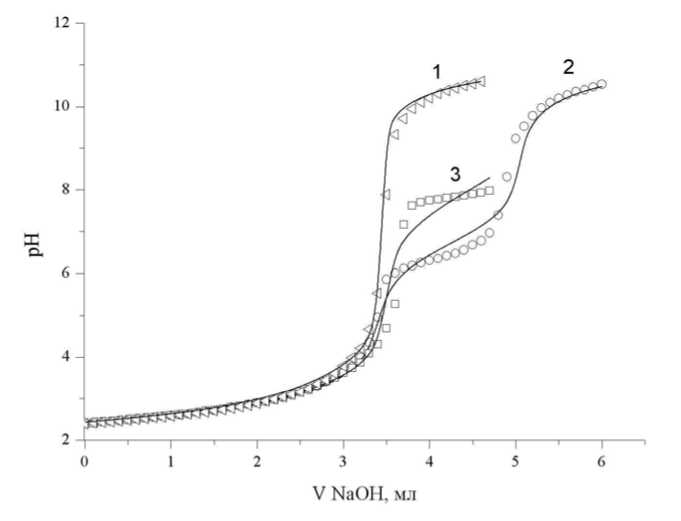
Рис. 3. Кривые титрования систем Cu2+ - Na 4 hep (2) и Zn2+ - Na 4 hep (3), C Cu2+ = 1,20∙10-3M, C Zn2+ = 1,12∙10-3 M, C hep4- = 1,16∙10-3 M, C HCl =0,0048 М, температура 37°С, ионная сила – 0,15 М NaCl:
точки – эксперимент, линии – расчет; для сравнения приведена кривая титрования гепарина (1): C hep4- = 1,16∙10-3 M, C HCl =0,0048 М
В результате математической обработки экспериментальных данных было выявлено, что ионы меди и цинка образуют с гепарином однотипный набор комплексов – средние гепаринаты, а также смешаннолигандные гидроксокомплексы, существующие при высоких величинах рН. Рассчитанные нами величины логарифмов констант образования идентифицированных комплексов приведены в табл. 3.
Таблица 3
Величины логарифмов констант образования комплексов гепарина с ионами меди и цинка
|
Состав |
lgβ |
pH αмакс , ед. |
|
2- CuHep |
7,79±0,17 |
4,17 |
|
3- CuOHHep |
14,99±0,10 |
6,49 |
|
4- Cu(OH) Hep |
21,44±0,11 |
10,58 |
|
2- ZnHep |
2,94±0,35 |
4,72 |
|
ZnOHHep3- |
9,58±0,20 |
7,99 |
|
Zn(OH) Hep4- |
14,87±0,17 |
8,12 |
Характер распределения комплексных форм в исследованных модельных системах отражают концентрационные диаграммы распределения, приведенные на рис. 4 и 5.
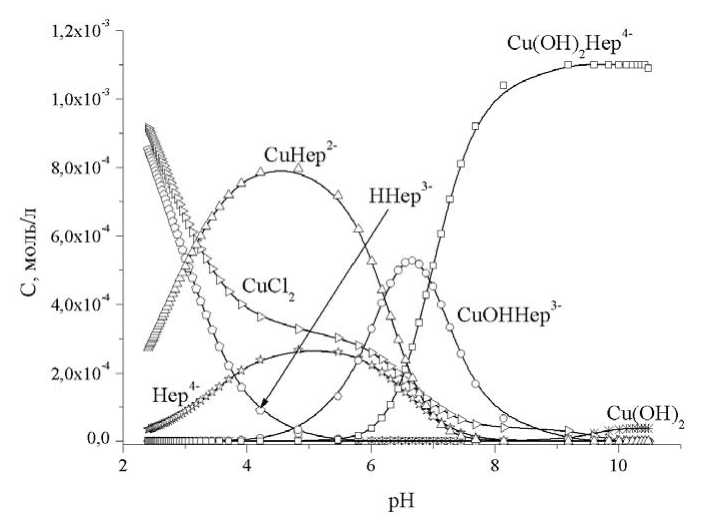
Рис. 4. Концентрационная диаграмма распределения комплексных форм в системе Cu2+ - Na 4 hep – H 2 O – HCl,
C Cu2+ = 1,20∙10-3 M, C hep4- = 1,16∙10-3 M, C HCl =0,0048 М, температура 37°С, ионная сила – 0,15 М NaCl
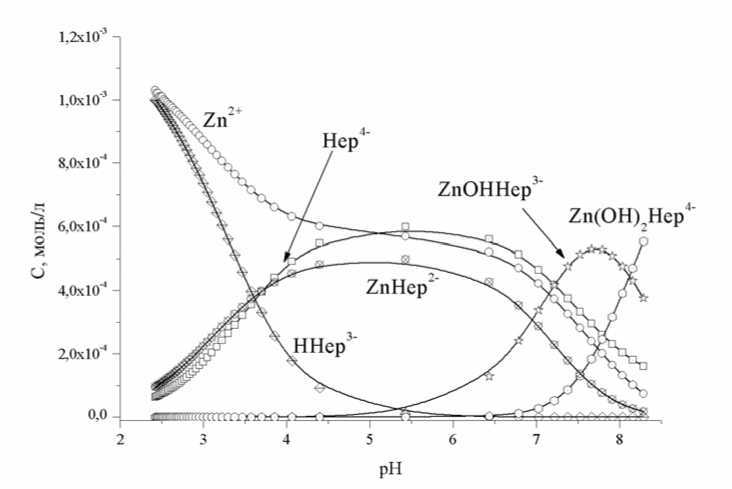
Рис. 5. Концентрационная диаграмма распределения комплексных форм в системе Zn2+ - Na 4 hep – H 2 O – HCl, C Cu2+ = 1,20∙10-3 M, C hep4- = 1,16∙10-3 M, C HCl =0,0048 М, температура 37°С, ионная сила – 0,15 М NaCl
Как следует из рис. 4 и 5, средние гепаринаты меди и цинка доминируют в слабокислой области, однако сохраняют значительные концентрации и в области рН стабильности плазмы. В слабощелочной и щелочной областях доминируют смешаннолигандные гидроксокомплексы. Данные, позволяющие судить о процессах образования комплексов в системе «гепарин – ион металла», достаточно разнообразны, но порой весьма противоречивы. Гепарин имеет несколько типов донорных групп: карбоксильная, сульфогруппы, гидроксогруппы, гликозидный и эфирный кислород, карбонильный кислород и амидный азот. Хотя непосредственное участие амидной группы в образовании связей маловероятно, все же полностью не исключается. Таким образом, в образовании комплексов преимущественно участвуют атомы кислорода. Образование хелатных циклов с участием депротонированных гидроксильных групп рибозных колец маловероятно, а вот участие в процессе координации гликозидных атомов кислорода является наиболее предпочтительным вариантом. Остается возможность образования хелатных циклов достаточно большого размера, к появлению которых может привести замыкание донорных группировок, принадлежащих разным субъединицам мономерного звена на центральном ионе [9; 11]. Согласно [13], ионы меди координируются карбоксильной группой α-L-идуронового кольца, кольцевым атомом кислорода идуронат-2-О-сульфата, гликозидным атомом кислорода, а также 6-О-сульфатной группой D-глюкозаминового фрагмента.
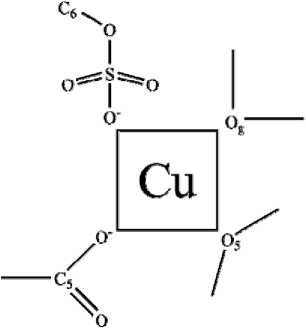
Рис. 6. Предполагаемая схема координации иона меди четырьмя донорными группами мономерного звена гепарина [по: 13]
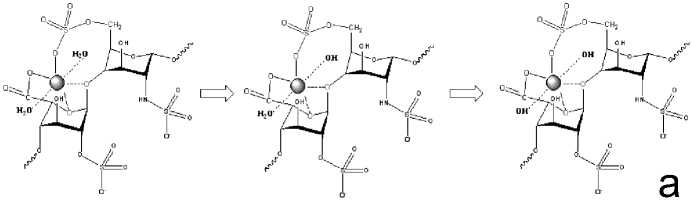
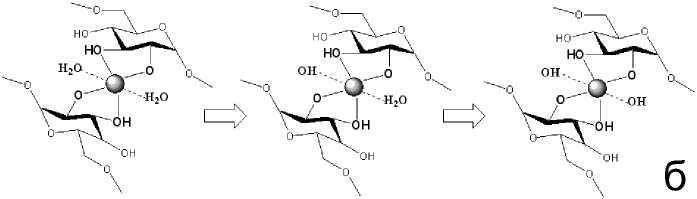
Рис. 7. Сравнение механизмов взаимодействия ионов меди с гепарином (a) с аналогичными взаимодействиями ионов меди с декстраном (б) [по: 10]
Исходя из идентифицированного набора комплексных форм для обеих систем, можно полагать, что в слабокислой области ионы меди и цинка связаны с донорными группами и, кроме того, за счет реализации координационного числа, равного 6, ионы меди дополнительно координируют две молекулы воды, учесть которые при составлении модели невозможно. Гидролиз ионов меди и цинка протекает непосредственно в «матрице»; происходит последовательное замещение молекул воды в координационной сфере на гидроксид-ионы.
Для примера приведем схему последовательного образования всего набора комплексных форм в системе CuCl 2 – Na 4 hep (рис. 6). Следует отметить, что аналогичный механизм образования комплексных форм характерен, для чего и обнаружен и при взаимодействии ионов меди с декстраном. Видно (рис. 7), что в случае гепарина, координация двух цепей невозможна прежде всего в силу большей дентатности гепарина, нежели декстрана. В первом случае монозвено ведет себя как четырехдентатный лиганд, тогда как во втором (декстран) – монозвено бидентатно.
Точных сведений о механизме координации ионов цинка гепарином нет.
Для подтверждения выводов, полученных методами рН – метрического титрования и математического моделирования при изучении взаимодействия ионов меди с гепарином выделили компексную форму с максимумом концентрации при 10 ед. рН, полагая, что ее состав может быть описан формулой Na 4 [CuHep(OH) ]. Для этого смешали рассчитанные количества реагентов, довели рН до требуемого значения с помощью раствора гидроксида натрия. При этом наблюдали образование раствора синей окраски. Комплекс осадили ацетоном, отделили центрифугированием и высушили в токе теплого воздуха. Полученный комплекс представляет собой стеклообразное хрупкое вещество зеленовато-синего цвета. Легко растворим в воде. Раствор устойчив в течение длительного времени. Для подтверждения количественного состава навеску комплекса растворили и оттитровали трилоном - Б в среде аммиачного буфера и в присутствии мурексида в качестве металлохромного индикатора. Было найдено, что в выделенном веществе содержится 8,82% меди по массе, тогда как теоретическое содержание меди в комплексе составляет величину порядка 7,85%. Полученный результат может говорить о том, что выделенному веществу реально соответствует предложенная стехиометрия и выводы, полученные при математическом моделировании исследованных систем, корректны. В результате проведенного исследования установлено, что ионы Cu2+, Zn2+, образуют ряд комплексов с гепарином, характеризующихся различной устойчивостью. Pазница в устойчивости соответствующих комплексных форм ионов Cu2+, Zn2+ с гепарином объясняется разным сродством этих ионов к донорным группам мономерного звена гепарина.
Tver State University
It is investigated complex high-molecular heparin with copper ions (II)) and zinc (II) by means of methods pH ─ potentiometric titration and mathematical modelling. It is established that copper and zinc ions form a number of complexes with heparin, characterised by various stability. The difference in stability speaks various affinity of these ions to донорным to groups of a monomeasured link heparin.


