Химические процессы при микродуговом оксидировании
Автор: Михеев А.Е., Трушкина Т.В., Гирн А.В., Раводина Д.В., Ивасев С.С.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 2 (48), 2013 года.
Бесплатный доступ
Рассмотрены химические процессы, протекающие при микродуговом оксидировании (МДО) алюминиевого сплава АМг-6 в силикатно-щелочном электролите; показаны возможные химические превращения в результате взаимодействия компонентов, входящих в состав электролитов; приведены результаты исследований по определению элементного состава получаемых покрытий; установлена зависимость содержания таких оксидных элементных форм, как SiO 2 и Al2О 3 химического состава покрытия от технологических режимов. Проведенные исследования показывают, что покрытие на образцах алюминиевого сплава состоит из двух основных оксидных элементных форм: SiO 2 и Al2О 3. При проведении исследования фазового состава покрытия методом рентгеноструктурного анализа было выявлено, что покрытие, сформированное микродуговым оксидированием на сплаве АМг-6, состоит из а и γ-Al 2O 3, причем а фаза Al 2O 3 присутствует только во внутренних слоях покрытия, γ-Al 2O 3 присутствует по всей толщине покрытия, и на внешнем крае покрытия выявлена фаза муллита (3Al 2O 3 • 2SiO 2) и оксид кремния SiO 2.
Микродуговое оксидирование, химические реакции, алюминиевый сплав, элементный анализ
Короткий адрес: https://sciup.org/148177062
IDR: 148177062 | УДК: 541.138.2
Текст научной статьи Химические процессы при микродуговом оксидировании
Микроплазменное оксидирование является сложным многофакторным процессом. Влияние отдельных факторов на свойства и качество покрытий исследуются достаточно широко, особое внимание уделяют анодно-катодному режиму процесса, который обеспечивает получение покрытий с повышенными физикомеханическими характеристиками, такими как адгезия, микротвердость, прочность и износостойкость [1; 2]. Но в данный период по микроплазменным процессам еще нет целостной картины, описывающий весь процесс МДО, в том числе и с точки зрения происходящих химических процессов. Характеристики МДО покрытий в значительной степени зависят от технологических режимов, состава и концентрации электролитов и ряда других факторов. В работе рассмотрены процессы химических превращений в силикатнощелочном растворе электролита, в котором содержащиеся катионы и/или анионы образуют нерастворимые оксиды, входящие в состав покрытия. Обработке подвергались образцы из алюминиевого сплава АМг-6 в электролите, содержащем 4 г/л NaOH и 10 г/л Na2SiO3, при следующих технологических режимах: плотность тока I = 5–40 А/дм2; продолжительность оксидирования – 60 мин; соотношение анодной и катодной составляющих силы тока I k / I a , = 0,6–1,4; температура электролита – 15–40 °С. В процессе химических превращений происходит последовательное формирование покрытия переменного фазового состава, содержащее различные аллотропические модификации оксида алюминия: α-Аl 2 О 3 , δ-Аl 2 О 3 , γ-Аl 2 О 3 и муллита 2SiO2·3Аl2O3. Рассмотрим возможные химические реакции, приводящие к их образованию.
В процессе МДО на поверхности металла возможно растворение алюминия с образованием тетрагид-роксоалюмината:
2Al + 2OH– + 6H 2 O →2[Al(OH) 4 ]– + 3H 2
В электролите происходит диссоциация силиката натрия:
Na 2 SiO 3 + 3H 2 O ↔ 2Na+ + 2OH– + H 4 SiO 4
Na 2 SiO 3 + H 2 O ↔ NaНSiO 3 + NaOН
SiO 3 – + H 2 O ↔ НSiO 3 – + OH–
При взаимодействии силикат-иона с водой образуется поликремнекислота HSiO 3 . Возникшее поверхностное соединение – поликремнекислота – содержит реакционноспособные силанольные группы SiOH, способные к частичной диссоциации в воде по кислотному типу:
SiOН →SiO– + Н+
Образующиеся ионы Н+ переходят в жидкую фазу, но вследствие кулоновского взаимодействия с ионами –SiO– образуют внешнюю обкладку в растворе у поверхности твердой фазы. Ионы ОН– способствуют диссоциации силанольных (SiOH) групп. Возникает ЭДС с внутренней обкладкой (определяющей отрицательный знак Δφ), состоящей из –SiO–. Потенциало-пределяющими ионами будут ионы, влияющие на степень диссоциации SiOH-групп, а именно Н+ и ОН–:
О :
si о™ ; н
О :
I :
-si-o- ; н+
О :
Затем происходит взаимодействие ионов алюминия с одной силанольной группой (образование моно-дентатного комплекса):
SiOН + Al3+ → SiOAl2+ + Н+
Связывание одного иона алюминия с двумя силанольными группами (образование бидентатного комплекса) выражается формулой
2SiOН + Al3+ → (SiO) 2 Al+ + 2Н+
Связывание одного иона алюминия с тремя силанольными группами (образование тридентатного комплекса):
3SiOН + Al3+ → (SiO)3Al+ + 3Н+ а также образование комплекса, в котором с силанольной группой взаимодействует гидролизованный ион металла:
2SiOН + Al3+ +H 2 O→ (SiO) 2 AlOH + 2Н+
В этом растворе возможен гидролиз компонентов электролита с последующим термолизом продуктов гидролиза в зоне разряда:
SiO 3 2– + 2Н+ → Н 2 SiO 3 → SiO 2 + H 2 O
Авторы работы [1] считают, что разлагаясь, при высоких температурах кремниевая кислота дает диоксид кремния SiO 2 в виде α-кристобалита и α-кварца, и воду, а далее возможно образование силиманита на алюминиевом электроде по реакции
Al2O 3 + SiO2 →Al2SiO 5
Если в составе электролита есть силикаты, то образующийся из них в разряде оксид кремния при нагреве с Al 2 O 3 и другими оксидами металлов может дать тугоплавкие и термически стойкие вещества, не взаимодействующие с растворами большинства кислот и щелочей – алюмосиликаты, такие, как ортоклаз K[AlSi 3 O 8 ], альбит Na[AlSi3O8], нефелин Na[AlSiO4] [3].
При МДО выделяют реакции анодного и катодного полупериода [3]. В анодный полупериод будут протекать реакции растворения алюминия, образование кислорода из гидроксид-ионов и оксида алюминия:
2OH– – 4e = O 2 ↑ + 2H 2 O
Al0 – 3e +OH– → Al(OH) 3
Al0 – 1e +2OH– → AlO 2 – +H 2
2Al0 – 6e +6OH– → Al 2 O 3 ↓+3H 2 O
В катодный полупериод будет происходить восстановление воды, ионов водорода и оксидов металлов, входящих в состав покрытия:
2H 2 O +2e = 2OH– + H 2 ↑
2H+ +2e = H 2 ↑
Al 2 O 3 ↓+ 6e +3H+ = 2Al0 + 3OH–
SiO 2 +4e = 4HSiO 2 ↓ + O ↑ + 2H 2 O
В присутствии метасиликата натрия в анодный полупериод становится возможным разряд ионов НSiO3 – продуктов гидролиза метасиликата натрия:
4HSiO 3 – – 4e = 4HSiO 2 ↓ + O ↑ + 2H 2 O
Кроме того, при повышенных температурах в каналах пробоя пленки может протекать химическая реакция алюминия с метасиликатом натрия, приводящая к образованию силикатов типа nSiO 2 и mSiO 2 алюмосиликатов с фазами – 3Al 2 O 3 ·2SiO 2 (муллит), Al2O3·2SiO2 (каолин), Al2O3·SiO2 (силиманит):
[mSiO 2 ∙ n SiO 2 ∙ H 2 O] =
= mSiO 2 ∙ n SiO 2 ∙ H 2 O +1/2O 2 ↑ + 2e
2Al + 3Na 2 O ∙ 3nSiO 2 +6H 2 O =
= 6NaOH + Al 2 O 3 + 3nSiO 2 +3H 2 ↑
На поверхности металла возможно образование неоднородного покрытия, включающего оксид алюминия и поверхностные комплексы, образующиеся в результате взаимодействия с силанольными группами, а также формирование покрытия переменного фазового состава, содержащего различные аллотропические модификации оксида алюминия (α – Аl 2 О 3 , δ-Аl 2 О 3 , γ-Аl 2 О 3) и муллита (2SiO 2 ·3Аl 2 O) 3 .
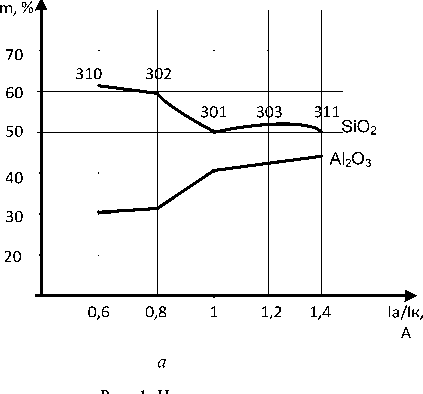
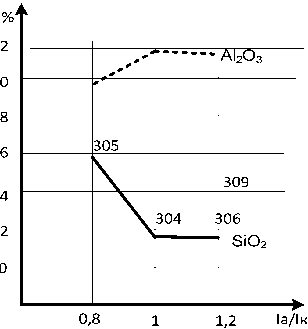
В работе были проведены исследования по выявлению химического состава полученных покрытий на рентгенофлуоресцентном спектрометре ARL Quant’x. По результатам элементного анализа на образцах алюминиевого сплава АМг-6, обработанных МДО в силикатно-щелочном электролите, было выявлено содержание таких оксидных элементных форм, как SiO 2 и Al 2 О 3 (рис. 1), содержание которых зависит от технологических режимов.
В работе [4] установлено, что покрытие, сформированное микродуговым оксидированием на сплаве АМг-6, состоит из α и γ-Al 2 O 3 , причем α фаза Al 2 О 3 присутствует только во внутренних слоях покрытия, γ-Al 2 O 3 присутствует по всей толщине покрытия и на внешних слоях покрытия выявлена фаза муллита (3Al 2 O 3 · 2SiO 2 ) и оксида кремния SiO 2 . Изменение количественного соотношения фазовых составляющих Аl 2 О 3 от плотности тока I S и отношения I к / I а представлены на рис. 2.
. .
m,
A
б
нение химического состава МДО-покрытия в зависимости от Ik/Ia: а – плотность тока 20 А/дм2; б – плотность тока 10 А/дм2
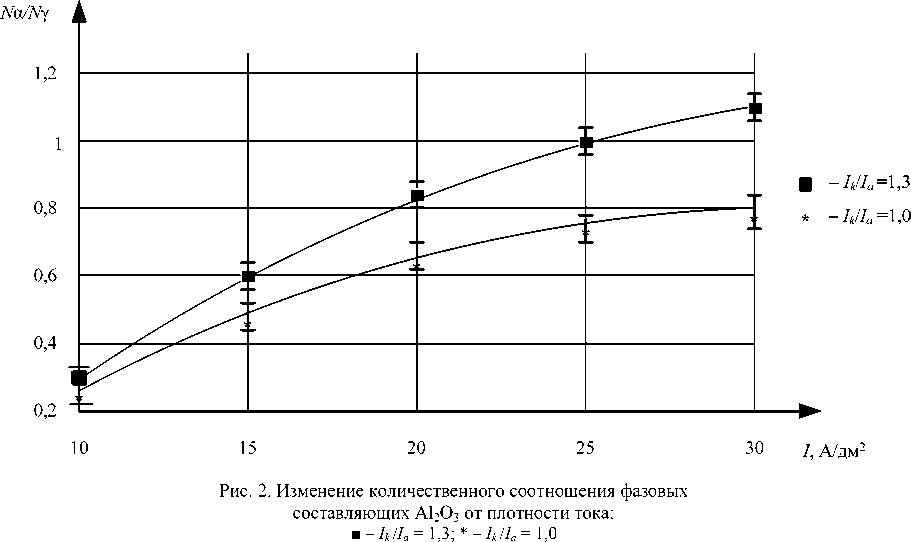
Повышение содержания модификации α-Аl 2 О 3 в покрытии, происходит за счет роста плотности тока и увеличения отношения I к / I а .
В процессе химических превращений происходит последовательное формирование покрытия переменного фазового состава, содержащее различные аллотропические модификации оксида алюминия: α-А12О3, δ-А1 2 О 3 , γ-А1 2 О 3 и муллита 2SiO 2 ·3А1 2 O 3 .
Экспериментально подтверждено, что образование различных аллотропических модификаций, содержание той или иной фазы А1 2 О 3 и муллита зависит от режимов обработки: соотношения анодной и катодной составляющих силы тока и плотности тока.


