Химический эксперимент: изучаем реакции гидроксилирования
Автор: Бахтыгалиева Айгерем Саламатовна, Савин Геннадий Анатольевич
Журнал: Грани познания @grani-vspu
Рубрика: Химия
Статья в выпуске: 3 (74), 2021 года.
Бесплатный доступ
Исследована реакция гидроксилирования циклогексена различными реагентами. В качестве реагентов применены надмуравьиная, надуксусная и надбензойная кислоты. Показано, что наибольшие выходы продукта реакции достигаются при использовании надуксусной кислоты.
Алкены, циклогексен, гидроксилирование, надкислоты, диолы, гликоли
Короткий адрес: https://sciup.org/148322075
IDR: 148322075 | УДК: 547.1-3
Текст научной статьи Химический эксперимент: изучаем реакции гидроксилирования
Под реакциями гидроксилирования понимают процессы введения гидроксильных групп ОН в молекулы органических субстратов. Впервые такая реакция была проведена выдающимся русским химиком-органиком, учеником А.М. Бутлерова Владимиром Васильевичем Марковниковым в 1878 г. на примере гидроксилирования циклогексена водным раствором перманганата калия при 00С. В дальнейшем она была изучена на примере алкенов и была использована в синтезе гликолей (двухатомных спиртов, диолов) знаменитым русским химиком и педагогом Е.Е. Вагнером. В качестве реагента Вагнер использовал тот же нейтральный водный раствор перманганата калия (марганцовку) при температуре 0–50С. Сейчас эта реакция служит важным синтетическим методом получения диолов, является именной реакцией и носит имя Е.Е. Вагнера [2].
В качестве примера реакции Е.Е. Вагнера можно привести синтез этиленгликоля (этандиола-1,2) из этилена, который осуществляется согласно следующему уравнению реакции:
3 CH2=CH2 + 2 KMnO4 + 4 H2O →
→ 3 HO-CH2-CH2-OH + 2 MnO2↓ + 2 KOH.
Это окислительно-восстановительная реакция, в которой окислителем выступает перманганат калия за счет марганца в высшей степени окисления. Роль восстановителя выполняет органический субстрат – этилен. Признаком реакции является обесцвечивание раствора марганцовки и выпадение темно-коричневого осадка диоксида марганца. Отметим, что эта реакция легко осуществима, весьма наглядная, специфичная, поэтому ее широко используют также как качественную реакцию на кратные (двойные и тройные) связи в аналитической органической химии.
В настоящее время кроме перманганата калия в качестве гидроксилирующих реагентов применяют органические надкислоты (пероксокислоты). Это пероксосоединения на основе органических карбоновых кислот. Чаще всего используют надмуравьиную НСОО2Н, надуксусную СН3СОО2Н, надбензойную С 6 Н 5 СОО 2 Н кислоты. Причем их не выделяют в чистом виде, а применяют в момент их образования при взаимодействии соответствующей карбоновой кислоты с пероксидом водорода.
Надкислоты далее вводят в реакции гидроксилирования непредельных органических веществ, содержащих двойные связи. В общем виде схема процесса представлена ниже:
R 2 C=CR2 " + R-COO 2 H + H2O ^ R2C(OH)-C(OH)R2 " + R-COOH
Необходимо отметить, что при гидроксилировании алкенов пероксидом водорода в органических карбоновых кислотах образуются так называемые транс -диолы, в которых обе ОН-группы противоположно ориентированы в пространстве.
Промежуточными веществами в этом случае являются эпоксиды, или оксираны: процесс их образования из алкенов называется реакцией Прилежаева. Далее они превращаются в моноэфиры в результате раскрытия цикла, а последние при гидролизе в водной среде дают транс- диолы.
С помощью перманганата калия можно осуществить так называемое син -гидроксилирование ( син – вместе), в результате чего образуются цис -диолы – органические гидроксипроизводные, в которых обе ОН-группы одинаково ориентированы в пространстве:
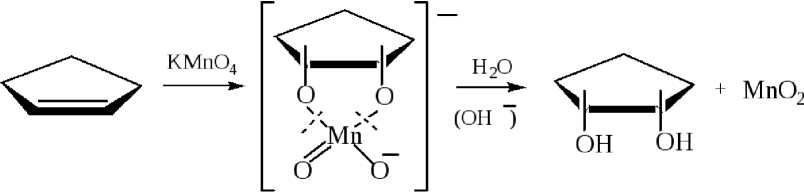
Как видно из схемы реакции при действии перманганата калия на кратную двойную связь образуется органический сложный эфир марганцовой кислоты, который далее гидролизуется до цис- диола.
Практический выход целевых продуктов при гидроксилировании перманганатом калия в нейтральной среде вполне удовлетворительный. Так, при гидроксилировании циклогексена выход цис диола составлял около 40% от теоретически возможного выхода:
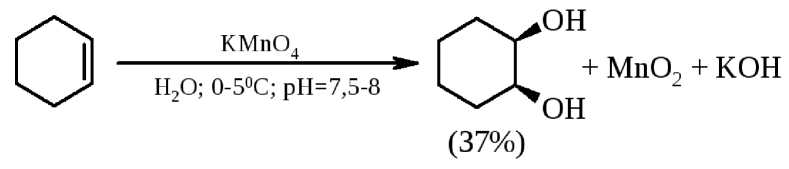
Такой же результат получается и при использовании в качестве гидроксилирующего реагента тетраоксида осмия OsO4 (реакция Р. Криге, 1936 г.).
Нами было проведено экспериментальное исследование гидроксилирующей способности циклогексена различными реагентами. Такими реагентами служили надмуравьиная, надуксусная и надбензойная кислоты. Их получали, смешивая 30%-й раствор пероксида водорода с соответствующими карбоновыми кислотами: муравьиной, уксусной и бензойной.
Органический субстрат – циклогексен, получали дегидратацией циклогексанола концентрированной серной кислотой. Реакцию проводили при нагревании циклогексанола с концентрированной серной кислотой. Циклогексен выделяли из реакционной смеси простой перегонкой при нормальном атмосферном давлении (760 мм рт. ст.). Следует отметить, что для повышения массовой доли выхода целевого непредельного углеводорода необходимо использовать свежеперегнанный циклический спирт [3].
Методика синтеза. Для проведения синтеза использовали круглодонную колбу Вюрца, снабженную термометром, прямой холодильник, аллонж, колбу – приемник и электрическую плитку для нагревания. В колбу Вюрца помещали 20,8 мл (20 г; 0,2 моль) свежеперегнанного циклогексанола и 5,5 мл концентрированной 96%-й серной кислоты (9.8 г; 0,1 моль). Смесь нагревали на песчаной бане при температуре 150-160 0С в течение 2–2,5 часов. За это время из реакционной смеси в колбу – приемник отгонялся образующийся целевой продукт – циклогексен. Затем нагревание прекращали, в колбу с циклоалкеном добавляли безводный хлорид кальция CaCl2 для поглощения воды. Получали 15 мл циклогексена (12,3 г; 0,15 моль), что составляло 75% от теоретически возможного выхода. Циклогексен использовали в дальнейшем в реакциях гидроксилирования без дополнительной очистки.
Гидроксилирование циклоалкена проводили при начальной температуре не выше 0–50С, при перемешивании реакционной смеси в течение 1,5–2,0 часов. Для проведения реакций использовали: круглодонные колбы, механические мешалки, капельные воронки, делительные воронки.
Следует отметить, что при взаимодействии циклогексена с надкислотами сначала образуется оксиран – оксид циклоалкена (реакция Прилежаева), который затем превращается в диол. Причем ключевой стадией этого процесса является протонирование оксирана. Таким образом, результат гидроксилирования во многом зависит от силы используемой кислоты.
Гидроксилирование циклогексена надмуравьиной кислотой.
В круглодонную колбу, снабженную мешалкой и капельной воронкой, помещали смесь, состоящую из 5,4 г 85%-й муравьиной кислоты (0,1 моль) и 11,3 г 30%-го пероксида водорода (0,1 моль). Смесь охлаждали льдом и прикапывали к ней при тщательном перемешивании 8,2 г (10,0 мл; 0,1 моль) циклогексена, после чего смесь оставляли на ночь. Затем смесь нейтрализовали 5,6 г (0,1 моль) оксида кальция (рН=7 по лакмусовой бумажке). Продукт экстрагировали эфиром, эфирный слой отделяли на делительной воронке, растворитель отгоняли, а полученные кристаллы диола очищали перекристаллизацией из этилацетата. Выход 7,0 г (60% от теоретически возможного выхода); т. пл. 103–1040С.
Гидроксилирование циклогексена надуксусной кислотой.
В круглодонную колбу, снабженную мешалкой и капельной воронкой, помещали смесь, состоящую из 6,0 г ледяной уксусной кислоты (0,1 моль) и 11,3 г 30%-го пероксида водорода (0,1 моль). Смесь охлаждали льдом и прикапывали к ней при тщательном перемешивании 8,2 г (10,0 мл; 0,1 моль) циклогексена, после чего смесь оставляли на ночь. Затем смесь нейтрализовали 5,6 г (0,1 моль) оксида кальция (рН=7 по лакмусовой бумажке). Продукт экстрагировали эфиром, эфирный слой отделяли на делительной воронке, растворитель отгоняли, а полученные кристаллы диола очищали перекристаллизацией из этилацетата. Выход 7,5 г (65% от теоретически возможного выхода); т. пл. 103–1040С.
Гидроксилирование циклогексена надбензойной кислотой.
В круглодонную колбу, снабженную мешалкой и капельной воронкой, помещали смесь, состоящую из 12,2 г бензойной кислоты (0,1 моль), 50 мл дистиллированной воды и 11,3 г 30%-го пероксида водорода (0,1 моль). Смесь охлаждали льдом и прикапывали к ней при тщательном перемешивании 8,2 г (10,0 мл; 0,1 моль) циклогексена, смесь оставляли на ночь. Затем смесь нейтрализовали 5,6 г (0,1 моль) оксида кальция (рН=7 по лакмусовой бумажке). Продукт экстрагировали эфиром, эфирный слой отделяли на делительной воронке, растворитель отгоняли, а полученные кристаллы диола очищали перекристаллизацией из этилацетата. Выход 5,0 г (43% от теоретически возможного выхода); т. пл. 103–1040С.
Сравнительный анализ полученных результатов.
Из описания методик гидроксилирования циклогексена различными реагентами следует, что они аналогичны. Это необходимо было для того, чтобы сравнить выходы продукта в одинаковых условиях. Практические выходы диола оказались различными.
Самый лучший результат (65% от теоретически возможного выхода) получен при использовании надуксусной кислоты. Это можно объяснить тем, что была использована ледяная (100%) уксусная кислота, концентрация реагента оказалась максимальной, что отразилось на выходе целевого продукта.
При использовании надмуравьиной кислоты выход диола был несколько ниже (60% от теоретически возможного выхода), несмотря на то, что муравьиная кислота значительно сильнее уксусной:
Кдисс.(НСООН) = 1,78•10-4; Кдисс.(СН3СООН) = 1,75•10-5.
Это можно объяснить двумя причинами. Во-первых, муравьиная кислота использована в виде 85%-го раствора, что уменьшает концентрацию реагента в реакционной смеси. Во-вторых, му- равьиная кислота, как известно, является одновременно и альдегидом. Таким образом, с образующимся диолом возможна ее реакция с образованием полуацеталей и ацеталей, значительно устойчивых к щелочному гидролизу. Это и снижает выход целевого продукта.
Наконец, при использовании в качестве реагента надбензойной кислоты, выход диола оказался самым низким (43% от теоретически возможного выхода). По-видимому, это связано со следующими обстоятельствами. Бензойная кислота плохо растворима в воде, поэтому (как это видно их методики синтеза) использовали достаточно много воды для ее растворения, а это резко снизило концентрацию реагента. Кроме того, бензойная кислота - слабая органическая кислота: Кдисс(С6Н5СООН)=6,2Ч0-5, что также явилось причиной сравнительно низкого выхода диола.
Таким образом, сравнительный анализ гидроксилирующей способности надмуравьиной, надуксусной и надбензойной кислот позволяет сделать вывод о целесообразности использования надуксусной кислоты в качестве реагента в реакции с циклогексеном. Модифицированную методику синтеза транс- циклогександиола-1,2 можно рекомендовать для практического применения в школьном курсе химии (на занятиях кружка, элективных курсах, факультативах) [1], а также в вузах на лабораторных занятиях по химическому синтезу.
Список литературы Химический эксперимент: изучаем реакции гидроксилирования
- Ахметов М.А., Ермакова Ю.А. Направления развития школьного химического эксперимента // Химия в школе. 2017. № 5. С. 37-42.
- Практикум по органической химии / под ред. Н.С. Зефирова. М.: Бином. Лаборатория знаний, 2015.
- Титце Л., Айхер Т. Препаративная органическая химия / под ред. Ю.Е. Алексеева; пер. с нем. К.В. Аванесян [и др.]. М.: Мир, 1999.


