Химиолучевое лечение местнораспространенного неоперабельного рака желудка: ретроспективный анализ выживаемости
Автор: Ружникова А.А., Литинский С.С., Асахин С.М., Ружников А.О., Вальков М.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (54), 2012 года.
Бесплатный доступ
Представлен анализ общей выживаемости 164 больных местнораспространенным неоперабельным раком желудка, получавших лучевую терапию (n=109), химиолучевую (n=25) и химиотерапию (n=30). Критерии включения больных в исследование: ЛТ в СОД не менее 40 Гр, не менее 4 курсов ХТ в монорежиме или в комбинированной схеме. Медиана наблюдения всех пациентов составила 82 мес. К моменту анализа погибло 146 (89 %) из всех наблюдаемых больных. Медиана выживаемости больных, получивших лучевую терапию, составила 24 (ДИ 19–29) мес, химиолучевую терапию – 20,1 (ДИ 13–28), химиотерапию – 10 (ДИ 7–13) мес соответственно (χ 2=24,6, р2–3 (ОР=0,41) и статус по ECOG менее 2 (ОР=0,59) приводили к снижению риска смерти. Выявлено увеличение показателей общей выживаемости больных с местнораспространенным неоперабельным раком желудка, получавших лучевую или химиолувую терапию, по сравнению с химиотерапией.
Неоперабельный рак желудка, лучевая терапия, химиотерапия, выживаемость
Короткий адрес: https://sciup.org/14056277
IDR: 14056277 | УДК: 616.33-006.6-08:615.28:615.849.1
Текст научной статьи Химиолучевое лечение местнораспространенного неоперабельного рака желудка: ретроспективный анализ выживаемости
Рис. 1. Алгоритм включения больных с МРНРЖ в проведенное ретроспективное исследование чаще, чем в западноевропейских странах, и в 6 раз чаще, чем в США, занимая 2-е место в структуре смертности от злокачественных новообразований как у мужчин (после рака легкого), так и у женщин (после рака молочной железы) [9].
Хирургическое лечение является единственным методом, способным излечить больных РЖ I–II стадии, редко III стадии. Резектабельность РЖ составляет 25–50 % [26]. Это связано как с удручающим состоянием ранней диагностики и высоким уровнем запущенности, так и с наличием тяжелых сопутствующих заболеваний, часто встречающихся у пожилых больных РЖ. В 2009 г. в РФ было впервые выявлено 24,6 % больных РЖ I–II стадии, тогда как III и IV– 27,8 % и 42,1 % соответственно [3].
Важно отметить, что практически отсутствует практика разделения МРНРЖ и метастатического РЖ, хотя часть больных МРНРЖ могут длительное время оставаться без отдаленных метастазов и, таким образом, потенциально нуждаться в локаль- ном лечении [24]. В клинике ГБУЗ АО «АКОД» в течение последних 10 лет при лечении больных МРНРЖ, помимо химиотерапии, применяется ЛТ.
Цель исследования – провести ретроспективный анализ выживаемости больных МРНРЖ, получавших ХТ, ЛТ и ХЛТ, по данным Архангельского областного канцер-регистра.
Материал и методы
В работе проведен анализ исходов лечения больных МРНРЖ из базы данных канцер-регистра Архангельской области с 04.11.1993 по 19.03.2010. Для анализа отобраны больные, получавшие химиотерапию как современный стандарт лечения МРНРЖ, составившие контрольную группу, и больные, получавшие ЛТ как единственный вариант лечения либо ее сочетание с ХТ (рис. 1).
Отбор проводился по следующим исходным критериям: морфологическая верификация диагноза; неоперабельный в силу местной распространенности, либо по медицинским противопоказаниям, либо по причине отказа от хирургического лечения РЖ II–III стадии (Т2–4N0–3М0); ECOG 0–2; возраст больных старше 18 лет; доза ЛТ не менее 40 Гр; отсутствие отдаленных метастазов; отсутствие в анамнезе других злокачественных новообразований, кроме адекватно леченных базалиомы кожи и рака шейки матки in situ; отсутствие сопутствующих заболеваний в стадии декомпенсации, беременности. Больные, включенные в анализ и получавшие лечение до 2009 г., были рестадированы в соответствии с классификацией TNM 7 пересмотра [23].
В зависимости от вида проведенного лечения больных разделили на 3 группы: ЛТ, ХТ и ХЛТ. Дистанционную ЛТ проводили на гамма-терапевтических установках РОКУС-АМ (Равенство, СПб.) либо на линейном ускорителе электронов Clinac2100 C (Varian, USA). Согласно локальному стандарту лечения МРНРЖ облучение проводили в режиме традиционного фракционирования (разовая доза 2 Гр, ежедневно, 5 раз в нед) либо ускоренного гиперфракционирования (разовая доза 1,3 Гр, ежедневно дважды в день с межфракционным интервалом не менее 5 часов, 5 дней в нед) до дозы не менее 40–66 Гр либо биологического ее эквивалента [1]. В первичный объем облучения входили первичная опухоль и области регионарного лимфооттока до уровня не менее D2.
Облучение проводили с 2 встречных фигурных полей до СОД 40 Гр, либо ее биологического эквивалента, с экранированием почек, печени, сердца. Экранирования спинного мозга не проводили. Размеры полей составляли 12×12 – 15×15 см. В дальнейшем размеры и форму полей редуцировали до уровня первичной опухоли с отступами ±3 см в верхне-нижнем и ±2 см в медиально-латеральном, передне-заднем направлениях. Облучение на 2-м этапе проводили до СОД 50–65 Гр (с учетом дозы, подведенной на первом этапе) 3–4 открытыми полями по изоцентру, при этом доза на спинной мозг не должна была превышать 10 % от нормализованной дозы в мишени.
Химиотерапию большинству больных проводили с препаратом платины или фторурацила (ФУ) в стандартных режимах. Использовалась ХТ как в монорежиме (ФУ 425 мг/м2 с 1 по 5-е сут, каждые 28 сут; капецитабин 2500 мг/м2 с 1 по 14-е сут, интервал 7 сут; УФТ 400 мг per os 2 раза в день с 1 по 14-е сут), так и в комбинации (цисплатин 100 мг/м2 в 1-е сут + ФУ 1000 мг/м2 24-часовая инфузия с 1 по 5-е сут, каждые 28 сут; ФУ 500 мг/м2 + лейковорин 300 мг/м2 + этопозид 120 мг/м2 с 1 по 3-и сут, каждые 28 сут; доксорубицин 20 мг/м2 1, 7-й дни + этопозид 100 мг/м2 на 4–6-е сут + цисплатин 40 мг/м2 во 2, 8-е сут, каждые 28 сут) [2].
Назначение ХТ и ЛТ в группе ХЛТ осуществляли последовательно. Всего изначально планировали не менее 4 курсов ХТ, но для включения в анализ выживаемости допускалось не менее 2 проведенных курсов ХТ. В группу ХЛТ отбирали больных МРНРЖ, которым после лечебной дозы ЛТ было проведено не менее 2 курсов ХТ по одной из схем, указанных выше.
Для удобства статистической обработки результатов непрерывные переменные (возраст больных и доза ЛТ) трансформировали в порядковые. Оценка распределения долей проводилась методом χ2 с помощью точного метода Фишера. Первичным критерием оценки выживаемости установлена общая выживаемость – как промежуток в месяцах между датой установления диагноза РЖ и смертью от любой причины. Цензурирование проводили по дате последней проверки баз канцер-регистра либо по дате последней явки на контрольный осмотр для выбывших из-под наблюдения. Выживаемость больных представляли в виде Ме (95 % доверительный интервал (ДИ)) и графически – в виде кривых Каплана–Майера. Различия в выживаемости между группами определяли лог-ранговым методом. Оценка кумулятивной выживаемости проведена с помощью таблиц дожития. Значения выживаемости в течение 1, 3 и 5 лет представляли в виде процентов с ДИ. Оценка относительного риска смерти с учетом влияния исходных факторов (пол, возраст, группа лечения, распространенность первичной опухоли, поражение лимфоузлов, статус ECOG, сопутствующая патология, пробная лапаротомия) проводилась с помощью регрессионной модели пропорциональных рисков Кокса. Введение факторов, оказавших значимое влияние на прогноз в однофакторных моделях, в многофакторную регрессионную модель осуществляли форсированным методом. Все сравнения были двусторонние.
Результаты и обсуждение
В группу ЛТ было включено 109 человек, в группу ХТ – 25, ХЛТ – 30 человек. При анализе характеристик пациентов распределение в группах по полу, ECOG-статусу, локализации опухоли, гистологическому варианту было равномерным (табл. 1). В то же время ЛТ значимо больше получали пациенты возрастные, с выраженной сопутствующей патологией (р<0,0001). В группах ХТ и ХЛТ большинству больных проведена эксплоративная лапаротомия, тогда как в группе ЛТ этот диагностический этап присутствовал в 13,8 % случаев. В распределении по распространенности первичной опухоли отмечено преобладание Т2–3 в группе ЛТ (р<0,0001), в группах ХТ и ХЛТ превалировали пациенты с N+ (р<0,0001).
Медиана времени наблюдения для всех больных составила 82,12 (26,04–222,5) мес. К моменту анализа погибло 146 (89,0 %) из 164 наблюдаемых больных. Живы 16 из 109 (14,7 %) больных в группе ЛТ и 2 из 30 (6,7 %) больных в группе ХЛТ. В группе ХТ все больные умерли. Медиана выживаемости в группе ЛТ составила 24,3 (ДИ 19,3–29,4) мес; в группе ХТ –10,1 (ДИ 7,1–13,0) мес; в группе – ХЛТ 20,5 (ДИ 12,7–28,4) месяца, χ2= 24,58, р<0,0001 (рис. 2). Медиана выживаемости больных, получавших ХТ препаратами платины, составила 12,2 (ДИ 0,0–40,0) мес; без платины – 14,0 (ДИ 8,0–19,9) мес (χ2=2,84, р=0,092). Кумулятивная выживаемость пациентов представлена в табл. 2.
Учитывая неравномерность распределения в группах по исходным параметрам, проведена регрессия Кокса (табл. 3). В модели множественной регрессии модели после коррекции выживаемости по полу, тяжести сопутствующей патологии, проведению эксплоративной лапаротомии, критериям N и Т, локализации и гистотипу опухоли, относительный риск (ОР) смерти в группе ЛТ снижался в 3 раза (95 % ДИ 0,21–0,87, р=0,018), в группе
ХЛТ – в 2,5 раза (ДИ 0,21–0,71, р=0,002) по сравнению с группой ХТ. Другими значимыми факторами прогноза в модели множественной регрессии были первичная распространенность опухоли – Т4 vs Т2–3 (ОР=2,47, 95 % ДИ 1,56–3,92, р<0,0001), ECOG 0–1 vs 2 (ОР=0,59, 95 % ДИ 0,38–0,52, р=0,021),
Таблица 1
|
Факторы |
ЛТ (n=109) |
ХТ (n=25) |
ХЛТ (n=30) |
р |
|
Пол |
||||
|
Женщины |
51 (46,8 %) |
8 (32 %) |
8 (26,7 %) |
0,086 |
|
Мужчины |
58 (53,2 %) |
17 (68 %) |
22 (73,3 %) |
|
|
Возраст |
||||
|
Младше 50 |
1 (0,9 %) |
6 (24,0 %) |
6 (20,0 %) |
<0,0001 |
|
50-59 лет |
14 (12,8 %) |
8 (32,0 %) |
8 (26,7 %) |
|
|
60-69 лет |
36 (33,0 %) |
8 (32,0 %) |
12 (40,0 %) |
|
|
70 лет и старше |
58 (53,2 %) |
3 (12,0 %) |
4 (13,3 %) |
|
|
Пробная лапаротомия |
15 (13,8 %) |
22 (88,0 %) |
20 (66,7 %) |
<0,0001 |
|
Гастроэнтероанастомоз |
4 (3,7 %) |
8 (32,0 %) |
3 (10,0 %) |
<0,0001 |
|
Размер первичной опухоли |
||||
|
т. 2–3 |
83 (76,1 %) |
7 (28,0 %) |
12 (40,0 %) |
<0,0001 |
|
Т 4 |
26 (23,9 %) |
18 (72,0 %) |
18 (60,0 %) |
|
|
Поражение лимфоузлов |
||||
|
N+ |
23 (21,1 %) |
20 (80,0 %) |
16 (53,3 %) |
<0,0001 |
|
N- |
86 (78,9 %) |
5 (20,0 %) |
14 (46,7 %) |
|
|
Стадия |
||||
|
I |
2 (1,8 %) |
- |
- |
<0,0001 |
|
II |
70 (64,2 %) |
3 (12,0 %) |
10 (33,3 %) |
|
|
III |
21 (19,3 %) |
5 (20,0 %) |
6 (20,0 %) |
|
|
IV |
16 (14,7 %) |
17 (68,0 %) |
14 (46,7 %) |
|
|
Локализация опухоли |
||||
|
Кардия |
57 (52,3 %) |
6 (24,0 %) |
15 (50,0 %) |
0,170 |
|
Тело |
33 (30,3 %) |
12 (48,0 %) |
8 (26,7 %) |
|
|
Дистальный отдел |
13 (11,9 %) |
5 (20,0 %) |
3 (10,0 %) |
|
|
Субтотальное/тотальное |
6 (5,5 %) |
2 (8,0 %) |
4 (13,3 %) |
|
|
Дифференцированная аденокарцинома |
||||
|
Да |
67 (61,5 %) |
13 (52,0 %) |
20 (66,7 %) |
0,531 |
|
Нет |
42 (38,5 %) |
12 (48,0 %) |
10 (33,3 %) |
|
|
Статус по ECOG |
||||
|
0–1 |
85 (78,0 %) |
16 (64,0 %) |
25 (83,3 %) |
0,212 |
|
2 и более |
24 (22,0 %) |
9 (36,0 %) |
5 (16,7 %) |
|
|
Оценка степени тяжести сопутствующих заболеваний по Charlson [5] |
||||
|
0–2 |
19 (17,4 %) |
12 (48,0 %) |
17 (56,7 %) |
<0,0001 |
|
3 и более |
90 (82,6 %) |
13 (52,0 %) |
13 (43,3 %) |
|
Распределение пациентов в сравниваемых группах
возраст 60–69 лет vs 70 и старше (ОР=0,59, 95 % ДИ 0,39–0,92, р=0,020).
Таким образом, на основании проведенного ретроспективного исследования по данным Архангельского областного канцер-регистра с 04.11.1993 по 19.03.2010 г. показано, что больные МРНРЖ, получавшие ЛТ как единственный метод лечения или в сочетании с ХТ, имели значимо более высокую выживаемость по сравнению с группой ХТ.
Лучевая терапия в настоящее время не является стандартом лечения больных МРНРЖ, как правило, назначается c паллиативной целью для купирования дисфагии [16, 17]. Лечение с лечебной целью считается нецелесообразным в связи с предполагаемым низким терапевтическим интервалом (относительная радиорезистентность опухоли и высокая радиочувствительность критических здоровых тканей) и подвижностью опухоли. В нашем исследовании ЛТ при МРНРЖ использована в лечебном режиме до радикальной дозы. Предлагая больным МРНРЖ этот метод лечения, мы исходили из следующих соображений.
Существующий опыт применения предоперационной ЛТ свидетельствует о значительной чувствительности опухоли к лучевому/химиолучевому лечению. Морфологически подтвержденную полную регрессию опухоли находят у 9–20 % больных,
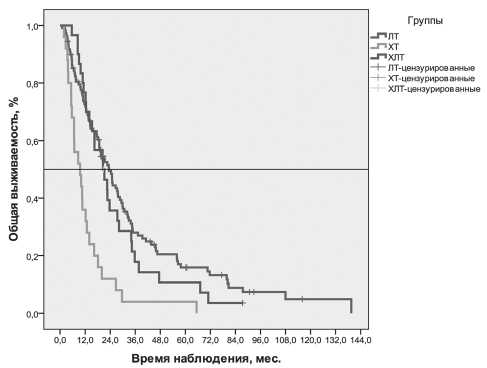
Рис. 2. Показатели общей выживаемости больных МРНРЖ в зависимости от метода лечения выраженную регрессию – более чем у половины [4, 12]. Будучи примененной в послеоперационном периоде, ЛТ/ХЛТ приводит к увеличению безреци-дивной и общей выживаемости [14].
Местнораспространенные опухоли прорастают в окружающие ткани и перестают быть подвижными.
В настоящее время ХТ является стандартом лечения МРНРЖ и метастатического РЖ, при этом наиболее часто пациентам назначается симптоматическая терапия. В метаанализах показано, что медиана выживаемости больных с диссеминированной формой РЖ, получающих ХТ, составляет 7,5–12 мес, тогда как при лучшей поддерживающей терапии – 3–5 мес ( ОР=0,37, 95 % ДИ 0,24–0,55, р=0,19) [7, 13, 22]. В нашем ретроспективном исследовании медиана выживаемости в группе ХТ составила 10,1 мес, что согласуется с данными других авторов.
В течение многих лет ХТ применяется как в монорежиме, так и в комбинации с препаратами платины. 5-фторурацил является наиболее широко используемым препаратом в лечении РЖ с частотой
Таблица 2
Кумулятивная выживаемость пациентов
|
Выживаемость |
ЛТ |
ХТ |
ХЛТ |
|||
|
% |
ДИ |
% |
ДИ |
% |
ДИ |
|
|
1-годичная |
69,5 |
61,3–77,7 |
36,0 |
17,2–54,8 |
75,8 |
61,1–90,4 |
|
3-летняя |
25,3 |
11,6–39,1 |
4,0 |
0,0–57,3 |
19,4 |
0,0–48,8 |
|
5-летняя |
14,4 |
0–33,6 |
4,0 |
0,0–4,0 |
12,9 |
0,0–12,9 |
Таблица 3
Однофакторный и многофакторный анализ выживаемости больных МРНРЖ (регрессия Кокса)
Наше исследование может иметь ряд недостатков. Ретроспективный характер приводит к высокому риску отбора больных в группы лечения по предпочтению лечащего врача. Значимая нерав- номерность распределения больных по исходным факторам (возраст пациента, сопутствующая патология, статус по ECOG, проведение эксплоративной лапаротомии, первичная распространенность опухоли, поражение регионарных лимфоузлов) является подтверждением предполагаемого. Однако использование регрессии Кокса и выравнивание показателей с учетом неравномерностей позволяет частично преодолеть этот недостаток. После выравнивания регрессионной модели Кокса различия выживаемости больных МРНРЖ в группах ЛТ и ХЛТ по сравнению с группой ХТ оставались высоко значимыми.
Кроме того, в группе ЛТ значительно меньшей доле пациентов – 13,8 % против 88,0 % и 66,7 % – в группах ХТ и ХЛТ выполнялась пробная лапаротомия, которая является наиболее точным методом диагностики неоперабельности опухолевого процесса. Неинвазивное стадирование имеет тенденцию к недооценке распространенности по критериям N и М, что, возможно, явилось причиной большей доли относительно ранних стадий в группе ЛТ. При этом даже после коррекции отдаленные результаты в этой группе были значимо выше, чем в группе только системного лечения.
Больных в исследование включали на протяжении длительного срока, когда методы диагностики менялись. Это потенциально могло привести к отбору более ранних стадий в группы лечения. Однако анализ (не представлен) показал, что включение в группы исследования в течение его срока было равномерным. Это позволяет предполагать, что длительный срок включения в исследование на его результаты не повлиял.
Имеются также недостатки стадирования. До 2009 г. использовалась 6-я версия TNM, в которой присутствовала IV стадия по местной распространенности. Автоматическое рестадирование, заключавшееся в переносе IV стадии в III, могло привести к ошибкам. Кроме того, ретроспективный характер исследования привел к тому, что количество больных в группах лечения было неравномерным – ЛТ (n=109), ХТ (n=25), ХЛТ (n=30). В группах ХЛТ и ХТ использовались разные схемы ХТ. Это также могло привести к статистическим погрешностям.
Все вышесказанное требует проведения проспективного исследования для подтверждения отличий в выживаемости больных в группах. Ди- зайн планируемого проспективного исследования должен включать две группы лечения: ХТ и ХЛТ.


