Химиопрофилактика отдаленных онкологических последствий на модели радиационного канцерогенеза
Автор: Беспалов В.Г., Александров В.А., Семенов А.Л., Кованько Е.Г., Иванов С.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (59), 2013 года.
Бесплатный доступ
Проведено сравнительное изучение антиканцерогенной активности синтетического ингибитора полиаминов α-дифторметилорнитина (ДФМО) и трех растительных препаратов на модели радиационного канцерогенеза у 615 самок крыс Вистар, которых подвергали тотальному γ-облучению в дозе 4 Гр. Крысам после облучения в течение 16 мес давали с питьевой водой ДФМО в концентрации 2 г/л, настойку из биомассы культуры ткани корня женьшеня (биоженьшень) – 20 мл/л, настойки корня элеутерококка или корневищ левзеи – по 10 мл/л. Оценивались частота и множественность злокачественных и доброкачественных опухолей молочной железы, эндокринных и репродуктивных органов, прочих локализаций. Наибольшая антиканцерогенная активность выявлена у биоженьшеня, который, по сравнению с облученным контролем, статистически значимо уменьшал общую частоту и множественность опухолей на 35 % и 58 %, в том числе злокачественных – на 60 % и 65 % соответственно. Антиканцерогенное действие ДФМО было слабее, чем у биоженьшеня, элеутерококк проявил еще более слабую антиканцерогенную активность. Левзея не влияла статистически значимо на радиационный канцерогенез. Препараты женьшеня являются наиболее перспективными для химиопрофилактики отдаленных онкологических последствий облучения
Радиационный канцерогенез, крысы самки, α-дифторметилорнитин, биоженьшень, элеутерококк, левзея
Короткий адрес: https://sciup.org/14056362
IDR: 14056362 | УДК: 616-006-022+612.014.482
Текст научной статьи Химиопрофилактика отдаленных онкологических последствий на модели радиационного канцерогенеза
Одним из отдаленных последствий воздействия ионизирующего излучения может быть возникновение опухолей [10, 14]. Актуальной задачей является поиск факторов, предупреждающих развитие новообразований у людей, перенесших ионизирующее облучение в результате ядерных катастроф, лучевой терапии и других обстоятельств. К сожалению, практически не изучены возможности торможения радиационного канцерогенеза с помощью химио-профилактических средств, назначение которых в онкологии для предупреждения опухолей в настоящее время вполне обосновано не только в экспериментах, но и в клинике [1, 5, 8, 11].
Мы выбрали для сравнительного изучения в качестве ингибиторов радиационного канцерогенеза синтетический лекарственный препарат α-дифторметилорнитин (ДФМО) и три натуральных лекарственных препарата из группы так называемых классических фитоадаптогенов: настойки корня женьшеня, элеутерококка и левзеи. В экспериментах ДФМО [3, 12] препараты из корня женьшеня, элеутерококка и левзеи [2, 4, 6] предупреждали развитие опухолей различных локализаций, индуцированных химическими канцерогенами. В эпидемиологических и клинических исследованиях у людей препараты женьшеня снижали общий онкологический риск и отдельно риск возникновения рака органов желудочно-кишечного тракта, легких, яичников [16]; ДФМО снижал риск развития новых случаев рака кожи у больных с раком кожи в анамнезе [7], предупреждал появление новых аденоматозных полипов ободочной и прямой кишки у пациентов с удаленными колоректальными полипами в анамнезе [13], вызывал регрессию предраковых изменений кожи [9], уменьшал объем простаты у мужчин из группы риска рака данного органа [15]. В качестве возможных ингибиторов радиационного канцерогенеза все 4 данных препарата изучены нами впервые.
Цель исследования – изучить и сравнить антиканцерогенное действие ДФМО и растительных препаратов на модели канцерогенеза, вызванного у самок крыс гамма-облучением.
Материал и методы
В эксперименте использованы 615 крыс-самок Вистар, полученных из питомника «Рапполово» РАМН (Ленинградская область, Россия) с начальной массой тела 140–160 г. Эксперимент состоял из двух серий, которые проводились в разное время. Животные содержались в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментов и иных научных целей (Страсбург, 1986); получали сбалансированный корм из натуральных ингредиентов и питьевую воду без ограничений. Крысы в группе 1 (интактный контроль) не подвергались никаким воздействиям. Все другие животные обеих серий были подвергнуты однократному тотальному γ-облучению на установке ИГУР-1 (137Cs, мощность дозы 1,34 Гр/мин) в дозе 4 Гр. В первой серии облученные крысы были разделены на четыре группы: группа 2 – облученный контроль и три группы с воздействием модифицирующих факторов, в которых животные с 10-го дня после облучения и до конца эксперимента получали с питьевой водой один из 4 препаратов: в группе 3 – спиртовую настойку корневищ левзеи сафлоровидной Rhaponticum carthamoides (Willd.) и Iljin семейства Asteraceae (Томский химфарм-завод, Россия) в концентрации 10 мл/л; в группе 4 – спиртовую настойку корня элеутерококка колючего Eleutherococcus senticosus (Rupr. et Maxim.) Maxim. семейства Araliaceae (экспериментальный цех Горно-таежной станции Дальневосточного отделения РАН, Россия) 10 мл/л; в группе 5 – ДФМО (Merrel Dow Research Institute, США) 2 г/л. Во второй серии облученные крысы были разделены на 2 группы: группа 6 – облученный контроль и группа 7, в которой животным с 10-го дня после облучения и до конца эксперимента давали с питьевой водой спиртовую настойку из биомассы культуры ткани корня женьшеня обыкновенного Panax ginseng C.A. Mey. семейства Araliaceae (препарат биоженьшень производства Киришского биохимического завода, Россия) в концентрации 20 мл/л. Спиртовые настойки деалкоголизировали, а затем к остатку добавляли воду до первоначального объема. Использованы эффективные дозы препаратов, установленные в проведенных ранее экспериментах по торможению химического канцерогенеза [3, 4].
Крысы наблюдались в течение 16 мес, после чего оставшихся в живых животных забивали парами эфира. Всех павших и забитых крыс подвергали полной аутопсии. Органы с опухолями или подозрениями на опухолевый рост фиксировали в 10 % формалине, затем подвергали стандартной гистологической обработке и изучали при световой микроскопии. Для анализа опухоли были сгруппированы в 3 группы: молочной железы, эндокринных и репродуктивных органов, прочих локализаций.
Статистическая обработка результатов экспериментов осуществлялась на персональном компьютере с помощью программ EXCEL и STATISTICA. Вычисляли среднее арифметическое значение (М), ошибку среднего (m). Для статистического анализа показателей частоты и множественности использовали тест χ2, точный метод Фишера, критерий t (Стьюдента). Для сравнительной оценки эффектов препаратов частоту и множественность новообразований в группах облученного контроля принимали за 100 % и для дальнейшего сравнения брали относительные показатели опытных групп, полученные с использованием следующей формулы: А = 100 – (С×100)/D, где А (%) – показатель снижения частоты либо множественности новообразований в опытной группе; С (%) – частота либо множественность новообразований в опытной группе; D (%) – частота либо множественность новообразований в соответствующей группе об-
Таблица
влияние левзеи, элеутерококка, ДФМо и биоженьшеня на радиационный канцерогенез у крыс-самок
|
Параметры канцерогенеза |
Группа |
||||||
|
Первая серия |
Вторая серия |
||||||
|
1. Интактный контроль (n=91) |
2. Облученный контроль (n=103) |
3. Облучение + + левзея (n=80) |
4. Облучение+ + элеутерококк (n=87) |
5. Облучение + + ДФМО (n=80) |
6. Облученный контроль (n=40) |
7. Облучение + + биоженьшень (n=44) |
|
|
Опухоли всех локализаций |
|||||||
|
Частота |
20 (22 %) 7 (8 %) |
82 (80 %)а 45 (44 %)а |
59 (74 %)а 33 (41 %)а |
54 (62 %)аб 24 (28 %)аб |
47 (59 %)аб 14 (17 %)б |
28 (70 %)а 18 (45 %)а |
20 (45 %)аб 8 (18 %)б |
|
Множествен-ность |
20 (0,22±0,02) 7 (0,08±0,03) |
152 (1,48±0,08)а 52 (0,5±0,06)а |
104 (1,3±0,12)а 41 (0,51±0,08)а |
95 (1,09±0,07)аб 32 (0,37±0,08)а |
84 (1,05±0,07)аб 15 (0,19±0,05)аб |
70 (1,75±0,27)а 23 (0,58±0,12)а |
32 (0,73±0,15)аб 9 (0,2±0,07)б |
|
Опухоли молочной железы |
|||||||
|
Частота |
4 (4 %) 0 |
59 (57 %)а 20 (19 %)а |
44 (55 %)а 17 (21 %)а |
41 (47 %)а 14 (16 %)а |
32 (40 %)аб 4 (5 %)аб |
21 (52 %)а 13 (32 %)а |
13 (29 %)аб 4 (9 %)б |
|
Множествен-ность |
4 (0,04 ± 0,02) 0 |
84 (0,82 ± 0,06)а 21 (0,2 ± 0,04)а |
64 (0,8±0,1)а 22 (0,28±0,07)а |
60 (0,69±0,07)а 20 (0,23±0,06)а |
50 (0,62±0,07)аб 4 (0,05±0,02)аб |
36 (0,9±0,16)а 15 (0,38±0,09)а |
20 (0,45±0,13)аб 5 (0,11±0,06)б |
|
Опухоли эндокринных и репродуктивных органов |
|||||||
|
Частота |
7 (8 %) 1 (1 %) |
28 (27 %)а 6 (6 %) |
18 (22 %)а 3 (4 %) |
20 (23 %)а 2 (2 %) |
25 (31 %)а 3 (4 %) |
12 (30 %) 2 (5 %) |
4 (9 %)б 0 |
|
Множествен-ность |
7 (0,08 ± 0,02) 1 (0,01 ± 0,01) |
34 (0,33 ± 0,04)а 6 (0,06 ± 0,02) |
19 (0,24±0,05)а 3 (0,04±0,02) |
23 (0,26±0,04)а 2 (0,02±0,02) |
25 (0,31±0,02)а 3 (0,04±0,02) |
20 (0,5±0,14) 2 (0,05±0,03) |
4 (0,09±0,04)б 0 |
|
Опухоли прочих локализаций |
|||||||
|
Частота |
9 (10 %) 6 (7 %) |
30 (29 %)а 24 (23 %)а |
17 (21 %)а 13 (16 %) |
10 (11 %)б 9 (10 %)б |
8 (10 %)б 7 (9 %)б |
10 (25 %) 5 (12 %) |
7 (16 %) 4 (9 %) |
|
Множествен-ность |
9 (0,1 ± 0,02) 6 (0,07 ± 0,03) |
34 (0,33 ± 0,04)а 25 (0,24 ± 0,04)а |
21 (0,26±0,06)а 16 (0,2±0,06) |
12 (0,14±0,04)б 10 (0,11±0,04)б |
9 (0,11±0,05)б 8 (0,1±0,04)б |
14 (0,35±0,1)а 6 (0,15±0,06) |
8 (0,18±0,07) 4 (0,09±0,04) |
Примечание: частота – абсолютное число крыс с опухолями (% по отношению к эффективному числу крыс); множественность – абсолютное количество опухолей (средняя величина по отношению к эффективному числу крыс, М ± m), в верхней строчке – для всех опухолей, в нижней строчке – отдельно для злокачественных опухолей в соответствующей группе. Разница статистически достоверна (при p<0,05–0,001): а – с группой интактного контроля, б – с группой своего облученного контроля.
лученного контроля. Данная методика расчета используется для оценки антиканцерогенной активности препаратов [3, 4].
Результаты и обсуждение
Некоторое количество крыс погибло от интер-куррентных заболеваний до появления первой опухоли, причем в облученных группах гибель была большей, чем в интактном контроле, как результат лучевой болезни. Все эти животные были исключены, и дальнейший анализ проводился только с эффективными крысами, пережившими срок появления первой опухоли в опыте. Результаты экспериментов с указанием эффективных крыс в каждой группе представлены в таблице.
В 1-й группе интактного контроля новообразования диагностированы у 22 % крыс, большинство опухолей молочной железы, эндокринных и репродуктивных органов были доброкачественными, тогда как среди опухолей прочих локализаций преобладали злокачественные. Во 2-й и 6-й группах облученного контроля, по сравнению с интактным контролем, были значительно повышены общая частота и множественность как всех, так и злокачественных опухолей, а также частота и множественность опухолей всех трех групп локализаций. Несмотря на разное время начала экспериментов в первой и второй серии, показатели развития новообразований у крыс из групп облученного контроля были близки (таблица). Опухоли, зарегистрированные у интактных животных, характерны для спонтанного опухолевого фона самок крыс Вистар. Облучение значительно стимулировало развитие злокачественных и доброкачественных опухолей, характерных по гистологическому типу для спонтанного опухолевого фона самок крыс Ви-стар, особенно молочной железы, а также вызывало ряд новых злокачественных и доброкачественных новообразований эндокринных и репродуктивных органов и прочих локализаций, не характерных для спонтанного канцерогенеза.
По сравнению с облученным контролем (группа 6), биоженьшень (группа 7) статистически значимо снижал общую частоту и множественность опухолей на 35 % и 58 % соответственно, всех злокачественных новообразований – на 60 % и 62 %; частоту и множественность опухолей молочной железы – на 44 % и 50 %, в том числе злокачественных новообразований – на 72 % и 71 %; частоту и множественность опухолей эндокринных и репродуктивных органов – на 70 % и 82 %, причем злокачественных новообразований данной локализации не было вообще; а также проявил тенденцию к торможению опухолей прочих локализаций. По сравнению с облученным контролем (группа 2), элеутерококк (группа 4) значимо снижал общую частоту и множественность опухолей соответственно на 22 % и 26%, частоту всех злокачественных новообразований – на 37 %; частоту и множественность опухолей прочих локализаций – на 60 % и 56 %, в том числе злокачественных новообразований – на 57 и 54%; но проявил лишь тенденцию к снижению частоты и множественности опухолей молочной железы, эндокринных и репродуктивных органов. Левзея проявила только не значимую тенденцию к торможению радиационного канцерогенеза.
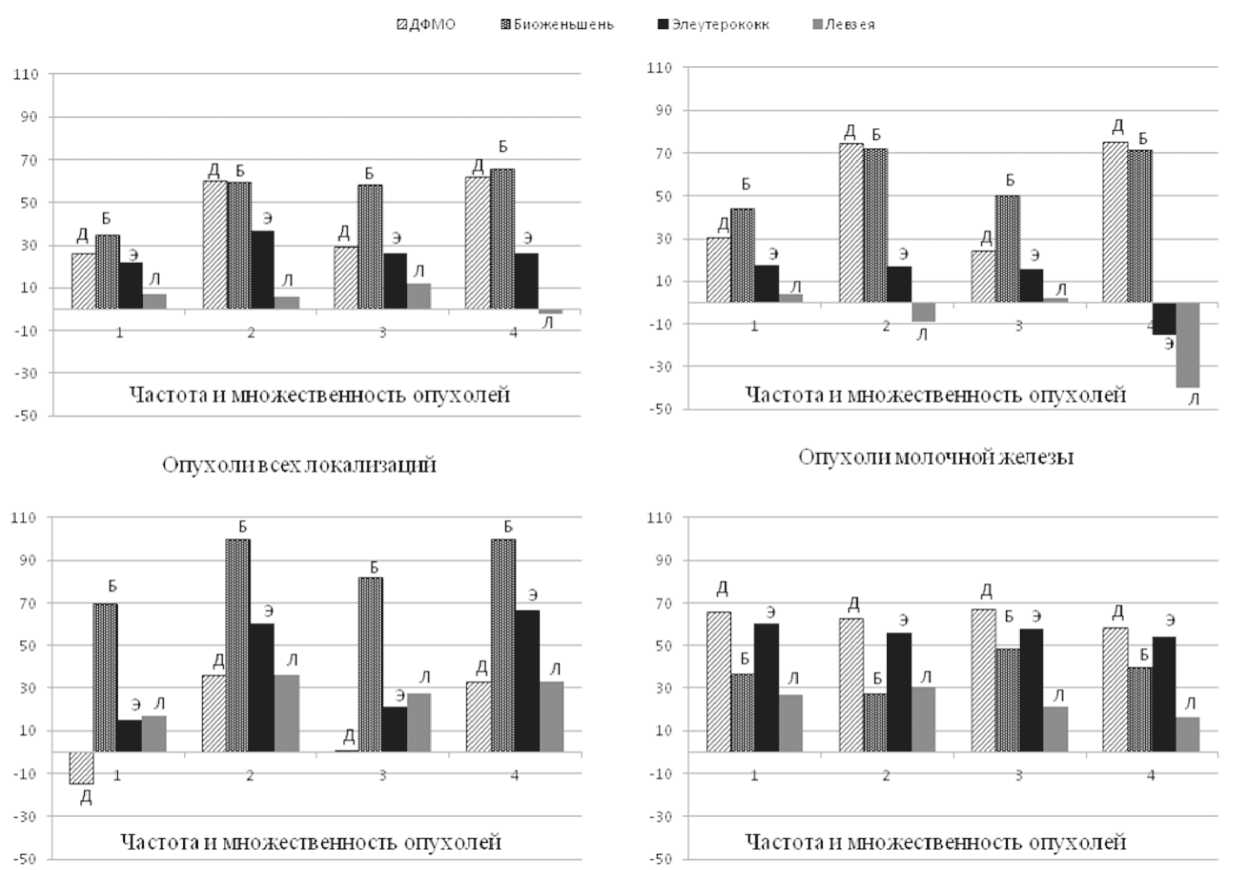
Опухоли эндокринных и репр одчжтивных ор ганов
Опухоли пр очих локализации
Рис. 1. Сравнительная эффективность ингибирования радиационного канцерогенеза у самок крыс ДФМО и растительными препаратами. Примечание: Д – ДФМО, Б – биоженьшень, Э – элеутерококк, Л – левзея; по оси ординат: изменение частоты или множественности опухолей в % (с положительным знаком – ингибирование) по отношению к соответствующей группе облученного контроля; по оси абсцисс:
1 – частота новообразований; 2 – частота отдельно злокачественных новообразований; 3 – множественность новообразований;
4 – множественность отдельно злокачественных новообразований
ДФМО проявил достаточно выраженное ингибирующее действие на радиационный канцерогенез. По сравнению с облученным контролем (группа 2), ДФМО (группа 5) значимо снижал общую частоту и множественность опухолей соответственно на 26 % и 29%, всех злокачественных новообразований – на 61 % и 62%; частоту и множественность опухолей молочной железы – на 30 % и 24%, в том числе злокачественных новообразований – на 74 % и 75%; частоту и множественность опухолей молочной железы – на 30 % и 24%, в том числе злокачественных новообразований – на 74 % и 75%; частоту и множественность опухолей прочих локализаций – на 66 % и 67%, в том числе злокачественных новообразований – на 61 % и 58%; однако не влиял на параметры развития опухолей эндокринных и репродуктивных органов.
Сравнительная ингибирующая активность испытанных препаратов представлена на рис. 1. Как по частоте опухолей, так и по их множественности наибольшая эффективность выявлена у биоженьшеня. Близкая к биоженьшеню и достаточно высокая активность проявилась у ДФМО. Такое соотношение отмечено при сравнении наиболее важных параметров канцерогенеза: суммарно для всех опухолей и отдельно для опухолей молочной железы как наиболее частой локализации. Развитие опухолей эндокринных и репродуктивных значимо ингибировал лишь биоженьшень. Развитие опухолей прочих локализаций наиболее эффективно тормозили ДФМО и элеутерококк (рис. 1).
Нами выявлены существенные различия ингибирующих эффектов на радиационный канцерогенез между препаратами, относящимися к одной группе классических фитоадаптогенов. Более того, считается, что женьшень и элеутерококк имеют сходные по химической структуре основные действующие вещества – тритерпеновые гликозиды: гинзенозиды у женьшеня и элеутерозиды у элеутерококка [2, 6]; действующими веществами левзеи считаются стероидные вещества – фитоэкдизоны [2, 6, 16]. Основоположник учения об адаптогенах Н.В. Лазарев, а также его последователи связывают антиканцерогенные эффекты фитоадаптогенов со способностью повышать неспецифическую сопротивляемость организма [2, 6]. Однако из трех растительных препаратов радиационный канцерогенез значимо тормозили только биоженьшень и элеутерококк, причем биоженьшень тормозил радиационный канцерогенез эффективнее, чем элеутерококк, как в общем, так и в отношении большинства органов, кроме группы прочих локализаций. Левзея вообще не влияла значимо на показатели развития каких-либо опухолей, индуцированных ионизирующим облучением. Следовательно, только повышения неспецифической сопротивляемости недостаточно для эффективного предупреждения радиационного канцерогенеза.
Механизмы профилактического действия биоженьшеня на радиационный канцерогенез могут быть многообразными: экстракты корня женьшеня и гинзенозиды стимулируют реакции Т-клеточного иммунитета и активность естественных клеток-киллеров, тормозят ангиогенез, улучшают межклеточное взаимодействие, активируют гены супероксиддисмутазы и каталазы, тормозят перекисное окисление липидов, вызывают апоптоз путем активации генов р53 и р21WAF1, ингибируют фосфодиэстеразную активность, индуцируют клеточную дифференцировку [2, 6, 16]. Антиканцерогенные механизмы элеутерококка близки к механизмам действия женьшеня: препараты элеутерококка стимулируют реакции макрофагов, повышают активность естественных клеток-киллеров, стимулируют выработку интерферона; обладают антиоксидантными свойствами, нормализуют гормональные и метаболические нарушения, усиливают процессы репарации ДНК [2, 6].
ДФМО является синтетическим аналогом орнитина, который предотвращает образование полиаминов и тормозит клеточную пролиферацию путем ингибирования орнитиндекарбоксилазы – ключевого фермента превращения орнитина в путресцин [3, 12]. Важно подчеркнуть, что растительный препарат биоженьшень тормозил радиационный канцерогенез более эффективно, чем синтетический препарат ДФМО, хотя антиканцерогенные эффекты элеутерококка были слабее, чем у ДФМО. Возможности применения ДФМО для химиопрофилактики рака ограничены, так как при длительном приеме высок риск побочных эффектов в виде диареи, болей в животе, тошноты и рвоты, гематологических расстройств, снижения слуха [12]. Препараты женьшеня и элеутерококка выгодно отличаются от ДФМО тем, что не имеют побочных и токсических эффектов [2, 6], и их длительный прием является безопасным, что делает перспективным применение данных растительных препаратов для химиопрофилактики отдаленных онкологических последствий облучения.


