Химиотерапия метастатических нейроэндокринных опухолейаранозой в монорежиме и в комбинации с капецитабином и темозоломидом
Автор: Полозкова Светлана Александровна, Орел Надежда Федоровна, Маркович Алла Анатольевна, Кузьминов Александр Евгеньевич, Горбунова Вера Андреевна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные статьи, собственные исследования
Статья в выпуске: 1 (5), 2013 года.
Бесплатный доступ
В статье представлены результаты клинического исследования, целью которого являлась оценка эффективности и безопасности режимов химиотерапии на основе отечественного производного нитрозомочевины Аранозы, применяемых в качестве терапии 1-5 линии при метастатических нейроэндокринных опухолях (мНЭО) различной локализации.Пациенты (n=49), включенные в исследование, получали один из 3-х режимов: Араноза в монорежиме (480-690 мг/м2 внутривенно с 1-3 д. каждые 3 недели), Араноза в комбинации с капецитабином (Араноза, 500-760 мг/м2 внутривенно в 1-2 д.; капецитабин, 2г/м2/сутки с 1-14 д. каждые 3 недели) и Араноза в комбинации с темозоломидом (Араноза, 450 мг/м2 внутривенно в 1-2 д.; темозоломид, 100 мг/м2/сутки с 3-6 д. каждые 3 недели). Аранозу в монорежиме получили 20 пациентов, режим Араноза/капецитабин - 22 пациента, и режим Араноза/темозоломид - 7 пациентов. Суммарно было проведено 337 курсов химиотерапии. Согласно оценке эффективности режимов Араноза,Араноза/капецитабин, Араноза/темозоломид, частота объективного ответа составила 40%; 22,7%; 28,6% соответственно, контроль роста опухоли - 75%; 77,3%; 57,2% соответственно. Режимы отличались хорошей субъективной переносимостью. Наиболее частым побочным эффектом являлась гематологическая токсичность 1-2 степени.Таким образом, Араноза в монорежиме и в комбинации с другими цитостатиками (капецитабином и темозоломидом) обладает противоопухолевой активностью при мНЭО и характеризуется удовлетворительной переносимостью.
Араноза, метастатические нейроэндокринные опухоли, капецитабин, темозоломид, химиотерапия
Короткий адрес: https://sciup.org/14045446
IDR: 14045446
Текст научной статьи Химиотерапия метастатических нейроэндокринных опухолейаранозой в монорежиме и в комбинации с капецитабином и темозоломидом
Нейроэндокринные опухоли (НЭО) могут возникать в различных органах из клеток диффузной эндокринной системы [1]. Большинство НЭО образуются в желудочно-кишечном тракте, поджелудочной железе и брон- холегочной системе [2]. Анализ базы данных Surveillance, Epidemiology, End Results показал, что заболеваемость НЭО в 2004 г. составила 5,25 на 100000 населения, а число больных НЭО за 29-летний период сбора сведений пре- высило в США 100000 человек [1]. Заболеваемость НЭО у мужчин выше, чем у женщин (соотношение 2,6:1,8) [3]. Зачастую возникновение НЭО носит спорадический характер, реже НЭО могут быть ассоциированы с рядом наследственных синдромов: множественной эндокринной неоплазией типов 1 и 2, болезнью Гиппеля-Линдау, туберозным склерозом и нейрофиброматозом I типа [1].
Определение нейроэндокринной дифференцировки с помощью иммуногистохимического исследования помогает при постановке диагноза НЭО [4]. Общим маркером для всех НЭО является уровень хромогранина А в крови. Кроме того, при возникновении специфических симптомов диагностическую ценность может иметь определение конкретных гормонов и биологически активных веществ [5].
В клинической практике принято разделять НЭО на функционирующие и нефункционирующие [6]. Функциональная активность НЭО определяется на основании клинических симптомов и данных серологического исследования, а не по экспрессии иммуногистохимических маркеров. Более того, не существует характерных гистологических признаков функционально активных НЭО [3]. Симптомы (приливы, диарея, фиброз клапанов правой половины сердца и брыжейки кишечника), связанные с гиперсекрецией и выбросом в системный кровоток гормонов и биологически активных веществ, ослабляются аналогами соматостатина; в настоящее время из препаратов этой группы доступны октреотид и ланреотид (последний в США одобрен только для лечения акромегалии).
Для НЭО предложен ряд гистологических классификаций (таблица1).
Отсутствие единой терминологии и классификации НЭО с определением стадии и степени злокачественности опухоли затрудняет оценку методов лечения и сравнение результатов публикуемых исследований [3].
На ранних стадиях для излечения часто достаточно хирургического вмешательства [1]. К сожалению, из-за позднего выявления опухоли это часто оказывается невозможным, так как заболевание диагностируется уже при наличии метастазов. Однако и для этой группы
Таблица 1. Номенклатура и классификация нейроэндокринных опухолей
|
Дифференцировка и степень злокачественности |
Число митозовa |
Ki-67, %b |
Традиционная классификация |
Классификация ENETS/BO3 |
Классификация Moran et al.6 |
|
Высоко-дифференцированные Низкая степень злокачественности (G1) |
< 2 |
≤ 2 |
Карциноид, опухоль из островковых клеток, (нейро) эндокринная опухоль ПЖ Карциноид, атипичный |
Нейроэндокринная опухоль G1 Нейроэндокринная |
Нейроэндокринный рак G1 Нейроэндокринный |
|
Промежуточная степень злокачественности (G2) |
2-20 |
3-20 |
карциноид,С опухоль из островковых клеток, (нейро) эндокринная опухоль ПЖ |
опухоль G2 |
рак G2 |
|
Низкодифференцированные Высокая степень злокачественности (G3) |
> 20 |
> 20 |
Мелкоклеточный рак Крупноклеточный нейроэндокринный рак |
Нейроэндокринный рак G3, мелкоклеточный Нейроэндокринный рак G3, крупноклеточный |
Нейроэндокринный рак G3, мелкоклеточный Нейроэндокринный рак G3, крупноклеточный |
Сокращения: ENETS — European Neuroendocrine Tumor Society; ПЖ — поджелудочная железа.
a На 10 полей зрения при большом увеличении микроскопа. Одно поле зрения составляет 2 мм2, необходимо оценить минимум 40 полей (при увеличении x 40) в областях с наибольшей плотностью митозов. Пограничные значения взяты из руководства по стадированию AJCC, 7-е издание [5].
b Окраска антителами MIB1; процент от 2000 клеток опухоли в областях с наибольшим окрашиванием ядер. Пограничные значения взяты из руководства по стадированию AJCC, 7-е издание [5].
c Термин «атипичный карциноид» применим только к НЭО легкого промежуточной степени злокачественности.
Химиотерапия метастатических нейроэндокринных опухолей аранозой в монорежиме и в комбинации с капецитабином и темозоломидом.
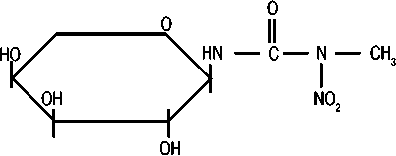
Рисунок 1. Структурные формулы стрептозотоцина и Аранозы
АРАНОЗА
СТРЕПТОЗОТОЦИН
(L-арабинопиранозил-1-метил-интрозомочевина)
Синтезирована и разработана в РОНЦ РАМН
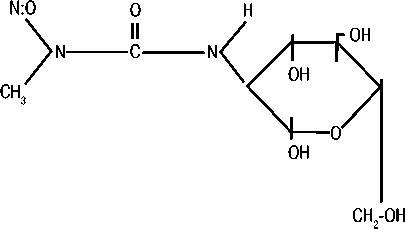
пациентов в некоторых случаях целесообразно хирургическое лечение с целью снижения опухолевого объема — циторедуктивная операция (debulkingsurgery) [7]. Большинство исследователей полагают, что паллиативную операцию следует проводить только если возможно удаление не менее 90% опухолевой массы, однако имеются сообщения о том, что и резекция меньшего объема улучшает отдаленные результаты [8]. При невозможности полного удаления опухоли и метастазов используются лекарственные методы лечения для контроля симптомов, остановки или торможения роста опухоли [7]. Эффективность системной химиотерапии при метастатических НЭО низкая, определяется локализацией первичной опухоли и степенью злокачественности [9]. Стрептозотоцин (2-дезокси-2 (3-метил-3-нитрозомочевина) — препарат, одобренный Комитетом по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA) для лечения распространенных НЭО поджелудочной железы [1]. Традиционные режимы для лечения НЭО поджелудочной железы включают стрептозотоцин+5-фторурацил, стрептозотоцин+доксорубицин и стрептозото-цин+ 5-фторурацил+доксорубицин. Следует иметь в виду, что RECIST критерии ответа, используемые сегодня, отличаются от тех критериев (нерадиографических), которые использовались в более старых исследованиях (например, клинический ответ и ответ со стороны размеров печени). Это частично объясняет разницу в частоте объективного ответа между более ранними и современными исследованиями. Очень высокая частота ответа в более ранних исследованиях, вероятно, является результатом использования нестандартных критериев оценки. В современных клинических исследованиях частота объективного ответа при режимах на основе стрептозотоцина не превышает 39% с продолжительностью ремиссии 9,3 месяца [9]. Однако широкое применение стрептозотоцина по этому показанию сдерживается его токсичностью [1]. Данный препарат в Российской Федерации не зарегистрирован. Араноза (3- (a-L-арабинопиранозил-1) — 1-метил-1-нитрозомочевина) — отечественный алкилирующий препарат, который так же, как и стрептозотоцин, является сахаросодержащим производным нитрозомочевины. Структурные формулы стрептозотоцина и Аранозы представлены на рисунке 1.
По экспериментальным данным Араноза обладает более высокой противоопухолевой активностью, чем ее ближайшие структурные аналоги — стрептозотоцин и нитрозометилмо-чевина [10]. В связи с этим в отделении химиотерапии ФГБУ РОНЦ им. Н. Н. Блохина РАМН у больных с метастатическими НЭО проводится изучение Аранозы и режимов на ее основе.
Материалы и методы исследования
В исследовании, проведенном на базе отделения химиотерапии ФГБУ РОНЦ им. Н. Н. Блохина РАМН, приняли участие 49 больных с метастатическими нейроэндокринными опухолями в возрасте от 19 до 74 лет (средний возраст — 52,6 года): 20 пациентов были вклю чены в группу Аранозы (ООО фирма «Глес», РФ) в монорежиме (с октября 2010 г. по февраль 2012 г.), 22 — в группу Арано-за/капецитабин (Кселода®Ф. Хоффманн-Ля РошЛтд., Швейцария) (с марта 2006 г. по февраль 2012 г.) и 7-в группу Араноза/темозо-ломид (Темодал®Шеринг-ПлауЛабо Н. В., Бельгия) (с ноября 2011 г. по февраль 2012 г). Исследователи выбирали режим химиотерапии для каждого больного: Араноза в монорежиме (480-690 мг/м2 внутривенно с 1-3 д. каждые 3 недели), Араноза в комбинации с капецитаби-ном (Араноза, 500-760 мг/м2 внутривенно в 1-2 д.; капецитабин, 2 г/м2/сутки с 1-14 д. каждые 3 недели) или Араноза в комбинации с темозоломидом (Араноза, 450 мг/м2 внутривенно в 1-2 д.; темозоломид, 100 мг/м2/сутки с 3-6 д. каждые 3 недели) в зависимости от соматического статуса, сопутствующих заболеваний, получаемой ранее химиотерапии. Все больные имели доступный (е) для оценки заболевания очаг (и), удовлетворительные показатели общего и биохимического анализов крови. Демографические характеристики пациентов представлены в таблице 2.
До введения Аранозы проводилась премедикация ондансетроном в дозе 8 мг и дексаметазоном в дозе 4 мг. Раствор Аранозы готовили непосредственно перед инъекцией путем растворения содержимого флакона (500 мг) в 20 мл 5%-го раствора глюкозы.
В соответствии с условиями исследования при удовлетворительной переносимости цитостатиков лечение продолжали до достижения максимального эффекта и далее проводили два курса консолидирующей химиотерапии в тех же режимах. В случае достижения стабилизации после четырех курсов химиотерапии без нарастания положительной динамики проводили еще 2-3 курса аналогичной химиотерапии, при подтверждении стабилизации химиотерапию завершали. Также основаниями для прекращения лечения являлись прогрессирование опухолевого процесса, непереносимая токсичность и отказ больного от лечения.
У 18 пациентов (36,7%) наблюдался карциноидный синдром, у 41 (83,7%) отмечалось повышение биохимических показателей (уровня серотонина, хромогранина А в крови и 5-ги-дроксииндолуксусной кислоты в суточной моче) при отсутствии клинических симптомов.
Таблица 2. Демографические характеристики пациентов (n=49)
|
Параметры |
Показатели |
|
Пол, n (%): |
|
|
— мужчины |
17 (34,7%) |
|
— женщины |
32 (65,3%) |
|
Средний возраст (лет): |
52, 6 (19,0-74,0) |
|
Статус по шкале ECOG, n (%): |
|
|
0 |
7 (14,3%) |
|
1 |
39 (79,6%) |
|
2 |
3 (6,1%) |
|
Локализация первичного очага, n (%): |
|
|
Поджелудочная железа |
23 (46,9%) |
|
Тонкая кишка |
10 (20,4%) |
|
Метастазы НЭО в печень без выявленного первичного очага (ВПО) |
6 (12,2%) |
|
Почка |
3 (6,1%) |
|
Слепая кишка |
3 (6,1%) |
|
Желудок |
1 (2,05%) |
|
Метастазы НЭО без выявленного первичного очага |
1 (2,05%) |
|
Печень |
1 (2,05%) |
|
Прямая кишка |
1 (2,05%) |
|
Подтверждение диагноза, n (%): |
|
|
Цитологическое |
3 (6,1%) |
|
Гистологическое |
46 (93,9%) |
|
Иммуногистохимическое |
43 (87,8%) |
|
Индекс пролиферации Ki-67 (n=43): |
|
|
менее 3% |
4 (9,3%) |
|
3 до 20% включительно |
30 (69,8%) |
|
более 20% |
9 (20,9%) |
|
Карциноидный синдром, n (%): |
18 (36,7%) |
|
Локализация метастазов n (%): |
|
|
Регионарные лимфатические узлы |
44 (89,8%) |
|
Печень |
43 (87,8%) |
|
Брюшина |
5 (10,2%) |
|
Кости |
5 (10,2%) |
|
Легкие |
3 (6,1%) |
|
Предшествующее лечение, n (%): |
|
|
Хирургическое лечение |
31 (63,3%) |
|
1 линия химиотерапии |
9 (18,4%) |
|
2 линии химиотерапии |
6 (12,2%) |
|
3 линии химиотерапии |
3 (6,1%) |
|
4 линии химиотерапии |
1 (2,1%) |
|
Иммунотерапия |
14 (28,6%) |
|
Биотерапия аналогами соматостатина |
21 (42,9%) |
|
Химиоэмболизация печеночной артерии |
2 (4,1%) |
|
Линия лечения, в которой использовалась Араноза, n (%): |
|
|
1 |
30 (61,2%) |
|
2 |
9 (18,4%) |
|
3 |
6 (12,2%) |
|
4 |
3 (6,1%) |
|
5 |
1 (2,1%) |
Химиотерапия метастатических нейроэндокринных опухолей аранозой в монорежиме и в комбинации с капецитабином и темозоломидом.
В связи с этим 30 больных во время проведения химиотерапии с использованием Аранозы одновременно получали пролонгированные формы аналогов соматостатина в дозах от 20-40 мг 1 раз в 4 недели, начиная с 1 или последующих курсов химиотерапии (таблица 3).
Таблица 3. Использование пролонгированных аналогов соматостатина в процессе химиотерапии и номер курса, с которого начато их использование
|
Доза аналогов соматостатина и курс, с которого начато их использование |
Количество пациентов (n=30) |
|
20 мг |
20 |
|
С 1 курса |
15 |
|
С 2 курса |
1 |
|
С 3 курса |
3 |
|
С 5 курса |
1 |
|
30 мг |
6 |
|
С 1 курса |
6 |
|
40 мг |
4 |
|
С 1 курса |
4 |
Результаты исследования и обсуждение
За исследуемый период 49 пациентам было проведено 337 курсов химиотерапии с использованием различных схем химиотерапии, при этом 132 курса проведены с использованием Аранозы в монорежиме, 185 — по схеме Араноза/капецитабин и 20 — по схеме Арано-за/темозоломид (таблица 4).
В таблице 5 представлена эффективность режимов химиотерапии на основе Аранозы
Таблица 4. Используемые схемы лечения и число курсов химиотерапии
|
Схема |
Число курсов |
% |
|
|
1 |
Араноза |
132 |
39,2 |
|
2 |
Араноза/капецитабин |
185 |
54,9 |
|
3 |
Араноза/темозоломид |
20 |
5,9 |
|
Итого: |
337 |
100 |
|
В процессе лечения оценку объективного эффекта проводили каждые 2 курса в соответствии с критериями RECIST, версия 1.0., с использованием визуализационных методов (ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография), биохимического ответа — путем определения динамики экскреции 5-ГИУК (5-гидрок-сииндолуксусной кислоты) в суточной моче, уровня хромогранина А и серотонина в периферической крови и симптоматического ответа перед началом каждого цикла лечения.
После завершения лечения у больных с эффектом и стабилизацией процесса проводилось обследование по указанным выше критериям каждые 3-4 месяца до регистрации прогрессирования (по критериям RECIST 1.0.).
Оценка безопасности лечения осуществлялась на основании регистрации нежелательных явлений в соответствии с критериями общей токсичности Национального института рака США — шкалы NCI-CTCAE, версия 3.0. В течение всего периода проведения химиотерапии осуществляли контроль показателей функции костного мозга, почек, печени и сердца.
(оценка по шкале RECIST 1.0.). Частота объективного ответа в группах Араноза, Араноза/ка-пецитабин, Араноза/темозоломид составила 40%; 22,7%; 28,6% соответственно, контроль роста опухоли (частота полных и частичных регрессий, а также стабилизации опухолевого процесса) — 75%; 77,3%; 57,2% соответственно. У одного пациента из группы Араноза/ка-пецитабин достигнут полный эффект, подтвержденный гистологически.
Необходимо отметить, что у 2-х пациентов с химиоэмболизацией печеночной артерии (ХЭПА) в анамнезе после 2-х курсов химиотерапии на основе Аранозы (первая и вторая линия) зарегистрировано раннее прогрессирование заболевания.
Большинство опухолей (n=30) были высокодифференцированными, с индексом пролиферации Ki-67, равным 3-20% (G2). У 6 пациентов индекс пролиферации не был определен. Эффективность химиотерапии с использованием Аранозы в зависимости от индекса пролиферации Ki-67 представлена в таблице 6.
У 17 (94,4%) из 18 пациентов был получен симптоматический эффект в виде уменьшения
Таблица 5. Эффективность использования Аранозы в монорежиме и в комбинации с капецитабином/темозоломидом у больных мНЭО (n=49)
У 25 (61%) из 41 больных с повышением биохимических показателей (уровня серотонина, хромогранина А в крови и 5-гидрок-сииндолуксусной кислоты в суточной моче) наблюдался биохимический ответ в виде их снижения, у 15 (36,6%) пациентов оценить биохимический ответ на лечение оказалось невозможно.
При изучении токсичности проводимой химиотерапии проанализировано 337 курсов химиотерапии. В таблице 7 представлены данные о токсичности по группам лечения (Араноза, Араноза/капецитабин, Араноза/темозоломид).
Следует отметить удовлетворительную субъективную переносимость режимов на осно-
Таблица 6. Эффективность лечения в зависимости от индекса пролиферации Ki-67 (n=43)
Химиотерапия метастатических нейроэндокринных опухолей аранозой в монорежиме и в комбинации с капецитабином и темозоломидом.
пии. Что касается гематологической токсичности 3-4 степени, то в группе Аранозы в монорежиме тромбоцитопения и нейтропения возникали чаще, что, вероятно, связано с большей дозой Аранозы в данном режиме. Случаев фебрильной нейтропении не было отмечено ни у одного пациента. Гематологические осложнения были обратимыми и не требовали прекращения химиотерапии. Одному пациенту из-за длительно сохраняющейся тромбоцитопении 3-4 степени в течение 5 суток проведено переливание 1 дозы тромбоконцентрата для соблюдения интервала между введениями цитостатиков. Анемии были невыраженными и не влияли на ход лечения.
Негематологические осложнения были представлены тошнотой, астенией, ладонно-подошвенным синдромом 1-2 степени, гепатотоксичностью: гипербилирубинемией и повышением уровня АЛТ (аланинамино-трансферазы)/АСТ (аспартатаминотрансферазы) 1-2 степени (таблица 7) и не требовали коррекции проводимой терапии. У одного пациента лечение капецитабином было прекращено из-за кардиологической токсичности в виде частых желудочковых экстрасистол, что потребовало перевода в группу Аранозы в монорежиме. При лечении Аранозой в монорежиме эпизодов желудочковой экстрасистолии зафиксировано не было. В дальнейшем, в отношении эффекта, пациент оценивался в группе монотерапии Аранозой. Случаев нефротоксичности не было отмечено ни у одного больного, в то время как по литературным данным при использовании стрептозотоцина нефротоксичность наблюдается в 65% [11].
Увеличение интервала между курсами химиотерапии на 7-14 дней вследствие побочных эффектов потребовалось при проведении 19 курсов в группе Аранозы в монорежиме (из них 3 курса в связи с повышением трансаминаз (АЛТ/АСТ), 14 курсов — в связи с тромбоцитопенией и 2 курса — в связи с нейтропенией), 12 курсов — в группе Араноза/капецитабин (из 11 — в связи с тромбоцитопенией и 1 — в связи с нейтропенией). В группе Араноза/те-мозоломид ни один из курсов химиотерапии не был отложен.
Исходно доза Аранозы была меньше запланированной на 25-30% у 3-х пациентов в связи с низким показателем индекса массы тела (ИМТ), массивным поражением ткани печени метастатическим процессом и общим состоянием ECOG 2.
В процессе лечения редуцировать дозу Ара-нозы на 25-30% понадобилось у 4 пациентов в группе Аранозы в монорежиме вследствие тромбоцитопении 3-4 степени (при этом доза препарата исходно составляла 530-690 мг/м2 в 1-3дни) и у 1 пациента в группе Арано-за/капецитабин (исходная доза Аранозы — 600-650 мг/м2 в 1-2 д.) вследствие тромбоцитопении 4 степени. Редукций доз препаратов в группе Араноза/темозоломид не проводилось.
В настоящее время из 49 пациентов 13 продолжают лечение, 10 находятся в состоянии ремиссии без признаков прогрессирования, у 21 пациента зарегистрировано прогрессирование заболевания (у 13 — в процессе лечения, у 8 — в процессе наблюдения после завершения лечения с определенным эффектом), одна пациентка умерла в период наблюдения через 3 месяца после завершения лечения в связи с нарушением ритма сердца. Среднее время до прогрессирования составило 6,3 мес. (от 2 до 17 мес.) (n=21). Проследить течение заболевания после завершения лечения режимами на основе Аранозы у 4-х пациентов не удалось. Данные пациенты в анализ выживаемости не вошли.
Заключение
Полученные данные свидетельствуют об эффективности и переносимости режимов на основе Аранозы при метастатических НЭО различной локализации. Частота объективного ответа в группах Араноза, Араноза/капеци-табин, Араноза/темозоломид составила 40%; 22,7%; 28,6% соответственно, контроль роста опухоли (частота полных и частичных регрессий, а также стабилизации опухолевого процесса) — 75%; 77,3%; 57,2% соответственно. Следует отметить, что даже в группе больных с исчерпанными ранее возможностями лекарственной терапии (ранее многократно получавших цитостатики, а также иммунотерапию) было возможно достижение объективного, биохимического и симптоматического эффектов. Режимы на основе Аранозы характеризовались удовлетворительной переносимостью. Наиболее частым побочным эффектом была гематологическая токсичность.
Таблица 7. Токсичность режимов с Аранозой (по курсам: n=337)
|
Степень |
Араноза (n=132) |
Араноза/ капецитабин (n=185) |
Араноза/ темозоломид (n=20) |
|
|
Нейтропения |
1 |
8 (6,1%) |
6 (3,2%) |
2 (10,0%) |
|
2 |
3 (2,3%) |
10 (5,4%) |
0 |
|
|
3 |
2 (1,5%) |
1 (0,5%) |
0 |
|
|
4 |
6 (4,5%) |
0 |
0 |
|
|
Тромбоцитопения |
1 |
30 (22,7%) |
18 (9,7%) |
0 |
|
2 |
3 (2,3%) |
1 (0,5%) |
2 (10,0%) |
|
|
3 |
2 (1,5%) |
2 (1,0%) |
0 |
|
|
4 |
5 (3,8%) |
0 |
0 |
|
|
Анемия |
1 |
1 (0,8%) |
2 (1,0%) |
0 |
|
2 |
0 |
0 |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Повышение АСТ/АЛТ |
1 |
23 (17,4%) |
14 (7,6%) |
1 (5,0%) |
|
2 |
1 (0,8%) |
2 (1,0%) |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Гипербилирубинемия |
1 |
7 (5,3%) |
13 (7,0%) |
0 |
|
2 |
0 |
1 (0,5%) |
0 |
|
|
3 |
0 |
1 (0,5%) |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Кардиотоксичность |
1 |
0 |
2 (1,0%) |
0 |
|
2 |
0 |
0 |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Тошнота |
1 |
1 (0,8%) |
2 (1,0%) |
3 (15,0%) |
|
2 |
0 |
0 |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Астения |
1 |
7 (5,3%) |
1 (0,5%) |
0 |
|
2 |
0 |
3 (1,6%) |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
|
|
Ладонно-подошвенный синдром |
1 |
0 |
12 (6,5%) |
0 |
|
2 |
0 |
2 (1,0%) |
0 |
|
|
3 |
0 |
0 |
0 |
|
|
4 |
0 |
0 |
0 |
Химиотерапия метастатических нейроэндокринных опухолей аранозой в монорежиме и в комбинации с капецитабином и темозоломидом.
Список литературы Химиотерапия метастатических нейроэндокринных опухолейаранозой в монорежиме и в комбинации с капецитабином и темозоломидом
- Matthew H. Kulke, Lillian L. Siu, Joel E. Tepper, George Fisher, Deborah Jaffe, Daniel G. Haller, Lee M. Ellis, Jacqueline K. Benedetti, Emily K. Bergsland, Timothy J. Hobday, Eric Van Cutsem, James Pingpank, Kjell Oberg, Steven J. Cohen, Mitchell C. Posner, James C. Yao. Будущие подходы к лечению нейроэндокринных опухолей: консенсусные рекомендации встречи по планированию клинических исследований нейроэндокринных опухолей, проведенной Национальным институтом рака США//J. Clin. Oncol. -2011. -Том 5, 2. -С. 160-169
- Maggard M. A., O’Connell J. B., Ko C. Y. Updated population-based review of carcinoid tumors//Ann Surg. -2004. -240. -P. 117-122
- Arnold C. Neuroendocrine tumors of the gastrointestinal tract//Praxis. -2007. -Vol. 96, 1-2. -P. 19-28
- David S. Klimstra, MD, Irvin R. Modlin et al. Необходимый минимум данных в заключении морфолога при нейроэндокринных опухолях. Результаты дельфийского голосования//Тhe American Journal of Surgical Patholog. -2010. -Том 34, 3, март 2010. -С. 300-311
- Pavel M. Дилеммма диагноза -роль врачей различных специальностей//Consilium Medicum. -2009. -Экстравыпуск. -С. 8-9
- Патютко Ю. И., Сагайдак И. В., Гахраманов А. Д. Нейроэндокринные опухоли поджелудочной железы//Эффективная фармакотерапия. -2010. -2. -С. 14-18
- Горбунова В. А., Орел Н. Ф. Нейроэндокринные опухоли: мультидисциплинарный подход к диагностике и лечению//Эффективная фармакотерапия. -2010. -2. -С. 30-33
- Saxena A., Chua T. C., Sarkar A. et al. Progression and survival results after radical hepatic metastasectomy of indolent advanced neuroendocrine neoplasms support an aggressive surgical approach//Surgery. -2011. -149 (2). -P. 209-220
- Kouvaraki M.A., Ajani J.A., Hoff P. et al. Fluorouracil, doxorubicin, and streptozocin in the treatment of patients with locally advanced metastatic pancreatic endocrine carcinomas//J. Clin. Oncol. -2004. -22 (23). -P. 4762-4771
- Горбунова В. А., Орел Н. Ф., Егоров Г. Н. Новые противоопухолевые препараты, созданные в России. Этюды химиотерапии. Юбилейный сборник, посвященный 40-летию отделения химиотерапии РОНЦ им. Н. Н. Блохина РАМН/Под редакцией проф. В. А. Горбуновой. -Москва. -2000. -С. 22-47
- Eriksson B., berg K. Neuroendocrine tumours of the pancreas//Br J Surg. -2000. -87. -C. 129-131


