Хирургическая коррекция рефрактерных венозных трофических язв
Автор: Каторкин С.Е., Кушнарчук М.Ю., Мельников М.А., Жуков А.А., Кравцов П.Ф., Репин А.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 (49), 2021 года.
Бесплатный доступ
Цель исследования. Изучить эффективность послойной дерматолипэктомии и эндоскопической фасциотомии в оперативном лечении рефрактерных венозных трофических язв.Материал и методы. Пациентам (n = 105) С6 клинического класса выполнялись кроссэктомия и короткий стриппинг. В І группе (n = 35) проводилась свободная аутодермопластика трофических язв перфорированным лоскутом. Во ІI группе (n = 36) выполнялись shave therapy и аутодермопластика. В IIІ группе (n = 34) выполнялись фасциотомия, shave therapy и аутодермопластика. Отдаленные результаты лечения изучены в период от 1 до 12 месяцев.Результаты. Полное заживление венозных трофических язв наблюдалось в І группе на 49,4 ± 7,2, во II - на 31,4 ± 4,7, в III - на 32,1 ± 3,6 сутки (t1-2 = 2,09; p1-2 = 0,049; t1-3 = 2,24; p1-3 = 0,024; t2-3 = 0,03; p2-3 = 0,763). Полное приживление аутодермотрансплантата зафиксировано у 7 (19,4 %) пациентов I группы, в 27 (77,1 %) наблюдениях во II группе и у 27 (79,4 %) пациентов III группы сравнения (χ21-2 = 23,674; p1-2 = 0,001; χ21-3 = 25,173; p1-3 = 0,001; χ22-3 = 0,052; p2-3 = 0,826).Заключение. Послойная дерматолипэктомия с аутодермопластикой и эндоскопической декомпрессионной фасциотомией является эффективным методом лечения персистирующих рефрактерных венозных трофических язв.
Хронические заболевания вен, хроническая венозная недостаточность, рефрактерные венозные трофические язвы, липодерматосклероз, хронический венозный компартмент синдром, дерматолипэктомия, shave therapy, фасциотомия
Короткий адрес: https://sciup.org/143176789
IDR: 143176789 | УДК: 616.14-002.44-005-036.12-06-089 | DOI: 10.20340/vmi-rvz.2021.1.CLIN.3
Текст научной статьи Хирургическая коррекция рефрактерных венозных трофических язв
Cite as: Katorkin S.E., Kushnarchuk M.J., Melnikov М.A., Zhukov A.A., Kravtsov P.F., Repin A.A. The surgical correction of refractory venous trophic ulcers. Bulletin of the Medical Institute Reaviz. Rehabilitation, Doctor and Health. 2021;1(49):38-46. CLIN.3
Трофические язвы (ТЯ), осложняющие течение хронических заболеваний вен (ХЗВ), характеризуются рефрактерным течением с повышенной склонностью к рецидивам [1–4]. Добиться длительной и безре-цидивной эпителизации венозных ТЯ только консервативными методами, являющимися обязательными при подготовке пациента к оперативному вмешательству и единственно возможными при наличаи противопоказаний к нему, практически не удается [5–8]. Согласно Российским клиническим рекомендациям по диагностике и лечению хронических заболеваний вен (2018 г.), необходимо комбинированное применение комплексного консервативного лечения, включающего компрессионную терапию, системную фармакотерапию с назначением флеботропных и антигистаминных лекарственных препаратов, нестероидных противовоспалительных средств, различных вариантов дебридмента ТЯ (хирургический, ферментный, механический, аутолитический), раневых покрытий нового поколения и хирургической коррекции нарушений венозной гемодинамики [9].
До сих пор в клинической практике отсутствует единый подход к выбору метода хирургического лечения пациентов с ТЯ венозной этиологии. В последние годы большинством отечественных и зарубежных флебологов пациентам с ХВН клинического класса С6 рекомендуется не стремиться к достижению эпителизации ТЯ консервативными методами, а выполнять раннюю оперативную коррекцию нарушений венозной гемодинамики нижних конечностей [8,
10–12]. Рефрактерные венозные ТЯ с отсутствием эпителизации после адекватного лечения на протяжении трех месяцев, при отсутствии противопоказаний, подлежат хирургическому лечению [11]. В настоящее время при выраженных трофических нарушениях и циркулярном липодерматоскле-розе, когда малоинвазивные способы устранения горизонтального рефлюкса и обработки несостоятельных перфорантны вен не эффективны и чреваты осложнениями, в специализированных сосудистых отделениях применяется эндоскопическая диссекция (SEPS). Наряду с хирургической коррекцией венозной системы у пациентов с рефрактерными персистирующими венозными ТЯ на фоне развития выраженных трофических изменений мягких тканей нижних конечностей практический интерес представляет метод послойного иссечения ТЯ с фиброзно-измененными тканями – shave therapy (ST) и пластикой перфорированным аутодермотрансплантатом (ППА) [12–15]. При этом остается дискуссионным вопрос о большей эффективности ST в качестве самостоятельного метода или в комбинации с хирургическими вмешетель-ствами на венозной системе нижних конечностей. Развитие циркулярного липодерма-тосклероза у пациентов с рефрактерными персистирующими ТЯ приводит к формированию хронического венозного компарт-мент синдрома (CVCS) [1, 12]. При подтверждении развития CVCS методами инструментальной диагностики (КТ, измерение давления в мышечно-фасциальных футлярах голени), для его коррекции исполь- зуются различные варианты фасциотомии (FT) с приоритетом эндоскопических методик [12]. Определение эффективности применения этих методов хирургического лечения пациентов с ТЯ нижних конечностей венозной этологии, по нашему мнению, является актуальным.
Цель исследования: изучить эффективность ST и FT в комплексном лечении пациентов с венозными ТЯ и ХВКС.
Материал и методы
В основу проведенного сравнительного непараллельного клинического исследования положены результаты диагностики и применения различных методов хирургического лечения 105 пациентов с ХЗВ клинического класса С6 по классификации CEAP (1994 г.), находившихся на стационарном лечении в сосудистом отделении клиники госпитальной хирургии Клиник ФГБОУ ВО СамГМУ Минздрава РФ в период с 2009 по 2017 годы. Хирургическая коррекция нарушений венозного оттока у всех пациентов включала кроссэктомию, короткий стрип-пинг и миниинвазивную обработку варикозно трансформированных притоков большой и малой подкожных вен вне зоны липодерматосклероза по типу способа На-рата или с применением минифлебэкстрак-торов («Venosan», Швейцария).
Методом случайной выборки пациенты были разделены на три группы сравнения. В І группе (n = 36), включавшей 23 (63,9 %) женщины и 13 (36,1 %) мужчин, флебэкто-мию дополняли проведением ППА. Средний возраст составил 63,1 ± 7,5 года. Варикозная болезнь (ВБ) была выявлена в 28 (77,8 %), а посттромбофлебитическая болезнь глубоких вен нижних конечностей (ПТФБ) в стадии реканализации – в 8 (22,2 %) наблюдениях. Анамнез ХЗВ составил 15,9 ± 4,7 лет. Планиметрические показатели площади ТЯ от 118 до 214 см2 (167 ± 23 см2), а длительность ТЯ – от 2 до 11 лет (6,2 ± 2,3 года). У 31 (72,2 %) пациен- та ТЯ локализовалась на левой, а в 10 (27,8 %) наблюдениях – на правой голени.
Во ІI группе пациентов (n = 35) флебэк-томия дополнялась ST, забором аутодермотрансплантата и ППА (рис. 1). Применялся дерматом Acculan 3Ti (GA 670 «B. Braun», ФРГ) с возможностью регулировки толщины и ширины послойно срезаемых поверхностей ТЯ и фиброзно-измененных тканей. После хирургического дебридмента поверхности ТЯ на раневой дефект укладывали аутодермотрансплантат. Для его расщепления использовали перфоратор BA720R («B. Braun», ФРГ), что позволяло увеличивать площадь кожного лоскута до 1:6. Забор аутодерматотрансплантата производили с передней поверхности бедра интактной конечности. Во II группе пациентов также преобладали женщины – 22 (62,8 %). Средний возраст составил 61,1 ± 6,3 года. ПТФБ диагностирована у 8 (22,8 %), а ВБ – у 27 (77,2 %) пациентов. Длительность ХЗВ составила 16,8 ± 4,4 лет при анамнезе ТЯ 6,8 ± 1,7 лет. Площадь ТЯ варьировала от 128 до 226 см 2 (178 ± 21 см 2 ). У 24 (68,6 %) пациентов ТЯ локализовалась на левой нижней конечности.
В III группе (n = 34) флебэктомия дополнялась SEPS с декомпрессионной FT, ST и ППА. При выполнении FT использовался однопортовый клинок для SEPS («МФС», Казань). Женщин было 22 (64,7 %), мужчин –12 (35,3 %). Средний возраст пациентов составил 59,2 ± 6,4 года. ВБ – у 26 (76,5 %), ПТФБ – у 8 (23,5 %) пациентов. Длительность течения ХЗВ составила 16,4 ± 4,2 года. Площадь ТЯ – 176 ± 22 см 2 . Анамнез ТЯ составил в среднем 6,6 ± 1,6 года. В 22 (64,7 %) наблюдениях ТЯ локализовалась на левой голени.
Средний срок предоперационной подготовки ТЯ, заключающейся в ежесуточной двукратной обработке ТЯ с использованием антисептических растворов и мазевых повязок, постуральном дренаже, компрессионной терапии и применении флеботроп-ных препаратов, составил 6,3 ± 0,8 суток во всех группах сравнения.
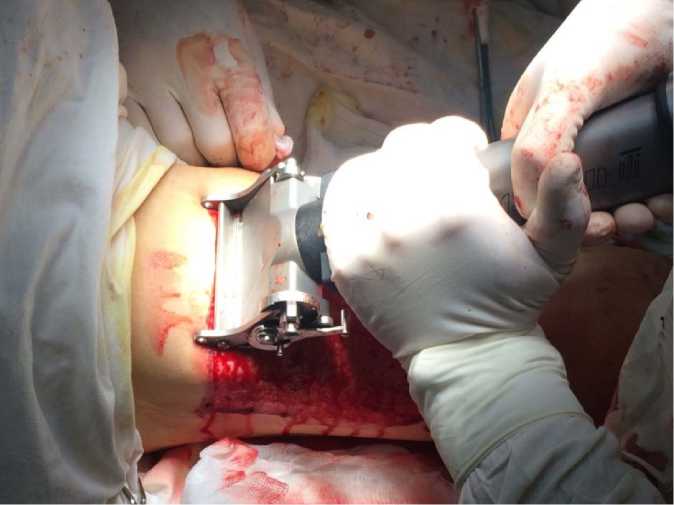
Рис. 1. Фрагмент выполнения послойной дерматолипэктомии и пластики трофической язвы перфорированным аутодермотрансплантатом у пациентки c клиническим диагнозом: С6S, Ep, As,p,d, Pr; LІІІ
В послеоперационном периоде назначались анальгетики, антибиотики, дезагре-ганты и флеботоники, а также компрессионная терапия. Уровень микробной обсе-мененности ТЯ в группах сравнения при госпитализации пациентов статистически значимо не различался ( χ 21-2 = 0,001; p 1-2 = 0,975; χ 21-3 = 0,048; p 1-3 = 0,875; χ 22-3 = 0,013; p 2-3 = 0,887). Сроки очищения ТЯ и появления грануляций в исследуемых группах после проведения предоперационной подготовки также не имели статистически значимых различий – 5,9 ± 0,9, 5,6 ± 0,8 и 5,7 ± 0,8 суток (t 1-2 = 0,25; p 1-2 = 0,801; t 1-3 = 0,17; p 1-3 = 0,873; t 2-3 = 0,09; p 2-3 = 0,952) соответственно.
Критериями оценки эффективности проведенного хирургического лечения пациентов клинического класса С6 являлись: сроки эпителизации ТЯ после окончания стационарного этапа и на протяжении 12 месяцев послеоперационного периода, степень прогрессирования заболевания (в баллах) по клинической шкале оценки тяжести ХЗВ – VCSS (Venous Clinical Server-ity Score), а также динамические изменения маллеолярного объема нижних конечно- стей (см), для стандартизации которого использовали специальное устройство «Leg-O-Meter». Статистически значимой разницы исходной тяжести ХЗВ нижних конечностей у пациентов групп сравнения не было выявлено – 52,3 ± 2,5, 51,4 ± 2,7, и 51,6 ± 2,3 (t1-2 = 0,24, t1-3 = 0,21, t2-3 = 0,06) соответственно. При определении маллеолярного объема также не было зафиксировано статистически значимых различий в показателях отека нижних конечностей – 27,8 ± 0,8, 27,3 ± 0,8 и 27,6 ± 0,8 (t1-2 = 0,44, t1-3 = 0,18, t2-3 = 0,27) соответственно.
Статистическую обработку полученных цифровых результатов проводили методами вариационной статистики (парметриче-ский анализ) с помощью программы «Microsoft Excel». Полученные данные представлены в виде абсолютных и относительных величин, средних со стандартными отклонениями. Значимость различий количественных данных оценивали c использованием t-критерия Стьюдента, при оценке различия долей использовали критерий χ 2 . Критические значения уровня статистической значимости при проверке нулевой гипотезы принимали равными p ≤ 0,05.
Результаты и обсуждение
Статистически значимых различий между I, II и III группами сравнения по нозологии ( χ 21-2 = 0,004; p 1-2 = 0,995; χ 21-3 = 0,017; p 1-3 = 0,971; χ 22-3 = 0,004; p 2-3 = 0,995), анамнезу заболевания (t 1-2 = 0,14; p 1-2 = 0,891; t 1-3 = 0,08; p 1-3 = 0,923; t 2-3 = 0,07; p 2-3 = 0,934), длительности (t 1-2 = 0,21; p 1-2 = 0,829; t 1-3 = 0,14; p 1-3 = 0,891; t 2-3 = 0,09; p 2-3 = 0,912) и планиметрическим параметрам ТЯ (t 1-2 = 0,18; p 1-2 = 0,863; t 1-3 = 0,28; p 1-3 = 0,792; t 2-3 = 0,07; p 2-3 = 0,934), а также полу ( χ 21-2 = 0,008; p 1-2 = 0,993; χ 21-3 = 0,005; p 1-3 = 0,997; χ 22-3 = 0,026; p 2-3 = 0,975) и возрасту (t 1-2 = 0,2; p 1-2 = 0,831; t 1-3 = 0,4; p 1-3 = 0,689; t 2-3 = 0,21; p 2-3 = 0,823) не зафиксировано.
Патологический рефлюкс в системе глубоких вен выявлен у 28 (77,8 %) пациентов I группы, у 30 (85,7 %) во II и у 29 (85,3 %) в III группе. Статистически значимых различий не выявлено ( χ 21-2 = 0,402; p 1-2 = 0,513; χ 21-3 = 0,336; p 1-3 = 0,551; χ 22-3 = 0,002; p 2-3 = 0,981). Патологический рефлюкс по перфорантным венам был выявлен у 33 (91,7 %) пациентов I группы, у 30 (85,7 %) во II и у 32 (94,1 %) в III группе. Статистически значимых различий также не выявлено ( χ 21-2 = 0,629; p 1-2 = 0,432; χ 21-3 = 0,158; p 1-3 = 0,673; χ 22-3 = 1,336; p 2-3 = 0,257).
По данным КТ в области ТЯ суммарная толщина кожи и подкожной клетчатки уменьшалась у пациентов I группы до 6,3 ± 1,7 мм, II группы – до 7,0 ± 2,3 мм, III группы – до 5,8 ± 1,9 мм. Статистически значимых различий между группами не выявлено (t 1-2 = 0,24; p 1-2 = 0,812; t 1-3 = 0,2; p 1-3 = 0,842; t 2-3 = 0,4; p 2-3 = 0,621). Плотность подкожной клетчатки у пациентов I группы была увеличена (в норме плотность – 125,0 ± 3,04 HU) до 8,2 ± 2,8 HU, во II группе – до 7,1 ± 3,9 HU, в III группе – до 5,6 ± 3,5 HU. Статистически значимых различий также не зафиксировано (t 1-2 = 0,23; p 1-2 = 0,817; t 1-3 = 0,58; p 1-3 = 0,562;
t 2-3 = 0,29; p 2-3 = 0,786). Наблюдались характерные для выраженного липодерма-тосклероза изменения структуры подкожной клетчатки с ее фиброзом, оссифици-рованнием фасции и капсулы голеностопного сустава с прилегающим сухожилием.
Послеоперационный период у всех пациентов (n = 105) протекал без осложнений. Пациенты начинали самостоятельно передвигаться без дополнительной опоры на следующие сутки после операции. Специфических особенностей, обусловленных выполнением ST, SEPS и FT, у пациентов II и III групп не выявлено. Умеренно выраженный болевой синдром в области послеоперационных ран и забора кожного лоскута наблюдался у всех пациентов (n = 105) и купировался применением ненаркотических анальгетиков. В I группе болевой синдром, более выраженный в месте забора аутодермотрансплантата, сохранялся у 3 (8,3 %) пациентов до 8 послеоперационных суток. У 8 (22,8 %) пациентов II группы и у 7 (20,1 %) III группы он был наиболее выражен в области хирургического дебридмента, сохранялся до 6 суток. Необходимо отметить, что при довольно обширной раневой поверхности после проведения ST, уже на 1–2-е сутки после хирургического вмешательства у большей части пациентов II и III групп сравнения отмечалось быстрое снижение болевого синдрома, вплоть до его купирования. По данным УЗАС наиболее выраженное улучшение показателей венозной гемодинамики в нижних конечностях было зафиксировано у пациентов III группы. После проведения SEPS и FT объемная скорость венозного оттока составляла 236,51 ± 11,4 мл/мин. Это свидетельствует о значительном улучшении дооперационных показателей – 321,03 ± 2,38 мл/мин., а также объемной скорости венозного оттока у пациентов I и II групп – 276,02 ± 12,06 мл/мин.
У пациетов I группы только в 7 (19,4 %) наблюдениях было отмечено полное приживление кожного лоскута. Частичный некроз трансплантата наблюдался у 29
(80,6 %) пациентов I группы. Его средние размеры составили 67,1 ± 10,5 см2. При динамическом наблюдении было отмечено, что возникшие раневые дефекты не эпите-лизировались полностью у 3 (8,3 %) пациентов I группы. С нашей точки зрения, это объясняется отсутствем адекватной коррекции нарушений венозной гемодинамики с ликвидацией горизонтального венозного рефлюкса, а также оставлением на поверхности ТЯ измененных тканей, ухудшающих приживление аутотрансплантата. Во II группе отмечено возрастание наблюдений, что мы непрсредственно связываем с проведением ST, с полным приживлением аутодермотрансплантата – у 27 (77,1 %) пациентов, при снижении количества пациентов с частичным некрозом кожного лоскута – у 8 (22,9 %). При этом, его средние размеры статистически значимо отличались от I группы и составили 24,3 ± 4,8 см2. Большая часть трансплантата у этих пациентов II группы находилась в удовлетворительном состоянии и была сохранена. Возникшие дефекты эпителизировались в течение 42,4 ± 4,5 суток послеоперационного периода за счет разрастания эпителия с первично приживленных участков. В III группе также отмечено статистически значимое снижение числа наблюдений с частичным некрозом трансплантата – 7 (20,6 %) пациентов, по сравнению с I группой. Его средняя площадь составляла 22,4 ± 4,6 см2, а сроки эпителизации – 41,2 ± 4,6 суток. У остальных 27 (79,4 %) пациентов III группы отмечено полное приживление аутодермотрансплантата. Таким образом, полное приживление аутодермотрансплантата статистически значимо чаще отмечается у пациентов II и III групп по сравнению с I группой (χ21-2 = 23,674; p1-2 = 0,001; χ21-3= 25,173; p1-3 = 0,001; χ22-3 = 0,052; p2-3 = 0,826). Статистически значимой разницы между пациентами II и III групп не выявлено.
Средние сроки стационарного послеоперационного периода у пациентов групп сравнения соответственно составили 11,7 ± 1,8 суток, 9,3 ± 1,7 суток и 9,4 ± 1,8 суток. Полная эпителизация ТЯ у пациентов I группы была в 33 (91,7 %) наблюдениях достигнута на 49,4 ± 7,2 сутки. При этом, полная эпителизация ТЯ во II и III группах зафиксирована соответственно на 31,4 ± 4,7 и 32,1 ± 3,6 сутки послеоперационного периода. Таким образом, сроки эпителизации ТЯ статистически значимо меньше у пациентов II и III групп по сравнению с пациентами I группы (t 1-2 = 2,09; p 1-2 = 0,049; t 1-3 = 2,24; p 1-3 = 0,024; t 2-3 = 0,03; p 2-3 =0,763). Статистически значимой разницы между II и III группами не выявлено.
При контрольном осмотре через 12 месяцев рецидива ТЯ не было выявлено ни у одного пациента II и III групп и у 33 (91,7 %) пациентов I группы. Оценка эффективности проведенного лечения по шкале VCSS приведена в табл. 1.
Таблица 1. Динамическая оценка (в баллах) эффективности лечения пациентов (n = 105) клинического класса С6 по шкале VCSS
|
Группы пациентов |
Сроки наблюдения |
||||
|
До госпитализации (М ± σ ) |
На момент выписки (М ± σ ) |
Через 2 месяца (М ± σ ) |
Через 6 месяцев (М ± σ ) |
Через 12 месяцев (М ± σ ) |
|
|
I группа |
52,3 ± 2,5 |
49,1 ± 2,9 |
36,7 ± 4,3 |
29,4 ± 3,8 |
26,3 ± 3,5 |
|
II группа |
51,4 ± 2,7 |
53,1 ± 3,1 |
27,8 ± 3,8 |
17,9 ± 4,1 |
15,9 ± 3,7 |
|
III группа |
51,6 ± 2,3 |
52,8 ± 2,7 |
26,6 ± 4,7 |
15,8 ± 3,7 |
12,7 ± 2,5 |
|
t 1-2 -критерий |
0,24 |
0,94 |
1,55 |
2,06* |
2,04* |
|
t 1-3 -критерий |
0,21 |
0,93 |
1,59 |
2,56* |
3,16* |
|
t 2-3 -критерий |
0,06 |
0,07 |
0,20 |
0,38 |
0,72 |
Примечание: * – р < 0,05.
Статистически значимое уменьшение тяжести ХЗВ отмечалось у пациентов II и III групп по сравнению с пациентами I группы через 6 и 12 месяцев после операции. При контрольном осмотре через 12 месяцев было зафиксировано статистически значимое уменьшение маллеолярного объема оперированной конечности как во ІI (t = 3,6; р = 0,001) и III (t = 4,15; р = 0,001), так и в І (t = 2,2; p = 0,035) группах (табл. 2). Это свидетельствует о статически значимом уменьшении отечного сидрома.
Отсутствие рецидива ТЯ через 12 месяцев после применения ST с ППА свидетельствует об эффективности этих методов. Это согласуется с динамической оценкой W. Schmeller и Y. Gaber (1998) отдаленных результатов после применения послойной дерматолипэктомии в 75 наблюдениях у пациентов с рефрактерными персистирующими венозными ТЯ в течении двух лет. Согласно опубликованным результатам, рецидив ТЯ отсутствовал в 67 % наблюдений [15]. Аналогичную тенденцию зафиксировали H.-J. Hermanns, А. Hermanns и Р. Waldhausen (2011). Рецидив ТЯ отсутствовал в течение 3-х лет после ST в 79,2 % наблюдений [3]. Необходимо согласиться с мнением ряда флебологов, которые рекомендуют непременно сочетать хирургический дебридмент с коррекцией венозного оттока [12, 13]. А отсутствие рецидива ТЯ в отдаленном периоде после выполнения ST в 80 % наблюдений позволило ряду клиницистов считать ее методом выбора для хирургического лечения рефрактерных и персистирующих венозных ТЯ [11, 12]. Мы полностью согласны с авторами, утверждающими, что пересадка перфорированного аутодемотрансплантата на уже гранулирующую поверхность ТЯ менее эффективна. Остающиеся при этом на поверхности ТЯ измененные ткани являются основой для последующего рецидивирова-ния ТЯ [2, 12–14]. Кроме того, без предварительной этапной или одномоментной коррекции нарушений венозной гемодинамики, присущих ХВН, применение любых методов пластики ТЯ неэффективно, особенно в отдаленном периоде [2, 6, 8]. Сочетание ST, SEPS и FT является эффективным способом хирургической коррекции пациентов С6 клинического класса с персистирующими ТЯ и развитием CVCS, приводящим к устойчивому снижению подфасциального давления [12].
Заключение
Таким образом, применение хирургической коррекции нарушений венозной гемодинамики в сочетании с shave-therapy и пластикой перфорированным аутодермотрансплантатом является эффективным методом лечения пациентов с ХВН, осложненной персистирующими рефрактерными ТЯ. При выявлении CVCS оперативное вмешательство необходимо дополнять эндоскопической декомпрессионной фасциотомией.
Таблица 2. Динамические показатели маллеолярного объема (см) у пациентов (n = 105) с ХЗВ клинического класса С6 класса в послеоперационном периоде
|
Группы пациентов |
Сроки наблюдения |
||||
|
До госпитализации (М ± σ ) |
На момент выписки (М ± σ ) |
Через 2 месяца (М ± σ ) |
Через 6 месяцев (М ± σ ) |
Через 12 месяцев (М ± σ ) |
|
|
I группа |
27,8 ± 0,8 |
28,0 ± 0,9 |
25,7 ± 1,0 |
25,5 ± 0,6 |
25,8 ± 0,7 |
|
II группа |
27,3 ± 0,8 |
28,1 ± 1,1 |
25,4 ± 0,8 |
23,9 ± 0,5 |
24,1 ± 0,6 |
|
III группа |
27,6 ± 0,8 |
28,2 ± 0,7 |
24,8 ± 0,6 |
22,9 ± 0,8 |
23,1 ± 0,6 |
|
t 1-2 -критерий |
0,44 |
0,07 |
0,23 |
2,05* |
2,18* |
|
t 1-3 -критерий |
0,18 |
0,18 |
0,77 |
2,60* |
2,93* |
|
t 2-3 -критерий |
0,27 |
0,08 |
0,60 |
1,06 |
1,18 |
Примечание: * – р < 0,05.
Список литературы Хирургическая коррекция рефрактерных венозных трофических язв
- Kotelnikov G.P., Losev 1.1., Sizonenko Ya.V., Katorkin S.E. Osobennosti diagnostiki i taktiki lecheniya patsiyentov s sochetannym porazheniyem oporno-dvigatelnoy i venoznoy sistem nizhnikh konechnostey. Novosti khirurgii. 2013;21(3):42-53. (In Russ). http://dx.doi.org/10.18484/2305-0047.2013.3.42
- Shevchenko Yu.L., Stoyko Yu.M., Gudymovich V.G., Ivanov A.K. Kompleksny podkhod v lechenii obshirnykh troficheskikh yazv goleney v mnogoprofilnom statsionare. Vestnik eksperimentalnoy i klinicheskoy khirurgii. -Vestnik of experimental and clinical surgery. 2014;7(3):221-27. (In Russ). http://dx.doi.org/10.18499/2070-478X-2014-7-3-221-227
- Hermanns H.-J., Hermanns А., Waldhausen Р. Therapy-resistant Ulcera cruris et pedis in ludicrous foot deformity. Phlebologie. 2011;40(6):334-336.
- Katorkin S.E., Losev I.I., Sizonenko Y.V. Patients with venous and musculoskeletal disorders of the legs: functional and clinical methods for diagnosis and therapy. Vasomed. 2014;26(1):6-8.
- Dibirov M.D., Magdiyev A.Kh. Lecheniye venoznykh troficheskikh yazv v starcheskom vozraste. Flebologiya. 2016;10(4):224-228. (In Russ). http://doi.org/10.17116/flebo2016104224-228
- Katorkin S.E., Zhukov A.A., Kushnarchuk M.Yu. Kombinirovannoye lecheniye vazotroficheskikh yazv pri khronicheskoy venoznoy nedostatochnosti nizhnikh konechnostey. Novosti khirurgii. 2014;22(6):701-709. (In Russ). http://doi.org/10.18484/2305-0047.2014.6.701
- Braun S., Jünger M. Methoden des Wunddebridements bei venösem Ulcus cruris. Phlebologie. 2003;32(6):152-156.
- Schwahn-Schreiber C. Surgery of ulcus cruris venosum. Phlebologie. 2010;39(3):156-162.
- Stoyko Yu.M., Kirienko A.I., Zatevahin I.I. Russian clinical guidelines for the diagnosis and treatment of chronic venous diseases. Flebologiya. 2018;12(3):146-240. (In Russ).
- Katorkin S., Sizonenko Y., Nasyrov M. Photodinamic therapy in the treatment of trophic leg ulcer. Vasomed. 2015;27(2):82-84.
- Hermanns H.-J., Schwahn-Schreiber Ch., Waldermann F. Importance of surgical treatment in venous leg ulcers. Consensus document and therapeutical instructions of the study-group Surgical Treatment in Venous Leg Ulcers. Phlebologie. 2006;35(4):199-203.
- Stoffels I., Dissemond J., Klode J. Modern wound surgery - Surgical treatment options. Phlebologie. 2013;42(4):199-204. http://doi.org/10.12687/phleb2149-4-2013
- Sushkov S.A., Kukhtenkov P.A., Khmelnikov V.Ya. Pervy opyt primeneniya posloynoy dermatolipektomii (shave-therapy) pri lechenii khronicheskoy venoznoy nedostatochnosti. Novosti khirurgii. 2007;15(1):53-57. (In Russ).
- Hermanns H.-J., Gallenkemper G., Kanya S., Waldhausen P. Die Shave-Therapie im Konzept der operativen Behandlung des therapieresistenten Ulcus cruris venosum Aktuelle L. Phlebologie. 2005;34(4):209-215.
- Schmeller W., Gaber Y. Die Spätergebnisse nach Shave-Therapie sind abhängig vom Zustand des tiefen Venensystems. Phlebologie. 1998;27(6):195-200.


