Хирургическая техника катетеризации печеночной артерии при селективной внутриартериальной химиотерапии
Автор: Ермаков Анатолий Викторович, Зикиряходжаев Азиз Дильшодович, Лазутина Татьяна Николаевна, Леонтьев Алексей Викторович, Волченко Надежда Николаевна, Беляков Михаил Михайлович, Каприн Андрей Дмитриевич, Костин Андрей Александрович
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 (19), 2016 года.
Бесплатный доступ
Изучены возможности и отработана методика использования радиофармпрепарата «Технефит 99тТс» для определения и биопсии сторожевых лимфатических узлов с их морфологическим исследованием при выполнении операций у больных с начальными стадиями злокачественных новообразований на модели рака молочной железы и меланомы кожи. Определены оптимальная дозировка активности, объем и особенности введения радиоактивного коллоида для возможного исследования и биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99тТс» у больных со злокачественными новообразованиями различных локализаций на модели рака молочной железы и меланомы кожи туловища и конечностей с наилучшими показателями в 1 серии исследования. При изучении возможности срочного гистологического и цитологического исследования сторожевых лимфатических узлов в диагностике метастазов наиболее оптимально использование сочетания обоих методов для получения наиболее достоверных результатов. При отработке методики и изучении возможности использования радиофармпрепарата «Технефит 99тТс» для определения и биопсии сторожевых лимфатических узлов с их морфологическим исследованием при выполнении операций у больных с начальными стадиями злокачественных новообразований не получено результатов, отвечающих характеристикам зарубежных аналогов, что свидетельствует о невозможности его использования в диагностике метастазов в лимфатических узлах.
Рак молочной железы, коллоидные радиофармпрепараты, биопсия сторожевого лимфатического узла
Короткий адрес: https://sciup.org/140222661
IDR: 140222661 | DOI: 10.18027/2224-5057-2016-3-63-76
Текст научной статьи Хирургическая техника катетеризации печеночной артерии при селективной внутриартериальной химиотерапии
АКТУАЛЬНОСТЬ
Для проведения регионарной химиотерапии при локализации патологического процесса в печени используют введение лекарственных препаратов через собственную печеночную артерию, разбужированную пупочную вену, воротную вену. Проведение регионарной химиотерапии через названные сосуды позволяет создать большую концентрацию противоопухолевых лекарственных препаратов в печени, чем при проведении системной химиотерапии [1, 3]. Большая концентрация противоопухолевых лекарственных препаратов в печени при проведении регионарной химиотерапии по сравнению с системной повышает повреждающий эффект химиопрепаратов на опухолевые клетки [2].
В литературе описан способ лечения метастатического поражения печени, направленный на образование временных высоких доз цитостатиков в органе, которые включают введение катетера в собственную печеночную артерию через желудочно-сальниковую артерию, путем выделения последней, перевязки проксимального конца и введение катетера через дистальный конец с дальнейшим проведением в собственную печеночную артерию, введения через катетер отдельных цитостатиков и их соединений фракциями или капельными длительными курсами. После катетеризации катетер выводится через контрапертурный прокол на коже (Гаспарян С. А. и соавт. [4, 5, 9, 10].
Недостатки этого способа лечения метастазов в печень состоят в том, что при извлечении катетера после окончания лечения, либо тромбоза последнего отсутствуют визуальные и пальторные методы определения наличия кровотечения из катетеризируемого сосуда, а так как основные стволы этих артерий принадлежат к сосудам 3 и 4 уровня и стволы артерий могут быть расположены в конгломерате метастатически пораженных лимфатических узлов, то развившееся кровотечение может быть смертельно опасным.
К тому же после извлечения катетера при данном способе нередко образуются гематомы, при вторичном инфицировании которых возникает масса осложнений, результаты лечения которых остаются неудовлетворительными [7]. Малиновским Н. Н. и Северцевым А. Н. описан способ регионарной химиотерапии печени, при котором непосредственно катетеризируют собственную печеночную артерию с последующим введением в нее химиопрепаратов [6, 12, 13]. Недостатком описанного способа является его высокая травматичность и большая опасность развития кровотечения, так как сосудистая культя после извлечения катетера остается в свободной брюшной полости. Попытки эмболизации артерии перед извлечением катетера не всегда позволяют добиться ожидаемого результата вследствие реканализации сосуда [8, 11, 13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Разработка хирургических доступов к печеночной артерии для интраоперационной катетеризации с последующей селективной внутриартериальной химиотерапией у пациентов с метастазами в печень.
МАТЕРИАЛЫ И МЕТОДЫ
Неоднократные попытки сопоставления классификации N. Michels (1955) с хирургическими этапами катетеризации печеночной артерии привели к необходимости обобщения и упрощения анатомических вариантов, что представлено в классификации Рис. 1: при катетеризации печеночной артерии принципиальное значение имеют 4 типа артериального кровоснабжения. Многочисленные анатомические варианты артериального кровоснабжения печени скорее представляют теоретический, нежели практический интерес.
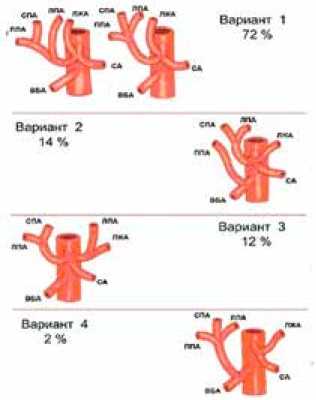
Рис. 1. Упрощенные типы артериального кровоснабжения (приведено из монографии проф. Гранова)
(а)
(б)
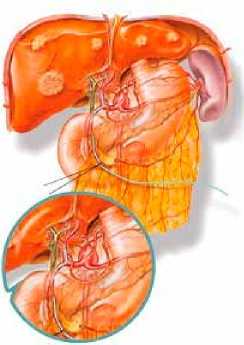
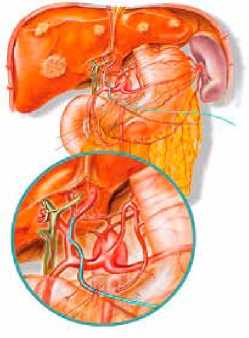
Рис. 2. Варианты катетеризации печеночной артерии через правую желудочно-сальниковую артерию (а) и правую желудочную (б) артерию
Согласно приведенной классификации, типичное отхождение правой, средней и левой печеночных артерий от общей печеночной артерии встречается практически в 72%. Этот наиболее простой вариант кровоснабжения печени позволяет выполнять катетеризацию через правую желудочно-сальниковую артерию – первый тип кровоснабжения. Разработан и внедрен в клиническую практику способ катетеризации печеночной артерии через правую желудочно-сальниковую артерию, который позволяет быстро и без риска кровотечения установить катетер при 1 типе кровоснабжения печени.
Длина препарированной части сосуда составляет в среднем от 5 до 7 см. После катетеризации собственной печеночной артерии выводят культю артерии с катетером через сформированный тоннель в круглой связке печени в контрапертурный прокол в правом подреберье и оставляют в таком состоянии на весь срок лечения, либо устанавливают подкожный артериальный порт.
Таким образом, с одной стороны обеспечивают возможность транспорта противоопухолевых препаратов непосредственно к органу-мишени, а с другой стороны отграничивают препарированный артериальный сосуд от свободной брюшной полости.
Разработан способ катетеризации печеночной артерии через правую желудочную артерию. Данный хирургический прием используют при 2 и 3 типах артериального кровоснабжения печени по разработанной классификации. Второй и третий варианты артериального кровоснабжения печени предусматривают необходимость раздельной катетеризации правой и левой долей печени с установкой двух катетеров. Второй по частоте вариант артериального кровоснабжения печени – это отхождение правой печеночной артерии от верхней брыжеечной артерии (частота около 14%). При данном анатомическом варианте имеется 2 артериальных источника кровоснабжения, поэтому катетеризацию артериальных сосудов правой доли производят через правую желудочно-сальниковую артерию, а артериальный доступ к левой доле осуществляют через правую желудочную артерию.
Для третьего варианта типичным является отхождение правой и средней печеночных артерий от общей печеночной артерии, при этом левая доля получает артериальное кровоснабжение от левой желудочной артерии (частота 12%). При третьем типе кровоснабжения выполняется катетеризация правой печеночной артерии через правую желудочно-сальниковую артерию, левой печеночной артерии через правую желудочную артерию либо через ветви левой желудочной артерии.
Четвертый тип артериального кровоснабжения встречается достаточно редко (частота до 2%). Он характеризуется отхождением общей печеночной артерии от верхней брыжеечной. В этом случае возможна катетеризация через
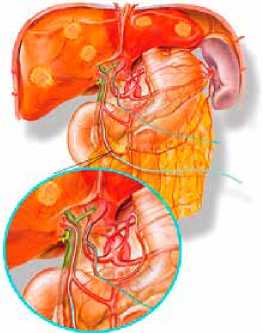
Рис. 3. Вариант раздельной катетеризации правой и левой долей печени с установкой двух катетеров
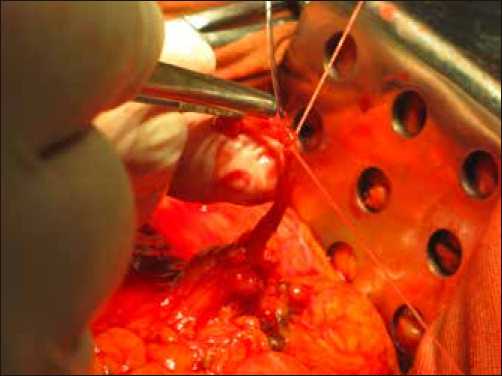
Фото 1. Расположение катетера в собственной печеночной артерии контролируют пальпаторно. Как правило длина катетера составляет 12–14 см
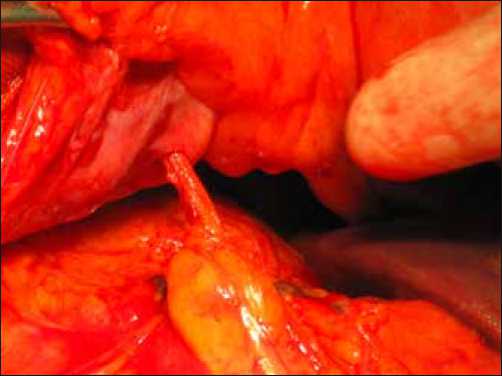
Фото 2. Выведение катетера на переднюю брюшную стенку через круглую связку печени обеспечивает возможность удаления катетера в последующем (после завершения химиотерапии) без повторной операции
правую желудочно-сальниковую артерию с установкой одного катетера.
Проводят катетер из правой желудочно-сальниковой артерии через желудочно-двенадцатиперстную артерию в собственную печеночную артерию.
Конец мобилизованной правой желудочно-сальниковой артерии с введенным в нее катетером с помощью подтягивания за длинные концы лигатур и фиксации последних в коже выводят на переднюю брюшную стенку через сформированный тоннель в контрапертурный прокол.
Во всех случаях катетеризации сосудов интраоперационно производился хроматоскопический контроль правильности установки катетера, для чего в установленный и фиксированный катетер медленно вводился 1% раствор метиленовой сини, при этом в качестве растворителя применялся раствор глюкозы 5%. Как правило, через 10–15 секунд наступает окрашивание зоны, кровоснабжаемой катетеризированным сосудом. При необходимости установка катетера корректируется.
РЕЗУЛЬТАТЫ
Селективная внутриартериальная химиотерапия по описанному методу проведена у 326 пациентов с метастазами в печень колоректального рака. В процессе или после лечения осложнения возникли у 17 больных, что составляет 5,2%. При определении степени токсичности реакций была использована шкала NCI – CTC (1999 г.).
Токсические реакции 1 степени были выявлены у 5 (5,8%) больных, 2 степени – у 7 (8,12%) больных, 3 степени – у 4 (4,64%) больных, а 4 степени – у 1 (1,16%) больного, соответственно.
Наибольшее количество осложнений (8–47%) было связано с общетоксическим действием химиопрепаратов. У 6 больных (35,3%) возникли осложнения, связанные с пребыванием катетера в сосуде, причем у половины отмечался тромбоз катетера в раннем послеоперационном периоде. Артериит, стойкий ангиоспазм, пролежень сосуда, местные реакции в виде дерматита отмечены в единичных наблюдениях. В связи с некорректной установкой внутриартериального катетера в единичном случае нами был зафиксирован ожог мягких тканей по ходу поясничных артерий, что по данным литературы является редким наблюдением.
В качестве клинического примера эффективности активной хирургической тактики приводим результаты компьютерной томографии пациента К. Функциональные пробы (класс В по Чайлд-Пью как следствие кардиогенного цирроза печени) не позволили выполнить правостороннюю гемигепатэк-томию, вследствие чего была произведена катетеризация печеночной артерии с одномоментной криодеструкцией метастатического узла 6–7 сегментов правой доли печени.
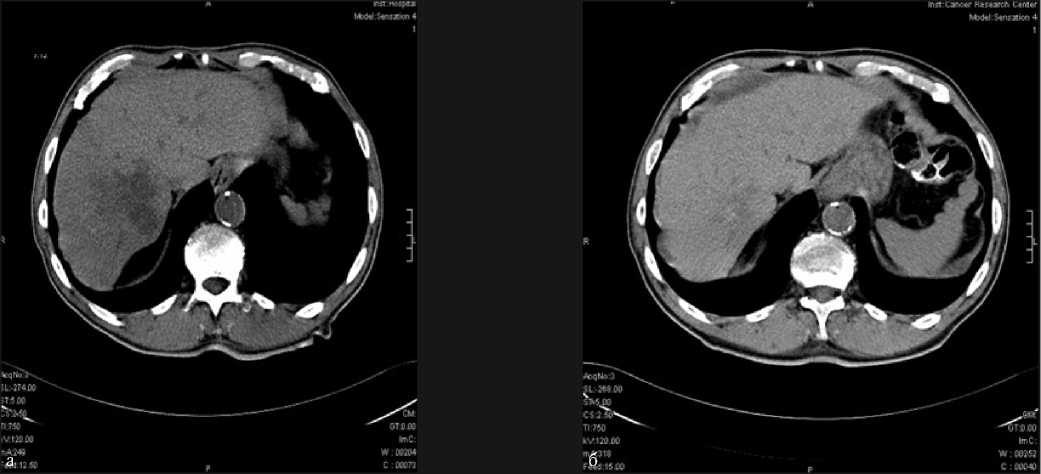
Рис. 4. Аксиальные компьютерные томограммы больного К. 64 лет. Метастаз рака поперечной ободочной кишки: а – метастаз в 7 сегменте печени до лечения, б – снимок спустя 6 недель после 3 курсов внутриартериальной ПХТ и криодеструкции. Уровень РЭА уменьшился до 20,1 нг/мл
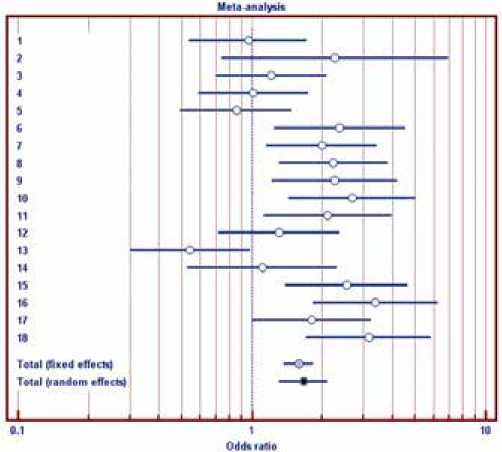
Рис. 5. Форест-диаграмма сравнения пятилетней выживаемости по литературным данным с собственными результатами: белыми кругами отмечены результаты сопоставления для литературного источника, серым кругом – обобщенный результат в моделе фиксованных эффектов, черным кругом – обобщенный результат в моделе случайных эффектов (приведено значение ШВ и 95% ДИ)
При проведении сравнения обобщенных отдаленных результатов рассчитывался показатель ШВ = (Шансы пережить 5 лет, полученные в нашем исследовании/Шансы пережить 5 лет, полученные в литературном источнике) для каждого литературного источника. Значение ШВ>1 указывает на преимущества предложенной методики, ШВ<1 – преимущества методики литературного источника. Для обобщения результатов (Total Effect) проводился анализ гомогености результатов, полученных в литературных источниках: при гомогености для обобщения использовалась модель фиксированного эффекта, при гетерогености – модель случайного эффекта. На рис. 5 приведена форест-диаграмма ШВ. При проверке гомогености результатов, приведенных в литературных источниках, нулевая гипотеза отбрасывается (p<0,001), для проведения оценки используется результат, полученный в моделе случайного эффекта. Установлено, что пятилетняя выживаемость больных, подвергнутых селективной внутриартериальной полихимиотерапии, статистически значимо выше результатов, приведенных в литературных источниках (p<0,05), обобщенное значение ШВ=1,7 (95% ДИ 1,3–2,1).
ВЫВОДЫ
Предложенный метод лечения больных позволяет реализовать селективную внутриартериальную полихимиотерапию у больных с различными вариантами кровоснабжения печени. Целесообразно во всех случаях производить блочную лимфодиссекцию ворот печени с обнажением структур чревного ствола и холецистэктомией.
Предложенная последовательность действий при выполнении селективной внутриартериальной полихимиотерапии позволяет одновременно учитывать анатомические варианты, а также избегать возможных ошибок и осложнений.
СЛОВА БЛАГОДАРНОСТИ фессору Седакову И. Е. за ценные замечания в процессе осуществления научной и практической части работы Автор считает своим долгом выразись слова благодар- и всестороннюю поддержку.
ности Академику АМНУ профессору Бондарю Г. В. и про
Список литературы Хирургическая техника катетеризации печеночной артерии при селективной внутриартериальной химиотерапии
- Blakeslee D.B., Becker G.D., Simpson G. T. Lymphoscintigraphy of the neck. Otolaryngol Head and Neck.//Surg. Oncol -1985,-V. 93 -P. 361-365.
- Krag D. N., Weaver D. L., Alex J. C., Fairbank J.T. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe//Surg. Oncol -1993-V. 101.-P. 335-339.
- Alazraki N. P., Styblo T., Grant S. F., Cohen C., Larsen T. Aarsvold J. N. Sentinel node staging of early breast cancer using lymphoscintigraphy and the intraoperative gamma-detecting probe//Semin. Nucl. Med-2000.-V.30-P. 56-64.
- Ames F., Laronga C., Ross M., Alderfer J. Tumor Location and Nodal Drainage Patterns on Lymphoscintigraphy Are Predictors of Axillary Sentinel Lymph Node Status//J. of ASCO -2001.-V.20.-P. 40-43.
- Романов И.С., Оджарова A.A., Ротин Д.Л., Ненушкин М.И. «Сторожевые» лимфатические узлы при плоскоклеточном раке головы и шеи.//Вестник оториноларингологии.-2007,-№6.-С. 14-17
- Kern K.A., Rosenberg R. J. Preoperative lymphoscintigraphy during lymphatic mapping for breast cancer: improved sentinel node imaging using subareolar injection of technetium 99m sulfur colloid.//J Am. Coll. Surg.-2000.-V. 191.-P. 479-489.
- Прилепо Ю. В. «Способ диагностики метастазирования при раке молочной железы или меланоме».//Патент РФ -Ns 2195871.-2003.
- Tu Weixia, Denizot B. Synthesis of small-sized rhenium sulfide colloidal nanoparticles.//J. Colloid Interface Sei -2007,-V. 310,-P. 167-170.
- Khalkhali I., Cutrone J. A., Mena I. J. Scintimammography: the complementary role of Tc-99m Sestamibi prone breast imaging for the diagnosis of breast carcinoma//Radiology-1995.-V.196,-P. 421-426.
- Tsopelas Ch. 99mTc-Labeled and Unlabeled Antimony Trisulfide and Rhenium Sulfide Colloids Intended for LymphoscintigraphicApplication.//J. Nucl. Med-2001 -V. 42,-P 460-466.
- Weiss M., Kunte Ch., Schmid R.A., Konz B. Sentinel node mapping in patients with malignant melanoma using melanomaTc-99m colloidal rhenium sulfide.//J. Clin. Nucl. Med.-2003.-V 28,-P. 379-384.
- Mochiki E., Kuwano H., Kamiyama. Y., Aihara R., Nakabayashi T., Endo К. Sentinel lymph node mapping with technetium-99m colloidal rhenium sulfide in patients with gastric carcinoma.//Amer. J. Surg.-2006 -191.-P. 465-469.
- Nunez, Eutimio Gustavo Fernandez/Faintuch, Bluma Linkowski/Teodora, Rodrigo/Wiecek D. P., Martinelli J. R., Da Silva N. G., Castanheira C. E., Pasqualini R. Influence of colloid particle profile on sentinel lymph node uptake.//J. Nucl. Med. Biol.-2009,-V 36,-P. 741-747.
- Jimenez I. R., Roca M., Vega E., Garda M. L., Benitez A., Bajén M. Particle sizes of colloids to be used in sentinel lymph node radiolocalization.//J. Nucl.Med. Commun.-2008,-V 29-P. 166-172.
- Bensimhon L., Métayé T., Guilhot J., Perdrisot R. Influence of temperature on the radiochemical purity of 99mTc-colloidal rhenium sulfide for use in sentinel node localization.//J. Nucl. Med. Commun.-2008,-V 29,-P. 1015-1020.
- Свешников K. A., Русейкин Н. С. Скорость движения лимфы в здоровой и травмированной конечностях.//Современные проблемы науки и образования -2008-№2-С. 22-28.
- Панченков P.T., Ярема И.В., Сильманович H.H. Лимфостимуляция. М.: Медицина. 1986.237 с
- Koizumi M., Nomura E., Yamada Y. et al. Sentinel node detection using 99mTc-rhenium sulphide colloid in cancer patients: evaluation of 1 day and 2 day protocols and a dose-finding study. Nucl Med Commun 2003; 24: 663-670
- Mirzaei S., Rodrigues M., Hoffmann B. et ai. Sentinel lymph node detection with large human serum albumin colloid particles in breast cancer. Eur.J.Nucl.Med.Mol.Imaging 2003; 30: 874-878.
- Krízová H., Wald M., Strnad P. et al. Detection of the sentinel node in breast carcinoma using method of a single subcutaneous injection of radiopharmaceutical. Neoplasma 2004; 51:44-48.


