Хирургические операции на корне аорты в условиях работающего сердца: описание серии случаев
Автор: Марченко А.В., Мялюк П.А., Петрищев A.А., Самошина Ф.Б., Андрианова А.А., Белов В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.40, 2025 года.
Бесплатный доступ
Цель: на примере операций, проведенных в клинике с марта по ноябрь 2024 г., описать методику оперативного вмешательства на аорте и аортальном клапане в условиях работающего сердца при постоянной антеградной коронарной перфузии миокарда и / или при комбинации ее с кардиоплегической остановкой сердца; а также оценить эффективность данного способа защиты миокарда и возможности его дальнейшего применения в аортальной хирургии. Материал и методы. С марта по ноябрь 2024 г. в ФЦССХ имени С.Г. Суханова Минздрава России (г. Пермь), в плановом порядке прооперированы 12 пациентов. Средний возраст пациентов составил 57,75 ± 9,8 лет; мужчин было 10 (83,7%), женщин – 2 (16,3%). Всем им было выполнено протезирование аорты на работающем сердце: супракоронарное протезирование аорты (1 пациент); супракоронарное протезирование аорты и протезирование аортального клапана (1 пациент); супракоронарное протезирование аорты и аортокоронарное шунтирование (АКШ) с использованием радиочастотной аблации (РЧА) (1 пациент); операция Бенталла – Де Боно (1 пациент); операция Дэвида (7 пациентов). Двум пациентам оперативное лечение было проведено из мини-J-стернотомии. Одному пациенту также было выполнено коронарное шунтирование (КШ). Среди пациентов было двое с ранее перенесенными операциями (АКШ и малоинвазивное прямое шунтирование коронарных артерий (MIDCAB)). В исследовании использованы два варианта методики: при первом варианте оперативное вмешательство проходило на работающем сердце с применением постоянной антеградной коронарной перфузии миокарда (8 пациентов); второй вариант заключался в комбинировании кардиоплегической остановки сердца с коронарной перфузией миокарда на работающем сердце (4 пациента). Результаты. За период исследования ни один пациент не умер. Показатели послеоперационных параметров (кардиомаркеры, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ)) оставались в пределах нормы. Был отмечен ряд осложнений: один случай фибрилляции предсердий, купированный в течение первых суток, один случай трепетания желудочков интраоперационно с восстановлением ритма после дефибрилляции, один случай ревизии средостения с целью гемостаза. Заключение. Учитывая удовлетворительные интраи послеоперационные данные хирургического лечения пациентов с патологией аорты на работающем сердце с параллельным искусственным кровообращением, а также отсутствие повышения показателей кардиомаркеров и других критериев повреждения миокарда в периоперационном периоде, мы считаем данную методику применимой в хирургической практике. Дальнейшее развитие и использование в аортальной хирургии методики в условиях работающего сердца с применением постоянной антеградной коронарной перфузии миокарда позволит снизить стрессовую нагрузку на сердце во время операции, минимизировать риски послеоперационных осложнений и ускорить сроки реабилитации пациента.
Аортальная хирургия, параллельное искусственное кровообращение, работающее сердце, постоянная антеградная коронарная перфузия
Короткий адрес: https://sciup.org/149148593
IDR: 149148593 | УДК: 616.12-008.64:616.126.52-089.819 | DOI: 10.29001/2073-8552-2025-40-2-159-167
Текст научной статьи Хирургические операции на корне аорты в условиях работающего сердца: описание серии случаев
Аневризма аорты подразумевает под собой расширение любой части аорты, в том числе ее восходящего отдела, из-за постоянного давления крови на ослабленную и уязвимую стенку сосуда, так как в последней развиваются дегенеративные изменения медиального слоя стенки. На данный момент хирургическая коррекция аневризмы грудной аорты, включая ее восходящую часть, является единственным эффективным способом профилактики острого аортального синдрома. Помимо этого актуален вопрос о консервативной коррекции процессов внутри стенки сосуда, направленной на предотвращение развития данного заболевания [1].
Хирургическое лечение аорты требует тщательной предоперационной подготовки, кропотливой работы хирурга интраоперационно и слаженного наблюдения за пациентом реаниматологами в послеоперационном периоде. Количество операций на аорте в мире с каждым годом имеет тенденцию к увеличению. Несмотря на то, что технологическое обеспечение при операциях на аорте постоянно совершенствуется, хирурги часто встречаются с различными осложнениями во время операций на корне и восходящей аорте в связи с длительной остановкой кровообращения и продолжительным искусственным кровообращением.
Одной из причин высокого процента послеоперационных осложнений в аортальной хирургии является ишемическое повреждение миокарда при длительной кардиоплегической остановке миокарда. Даже современные вариации кардиоплегических растворов не обеспечивают стопроцентной защиты миокарда. Ишемические повреждения возникают во время длительной остановки коронарного кровообращения и усиливаются после возобновления коронарной реперфузии [2]. При кардиоплегической остановке сердца – ишемии миокарда – в первую фазу («ожидание») происходит угнетение дыхательной цепи в митохондриях в кардиомиоцитах. Используя накопленный кислород, миокард еще может функционировать без повреждений. При истощении кислородного резерва наступает вторая фаза («выживание») – переключение аэробного механизма на анаэробный.
Анаэробный обмен восполняет лишь одну треть необходимой миокарду энергии, а недоокисленные продукты метаболизма изменяют кислотно-щелочную среду, вызывая клеточный ацидоз. Прекращается выработка энергии, развивается дефицит аденозинтрифосфата, изменяется проницаемость мембран для ионов кальция, натрия, водорода. В эту фазу миокард уже претерпевает ишемические изменения в виде снижения сократительной функции, но эти изменения являются обратимыми. В третьей фазе («повреждение и восстановление»), начинающейся через 10–20 мин кардиоплегической остановки, накопление и избыток кальция в клетках провоцируют гибель кардиомиоцитов и развитие участков некроза миокарда. На этапе обратимых повреждений менее выраженными осложнениями являются временное снижение фракции выброса левого желудочка и развитие аритмий. Более критичным является так называемое «каменное сердце», которое может развиться в связи с накоплением в кардиомиоцитах кальция и уменьшением способности к расслаблению [2]. Кроме этого, длительное искусственное кровообращение часто приводит к продленной искусственной вентиляции легких в отделении реанимации, что в свою очередь вызывает респираторные осложне- ния. До сих пор не существует достоверно эффективных интраоперационных методик защиты легких при кардиохирургических операциях [4].
Еще одна распространенная причина осложнений – это неконтролируемое кровотечение, связанное с длительно функционирующим искусственным кровообращением, гипотермическим циркуляторным арестом, сложным комбинированным оперативным вмешательством. Даже при правильно выполненной технике оперативного вмешательства и использовании всего допустимого резерва медикаментозной терапии кровотечение у таких пациентов часто бывает трудно остановить в течение длительного и тщательного гемостаза [5].
Частота послеоперационных осложнений и относительно высокая летальность при открытой аортальной хирургии с кардиоплегической остановкой сердца вынуждают сердечно-сосудистых хирургов искать альтернативные варианты для снижения «стресса» сердца во время оперативного вмешательства, сокращения времени искусственного кровообращения и времени операции, снижения объема кровопотери и уменьшения рисков развития ишемических повреждений.
Цель исследования: приобретение опыта аортальной хирургии на работающем сердце, анализ результатов и эффективности оперативного вмешательства без кардиоплегической остановки или ее минимализации.
Материал и методы
За период с марта по ноябрь 2024 г. в нашем центре были прооперированы 12 пациентов с патологией аорты, которым было выполнено протезирование аорты и аортального клапана на работающем сердце с параллельным искусственным кровообращением с применением тепловой кровяной антеградной перфузии миокарда. Всем пациентам, включенным в исследование, было проведено плановое протезирование восходящего отдела аорты с различными вариантами реконструкции корня аорты и сочетанными операциями на сердце. Средний возраст пациентов, среди которых было 10 мужчин (83,7%) и 2 женщины (16,3%), составил 57,75 ± 9,8 лет. Были проведены следующие виды операций: супракоронарное протезирование аорты (1 пациент), супракоронарное протезирование аорты и протезирование аортального клапана (1 пациент), супракоронарное протезирование аорты и аортокоронарное шунтирование (АКШ) с использованием радиочастотной аблации (РЧА) (1 пациент), операция Бенталла – Де Боно (1 пациент), операция Дэвида (7 пациентов, включая одного пациента с имплантацией гомографта), таблица 1.
Двум пациентам оперативное лечение проводилось из мини-J-стернотомии. Одному пациенту также выполнялось коронарное шунтирование (КШ). Среди пациентов было двое с ранее перенесенными операциями (АКШ и малоинвазивное прямое шунтирование коронарных артерий (MIDCAB)). В исследовании использованы два варианта методики: при первом варианте оперативное вмешательство проходило на работающем сердце с применением постоянной антеградной коронарной перфузией миокарда (8 пациентов); второй вариант заключался в комбинировании кардиоплегической остановки сердца с коронарной перфузией миокарда на работающем сердце (4 пациента).
По данным эхокардиографии (ЭхоКГ), у всех пациентов отмечалась удовлетворительная функция миокарда
|
Таблица 1 . Оперативные вмешательства на аорте на работающем сердце Table 1 . Surgical interventions on the aorta on a beating heart |
|
|
Название операции |
Количество пациентов |
|
Операция Дэвида (в т. ч. гомографт) |
7 |
|
Операция Дэвида + КШ |
1 |
|
Операция Бенталла Де Боно |
1 |
|
Супракоронарное протезирование + протезирование аортального клапана |
1 |
|
Супракоронарное протезирование + КШ + РЧА |
1 |
|
Супракоронарное протезирование |
1 |
|
Всего |
12 |
Примечание: КШ – коронарное шунтирование.
левого желудочка, у 3 пациентов выраженная регургитация на аортальном клапане, у 2 пациентов выраженный стеноз аортального клапана (табл. 2).
Методика операции
Всем пациентам доступ был осуществлен через срединную стернотомию, 10 пациентам выполнена полная стернотомия, 2 пациентам J-стернотомия по 4-е межреберье. Подключение аппарата искусственного кровообращения: канюляция аорты для артериальной перфузии производилась в дугу на уровне брахиоцефального ствола, венозная двухпросветная канюля устанавливалась в правое предсердие. Дополнительная артериальная линия для тепловой антеградной артериальной перфузии миокарда монтировалась через дополнительный ролик аппарата искусственного кровообращения. К этой линии присоединялась разводка из четырех гибких канюль для антеградной артериальной перфузии через устья коронарных артерий. После начала нормотермического искусственного кровообращения производилось выделение восходящей аорты и корня аорты. Затем выделялись устья левой и правой коронарной артерии. Устья «обходили» силиконовыми держалками, после чего их брали на турникеты (рис. 1).
После выделения корня и устьев коронарных артерий накладывали зажим на аорту, выполнялась аортотомия. Затем в устья левой и правой коронарной артерии устанавливались гибкие канюли, затягивались турникетами с силиконовыми держалками, после чего начиналась артериальная коронарная перфузия (поток 300 мл/мин, среднее давление перфузии – 80 мм рт. ст.) (рис. 2).
Следующим этапом выполнялась мобилизация аорты, выкраивание «кнопок» устьев левой и правой коронарных артерий. Проводилось протезирование корня аорты по различным методикам: имплантация клапансодержа-щего кондуита по методике Бенталла Де Боно, реимплантация аортального клапана в сосудистый протез по методике Дэвида, одному пациенту была выполнена имплантация аортального гомографта. После реконструкции корня аорты осуществлялась реимплантация устьев коронарных артерий. Для удобства вначале выполнялась задняя губа анастомоза левой коронарной артерии в протез или гомографт обвивным швом монофиламентной нитью 6-0 (рис. 3а). Затем проводилась переканюляция левой коронарной артерии другим гибким катетером, который заранее был пропущен внутри сосудистого проте- за или гомографта. После этого заканчивалась передняя губа анастомоза левой коронарной артерии (рис. 3б).
В той же последовательности проводилась реимплантация правой коронарной артерии. Таким образом, два катетера для коронарной перфузии левой и правой коронарной артерии проходили внутри сосудистого протеза или гомографта (рис. 4). Завершительным этапом выполнялся анастомоз сосудистого протеза с аортой с последующей профилактикой воздушной эмболии, удалением гибких катетеров, снятием зажима с аорты.
При повторных операциях или при выраженном кальцинозе корня и устьев коронарных артерий могут возникнуть сложности при выделении устьев коронарных артерий. В таких ситуациях мы применяем комбинированную методику плегии-перфузии миокарда. Если при выделении коронарных артерий существует риск повредить сами артерии, то первым этапом выполняется обычная тепловая кровяная антеградная селективная кардиоплегия. На остановленном сердце выделяются устья коронарных артерий, которые обходятся силиконовыми держалками на турникетах. После этого по описанной выше методике в устья коронарных артерий устанавливаются гибкие канюли, начинается антеградная кровяная перфузия миокарда (поток 300 мл/мин, среднее давление перфузии 80 мм рт. ст.). Восстановление сердечной деятельности происходит обычно на 2-й мин, показатели электрокардиографии (ЭКГ) возвращаются к исходным к 5-й мин. Данная методика позволяет минимизировать длительность кардиоплегического ареста и одновременно уменьшать риски при выделении устьев коронарных артерий у таких пациентов.
У пациентов с сочетанным АКШ перфузия выполнялась по представленной выше методике в устья коронарных артерий, а после наложения дистальных анастомозов венозных графтов дополнительно через венозные графты.
На всех этапах операции проводился постоянный мониторинг элевации и депрессии сегмента ST,согласно данным ЭКГ. Контроль маркеров повреждения миокарда осуществлялся до и после основного этапа операции. Всем пациентам была выполнена чреспищеводная ЭхоКГ до и после операции с контролем сократимости миокарда желудочков и аортальной регургитации.
Результаты
Среди 12 пациентов интраоперационно и в ближайший послеоперационный период ни один пациент не умер. Отсутствовали такие осложнения, как развитие острой сердечной и почечной недостаточности, острой недостаточности мозгового кровообращения и полио-гранной недостаточности.
Интраоперационно у одного пациента с постоянной коронарной антеградной перфузией миокарда развилась фибрилляция предсердий, которую удалось купировать медикаментозной кардиоверсией амиодароном в первые сутки после оперативного вмешательства.
У второго пациента, прооперированного по комбинированной методике, на операционном столе в момент смены кардиоплегической остановки сердца на переканюляцию коронарных артерий интракоронарными канюлями для постоянной антеградной коронарной перфузии началась фибрилляция желудочков. После однократной дефибрилляции сердечный ритм восстановился. Мы связываем возникновение нарушения ритма
Таблица 2 . Клинические и эхокардиографические показатели пациентов
Table 2 . Clinical and echocardiographic parameters of patients
|
Вид операции |
Возраст, лет |
Пол |
КДО, мл |
ФВ, % |
Аорта max, мм |
Аортальная регургитация, ст. |
Пиковый градиент на аортальном клапане |
Толщина МЖП |
|
Супракоронарное протезирование |
66 |
ж |
160 |
46 |
54 |
1 (10%) |
11 |
14 |
|
Операция Бенталла Де Боно |
65 |
м |
325 |
48 |
62 |
3 (50%) |
31 |
25 |
|
Операция Дэвида |
49 |
м |
178 |
44 |
57 |
2 (17%) |
7 |
15 |
|
Операция Дэвида + пластика аортального клапана |
59 |
м |
130 |
56 |
53 |
3 (50%) |
8 |
19 |
|
Супракоронарное протезирование + протезирование аортального клапана |
57 |
м |
82 |
57 |
48 |
1 (9%) |
70 |
19 |
|
Операция Дэвида + пластика аортального клапана |
33 |
м |
127 |
56 |
64 |
2 (20%) |
8 |
13 |
|
Имплантация гомографта |
63 |
ж |
103 |
59 |
47 |
1 (9%) |
80 |
14 |
|
Супракоронарное протезирование + АКШ + РЧА |
66 |
м |
230 |
35 |
49 |
1 (18%) |
8 |
16 |
|
Операция Дэвида |
64 |
м |
124 |
56 |
55 |
1 (5%) |
9 |
14 |
|
Операция Дэвида + пластика аортального клапана |
54 |
м |
110 |
70 |
54 |
3 (38%) |
4 |
9 |
|
Операция Дэвида |
57 |
м |
150 |
62 |
53 |
1 (15%) |
5 |
15 |
|
Операция Дэвида + АКШ |
51 |
м |
170 |
58 |
68 |
2 (30%) |
7 |
18 |
Примечание: КДО – конечный диастолический объем, ФВ – фракция выброса, МЖП – межжелудочковая перегородка.
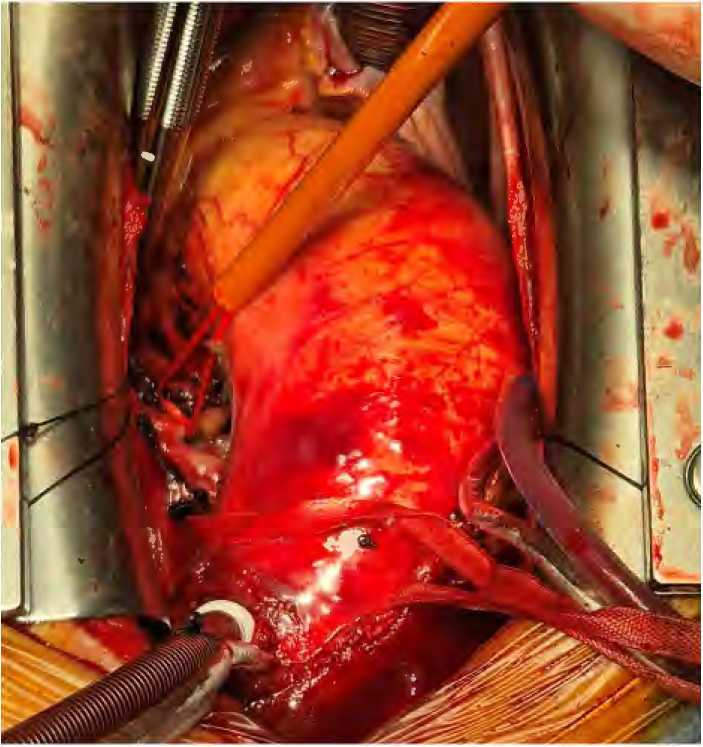
Рисунок 1. Мобилизация устьев коронарных артерий
Figure 1. Mobilization of the coronary artery ostium
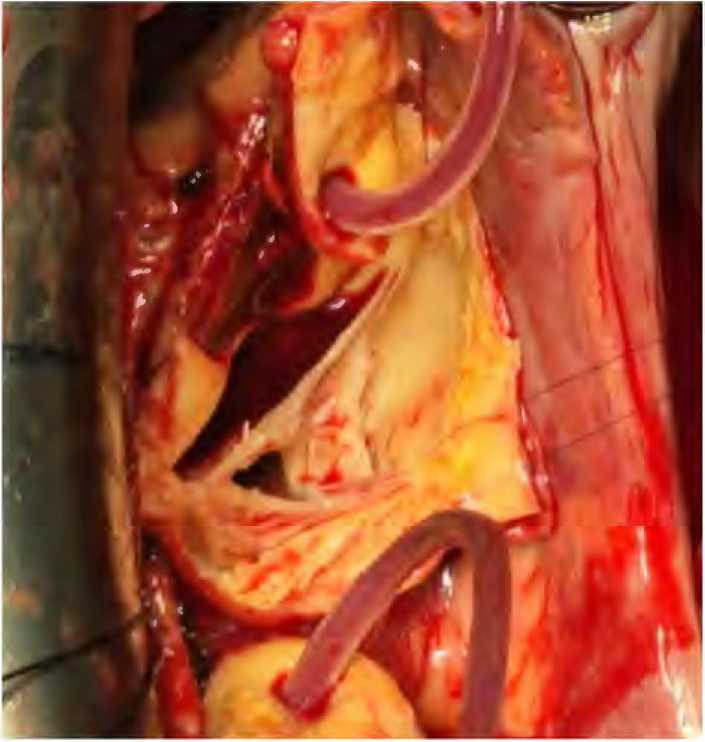
Рисунок 2. Антеградная коронарная перфузия в устья коронарных артерий
Figure 2. Antegrade coronary perfusion into the coronary artery ostium
в виде фибрилляции желудочков с возможным противопоказанием к данной методике: малый диаметр и / или атипичная анатомия устьев коронарных артерий не позволяют надежно установить интракоронарные канюли для подачи коронарной перфузии. В связи с этим при выполнении мультиспиральной компьютерной томографии грудной аорты и сердца мы добавили в протокол исследования показатель, который даст возможность отбирать для данной методики подходящих пациентов, учитывая диаметр и анатомический ход устьев коронарных артерий.
Еще одно осложнение возникло у пациента, не принимавшего ранее антикоагулянтную и антиагрегантную терапию: интраоперационно отмечалось длительное диффузное кровотечение. После тщательного гемостаза, гемотрансфузий и возврата кровопотери через аппарат CellSever кровотечение не прекратилось. Было принято решение выполнить тампонирование операционной раны и временное закрытие грудной клетки с последующим переводом в отделение реанимации. После обильного кровотечения по дренажам пациент взят в операционную на ревизию. Повторно проведен тщательный гемостаз с по-
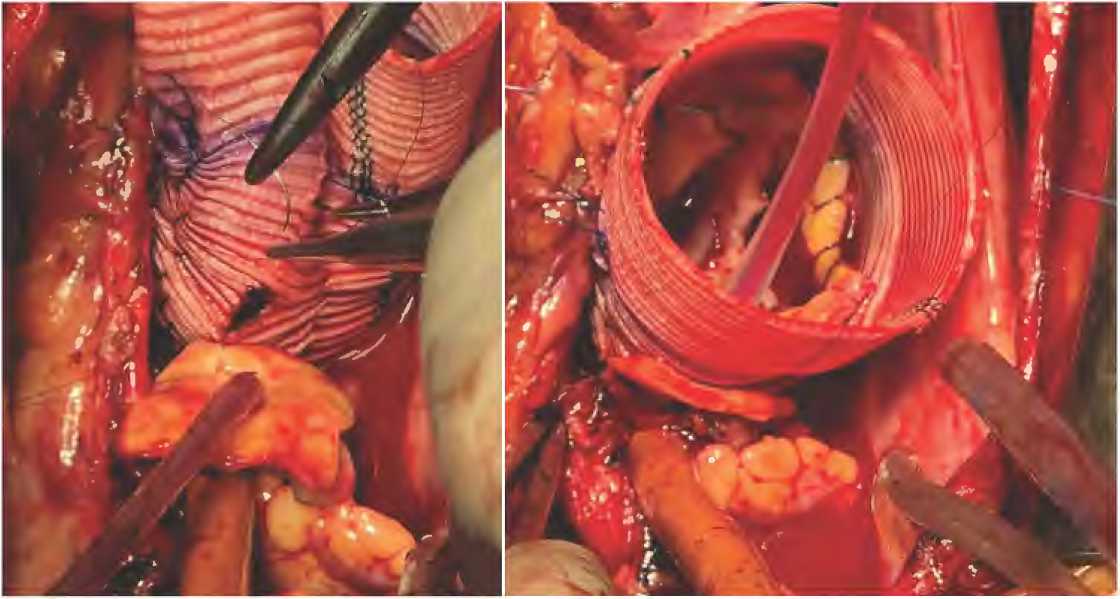
АБ
Рисунок 3. Реимплантация коронарных артерий: а – начало анастомоза с задней губы; б – завершение анастомоза швом на передней губе Figure 3. Reimplantation of coronary arteries: а – beginning of the anastomosis from the posterior lip; б – ending of the anastomosis with a suture on the anterior lip
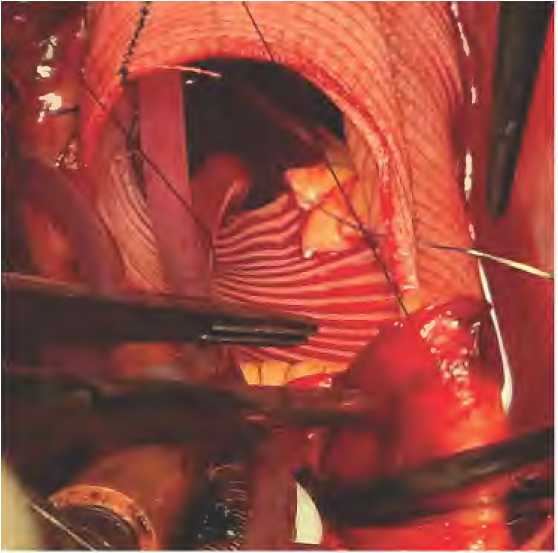
Рисунок 4. Катетеры для коронарной перфузии левой и правой коронарной артерии проходят внутри сосудистого протеза
Figure 4. Catheters for coronary perfusion of the left and right coronary arteries pass inside the vascular prosthesis ложительным эффектом. Объем кровопотери восполнен, пациент стабилизирован.
В послеоперационном периоде, согласно лабораторным (кардиомаркеры) и инструментальным данным (ЭКГ, ЭхоКГ), результаты были удовлетворительными.
Обсуждение
Такие оперативные вмешательства на работающем сердце, как АКШ и протезирование клапанов, уже себя зарекомендовали. Интраоперационные и послеоперационные данные свидетельствуют о меньшей степени повреждения миокарда, чем при кардиоплегической остановке [6–8].
Это подтверждается результатами, полученными в 2008 и 2010 гг. при сравнении классической методики протезирования клапанов в условиях кардиоплегической остановки сердца и методики с применением постоянной коронарной ретроградной перфузии миокарда.
Преимуществами постоянной коронарной ретроградной перфузии миокарда авторы считают сокращение длительности зажима, искусственного кровообращения, общей продолжительности операции, устранение ишемии миокарда, снижение вероятности осложнений в виде нарушений ритма сердца, острой сердечной и полиорган-ной недостаточности, послеоперационных кровотечений, проблем в системе свертывания крови, а также уменьшение процента послеоперационной летальности [2, 9].
В исследовании T.A. Salerno, проведенном в 2007 г., 346 пациентов с различными сердечными патологиями перенесли сердечно-сосудистые операции, включая процедуры на корне аорты, аортальном клапане и митральном клапане на работающем сердце с одновременной антеградной / ретроградной перфузией теплой крови. Основная идея методики заключалась в непрерывной перфузии коронарных артерий и коронарного синуса. Операции, как правило, проводили при системной температуре от 34 до 35 °C. Восходящая аорта была канюлирована с использованием артериальной канюли с боковым портом, которая использовалась для антеградной непрерывной нормотермической перфузии крови. Перед началом искусственного кровообращения в коронарный синус была установлена канюля. Когда аорта была пережата, начиналась перфузия коронарного синуса. После аортотомии два катетера (из бокового порта артериальной канюли) были введены в коронарные устья и использовались для перфузии левой и правой коронарных систем. Левая и правая коронарные канюли были пришиты к стенке аорты вдали от устья коронарных артерий.
Отмечен очень важный момент ретроградная перфузия хорошо переносится только в течение короткого периода и не рекомендуется для полной реконструкции аорты, так как сама по себе она не может обеспечить полную физиологическую защиту миокарда от ишемического повреждения. Несмотря на хорошие результаты, остался не ясным вопрос: нужна ли ретроградная перфузия для достижения оптимальной консервации в бьющемся пустом нормотермическом сердце, поскольку факторы, регулирующие метаболизм миокарда в этих условиях, сложны и трудно поддаются клиническому исследованию. Авторы подчеркивают, что эта методика осуществима как экспериментально, так и клинически, она безопасна, а также интраоперационно облегчает работу хирургов, так как позволяет адекватно оценить патологию аорты и аортального клапана. В своей практике они отказались от кардиоплегической остановки кровообращения во время плановых операций на клапанах и аорте [10].
В своей работе A. Mo (2010) описывает оперативное лечение разрывов синуса Вальсальвы при работающем сердце и преимущества данной методики, позволяющей оценивать функцию аорты и аортального клапана в условиях, близких к физиологическим.
В зависимости от диаметра фистулы и наличия или отсутствия аортальной регургитации применяли либо антеградную, либо ретроградную перфузию: при диаметре фистулы менее 1 см и без аортальной регургитации перфузию осуществляли антеградно через аортальную канюлю; при диаметре более 1 см с аортальной регургитацией использовали ретроградную перфузию [11].
В 1994 г. G.D. Buckberg и соавт. опубликовали результаты клинического исследования одновременной кровяной кардиоплегии антеградно через коронарные артерии и ретроградно через коронарный синус. Это исследование показало эффективность данного метода защиты миокарда у больных с кардиогенным шоком и больных с повторными операциями [12, 13].
Одним из первых хирургов, предложивших в 1989 г. клапаносохраняющую операцию, был T.E. David. При классической операции Дэвида выделяют корень и восходящую аорту, иссекают аортальные синусы, которые соединены с аортальным кольцом. Далее выделяют обе коронарные артерии. После реимплантации аортального клапана в сосудистый протез реконструируют аортальные синусы и реимплантируют коронарные артерии. По показателям долгосрочной выживаемости, снижения необходимости в реоперации и послеоперационных осложнений операция Дэвида оказалась эффективной. Сохранение физиологической структуры аортально-клапанного аппарата, фиксация оснований створок клапана и корня аорты приводят к снижению риска рецидива аортальной недостаточности, что делает эту методику более приоритетной в сравнении с прочими клапаносохраняющими операциями [14–17].
В своем докладе В.Е. Успенский рассказывал про семилетнее исследование, в которое были включены 47 пациентов, прооперированных по поводу патологии аорты. Всем пациентам было выполнено оперативное вмешательство в объеме операции Дэвида. По результатам проведенного исследования сделан вывод: протезирование восходящего отдела аорты с реимплантацией аортального клапана (операция Дэвида) является эффективным и безопасным методом хирургического лечения аневризмы восходящей аорты, сочетающейся с аортальной недостаточностью и неизмененными створками аортального клапана. Но это не значит, что полностью отсутствуют осложнения. В отдаленном послеоперационном периоде летальность составила 0%, в то время как в раннем – 2,1% (причиной смерти пациента стало острое нарушение мозгового кровообращения). Среди нелетальных послеоперационных осложнений были нарушения ритма сердца с последующей имплантацией постоянного электрокардиостимулятора, развитие острой сердечной недостаточности. Послеоперационное прогрессирование аортальной недостаточности до 3-й степени у 6,4% пациентов привело к реоперации – протезированию аортального клапана, два других пациента с аортальной недостаточностью 3-й степени оставлены под наблюдение1.
В исследовании, проведенном в Н. Новгороде, приняли участие 81 пациент с клапанными пороками сердца. Все больные были разделены на 4 группы: в трех группах применялись различные методики фармакохолодовой кардиоплегии, в одной группе – постоянная ретроградная коронарная перфузия. В 1-й группе защита миокарда осуществлялась двумя кардиоплегическими растворами: первый с содержанием калия 25–30 ммоль/л для остановки сердца, второй с содержанием калия 5 ммоль/л для повторной плегии через каждые 20–25 мин. Помимо плегии наружно охлаждалось сердце ледяной крошкой до 10–15 °С. Во 2-й группе пациентам выполнена кардиоплегия раствором «Консол» с температурой 4–6 °С, объемом 600–800 мл и одновременным внутриперикардиаль-ным охлаждением сердца, далее объемом 200–400 мл каждые 20–30 мин для поддержания остановки и защиты миокарда. В 3-й группе пациентов в качестве кардиоплегического раствора вводили «Кустодиол» с температурой 4–6 °С, объемом 1000–2000 мл (в зависимости от массы миокарда и длительности пережатия аорты) с одновременным внутриперикардиальным охлаждением однократно. В 4-й группе средством защиты миокарда стала постоянная ретроградная коронарная перфузия миокарда на работающем сердце. Методика включала в себя искусственное кровообращение с ультрафильтрацией в нормотермическом режиме. После пережатия аорты перфузия сокращающегося миокарда осуществлялась оксигенированной кровью ретроградно через коронарный синус. Помимо этого выполнялась стабилизация миокарда лидокаином до и после искусственного кровообращения.
Исследование крови, подающейся для постоянной ретроградной коронарной перфузии, и крови, оттекаю- щей из сердца, показало, что перед началом перфузии и перед ее завершением не было существенной разницы по транспорту кислорода, потреблению кислорода миокардом и коэффициенту тканевой экстракции, что говорит о благоприятном кислородном балансе и отсутствии метаболических нарушений. Показатели кардиомаркеров были в среднем в 5 раз ниже, чем в группах с кардиоплегической остановкой. Продолжительность оперативного лечения и искусственного кровообращения сократилась на 20%, так как не было необходимости охлаждать сердце до основного этапа и согревать после него. Восстановление ритма проходило не с асистолии, как в группах с кардиоплегической остановкой, а с брадикардии до исходного уровня частоты сердечных сокращений, что является наиболее благоприятным типом восстановления сердечной деятельности. Авторы отмечают, что данная техника дает хорошие результаты у пациентов с низкой сократительной функцией левого желудочка, снижается частота развития острой сердечной недостаточности и госпитальной летальности [2].
Заключение
Несмотря на развитие современных методов защиты миокарда и различных видов кардиоплегии, не решены проблемы с повреждением миокарда, особенно при длительных остановках сердца во время операций на грудной аорте.
Отсутствие или минимальная продолжительность кардиоплегической остановки кровообращения и физиологически постоянно работающее сердце способствовали снижению повреждающих факторов и их дальнейших осложнений. Во время проведения операции и сразу после нее у пациентов не было выявлено изменений по ЭКГ (элевации или депрессии сегмента ST), контроль тропонинов интра- и послеоперационно не выявил увеличения их значений. Контроль ЭхоКГ после перевода из операционной в реанимацию показал, что у всех пациентов в группе фракция выброса левого желудочка не снижалась, а нарушения локальной сократимости, аортальная регургитация отсутствовали. Всех пациентов экстубировали в первые сутки в среднем через 3–6 ч после операции. Пациенты переведены из отделения реанимации в стабильном состоянии на следующее утро, начата плановая ранняя активизация. Мы отметили, что у большинства пациентов данной группы сокращен срок послеоперационного госпитального периода. Пациенты выписаны из стационара в удовлетворительном состоянии с улучшением на амбулаторное долечивание.
Таким образом, представленные в нашей статье 12 случаев оперативного вмешательства на аорте и аортальном клапане в условиях работающего сердца позволяют говорить о положительном опыте выполнения операции по методике постоянной антеградной коронарной перфузии миокарда и / или при комбинации ее с кардиоплегической остановкой сердца.
Предложенная методика реконструкции корня аорты на работающем сердце безопасна и эффективна. Несмотря на это, требуется усовершенствование и увеличение количества операций для дальнейшего сравнительного анализа результатов аортальной хирургии в условиях кардиоплегии и коронарной перфузии.


