Хирургическое лечение дефектов грудной стенки после гнойного артрита грудинно-ключичного сочленения
Автор: Медведчиков-ардия М.А., Корымасов Е.А., Бенян А.С., Титов А.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Введение. Частота гнойного артрита грудинно-ключичного сочленения составляет менее 1 % всех инфекций суставов. Как правило, причиной является гематогенное распространение генерализованной инфекции или травма. Цель исследования: оценка эффективности мышечной пластики на реконструктивно-восстановительном этапе лечения гнойного артрита грудинно-ключичного сочленения. Материал и методы. Представлен результат лечения 24 пациентов (18 мужчин, 6 женщин, средний возраст 38,4 года) с гнойным артритом грудинно-ключичных сочленений в период с 1 января 2012 г. по 30 декабря 2022 г. Изучены причины, клинические проявления, варианты оперативного вмешательства и исход лечения. Результаты. Большинство пациентов (20 человек) предъявляли жалобы на боль и отёк тканей в области поражённого сочленения. У 4 пациентов основным симптомом была боль и ограничение подвижности руки на стороне воспаления, при этом внешних проявлений инфекционного процесса не определялось. Основными лабораторными показателями воспалительного процесса были лейкоцитоз (в среднем (12 ± 1,6)·109/л) и повышение уровня СРБ от 4 до 86 мг/л (в среднем 22 ± 4,2 мг/л). У 50 % пациентов был сахарный диабет 2 типа. У 14 пациентов помимо разрушенного грудинноключичного сочленения было поражение ребра/ребер, грудины. У 5 пациентов инфекционный процесс имел двусторонний характер. Каждому пациенту выполнена резекция ключицы и грудины вместе с грудинно-ключичным сочленением, при поражении ребер выполнялась их резекция. Интраоперационное осложнение зарегистрировано в одном случае - арозивное кровотечение из правой подключичной вены. Лечение всех пациентов было двухэтапным. Основным патогенным возбудителем был Staphilococcus aureus. После очищения раны проводили её закрытие местными или перемещенными тканями. Гистологическое исследование удалённых макропрепаратов у 18 пациентов выявило признаки острого остеомиелита. В интенсивной терапии нуждались 5 пациентов, из них 4 пациента умерли от прогрессирующего сепсиса на фоне полиорганной недостаточности и декомпенсированной сердечной недостаточности на фоне отёка лёгких. Рецидив инфекционного процесса в области операции возник у 1 пациента. Выводы. Гнойный артрит грудинноключичного сочленения не является самостоятельной болезнью. Лечение должно быть комплексным, направленным на хирургическое удаление патологически измененных структур и тканей, а также на интенсивную терапию с целью компенсации органных дисфункций.
Гнойный артрит, грудиноключичное сочленение, резекция ключицы, резекция грудины, остеомиелит, пластика грудной стенки, мышечные лоскуты
Короткий адрес: https://sciup.org/143180688
IDR: 143180688 | УДК: 616-089.87 | DOI: 10.20340/vmi-rvz.2023.3.CLIN.3
Текст научной статьи Хирургическое лечение дефектов грудной стенки после гнойного артрита грудинно-ключичного сочленения
ОРИГИНАЛЬНАЯ СТАТЬЯ ORIGINAL ARTICLE УДК 616-089.87
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Medvedchikov-Ardiia M.A., Korymasov E.A., Benian A.S., Titov A.N. Surgical treatment of chest wall defects after purulent arthritis of the sternoclavicular joint. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2023;13(3).
Актуальность. Гнойный артрит грудино-ключичного сочленения (ГКС) является редкой патологией, на долю которого приходится менее 1 % всех случаев септического артрита [1, 2]. Клинические варианты проявления могут быть различны: субфебрильная лихорадка в сочетании с локальной болью или яркая картина тяжёлого сепсиса [1, 3]. На сегодняшний день практически доказанными факторами риска можно считать мужской пол, центральные венозные катетеры, внутривенное введение наркотических препаратов, хронические заболевания, такие как хроническая почечная недостаточность (ХПН) и сахарный диабет (СД) [1]. Основным методом инструментальной диагностики является компьютерная томография, возможности визуализации которой позволяют выявлять не только состояние грудино-ключичного сочленения, но и степень распространенности патологического процесса на смежные структуры и ткани. Если факт инфекционного поражения ГКС является показанием к назначению антибактериальной терапии, то наличие абсцедирования этой зоны, медиастинита, остеомиелита грудины, ключицы или ребра/ребер, эмпиемы плевры является абсолютным показанием к хирургическому вмешательству [4]. Существуют различные подходы в лечении пациентов с гнойным артритом ГКС от сугубо консервативного до обширных резекционных операций [2]. Топографо-анатомиче- ское расположение патологического процесса обусловливает риск развития интраоперационных и послеоперационных осложнений. В силу редкости патологии многие вопросы хирургической тактики требуют накопления коллективного опыта (объём вмешательства в острую фазу заболевания, способы ликвидации дефектов грудной стенки на заключительном этапе лечения).
Цель исследования: оценка эффективности мышечной пластики на реконструктивно-восстановительном этапе лечения гнойного артрита грудинно-ключичного сочленения.
Материал и методы
Проведён ретроспективный анализ результатов лечения 24 пациентов с гнойным артритом грудинно-ключичных сочленений за период с 1 января 2012 г. по 30 декабря 2022 г., оперированных в хирургическом торакальном отделении ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» и гнойном хирургическом отделении ГБУЗ «Самарская городская клиническая больница № 1 им. Н.И. Пирогова». Мужчин было 18, женщин – 6. Средний возраст пациентов 38,4 ± 2,1 года (от 20 до 67 лет). Сахарный диабет (СД) был у 16 пациентов, хроническая почечная недостаточность (ХПН) – у 3, сочетание СД и ХПН – у 2 пациентов. У 4 пациентов диагностирован вирус иммунодефицита человека, 2 из них употребляли внутривенные наркотические препараты. У 10 из 24 пациентов были гнойные очаги на других участках тела. Двустороннее поражение ГКС было у 5 пациентов.
Клиническими проявлениями у 20 пациентов были боль и припухлость, локализованные над ГКС. У 4 пациентов была гиперемия и лихорадка (рис. 1). Выраженная гипертермия (более 38,5 °С) была зафиксирована у 7 пациентов, субфебрильная температура тела (до 37,8 °С) была у 11 пациентов, у 6 пациентов температура тела была в норме.
При поступлении всем пациентам оценивались про-воспалительные маркеры крови. Средний уровень лейкоцитов крови составил: (12 ± 1,6)·109/л (от 4·109/л до 28·109/л), средний уровень СРБ был 22 ± 4,2 мг/л (от 4 до 86 мг/л). Компьютерная томография органов грудной полости с внутривенным контрастированием выполнялась всем 24 пациентам, включая пациентов с ХПН, с последующим проведением им сеанса гемодиализа. Всем пациентам осуществляли бактериологическое исследование крови.
Лечение пациентов было двухэтапным. Объём хирургического вмешательства на первом этапе определялся наличием поражённых анатомических структур, а также общим состоянием пациента.
Для доступа к ГКС применяли дугообразный разрез в проекции медиальной части ключицы с последующим переходом на рукоятку грудины по средней линии до уровня 2 межреберья (рис. 2). В случае двустороннего поражения хирургический доступ проводили в проекции обеих ключиц. Если у пациента были признаки флегмоны и некроза мягких тканей грудной стенки, то проводилось их иссечение. Далее выделяли ГКС от окружающих тканей. Вскрывали ГКС. Полученное содержимое отправляли на микробиологическое исследование. Резекцию ключицы проводили с помощью пилы Джигли после мобилизации грудинного конца ключицы на расстоянии до 15 мм от ГКС. С помощью долота и молотка осуществляли остеотомию рукоятки грудины.
В случае вовлечения в инфекционный процесс рёбер проводили поднадкостничную их резекция с помощью рёберных кусачек. Если у пациента был диагностирован медиастинит, то объём оперативного вмешательства зависел от распространённости воспалительных изменений в средостении. В случае ограниченного переднего верхнего медиастинита достаточно было выполнить частичную резекцию рукоятки грудины, чтобы вскрыть средостение и создать условия для адекватной санации (рис. 3). Если медиастинит распространялся загрудинно на всём протяжении, то выполняли сквозное дренирование переднего средостения трубчатыми дренажами. Все удаляемые ткани отправляли на гистологическое исследование. После дебридмента рану вели либо открытым способом, либо применяли ва-куум-ассистированные повязки (рис. 4).
Четверым пациентам изначально было выполнено вскрытие и дренирование полости абсцесса без резекции костных структур из-за явлений гипокоагуляции. По стабилизации системы гемостаза в течение 7 суток им выполнена резекция грудины и ключицы с удалением ГКС. Резекция грудины и ключицы с удалением ГКС во время первого оперативного вмешательства проведены 16 пациентам, с дополнительной резекцией первого ребра – у 2 пациентов, с резекцией первого и второго рёбер – у 2 пациентов. Этап очищения раны составлял в среднем 7,2 суток (от 4 до 14 суток).
У 12 пациентов с целью купирования гнойного воспаления была применена методика лечения раны отрицательным давлением с помощью вакуум-ассистированных повязок. Среднее время проведения вакуумной терапии раны было 6,8 суток (от 3 до 12 суток). У 2 пациентов с эмпиемой плевры выполняли видеоторакоскопию, санацию и дренирование плевральной полости. Сквозное дренирование переднего средостения при медиастините выполнено 1 пациенту. У 10 пациентов была проведена операция по санации и удалению сопутствующих гнойных образований другой локализации: подкожные абсцессы конечностей в 7 случаях, острый гнойный артрит межфаланговых суставов стоп в 3 случаях.
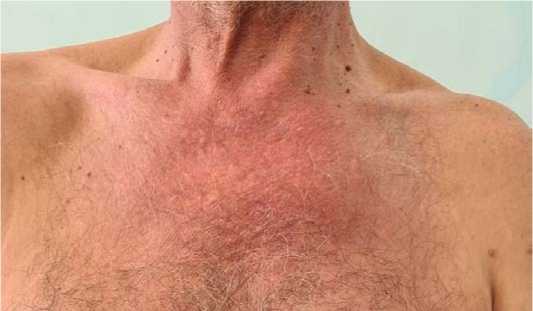
Рисунок 1. Вид передней грудной стенки пациента. Определяется гиперемия в области левого грудинно-ключичного сочленения
Figure 1. Photo of the anterior chest wall of the patient. Hyperemia is determined in the region of the left sternoclavicular joint
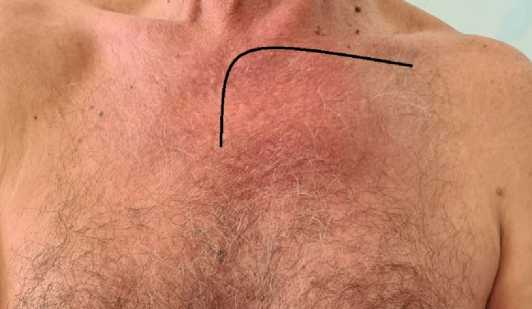
Рисунок 2. Вид передней грудной стенки пациента. Разметка для дугообразного доступа к грудинно-ключичному сочленению
Figure 2. Photo of the anterior chest wall of the patient. Marking for arcuate surgical approach to the sternoclavicular joint
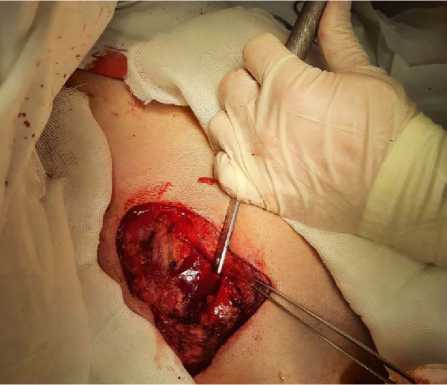
Рисунок 3. Интраоперационное фото. Резекция тела грудины
Figure 3. I ntraoperative photo. Resection of the body of the sternum
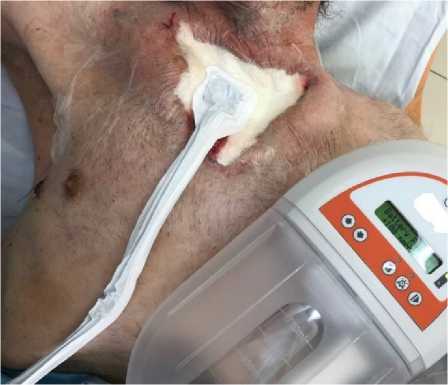
Рисунок 4. Вид передней грудной стенки пациента. Наложена вакуум-ассистированная повязка на рану груди
Figure 4. Photo of the anterior chest wall of the patient. Vacuum-assisted bandage applied to chest wound
Микробиологический анализ интраоперационного материала у 20 пациентов выявил рост Staphilococcus aureus, при этом у 2 пациентов был метицилинрезистентный его штамм. У 2 пациентов была смешанная флора EscheriChia coli и Staphilococcus aureus. У 2 пациентов роста патогенной микрофлоры выявлено не было. Все пациенты получали эмпирическую, затем этиотропную антибактериальную терапию. Препаратами выбора были карбапенемы (имипенем 0,5 г 4 раза в сутки или меропенем 1,0 г 3 раза в сутки). В случае микст-инфекции назначался тигециклин (50 мг 2 раза в сутки), при метицилинрезистентном Staphilococcus aureus применяли ванкомицин (1,0 г в сутки). Курс антибактериальной терапии в среднем составлял 14,5 суток (от 10 до 28 суток). Положительный посев крови на микрофлору был выявлен у 14 пациентов (Staphilococcus aureus).
По достижению стерильной раны или снижения уровня микрофлоры в ней до 103 КОЕ/г пациенту проводили второй этап хирургического лечения, направленный на устранение дефекта и восстановление целости кожного покрова грудной стенки. Осуществляли окончательный дебридмент раны, включающий в первую очередь резекцию изменённых краев костных структур (ключицы, ребер, грудины). Формирование мышечного лоскута осуществляли с учетом потенциального адекватного его кровоснабжения артериальными ветвями. При использовании лоскута большой грудной мышцы (БГМ) сначала проводили его выделение от кожно-подкожного слоя. Затем, ориентируясь на размер дефекта, отсекали БГМ на уровне IV или V межреберья до передней подмышечной линии, а также от места фиксации БГМ к II-IV ребрами и ключице (рис. 5). Мобилизованный лоскут БГМ в таком случае оказывался фиксированным лишь в области головки плечевой кости. Данный вариант мышечной пластики, как правило, оказывался адекватным при одностороннем поражении ГКС и ограниченной резекции грудины и ключицы.
В случае обширной раны при двустороннем поражении ГКС потребовалось формирование мобилизованных лоскутов БГМ с двух сторон. Возможными вариантами комбинированного использования лоскутов БГМ были мобилизованный с одной стороны и ротированный с другой. При этом ротированный лоскут БГМ кровоснабжается за счёт перфорантных ветвей внутренней грудной артерии. Также как и в предыдущем варианте проводили выделение БГМ от кожно-подкожного слоя до уровня передней подмышечной линии, пересекали и прошивали грудную ветвь торакоакромиальной артерии, проводили мобилизацию лоскута от грудной стенки и от ключицы. После разворота лоскут БГМ позиционировали и фиксировали в ране. Под мышечный лоскут во всех случаях устанавливали перфорированный вакуумный дренаж. Полнослойные лоскуты БГМ на торакоакромиальной артерии применяли в тех случаях, когда размеры раны (её глубина или площадь) не позволяли использовать изолированные мышечные лоскуты.
В случае дефицита кожи в области операции использовали полнослойные лоскуты БГМ на торакоакромиаль-ной артерии. Проводили дополнительный разрез кожи и подкожной клетчатки от середины ключицы до уровня второго межреберья. Далее, начиная от III ребра до нижнего края V ребра в границах парастернальной и срединно-ключичной линий, ориентируясь на размеры дефекта кожи в области основной раны, формировали кожный лоскут овальной формы. Дном этого лоскута была БГМ, которую отсекали от передней грудной стенки, сохраняя анатомическую целостность с кожной частью лоскута. Затем БГМ отсекали от грудной стенки до ключицы таким образом, что сохранялась та часть БГМ, в составе которой проходила кровоснабжающая лоскут грудная ветвь торакоаромиальной артерия (рис. 6).
Сформированный таким образом полнослойный лоскут после отделения кожно-подкожного слоя от БГМ перемещали в тоннеле в дефект грудной стенки, где фиксировали к краям раны. Место забора лоскута послойно ушивали. Рану под лоскутом БГМ дренировали вакуумным дренажём.
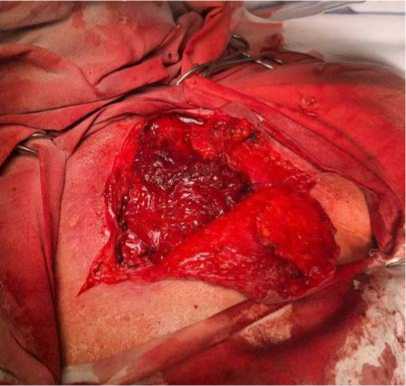
Рисунок 5. Интраоперационное фото. Мобилизованный лоскут большой грудной мышцы уложен в рану груди
Figure 5. Intraoperative photo. The mobilized flap of the pectoralis major muscle is placed in the chest wound
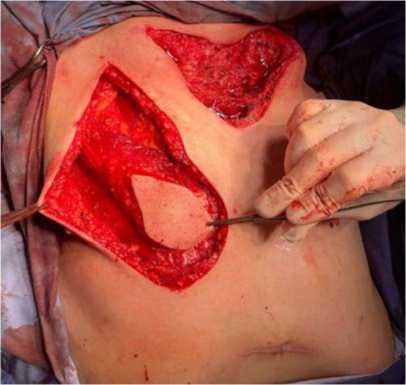
Рисунок 6. Интраоперационное фото. Полнослойный лоскут большой грудной мышцы сформирован на торакоакромиальной артерии Figure 6. Intraoperative photo. A full-thickness flap of the pectoralis major muscle was formed on the thoracoacromial artery
Устранение дефекта грудной стенки с помощью изолированных мышечных лоскутов большой грудной мышцы было выполнено у 18 пациентов с помощью перемещенных полнослойных лоскутов на торакоакромиальной артерии в двух случаях (с односторонним поражением ГКС – 1, с двухсторонним – 1). Изолированные мобилизованные мышечные лоскуты БГМ на грудной ветви торакоакромиальной артерии применяли у 12 пациентов (двусторонний вариант был реализован в двух случаях). Ротированный способ пластики лоскутом БГМ на перфорантных сосудах был выполнен у 3 пациентов. Еще у 3 пациентов была применена комбинация ротированных и мобилизованных лоскутов. Во всех случаях после перемещения мышечных лоскутов и их фиксации в ране проводили мобилизацию кожных краев с последующим их сшиванием. Четверым пациентам не выполнялась реконструктивно-восстановительная операция.
Результаты
Нами были изучены результаты лечения после второго реконструктивно-восстановительного этапа у 20 человек. Средняя продолжительность пребывания в стационаре составила 38,5 дней (от 12 до 102 дней). Интраоперационное осложнение в виде аррозивного кровотечения из правой подключичной вены было в одном случае.
Приводим клиническое наблюдение. Пациентка 68 лет, страдающая сахарным диабетом, была госпитализирована на 8-е сутки от начала заболевания. При обследовании выявлены абсцессы в области правого ГКС, правого локтевого сустава, также некроз кожи в области крестца и деструкция дистального межфалангового сустава первого пальца правой стопы. Объём операции в области ГКС заключался в широком вскрытии абсцесса, иссечении некротизированных тканей, резекции ключицы, рукоятки грудины, удалении ГКС, резекции I ребра справа (рис. 7).
Интраоперационно выявлено распространение гнойного процесса в область левого ГКС и переднего верхнего средостения. Дополнительно выполнена резекция левой ключицы с удалением левого ГКС, широкое вскрытие переднего средостения путём резекции рукоятки грудины.
При ревизии выявлено распространение гнойного процесса по клетчатке на правый сосудисто-нервный пучок шеи. Возникшее арозивное кровотечение из правой подключичной вены было остановлено путём прошивания её ad mass. Кровопотеря составила 350 мл. Также пациентке была выполнена некрэктомия области крестца, экзартику-ляция I пальца правой стопы с резекцией головки I плюсневой кости. Послеоперационный период сопровождался декомпенсацией хронической сердечной недостаточности. На фоне сепсиса нарастала полиорганная недостаточность. Пациентка погибла на 14-е сутки лечения в стационаре от прогрессирующей полиорганной недостаточности.
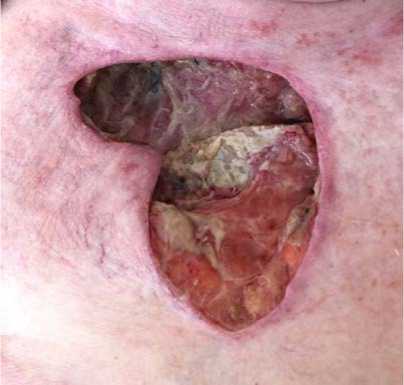
Рисунок 7. Вид раны передней грудной стенки пациентки. Резецированы правая ключица, I ребро, рукоятка грудины
Figure 7. View of the wound of the anterior chest wall of the patient. Resected right clavicle, first rib, sternum
В четырёх наблюдениях была длительная госпитализация из-за тяжёлого сепсиса. Этим пациентам потребовалась интенсивная терапия (средняя продолжительность пребывания в отделении интенсивной терапии составила 16 дней; диапазон – от 5 до 33 дней). Послеоперационное наблюдение пациентов составило от 30 до 368 дней.Реци-див остеомиелита грудины был обнаружен у одного пациента. Приводим клиническое наблюдение. Пациент, 58 лет, обратился через четыре месяца после резекции ГКС, удаления ретростернального абсцесса и миопластики мобилизованным лоскутом БГМ. При компьютерной томографии выявлена деструкция в области рукоятки грудины. Выполнена повторная операция – резекция рукоятки грудины, удаление секвестров. Дефект грудной стенки восполнили ротированным лоскутом БГМ с противоположной стороны. Дальнейшее наблюдение за пациентом в течение 250 дней не выявило рецидива инфекции.
Четверым пациентам не выполнялась реконструктивно-восстановительная операция. Во всех случаях это было связано с некупирующимися явлениями тяжёлого сепсиса и полиорганной недостаточности. Пациентам проводилась интенсивная терапия в отделении реанимации. Эти пациенты погибли.
Таким образом, летальность в группе пациентов с гнойным артритом ГКС составила 16,6 % (4 из 24 погибло).
Обсуждение
Учитывая редкость патологии, анализ даже такого небольшого числа пациентов с гнойным артритом грудиноключичного сочленения заслуживает особого внимания.
Актуальность проблемы связана с тем, что часто данной патологией страдают люди молодого возраста, в среднем до 45 лет [5]. В нашем исследовании средний возраст пациентов составил 38,4 года.
Наиболее распространённым фактором риска был сахарный диабет: у 16 из 24 пациентов (66,6 %).
Клиническая картина и лабораторные данные были весьма неспецифичными: лишь у 7 пациентов была стойкая гипертермия (29,1 %). Показатели уровня лейкоцитов и СРБ также не отражали клиническую картину в целом.
Считается, что достаточно прочная суставная капсула ГКС, состоящая из передней и задней грудинно-ключичных связок, может способствовать ограниченным клиническим проявлениям [6]. В то же время, в связи с вторичным характером абсцесса в области ГКС, местные проявления инфекционного процесса не всегда будут коррелировать с общим состоянием пациента.
В тяжёлых и запущенных случаях на фоне генерализованной инфекции происходит распространение гнойного процесса за пределы ГКС, что требует обширных резекций. В таком случае становится понятной и обоснованной активная радикальная хирургическая тактика, направленная на быстрое и полноценное удаление очага инфекции с последующим очищением раны и дальнейшем её пластическим закрытием.
Исключительно консервативное лечение может быть достаточным на ранних стадиях заболевания, когда воспалительный процесс представлен инфильтрацией тканей без явления абсцедирования [7]. Однако пациенты обращаются за медицинской помощью уже на фоне распространённого инфекционного процесса, включающего гнойный артрит ГКС, абсцесс средостения, остеомиелит грудины, рёбер, и практически всем пациентам показано хирургическое вмешательство [1].
В литературе имеются публикации, свидетельствующие о неэффективности малоинвазивных оперативных вмешательств (вскрытие и дренирование очага инфекции), достигающих 83 % при инфекции ГКС [8]. Причиной рецидива инфекции в области ГКС является наличие неустраненного очага в кости. Остеомиелит грудины, ключицы, ребра практически всегда сопровождает инфекционное поражение ГКС.
По данным компьютерной томографии, зона деструкции ключицы определялась у 13 пациентов, грудины – у 5, а ребра/ребер – у 4. Послеоперационное исследование костных структур подтвердило наличие остеомиелита у 18 пациентов (75 %).
В нашем исследовании из 20 радикально оперированных пациентов у одного возник рецидив инфекции, связанный с остеомиелитом грудины, что составило 5 %. Хотя по данным литературы рецидив остеомиелита встречается в 23 % случаев [2].
Обширная зона резекции костных и окружающих структур в зоне ГКС потенциально может привести к нестабильности верхней грудной апертуры. Но, к счастью, данная ситуация хорошо переносится, и подавляющее большинство пациентов, как правило, имеют лишь незначительные функциональные нарушения [9]. В нашем исследовании ни у одного пациента не было значимых отклонений в функциональной активности верхних конечностей. После дебридмента образующаяся рана требует пластической реконструкции. Основная задача данного этапа хирургического лечения заключается в устранении полости и адекватном прикрытии костных структур. Логичным и обоснованным является методика мышечной пластики грудной стенки с помощью лоскутов БГМ. Разработаны и широко применяются в практике различные варианты пластики несвободными изолированными мышечными лоскутами БГМ, в том числе и в онкологической практике [10]. Как правило, применение их возможно, если отсутствует дефицит кожи в области операции. При этом мышечная ткань устраняет остаточную полость в ране, а мобилизованные кожные края её позволяют полностью ушить дефект и устранить рану. В случае дефицита кожи приходится дополнительно осуществлять пластику путем перемещения кожных лоскутов. По нашему мнению, целесообразно применять полнослойные лоскуты БГМ на грудной ветви торакоакромиальной артерии в тех ситуациях, когда имеется обширная рана грудной стенки, а также дефицит кожи для полноценного устранения раневого дефекта.
Выводы
Трудность хирургического лечения гнойного артрита грудинно-ключичного сочленения на обоих этапах определяется особенностями анатомии зоны поражения (вовлечение кости и сустава), сложностью элиминации инфекции, персистирующей в кости, малой мобильностью тканей в зоне подлежащих костных структур и, в связи с этим, проблемным кровоснабжением рубцовых тканей после купирования гнойного воспаления. Это исключает возможность применения обычной кожной пластики и требует использования васкуляризированных мышечных лоскутов. Лечение гнойного артрита грудинно-ключичного сочленения в большинстве случаев хирургическое. Успех оперативного вмешательства зависит от его агрессивности и радикализма, направленного на удаление всех измененных структур и тканей. Интенсивная антибактериальная терапия и адекватная хирургическая тактика предопределяют успех лечения пациента. Различные способы мышечной пластики лоскутами БГМ, включая полнослойные варианты, являются хорошими и надёжными реконструктивно-восстановительными вмешательствами для устранения дефекта грудной стенки.
Список литературы Хирургическое лечение дефектов грудной стенки после гнойного артрита грудинно-ключичного сочленения
- Ross JJ, Shamsuddin H. Sternoclavicular septic arthritis: review of 180 cases. Medicine (Baltimore). 2004 May;83(3):139-148. https://doi.org/10.1097/01.md.0000126761.83417.29. PMID: 15118542.
- Von Glinski A, Yilmaz E, Rausch V, Koenigshausen M, Schildhauer TA, Seybold D, GeGmann J. Surgical management of sternoclavicular joint septic arthritis. J Clin Orthop Trauma. 2019 Mar-Apr;10(2):406-413. https://doi.org/10.1016/j..jcot.2018.05.001.
- Epub 2018 May 8. PMID: 30828216; PMCID: PMC6383133. Womack J. Septic arthritis of the sternoclavicular joint. J Am Board Fam Med. 2012 Nov-Dec;25(6):908-12. https://doi.org/10.3122/jabfm.2012.06.110196. PMID: 23136331.
- Moreno Martínez MJ, Moreno Ramos MJ, Linares Ferrando LF, Marras Fernandez-Cid C, Castaño Sanchez M, Peñas Martínez E. Sternoclavicular septic arthritis and empyema. ReumatolClin. 2012 Mar-Apr;8(2):102-3. https://doi.org/10.1016/j.reuma.2011.07.009. Epub 2011 Dec 5. PMID: 22153758.
- Mitsusada K, Dote H, Saito R, Atsumi T. Mediastinal abscess in an immunocompromised patient which progressed from sternoclavicular joint septic arthritis. BMJ Case Rep. 2022 Aug 31;15(8):e252103. https://doi.org/10.1136/bcr-2022-252103. PMID: 36129356; PMCID: PMC9438062.
- Abu Arab W, Khadragui I, Echavé V, Deshaies A, Sirois C, Sirois M. Surgical management of sternoclavicular joint infection. Eur J Cardothorac Surg. 2011;40(3):630-634.
- Kim S, Kanwar R, Marshall MB. Nonsurgical management of Fusobacterium necrophorum sternoclavicular septic arthritis: a case report. J Med Case Rep. 2022 Mar 3;16(1):90. https://doi.org/10.1186/s13256-022-03316-8. PMID: 35236398; PMCID: PMC8892743.
- Chun JM, Kim JS, Jung HJ et al. Resection arthroplasty for septic arthritis of the sternoclavicular joint. J Shoulder Elbow Surg. 2012;21(3):361-366.
- Bicos J, Nicholson GP. Treatment and results of sternoclavicular joint injuries. Clin Sports Med. 2003;22(2):359-370.
- Корымасов Е.А., Медведчиков-Ардия М.А., Бенян А.С. Клинический случай этапной коррекции осложнений со стороны грудной стенки после комбинированного лечения рака молочной железы. Альманах клинической медицины. 2019;47(8):740-744. [Korymasov E.A., Medvedchikov-Ardiya M.A., Benyan A.S. A clinical case of stage-by-stage correction of complications from the chest wall after combined treatment of breast cancer. Almanac of Clinical Medicine. 2019;47(8):740-744. (In Russ)] https://doi.org/10.18786/2072-0505-2019-47-076
- Котельников Г.П., Долгушкин Д.А., Лазарев В.А., Зельтер П.М. Применение компьютерной томографии для оценки плотности тканевого регенерата после хондропластики в эксперименте у кроликов. Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье. 2020;(5):28-35. [Kotelnikov G.P., Dolgushkin D.A., Lazarev V.A., Zel'ter P.M. UTILITY OF COMPUTED TOMOGRAPHY FOR THE ASSESSMENT OF TISSUE REGENERATE DENSITY AFTER CHONDROPLASTY IN AN EXPERIMENT WITH RABBITS. Bulletin of the Medical Institute "REAVIZ" (REHABILITATION, DOCTOR AND HEALTH). 2020;(5):28-35. (In Russ)]. https://doi.org/10.20340/vmi-rvz.2020.5.2
- Супильников А.А., Девяткин А.А., Павлова О.Н., Гуленко О.Н. Морфологические и физиологические аспекты течения раневого процесса (литературный обзор). Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье. 2016. № 3 (23). С. 144-151. [Supilnikov A.A., Devyatkin A.A., Pavlova O.N., Gulenko O.N. Morphological and physiological aspects of the wound process (literature review). Reaviz Medical Institute Bulletin: Rehabilitation, Physician and Health. 2016. № 3 (23). С. 144-151. (In Russ)].


