Хирургическое лечение или неоадъювантная химиотерапия при раке верхнеампулярного отдела прямой кишки: ретроспективное исследование
Автор: Лукмонов С.Н., Беленькая Я.В., Гордеев С.С., Садыков А.Ж., Мамедли З.З.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
Введение: В научной литературе имеется мало информации о роли неоадъювантной химиотерапии (НАХТ) при верхнеампулярном раке прямой кишки (в/а РПК), в связи с чем мы провели данное исследование. Цель нашего исследования - изучить роль НАХТ при в/а РПК.Материалы и методы: Мы провели ретроспективное когортное многоцентровое исследование, в ходе которого проанализировали данные историй болезни больных в/а РПК из архива ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих», ГБУЗ Ставропольского края «Ставропольский краевой клинический онкологический диспансер» и ГБУЗ Онкологического центра Калининградской области с 2007 по 2020 гг. Все пациенты были разделены на 2 группы: в 1 группу вошли больные, которым на 1 этапе лечения проводилась НАХТ, во 2 группу - те, кому на 1 этапе проводилось хирургическое вмешательство. Основным оцениваемым параметром была 3-летняя безрецидивная выживаемость (БРВ). Также оценивали частоту полного патоморфологического ответа (pCR), токсичность лечения, частоту послеоперационных осложнений (Clavien-Dindo), степень регрессии опухоли, частоту рецидивов и метастазов, 3-летнюю общую выживаемость (ОВ), частоту завершения полного курса.Результаты: В группу НАХТ включили 118 пациентов, в группу хирургии - 103 пациента. Исследуемые группы были сопоставимы по полу, статусу по шкале ASA и степени дифференцировки опухоли. Достоверно чаще поражение регионарных лимфоузлов было зафиксировано в группе НАХТ (р = 0,002). Медиана наблюдения составила 36,0 месяцев. При анализе 3-летней БРВ и ОВ достоверные различия не были выявлены. Частота развития рецидивов составила 3,9% в группе хирургического лечения и 0% в группе НАХТ (p = 0,046). Частота развития метастазов в исследуемых группах достоверно не различалась (p = 0,293). У 16 (13,6%) пациентов, получавших НАХТ, отмечался полный патологический ответ (pCR). Частота завершения полного курса НАХТ составила 91,5%. Гематологическая токсичность 3-4 степени наблюдалась у 4 пациентов (3,3%), негематологическая - у 4 пациентов (3,3%). Отмечена выраженная тенденция более частого развития несостоятельности анастомоза (НА) в группе хирургического лечения без проведения НАХТ (p = 0,07).Выводы: НАХТ имеет приемлемый профиль токсичности, не ухудшает онкологические результаты лечения и потенциально может быть использована для раннего начала системной терапии у отобранной группы пациентов.
Неоадъювантная химиотерапия, аденокарцинома, рак верхнеампулярного отдела прямой кишки
Короткий адрес: https://sciup.org/140305813
IDR: 140305813 | DOI: 10.18027/2224-5057-2024-14-1-9-20
Текст научной статьи Хирургическое лечение или неоадъювантная химиотерапия при раке верхнеампулярного отдела прямой кишки: ретроспективное исследование
Одной из нерешенных проблем терапии РПК продолжает оставаться выбор тактики лечения рака верхнеампулярного отдела прямой кишки (в/а РПК) в связи с тем, что этот отдел прямой кишки занимает промежуточное положение между тазовым отделом прямой кишки и сигмовидной кишкой, обычно покрыт серозной оболочкой по передней полуокружности, находится в брюшной полости, а не в полости таза, особенно у женщин. Обоснованность следования стандартам лечения РПК при локализации опухоли в верхнеампулярном отделе до сих пор вызывает споры. В последнее время одной из новых опций лечения РПК является использование неоадъювантной химиотерапии (НАХТ). Проведение НАХТ может привести к достиже- нию полного патоморфологического ответа на лечение у 10–15% пациентов [1]. Проведение НАХТ в сравнении с адъювантным режимом ХТ является более эффективным с точки зрения эрадикации микрометастазов [2], поскольку оперативное вмешательство способно усиливать активность факторов роста, что потенциально может стимулировать пролиферацию опухолевых клеток еще до начала адъювантной ХТ [3]. В исследовании FOXTROT, в котором изучалось лечение рака ободочной кишки, было показано достоверное снижение частоты прогрессирования при назначении НАХТ на 28% (ОР 0,72; 95% ДИ 0,54–0,98), а также повышение вероятности достижения резекции в объеме R0: в группе НАХТ — 94% в сравнении с 89% в хирургической группе (p = 0,001) при отсутствии повышения риска послеоперационных осложнений [4]. Учитывая анатомические особенности в/а отдела прямой кишки, его близость к сигмовидной кишке, результаты данного исследования можно экстраполировать на тактику лечения в/а РПК. Использование НАХТ в ряде исследований 2 фазы также показало преимущество при РПК, однако доказательных данных для однозначной рекомендации такой тактики лечения нет [5–7]. Bondeven с соавт. отмечают 7,0% случаев развития рецидивов при в/а РПК при отсутствии проведения неоадъювантной терапии [8]. Однако вопрос о необходимости проведения предоперационного лечения при в/а РПК остается открытым. В настоящее время в литературе не описана роль НАХТ при в/а РПК, что привлекло наше внимание и стало причиной проведения этого исследования.
Цель нашего исследования — изучить роль НАХТ при в/а РПК.
МАТЕРИАЛЫ И МЕТОДЫ
Мы провели ретроспективное когортное многоцентровое исследование, в ходе которого проанализировали данные историй болезни пациентов из архива ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих», ГБУЗ Ставропольского края «Ставропольский краевой клинический онкологический диспансер» и ГБУЗ Онкологического центра Калининградской области с 2007 по 2020 гг. Мы идентифицировали истории болезни больных в/а РПК. Все пациенты были разделены на 2 группы: в 1 группу вошли больные, которым на 1 этапе лечения проводилась НАХТ, во 2 группу — те, кому на 1 этапе проводилось хирургическое вмешательство.
Критериями включения были: гистологически верифицированный в/а РПК, возраст пациентов от 18 до 80 лет, локализация опухоли на 10–15 см от анокутанной линии, функциональный статус пациента 0–2 балла по шкале ECOG, стадии Tлюбое N1–2M0 и T4aN0–2M0 по классификации стадирования опухолей TNM.
Критериями исключения были: наличие инфаркта миокарда и острого нарушения мозгового кровообращения в течение 6 месяцев до начала лечения, метахронные или синхронные злокачественные новообразования, наличие метастазов, нестабильная стенокардия в течение 3 месяцев до начала лечения, проведенная ранее ЛТ или ХТ, клинически значимые заболевания центральной нервной системы и периферические невропатии в анамнезе, язвенный колит, беременность.
Клиническое стадирование проводилось с использованием компьютерной томографии (КТ) органов грудной клетки, брюшной полости с внутривенным контрастированием, магнитно-резонансной томографии (МРТ) органов малого таза. Пациентам, получавшим предоперационное лечение, МРТ органов малого таза выполняли как до начала НАХТ, так и перед хирургическим вмешательством. Объективный ответ оценивался по максимальному диаметру опухоли на сагиттальных Т2-изображениях МРТ в соответствии с критериями оценки ответа при солидных опухолях (Response evaluation criteria in solid tumors, RECIST v. 1.1) [9].
В группе НАХТ пациенты получали на предоперационном этапе 4 курса полихимиотерапии (ПХТ) по схеме XELOX (оксалиплатин 130 мг/м 2 внутривенно в 1-й день, капеци-табин 2000 мг 2 раза в день перорально, на 1–14-й дни, курс — 21 день). Пациентам без прогрессирования в течение последующих 4 недель производилось оперативное вмешательство. После окончания 4 курса ХТ повторно выполняли МРТ малого таза. Все пациенты были проинформированы о рисках и преимуществах НАХТ и подписали информированное согласие на лечение. НАХТ проводилась во всех вышеперечисленных центрах.
Пациентам контрольной группы проводилось только хирургическое лечение. Использовали как открытый, так и лапароскопический доступы, выбор хирургического доступа оставался на усмотрение оперирующего хирурга. Во всех группах применяли методику аппаратного двойного прошивания для формирования колоректального анастомоза.
Послеоперационные осложнения оценивали по классификации хирургических осложнений Clavien–Dindo [10].
Показания к проведению адъювантной ХТ определялись в соответствии с действовавшими на момент лечения пациента клиническими рекомендациями. Все пациенты получали адъювантную химиотерапию по месту жительства. В процессе анкетирования задавались вопросы о количестве пройденных курсов адъювантной химиотерапии.
После операции пациенты наблюдались в соответствии с действовавшими на момент лечения клиническим рекомендациям по лечению рака прямой кишки. Минимальный объём обследования был следующим. УЗИ брюшной полости и малого таза, онкомаркер РЭА определяли каждые 3 месяца в течение первых 2 лет наблюдения, далее — каждые 6 месяцев до 5 лет наблюдения. КТ органов грудной и брюшной полости с внутривенным контрастированием, МРТ таза, колоноскопию выполняли ежегодно.
КОНЕЧНЫЕ ТОЧКИИ СТАТИСТИЧЕСКИЙ АНАЛИЗ
Основным оцениваемым параметром была 3-летняя безрецидивная выживаемость (БРВ). Для демонстрации преимущества проведения НАХТ при в/а РПК (повышение 3-летней БРВ с 75% до 90%) с мощностью исследования 80% и достоверностью 5% потребовалось включить в каждую исследуемую группу не менее 97 пациентов.
Также оценивали частоту полного патоломорфо-гического ответа (pCR), токсичность лечения, частоту послеоперационных осложнений, степень регрессии опухоли, частоту рецидивов и метастазов, 3-летнюю общую выживаемость (ОВ), частоту завершения полного курса НАХТ по схеме CAPOX. Регрессию опухоли оценивали по шкале Dworak [11]. Категориальные переменные сравнивали с использованием критерия χ2 или точного крите- рия Фишера. Статистические тесты были двусторонними. Показатель p = 0,05 считали статистически значимым. ОВ и БРВ оценивали методом Каплана–Майера, а кривые сравнивали с помощью лог-рангового теста. При анализе данных использовалось программное обеспечение SPSS v. 23 (SPSS Inc., США).
РЕЗУЛЬТАТЫ
В исследование был включен 221 пациент с в/а РПК (табл. 1).
По основным клиническим параметрам пациенты были сопоставимы, не было отмечено статистически значимых различий между исследуемыми группами по возрасту, полу, шкале ASA, степени дифференцировки опухоли, стадии cT. Достоверно чаще поражение регионарных лимфоузлов было зафиксировано в группе НАХТ (р = 0,002), также статистически значимо чаще в группе НАХТ встречалось наличие лимфоваскулярной инвазии (p = 0,001) и поражение мезоректальной фасции (p = 0,001). Достоверно меньшее расстояние от анального края было у больных, которым на 1 этапе проводили НАХТ.
Данные об осложнениях НАХТ представлены в таблице 2.
У 1 (0,84%) пациента развился острый инфаркт миокарда после окончания НАХТ, который привел к летальному исходу. У 2 (1,7%) пациентов после про-
Таблица 1. Характеристика пациентов
Table 1. Patient characteristics
|
Категория |
Группа НАХТ N = 118 (100 %) |
Группа хирургического лечения N = 103 (100 %) |
Р |
||
|
N |
% |
N |
% |
||
|
Количество пациентов |
118 |
100 |
103 |
100 |
1,00 |
|
Пол |
|||||
|
Женский |
55 |
46,6 |
50 |
48,5 |
0,440 |
|
Мужской |
63 |
53,4 |
53 |
51,5 |
|
|
Возраст |
|||||
|
< 50 |
17 |
14,4 |
25 |
24,3 |
0,060 |
|
> 50 |
101 |
85,6 |
78 |
75,7 |
|
|
Статус по шкале ASA, n (%): |
|||||
|
I |
32 |
27,1 |
32 |
31,1 |
0,733 |
|
II |
68 |
57,6 |
54 |
52,4 |
|
|
III |
18 |
15,3 |
17 |
16,5 |
|
|
Степень гистологической дифференцировки опухоли |
|||||
|
высокодифференцированная |
15 |
12,7 |
20 |
19,4 |
0,597 |
|
умереннодифференцированная |
93 |
78,8 |
75 |
72,8 |
|
|
низкодифференцрованная |
9 |
7,6 |
7 |
6,8 |
|
|
недифференцированная |
1 |
0,8 |
1 |
1,0 |
|
|
сT |
|||||
|
cT1–2 |
8 |
6,8 |
12 |
11,7 |
0,153 |
|
cT3–4 |
110 |
93,2 |
91 |
88,3 |
|
|
cN |
|||||
|
сN0 |
14 |
11,9 |
39 |
37,9 |
0,002 |
|
cN1–2 |
104 |
88,1 |
64 |
62,1 |
|
|
EMVI |
|||||
|
EMVI – |
40 |
33,9 |
67 |
65,0 |
0,001 |
|
EMVI + |
78 |
66,1 |
36 |
35,0 |
|
|
CRM |
|||||
|
CRM – |
87 |
73,7 |
94 |
93,1 |
0,001 |
|
CRM + |
31 |
26,3 |
7 |
6,9 |
|
|
Расстояние от анального края |
|||||
|
10–12,5 см |
84 |
71,2 |
49 |
47,6 |
0,002 |
|
12,6–15 см |
34 |
28,8 |
54 |
52,4 |
|
Таблица 2. Токсичность НАХТ
Table 2. Toxicity of neoadjuvant chemotherapy
При оценке негематологической токсичности тошнота в легкой форме наблюдалась у 1/ 3 пациентов (37 больных, 31,3 %). Диарея и периферическая полинейропатия встречались у 16 (13,5%) и 11 пациентов (9,3%), соответственно.
Сто восемь (91,5%) пациентов завершили все 4 курса ПХТ. Помимо описанных выше 3 случаев кардиологических осложнений, причины прекращения химиотерапевтического лечения были следующие: у 1 (0,84%) пациента в процессе введения оксалиплатина на 1 курсе развился бронхоспазм, далее пациенту проводилась химиолуче-вая терапия (ХЛТ). У 1 (0,84%) пациента был зафиксирован ладонно-подошвенный синдром 3 степени, в связи с чем 4 курс ПХТ не проводился. У 1 (0,84%) больного в процессе прохождения 4 курса ПХТ развилась острая кишечная непроходимость, в связи с чем было выполнено формирование разгрузочной трансверзостомы, а также МРТ малого таза для оценки эффекта от проведенной НАХТ; отмечен частичный ответ, в последующем больному было проведено оперативное вмешательство. Четыре (3,3%) пациента получили только 3 курса ПХТ из-за развития токсичности III степени. После 3 курса у 1 больного (0,84%) выявлен острый тромбоз глубоких вен голени, после чего отменён 4 курс ПХТ.
Таблица 3. Результаты хирургического лечения
Table 3. Results of surgical treatment
|
Показатель |
НАХТ N (%) |
Хирургия N (%) |
P |
|
117 (100%) |
103 (100%) |
||
|
Объем операции |
|||
|
ТМЭ |
86 (73,5%) |
50 (48,5%) |
0,001 |
|
ПМЭ |
31 (26,5%) |
53 (51,5%) |
|
|
Осложнения |
|||
|
I |
12 (10,3%) |
5 (4,8%) |
0,830 |
|
II |
3 (2,6%) |
8 (4,9%) |
|
|
IIIA |
5 (4,2%) |
6 (5,8%) |
|
|
IIIB |
2 (1,7%) |
7 (6,8%) |
|
|
IV |
0 (0,0) |
1 (1,0%) |
|
|
Несостоятельность анастомоза (НА) |
|||
|
Нет |
109 (93,2%) |
89 (86,4%) |
0,072 |
|
Есть |
8 (6,8%) |
14 (13,6%) |
|
|
Частота cфинктеросохраняющих операций |
|||
|
Есть |
117 (100%) |
101 (98,1%) |
0,216 |
|
Нет |
0 (0%) |
2 (1,9%) |
|
|
Доступ |
|||
|
Открытый |
46 (39,3%) |
13 (12,6%) |
0,001 |
|
Лапароскопический |
71 (60,7%) |
90 (87,4%) |
|
|
Частота R0 резекций |
|||
|
R0 |
116 (99,1%) |
103 (100%) |
0,534 |
|
R1 |
1 (0,85%) |
1 (0,97%) |
|
|
Наличие превентивной кишечной стомы |
|||
|
Есть |
80 (68,4%) |
62 (60,2%) |
0,121 |
|
Нет |
37 (31,6%) |
41 (39,8%) |
|
ТМЭ — тотальная мезоректумэктомия
Таблица 4. Результаты патоморфологического ответа (%)
Table 4. Pathological response rate (%)
|
Степени регрессии опухоли по Dworak |
N, % |
|
4 |
16 (13,6%) |
|
3 |
13 (11,0%) |
|
2 |
65 (55,1%) |
|
1 |
24 (20,3%) |
Информация о проведённом хирургическом лечении суммирована в таблице 3.
При оценке результатов хирургического лечения было выявлено, что в группе НАХТ достоверно чаще выполнялась тотальная мезоректумэктомия (ТМЭ) в сравнении с группой хирургического лечения (p = 0,001). Отмечена выраженная тенденция более частого развития НА в группе хирургического лечения без проведения НАХТ (p = 0,07). Летальность после операции не выявлена. У 1 (0,8%) пациента в группе НАХТ по данным гистологического исследования послеоперационного материала выявлен подслизистый
Таблица 5. Патоморфологическая стадия, N (%)
Table 5. Pathomorphological stage, N (%)
|
Стадия |
НАХТ, N (%) |
Хирургия, N (%) |
|
ypT1–2N0M0 |
16 (13,6) |
19 (18,4) |
|
ypT3N0M0 |
44 (37,3) |
34 (33,0) |
|
ypT4aN0M0 |
3 (2,5) |
2 (1,9) |
|
ypT1–4N1–2M0 |
39 (33,1) |
48 (46,6) |
Таблица 6. Соблюдение режима адъювантой химиотерапии
Table 6. Compliance with adjuvant chemotherapy
|
Длительность АХТ |
Хирургия |
НАХТ |
p |
|
3 месяца и более |
82 (80,5%) |
112 (95%) |
< 0,001 |
|
6 месяцев |
59 (57,9%) |
80 (78,3%) |
0,16 |
Таблица 7. Отдаленные результаты лечения
Table 7. Long-term results of treatment
Мы оценили частоту развития лечебного патоморфоза в группе НАХТ (табл. 4).
При анализе результатов патоморфологического исследования выявлено, что у 16 (13,6%) пациентов, получавших НАХТ, отмечался полный патологический ответ (pCR) (4 степень по классификации Dworak). Мы изучили распределение стадий заболевания после гистологического исследования операционного материала (табл. 5).
Данные о соблюдении режима адъювантной химиотерапии представлены в таблице 6.
В нашем исследование из 227 пациентов АХТ в полном объеме (6 месяцев FOLFOX или XELOX) была проведена 93 пациентам (41,0%).
Медиана наблюдения составила 36,0 месяцев в группе хирургического лечения и 35,7 месяцев в группе НАХТ.
Частота развития рецидивов и метастазов представлена в таблице 7.
Частота развития рецидивов была достоверно выше в группе хирургического лечения (p = 0,046).
У 1 пациента по данным гистологического исследования была проведена резекция в объеме R1, что, возможно, явилось вероятной причиной рецидива, у 1 больного исходно в патологический процесс была вовлечена мезоректальная фасция. Трем пациентам после выявления
Таблица 8. Анализ клинических характеристик пациентов с развившимися рецидивами
Table 8. Analysis of clinical characteristics of patients with relapses
|
Показатели |
1-пациент |
2-й пациент |
3-й пациент |
4-й пациент |
|
Возраст |
56 |
62 |
54 |
51 |
|
Пол |
Ж |
М |
М |
М |
|
сTNM |
сT3dN2M0 |
сT3bN0M0 |
сT4aN0M0 |
сT3N2M0 |
|
Протяженность опухоли |
50 мм |
51 мм |
58 мм |
60 мм |
|
CRM |
– |
+ |
– |
+ |
|
EMVI |
+ |
– |
– |
+ |
|
Дифференцировка опухоли |
G1 |
G2 |
G2 |
G2 |
|
Операция |
Парциальная МЭ |
Тотальная МЭ |
Парциальная МЭ |
Парциальная МЭ |
|
Стома |
Илеостома |
Колостома |
Колостома |
Нет |
|
R0 |
R1 |
R0 |
R0 |
R0 |
|
pTNM |
pT1N1M0 |
pT3N0M0 |
pT3N0M0 |
pT3N2M0 |
|
pEMVI |
EMVI + |
pEMVI – |
pEMVI – |
pEMVI + |
|
Дистальная граница резекции (латеральный край резекции) |
0 см |
1 см |
5 см |
1 см |
|
НА |
Нет |
Нет |
Есть |
Нет |
|
Адъювантное лечение |
6 курсов FOFOX |
Нет |
Нет |
Нет |
|
Осложнения ХТ |
Периферическая нейропатия I ст. |
– |
– |
– |
|
Время рецидива п/о |
12 месяцев |
11 месяцев |
7 месяцев |
24 месяца |
|
Локализация рецидива |
В зоне анастомоза |
В зоне анастомоза |
В зоне анастомоза |
Внекишечный рецидив |
|
Лечение рецидива |
ХТ |
БПЭ с резекцией крестца на уровне S4. |
БПЭ с резекцией крестца на уровне S4. |
Резекция мочеточника слева и прямой кишки |
Таблица 9. Влияние факторов на БРВ — однофакторный регрессионный анализ (Cox-регрессия)
Table 9. Influence of factors on RFS — univariate regression analysis (Cox regression)
Частота метастазирования в исследуемых группах достоверно не различалась (р = 0,293).
Нами был проведен однофакторный анализ критериев, которые могли повлиять на показатели 3-летней безреци-дивной выживаемости, данные представлены в таблице 9.
При проведении однофакторного анализа выявлено достоверное влияние на БРВ следующих факторов: возраст, наличие послеоперационных осложнений, проведение парциальной МЭ и сфинктеросохраняющих операций. Данные представлены в таблице 8.
При проведении многофакторного анализа на риск прогрессирования достоверное влияние сохранял только возраст (OР 1,07; 95% ДИ 1,01–1,13; p = 0,01).
Графики 3-летней безрецидивной и общей выживаемости представлены на рисунках 1 и 2.
При анализе 3-летней безрецидивной и общей выживаемости достоверные различия не были выявлены. Медиана наблюдения составила 36,0 месяцев. Трехлетняя БРВ в группе НАХТ составила 90,7%, в хирургической группе — 93,6% (p = 0,91), а 3-летняя ОВ составила 94,5% и 98,5%, соответственно (p = 0,698) (рис. 2).
ОБСУЖДЕНИЕ
Наше исследование является одним из немногих, где сравнивается проведение НАХТ и хирургического лечения в/а РПК. В ходе нашего исследования установлено, что проведение НАХТ не влечет дополнительных рисков для пациента, однако проведение НАХТ на первом этапе лечения достоверно не влияет на ОВ и БРВ. Тем не менее,
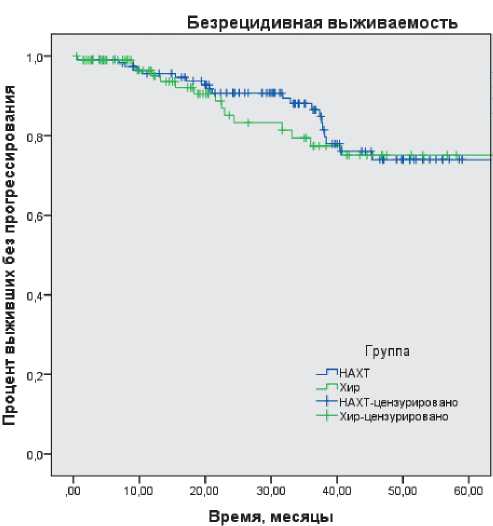
Рисунок 1. БРВ пациентов в зависимости от тактики лечения
в
*
л ш
ф
-
Figure 1. Relapse-free survival of patients depending on treatment tactics
0,6-
0,4-
0,2-
0,0-
,00
Группа
-ПНАХТ
—пхир
4“ НАХТ-цензуриро в ано
—Н Хир-цанзурировано
10,00 20,00 30,00 40,00 50,00 60,00
Время, месяцы
Рисунок 2. ОВ пациентов в зависимости от тактики лечения
-
Figure 2. Overall survival of patients depending on treatment
отсутствие влияния на выживаемость, вероятно, может объясняться не столько отсутствием эффекта НАХТ, сколько разнородностью наших исследуемых групп. Следует обратить внимание на ряд прогностических факторов, таких как локализация опухоли, частота поражения лимфатических узлов, которые были достоверно лучше в группе хирургического лечения, но, несмотря на это, результаты в группах НАХТ и хирургии практически не различаются. Возможно, потенциальное улучшение прогноза за счет клинических характеристик пациентов нивелировалось проведением НАХТ. Мы показали, что НАХТ улучшает локальный контроль при в/а РПК.
Таким образом, мы не достигли первичной конечной точки нашего исследования. Показатели 3-летней БРВ были идентичны в исследуемых группах и составили в группе НАХТ 90,7%, в хирургической группе — 93,6% (p = 0,91), что сходно с данными рандомизированного исследования FOWARC, в котором сравнивали все возможные три подхода лечения при РПК вне зависимости от локализации опухоли в определенном отделе прямой кишки. Авторы данной работы, как и мы, не получили достоверного преимущества ни одной такой тактики лечения: 3-летнняя БРВ в группе пациентов, которые получали 4 или 6 курсов ХТ по схеме mFOLFOX6 составила 90,7%, а в группе пациентов, получающих ХТ по схеме mFOLFOX6 и ЛТ — 89,1% [12].
Напротив, Miwa с соавт. в своем рандомизированном исследовании 2 фазы, где сравнивались эффективность и безопасность ХТ по схеме SOX (S-1 + оксалиплатин) с mFOLFOX6 в качестве НАХТ без проведения ЛТ при локализованном РПК, показали худшие результаты 3-летней БРВ по сравнению с нашими данными: в группе SOX 3-летняя БРВ составила 69,5% в сравнении с 73,4% в группе mFOLFOX (р = 0,5315) [7]. Также более низкие показатели по сравнению с нашими результатами показали Ding с соавт., на основании ретроспективного исследования, в котором сравнивали схемы ХТ mFOLFOXIRI и mFOLFOX 6, при этом 3-летняя БРВ составила 75% и 66,7% соответственно ( р = 0,047) [13]. В работе Matsuda с соавт. при изучении режима ХТ XELOXIRI при РПК 3-летняя БРВ составила 77,3% [5]. K. Toritani с соавт. в проспективном исследовании 2 фазы изучали эффективность ХТ по схеме mFOLFOX6 + панитумумаб. БРВ в данной работе составила 79,0% [14].
Напротив, в исследовании FOXTROT, где сравнивали НАХТ и хирургическое лечение при раке ободочной кишки, авторами были получены достоверно более высокие результаты 2-летней БРВ в сравнении с нашими: 2-летняя БРВ в группе НАХТ составила 83,1% в сравнении с 78,5% в хирургической группе (ОР 0,72; 95%ДИ 0,54–0,98) [4].
По данным разных исследований при хирургическом лечении данный показатель составляет от 71,5% до 94,4%. В работах, где применялась НАХТ, данный показатель составляет от 66,7% до 90,7 [4,5,7,12–14].
Однако, следует обратить внимание на то, что в нашем исследовании в группе НАХТ была достоверно ниже частота рецидивов РПК — 0% (р = 0,046).
В работах других авторов частота развития рецидивов составила от 0% до 13,9% [6,12,13,15–17].
В нашей работе частота развития рецидивов в хирургической группе была достоверно выше и составила 3,9% (р = 0,046).
Схожие данные по частоте развития рецидивов сообщают авторы крупного рандомизированного исследования MERCURY, в котором у 92% пациентов была выполнена резекция в объеме RO, а частота рецидивов составила 3,3 % [18]. Также Mathis и соавт. в своем ретроспективном исследовании, включающем 655 больных РПК, в котором хирургическое вмешательство в объеме передней резекции либо брюшно-промежностной экстирпации (БПЭ) прямой кишки выполнялось без предоперационного лечения, частота рецидивов составила 4,3% при медиане наблюдения 62 месяца [17].
Несмотря на отсутствие повышения БРВ в группе НАХТ, в нашем исследовании достоверно ниже была частота развития рецидивов, что может говорить об эффективности данного подхода.
При проведении нами многофакторного анализа для определения факторов, способных влиять на БРВ, был выделен лишь 1 фактор — возраст, то есть с повышением возраста риск прогрессирования растет (p = 0,01). Jing с соавторами в своем популяционном исследовании, в котором идентифицировали 226430 больных колоректальным раком, пришли к выводу, что возраст старше 60 лет ассоциирован с худшими результатами 5-летней ОВ и 5-летней раковоспецифичной выживаемости (p = 0,001) [19]. Также Kim и соавт. в ретроспективном исследовании (79 пациентов), сравнив результаты лечения больных РПК со стадией сT2–3N0 с предоперационной ХЛТ и без предоперационного лечения, отметили пожилой возраст как неблагоприятный фактор, влияющий на 5-летнюю ОВ (p = 0,045) [20]. В нашей работе только возраст при проведении многофакторного анализа достоверно влиял на БРВ. Это отличается от большинства аналогичных работ [19,20]. Возможными причинами являются низкая точность МРТ-стадирования (в рамках ретроспективного исследования не было возможности выполнить пересмотр исследований и контроль качества МРТ, пациенты получали лечение в разные временные периоды, нельзя исключить различное качество диагностики в исследуемых группах), а также сравнительно небольшой размер исследуемых групп.
При анализе частоты завершения АХТ в полном объеме было выявлено, что в нашей работе почти половина пациентов в хирургической группе не нуждалась в адъювантной ХТ. В мета-анализе, в котором изучалась диагностическая точность МРТ исследования для оценки категории T, N и поражения циркулярного края резекции при раке прямой кишки, авторы отмечают низкую точность МРТ исследования критерии N, специфичность составила 71% [21]. Эти недостатки могут быть преодолены только путем проведения проспективного рандомизированного исследования с двойным контролем МРТ стадирования.
Напротив, Shiraishi с соавт. в своем ретроспективном исследовании (102 пациента) по эффективности проведения НАХТ без применения ЛТ при нижнеампулярном РПК, проведя многофакторный анализ методом Cox-ре- грессии, сообщают о других прогностических факторах, таких как степень регрессии объема опухоли (p = 0,002) и усEMVI (экстрамуральная сосудистая инвазия после НАХТ) (p = 0,01) [21]. В литературе описаны и другие прогностические факторы для БРВ, например, наличие опухолевых депозитов, патологические стадии ypTNM II или III степени, критерии cT, пол и pTmac/pTmic (степени патологического ответа) [6,12,22].
В нашем исследовании частота pCR составила 13,6%, что схоже с результатами исследования CONVERT с 663 пациентами, в котором также сравнивалась НАХТ по схеме CAPOX с пролонгированным курсом ХЛТ, при этом частота pCR в группе НАХТ составила 11,0% [24]. Shrang с соавт. в пилотном исследовании с 32 пациентами продемонстрировали многообещающие результаты c 25% частотой pCR, хорошим уровнем ответа на проведенные 6 курсов ХТ по схеме FOLFOX + бевацизумаб [15].
В исследовании CORONA I использовался режим СAPOX (4 курса) в качестве НАХТ, результаты были схожи с нашими: частота pCR составила 12%, однако снижение стадии N на фоне лечения было выявлено в 56,7% случаев [24], что выше, чем в нашей работе, в которой процент снижения стадии N (от сN + до ypN0) составил 34,7% в группе НАХТ. Различный ответ на ХТ в указанных исследованиях можно объяснить проведением разных режимов ХТ (например, с добавлением таргетных препаратов) и различными временными промежутками между окончанием ХТ и операцией. Полный курс НАХТ в нашем исследовании окончили 91,5% пациентов, что сопоставимо с другими исследованиями, в которых данный показатель составил от 73 % до 91 % [24–27].
В нашей работе достоверно больше пациентов в хирургической группе оперировались с применением лапароскопического доступа по сравнению с открытым доступом, однако это может быть связано с тем, что мы собирали данные за достаточно длительный временной промежуток, и подходы врачей могли меняться.
При изучении нами гематологической токсичности наиболее часто встречалась нейтропения (9,3 % случаев), в том числе частота нейтропении III–IV степени составляла 2,5%, что меньше, чем в исследовании UNICANCER— PRODIGE, в котором описана частота нейтропении III степени — 12% [28], возможно это было связано с лучшей переносимости режима CAPOX в нашем исследовании, в сравнении с режимом FOLFIRINOХ в исследовании UNICANCER — PRODIGE.
Что касается негематологической токсичности, тошнота отмечалась у трети пациентов (31,1% случаев), среди них рвота развилась у 7,6% пациентов, причем во всех случаях отмечалась клинически незначимая I степень рвоты. Kenichiro c соавт. в своем проспективном исследовании, включающем 50 пациентов, получавших FOLFOX6 с пани-тумумабом, сообщают о 4% случаев развитие рвоты [14]. Однако в 1 (0,84%) случае отмечался летальный исход после ХТ от острого инфаркта миокарда. Glynne-Jones и соавт. в своем исследовании, включающем около 20 пациентов, сообщили об 1 (5%) случае развития острого инфаркта миокарда на фоне ХТ по схеме FOLFOX + бевацизумаб [29]. Также у 1 (0,84%) пациента в процессе 4 курса ПХТ развилась острая кишечная непроходимость, после чего была сформирована разгрузочная трансверзостома. О подобного рода тяжелых осложнениях ПХТ также сообщили Uehara c соавт.: на фоне непроходимости у 1 (3,1%) пациента выявили перфорацию толстой кишки [27].
При анализе результатов хирургического лечения, по нашим данным, была выявлена тенденция к более высокой частоте НА в хирургической группе (13,6%) по сравнению с группой НАХТ c частотой 6,8%, однако достоверных различий между группами по данному параметру зафиксировано не было (p = 0,07). В исследовании CONVERT, упомянутом выше, в котором сравнивали НАХТ и ХЛТ, достоверных различий между группами не было получено, а частота НА в группе НАХТ составила 5,9% (p = 0,913) [23].
К недостаткам нашей работы следует отнести несопоставимость исследуемых групп по ряду ключевых клинических параметров, включая клинические данные о поражении регионарных лимфатических узлов, расположение опухоли от анального края и частоту выполнения ТМЭ. Эти недостатки связаны с ретроспективным дизайном работы, отсутствием единых принципов селекции больных для проведения НАХТ или только хирургического лечения в разные годы набора материала. В связи с этим данную работу можно считать лишь предварительным анализом, данные которого могут учитываться при планировании последующих проспективных исследований. Также следует отметить, что медиана наблюдения для хирургической группы составила 36,0 месяцев, а в группе НАХТ — 35,7 месяцев. Мощность исследования недостаточна для окончательного ответа на цель работы из-за того, что не все пациенты завершили 3-летний период наблюдения.
ЗАКЛЮЧЕНИЕ
НАХТ имеет приемлемый профиль токсичности, не ухудшает онкологические результаты лечения и потенциально может быть альтернативой курсу ЛТ 5 × 5 Гр у отобранной группы пациентов. Для окончательного решения вопроса о роли данного метода лечения необходимо проведение проспективного рандомизированного исследования. Контроль качества МРТ-стадирования является принципиальным при проведении подобной работы. С учётом полученных данных мы инициировали рандомизированное клиническое исследование с двойным контролем качества МРТ-стадирования — RuCorT-01.
Список литературы Хирургическое лечение или неоадъювантная химиотерапия при раке верхнеампулярного отдела прямой кишки: ретроспективное исследование
- Kochkina S.O., Gordeev S.S., Fedyanin M.Yu., et al. Results of combined treatment with neoadjuvant chemotherapy without radiation therapy and a short-course of radiation therapy in patients with intermediate-risk rectal cancer. Clinical and Experimental Surgery. 2021;9(1):29-36. (In Russ.). https://doi.org/10.33029/2308-1198-2021-9-1-29-36.
- Hu Z., Ding J., Ma Z., et al. Quantitative evidence for early metastatic seeding in colorectal cancer. Nature Genet 2019;51(7):1113-1122. https://doi.org/10.1038/s41588-019-0423-x
- Zeamari S., Roos E., Stewart F.A. Tumour seeding in peritoneal wound sites in relation to growth-factor expression in early granulation tissue. Eur J Cancer 2004;40(9):1431-1440. https://doi.org/10.1016/j.ejca.2004.01.035
- Morton D., Seymour M., Laura Magill, et al. Preoperative chemotherapy for operable colon cancer: Mature results of an international randomized controlled trial. J Clin Oncol 2023;41(8):1541-1552. https://doi.org/10.1200/JCO.22.00046
- Matsuda C., Kudo T., Morimotoet Y., et al. A phase II study of neoadjuvant capecitabine, oxaliplatin, and irinotecan (XELOXIRI) in patients with locally advanced rectal cancer. Ann Gastroenterol Surg 2023;7(1):81-90. https://doi.org/10.1002/ags3.12600
- Tomida, A., Uehara K., Hiramatsuet K., et al. Neoadjuvant CAPOX and bevacizumab alone for locally advanced rectal cancer: long-term results from the N-SOG 03 trial. Int J Clin Oncol 2019;24(4):403-410. https://doi.org/10.1007/s10147-018-1372-6
- Miwa K., Oki E., Enomotoet M., et al. Randomized phase II study comparing the efficacy and safety of SOX versus mFOLFOX6 as neoadjuvant chemotherapy without radiotherapy for locally advanced rectal cancer (KSCC1301). BMC Cancer 2021;21(1):23 https://doi.org/10.1186/s12885-020-07766-5
- Bondeven P., Laurberg S., Hagemann-Madsen R.H., Pedersen B. Suboptimal surgery and omission of neoadjuvant therapy for upper rectal cancer is associated with a high risk of local recurrence. Colorectal Dis 2015;17 (3) 216-224. https://doi.org/10.1111/codi.12869
- Schwartz L.H., Litière S., de Vries E., et al. RECIST 1.1-Update and clarification: From the RECIST committee. Eur J Cancer 2016;62:132-137. https://doi.org/10.1016/j.ejca.2016.03.081
- Van Rooijen S., Huisman D., Stuijvenberget M., et al. Intraoperative modifiable risk factors of colorectal anastomotic leakage: why surgeons and anesthesiologists should act together. Int J Surg 2016;36 (Pt A): 183-200. https://doi.org/10.1016/j.ijsu.2016.09.098
- Dworak O., Keilholz L., Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorectal Dis 1997;12(1):19-23. https://doi.org/10.1007/s003840050072
- Deng Y., Chi P., Lan P., et al. Neoadjuvant modified FOLFOX6 with or without radiation versus fluorouracil plus radiation for locally advanced rectal cancer: final results of the Chinese FOWARC trial. J Clin Oncol 2019;37(34):3223-3233. https://doi.org/10.1200/JCO.18.02309
- Ding M., Zhang J., Hu H., et al. mFOLFOXIRI versus mFOLFOX6 as neoadjuvant chemotherapy in locally advanced rectal cancer: A Propensity Score Matching Analysis. Clin Colorectal Cancer 2022;21 (1) e12-e20. https://doi.org/10.1016/j.clcc.2021.11.009
- Toritani K., Watanabe J., Suwa Y., et al. A prospective, single-arm, multicenter trial of neoadjuvant chemotherapy with mFOLFOX6 plus panitumumab without radiotherapy for locally advanced rectal cancer. Int J Colorectal Dis 2020;35(12):2197-2204. https://doi.org/10.1007/s00384-020-03693-w
- Schrag D., Weiser M.R., Goodman K.A., et al. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol 2014;32(6):513-8. https://doi.org/10.1200/JCO.2013.51.7904
- Zhang W., Zhou H., Jiang J., et al. Neoadjuvant chemotherapy with modified FOLFOXIRI for locally advanced rectal cancer to transform effectively EMVI and MRF from positive to negative: results of a long-term single center phase 2 clinical trial. BMC Cancer 2023;23(1):592 https://doi.org/10.1186/s12885-023-11103-x
- Mathis K.L., Larson D.W., Dozois E.J., et al. Outcomes following surgery without radiotherapy for rectal cancer. Br J Surg 2012;99(1):137-143. https://doi.org/10.1002/bjs.7739
- Taylor F.G., Quirke P., Heald R.J., et al. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II, and III rectal cancer best managed by surgery alone: a prospective, multicenter, European study. Ann Surg 2011;253(4):711-9. https://doi.org/10.1097/SLA.0b013e31820b8d52
- Li J., Wang Z., Yuan X., et al. The prognostic significance of age in operated and non-operated colorectal cancer. BMC Cancer 2015;15:83. https://doi.org/10.1186/s12885-015-1071-x
- Kim J.G., Song K.D., Chaet D.I., et al. Indistinguishable T2/T3-N0 rectal cancer on rectal magnetic resonance imaging: comparison of surgery-first and neoadjuvant chemoradiation therapy-first strategies. Int J Colorectal Dis 2018;33(10):1359-1366. https://doi.org/10.1007/s00384-018-3131-6
- Shiraishi T., Sasaki T., Ikeda K., et al. Predicting prognosis according to preoperative chemotherapy response in patients with locally advanced lower rectal cancer. BMC Cancer 2019;19(1):1222 https://doi.org/10.1186/s12885-019-6424-4
- Díaz-González J.A., Calvo F.A., Cortés J., et al. Prognostic factors for disease-free survival in patients with T3-4 or N + rectal cancer treated with preoperative chemoradiation therapy, surgery, and intraoperative irradiation. Int J Radiat Oncol Biol Phys 2006;64(4):1122-8. https://doi.org/10.1016/j.ijrobp.2005.09.020
- Mei W.-J., Wang X.-Z., Li Y.-F., et al. Neoadjuvant chemotherapy with CAPOX versus Chemoradiation for Locally Advanced Rectal Cancer with Uninvolved Mesorectal Fascia (CONVERT): initial results of a phase III trial. Ann Surg 2023;277(4):557-564. https://doi.org/10.1097/SLA.0000000000005780
- Kamiya T., Uehara K., Nakayama G., et al. Early results of multicenter phase II trial of perioperative oxaliplatin and capecitabine without radiotherapy for high-risk rectal cancer: CORONA I study. Eur J Surg Oncol 2016;42(6):829-35. https://doi.org/10.1016/j.ejso.2016.02.014
- Fernandez-Martos C., Estevan R., Pijaume C.P., et al. Neoadjuvant capecitabine, oxliplatin, and bevacizumab (CAPOX-B) in intermediate-risk rectal cancer (RC) patients defined by magnetic resonance (MR): GEMCAD 0801 trial. Journal of Clinical Oncology 2012;30(15_suppl):3586-3586. https://doi.org/10.1200/jco.2012.30.15_suppl.3586
- Hasegawa J., Nishimura J., Mizushimaet T., et al. Neoadjuvant capecitabine and oxaliplatin (XELOX) with bevacizumab for locally advanced rectal cancer. Cancer Chemother Pharmacol 2014;73(5):1079-87. https://doi.org/10.1007/s00280-014-2417-9
- Uehara K., Hiramatsu K., Maeda A., et al. Neoadjuvant oxaliplatin and capecitabine and bevacizumab without radiotherapy for poor-risk rectal cancer: N-SOG 03 phase II trial. Japanese journal of clinical oncology 2013;43(10):964-971. https://doi.org/10.1093/jjco/hyt115
- Conroy T., Bosset J.-F., Etienne P.-L., et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22(5):702-715. https://doi.org/10.1016/S1470-2045(21)00079-6
- Glynne-Jones, R., et al. BACCHUS: A randomised non-comparative phase II study of neoadjuvant chemotherapy (NACT) in patients with locally advanced rectal cancer (LARC). Heliyon, 2018.4(9):p.e00804.


