Хирургическое лечение ишемической болезни сердца у пациентов с низкой фракцией выброса левого желудочка на работающем сердце в условиях искусственного кровообращения: непосредственные результаты
Автор: Чернявский Александр Михайлович, Несмачный Алексей Сергеевич, Бобошко Александр Владимирович, Николаев Дмитрий Андреевич, Бобошко Владимир Александрович, Эфендиев Видади Умудович, Подсосникова Татьяна Николаевна, Рузматов Тимур Махмуджанович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 1 т.19, 2015 года.
Бесплатный доступ
Цель. Оценить функцию левого желудочка (ЛЖ), осложнения и госпитальную летальность при хирургическом лечении ишемической болезни сердца (ИБС) у больных с низкой фракцией выброса (ФВ) ЛЖ при разных условиях обеспечения гемодинамики. Материал и методы. В проспективном рандомизированном исследовании приняли участие 60 пациентов с ИБС, осложненной выраженной дисфункцией ЛЖ (ФВ
Ишемическая болезнь сердца, дисфункция левого желудочка, бьющееся сердце, искусственное кровообращение, гемодинамическая поддержка
Короткий адрес: https://sciup.org/142140655
IDR: 142140655 | УДК: 616.127-005.4-089.166-78
Текст научной статьи Хирургическое лечение ишемической болезни сердца у пациентов с низкой фракцией выброса левого желудочка на работающем сердце в условиях искусственного кровообращения: непосредственные результаты
Ишемическая болезнь сердца в настоящее время наиболее распространенная причина сердечной недостаточности (СН) [1]. Операция прямой реваскуляризации миокарда улучшает как клиническую картину, так и прогноз у больных ИБС со сниженной функцией ЛЖ [2], но ассоциируется с более высокой летальностью и заболеваемостью по сравнению с пациентами с нормальной функцией ЛЖ [3]. Функция ЛЖ – один из главных предикторов выживаемости у пациентов с ИБС, а также важный критерий госпитальной и отдаленной летальности при сердечной недостаточности, обусловленной ишемической болезнью сердца.
Несмотря на улучшение за последние годы медикаментозной терапии и хирургической техники, проблема лечения ИБС с низкой фракцией выброса (ФВ) левого желудочка остается сложной и актуальной. Современные методы лечения – интенсивная медикаментозная терапия, хирургическая реваскуляризация миокарда, реконструкция ЛЖ и трансплантация сердца – продлевают жизнь пациентам с низкой ФВ ЛЖ. Изолированное коронарное шунтирование показывает лучшие результаты в отдаленной выживаемости по сравнению с медикаментозной терапией у пациентов с низкой ФВ ЛЖ [2].
При выполнении аортокоронарного шунтирования (АКШ) по стандартной методике используется искусственное кровообращение (ИК) и кардиоплегия (КП) для обеспечения оптимальных условий во время реваскуляризации. Эта техника связана с созданием вынужденной глобальной ишемии миокарда посредством специальных растворов. Однако какой бы раствор ни использовался для кардиоплегии, синдром низкого сердечного выброса встречается примерно в 10% случаев [5]. В течение последнего десятилетия вновь появился интерес к операциям на работающем сердце, которые позволяют избежать агрессивного действия ИК и кардиоплегии и, как следствие, глобальной ишемии миокарда. Проведенные исследования демонстрируют, что АКШ, выполненное пациентам с нормальной ФВ ЛЖ на работающем сердце без использования ИК, показывает лучшие ранние результаты в отношении функции ЛЖ по сравнению с АКШ, выполненной по стандартной методике [6]. Применение данной техники может быть полезно для пациентов с сердечной недостаточностью, однако ставится под сомнение возможность интраоперационной поддержки адекватного сердечного выброса во время манипуляций с сердцем, необходимых для реваскуляризации миокарда без ИК. Использование гибридной процедуры реваскуляризации миокарда на работающем сердце в условиях ИК (для обеспечения механической поддержки системного кровообращения) может предоставить некоторые преимущества для пациентов высокого риска при выполнении подобных операций.
В исследовании мы сравнили гибридную технику хирургического лечения ИБС на бьющемся сердце в условиях ИК со стандартной техникой АКШ с использованием кардиоплегии у больных ИБС с низкой ФВ ЛЖ.
Целью данной работы явилась оценка функции ЛЖ, осложнений и госпитальной летальности при хирургическом лечении ИБС у больных с низкой ФВ ЛЖ при разных условиях обеспечения гемодинамики.
Материал и методы
В проспективном рандомизированном исследовании учавствовали 60 пациентов с ИБС, осложненной выраженной дисфункцией левого желудочка (ФВ <35%), оперированных в период с января 2012 г. по январь 2014 г. Пациентов рандомизировали на две группы: в первой группе (ИК + БС) операция реваскуляризации миокарда выполнялась на работающем сердце в условиях параллельного ИК (n = 30), во второй (ИК + КП) – на кардиоплегически остановленном сердце в условиях нормотермического ИК (n = 30). Критерии включения: инфаркт миокарда (ИМ) в анамнезе, стенокардия напряжения, II–IV функциональный класс (ФК) хронической СН по NYHA, ФВ ЛЖ ≤ 35%, показания к АКШ (выставлялись согласно рекомендациям для коронарной хирургии) [7].
Функцию левого желудочка оценивали с помощью Эх-оКГ. Пациентам с аневризмой левого желудочка для определения способа реконструкции выполняли математическое моделирование расчета площади выключения рубца на основании данных ЭхоКГ по принятой в институте методике [8].
В обеих группах для профилактики сердечной недостаточности в предоперационном периоде применяли: внутриаортальную баллонную контрпульсацию (ВАБК) или левосимендан [9]. Способ превентивной поддержки гемодинамики определяли методом рандомизации.
Хирургическое вмешательство проводили у всех пациентов с применением интубационного наркоза в условиях превентивной поддержки функции ЛЖ. Доступ к сердцу осуществляли через срединную стернотомию с выделением левой внутренней грудной артерии. В качестве кондуитов также использовали большую подкожную вену нижней конечности и лучевую артерию.
Все операции выполняли в условиях нормотермического ИК. Канюляцию производили по стандартной методике: в аорту и правое предсердие. Объемную скорость перфузии поддерживали на уровне 2,5 л/(мин · м2). Артериальное давление поддерживали в пределах 60–80 мм рт. ст. С целью кардиоплегии однократно вводили раствор кустодиола в дозе 20 мл/кг. У всех пациентов первоначально выполняли дистальный анастомоз графта с коронарной артерией. Проксимальные анастомозы с восходящей аортой проводили после наложения всех дистальных анастомозов с боковым пережатием стенки аорты. При операции на бьющемся сердце применяли вакуумный стабилизатор миокарда. В случае наличия
Таблица 1 Предоперационная характеристика пациентов
|
Показатель |
ИК + БС, n = 30 |
ИК + КП, n = 30 |
р |
|
Возраст, лет |
59±8 |
58±6 |
0,8 |
|
Пол (мужчины), n (%) |
29 (97) |
27 (90) |
0,8 |
|
Инфаркт в анамнезе, n (%) |
30 (100) |
30 (100) |
1,0 |
|
ФК стенокардии, n (%) |
|||
|
1 |
2 (7) |
0 |
0,1 |
|
2 |
2 (7) |
2 (7) |
1,0 |
|
3 |
22 (72) |
25 (83) |
0,4 |
|
4 |
2 (7) |
1 (3) |
0,5 |
|
Нестабильная стенокардия, n (%) |
2 (7) |
2 (7) |
0,6 |
|
ФК СН по NYHA, n (%) |
|||
|
2 |
4 (14) |
1 (3) |
0,1 |
|
3 |
26 (86) |
28 (94) |
0,3 |
|
4 |
– |
1 (3) |
– |
|
Сахарный диабет, n (%) |
5 (17) |
8 (27) |
0,3 |
|
Атеросклероз БЦА, n (%) |
9 (30) |
14 (47) |
0,2 |
|
Инсульт в анамнезе, n (%) |
6 (20) |
3 (10) |
0,3 |
|
Артериальная гипертензия, n (%) |
24 (80) |
27 (90) |
0,4 |
|
ХПН, n (%) |
5 (17) |
2 (7) |
0,3 |
|
ХОБЛ, n (%) |
8 (27) |
4 (14) |
0,2 |
|
ФП до операции, n (%) |
2 (10) |
6 (20) |
0,1 |
|
Желудочковая экстрасистолия, n (%) |
4 (14) |
3 (10) |
0,5 |
|
EuroScore, баллы |
5,9±2,4 |
5,6±2,3 |
0,8 |
|
Predict death rate, % |
7 (4; 10) |
5 (4; 11) |
0,5 |
|
Курение, n (%) |
24 (80) |
20 (67) |
0,4 |
|
ФВ ЛЖ, % |
30 (26; 33) |
31 (27; 33) |
0,5 |
БЦА – брахиоцефальные артерии, ХПН – хроническая почечная недостаточность, ХОБЛ – хроническая обструктивная болезнь легких, ФП – фибрилляция предсердий аневризмы ЛЖ выполняли его реконструкцию на основании данных предоперационного моделирования по принятой в Институте методике [8].
Критерии исключения: предшествующее кардиохирургическое вмешательство, патология клапанов сердца (ишемическая митральная недостаточность 3–4 ст.), значимое атеросклеротическое поражение сосудов нижних конечностей; внесердечные заболевания с ожидаемой продолжительностью жизни менее 1 года.
Статистический анализ полученных результатов проводили с помощью программы Statistica 8.0. Для оценки нормальности распределения количественных признаков применяли визуальную оценку частотного распределения с последующим использованием критерия Колмогорова – Смирнова. Данные из совокупностей с нормальным распределением сравнивали с помощью t-критерия Стьюдента для независимых выборок. Сравнение данных из совокупностей с распределением, отличающимся от нормального, проводили с применением U-критерия Манна – Уитни. Сравнения качественных признаков осуществляли точным критерием
Фишера – Фримена – Холтера. Непараметрические количественные признаки приведены в виде медианы и границ межквартильного интервала. Статистически значимыми приняты различия при р <0,05.
Результаты
Основные демографические и клинические характеристики пациентов обеих групп достоверно между собой не различались (табл. 1).
Время операции и количество дистальных анастомозов были схожими в обеих группах. Группы не отличались по применению того или иного способа превентивной гемодинамической поддержки: в 50% (n = 15) случаев в каждой группе применялся ВАБК и в 50% (n = 15) – левосимендан. В качестве шунта к передней нисходящей артерии (ПНА) у всех пациентов использовали левую внутреннюю грудную артерию (ЛВГА). Всего в группе ИК + БС выполнили 62 дистальных анастомоза (30 артериальных) и 70 дистальных анастомозов (30 артериальных) в группе ИК + КП (р = 0,3). Таким образом, полнота реваскуляризации на работающем сердце
Таблица 2 Интраоперационные и послеоперационные данные обеих групп пациентов
|
Показатель |
ИК + БС, n = 30 |
ИК + КП, n = 30 |
р |
|
Кол-во дистальных анастомозов, n (%) |
|||
|
1 |
7 (23) |
4 (13) |
0,3 |
|
2 |
14 (46) |
12 (40) |
0,6 |
|
3 |
9 (31) |
14 (47) |
0,2 |
|
Реконструкция ЛЖ, n (%) |
12 (40) |
12 (40) |
1,0 |
|
ИКД, n (%) |
1 (3) |
2 (7) |
0,5 |
|
Длительность ИК, мин |
73 (57; 84) |
63 (58; 77) |
0,4 |
|
Окклюзия аорты, мин |
– |
41 (33; 56) |
– |
|
Время операции, мин |
180±26 |
175±26 |
0,7 |
|
ВАБК, n (%) |
15 (50) |
15 (50) |
1,0 |
|
Левосимендан, n (%) |
15 (50) |
15 (50) |
1,0 |
|
Длительность ИВЛ, ч |
8 (6; 15) |
8 (7;10) |
0,8 |
|
Темп дренажных потерь (1-е сутки), мл/кг |
5 (3; 7) |
4 (3;5) |
0,2 |
|
Темп дренажных потерь (суммарный), мл/кг |
12 (9; 17) |
11 (8; 14) |
0,08 |
|
Инотропная поддержка, n (%) |
18 (60) |
25 (83) |
0,7 |
Таблица 3 Характеристика послеоперационных осложнений
Как видно из табл. 2, группы не отличались друг от друга по длительности искусственной вентиляции легких (ИВЛ), темпу дренажных потерь и количеству пациентов, потребовавших инотропной поддержки в раннем послеоперационном периоде.
Общая характеристика и частота встречаемости послеоперационных осложнений по большинству событий были сопоставимы в обеих группах (табл. 3).
Однако нарушения ритма сердца по типу ФП в послеоперационном периоде чаще наблюдались у пациентов, оперированных на кардиоплегически остановленном сердце: в 3 (10%) и 10 (33%) случаях в группах ИК + БС и ИК + КП соответственно, р = 0,03. Среднее время пребывания пациентов в палате интенсивной терапии (ПИТ) и длительность госпитализации статистически значимо между группами не отлича-
Оценка глобальной сократимости исследуемых групп выявила статистически значимое увеличение ФВ ЛЖ в ранние сроки после операции в обеих группах (рис. 2).
Тем не менее, подробный анализ показателей функции ЛЖ по данным ЭхоКГ выявил статистически значимое снижение индекса конечного систолического объема ЛЖ в группе БС на 17 (26; 7) мл/м2 против 10 (29; 7) мл/м2 в группе КП (р = 0,05) (табл. 4).
Госпитальная летальность была выше в группе ИК + БС, но не являлась статистически значимой: 3% (n = 1) в группе ИК + КП и 7% (n = 2) в группе ИК + БС, р = 0,5. Причиной госпитальной летальности в одном случае стало угнетение гемодинамики через фибрилляцию желудочков, в двух случаях – прогрессирующая сердечная недостаточность.
Обсуждение
Дисфункция ЛЖ – один из наиболее важных факторов повышения заболеваемости и летальности в интраоперационном и послеоперационном периодах при выполнении операций на сердце у пациентов с низкой ФВ ЛЖ. Одной из основных проблем при кардиохирургических вмешательствах у таких пациентов является защита миокарда. Несмотря на новые методы защиты миокарда, усовершенствование анестезиологического обеспечения и хирургической техники, избежать послеоперационных осложнений, связанных с интраоперационной ишемией сердца, до сих пор не удает- ся [10]. Теоретически, идеальным решением этой проблемы являются альтернативные технологии, такие как операции на работающем сердце без использования ИК или на работающем сердце в условиях ИК. Различные исследования показали, что операции на работающем сердце без ИК безопасны и демонстрируют удовлетворительные краткосрочные клинические результаты в сравнении с традиционным АКШ [11]. Несмотря на эффективность и безопасность техники выполнения АКШ на работающем сердце без ИК, существуют мнения о возможной неполной реваскуляризации при выполнении таких операций, что приводит к рецидиву стенокардии, снижению выживаемости, а также необходимости повторных вмешательств в отдаленные сроки после операции. Более того, одно из важных недостатков этого метода – ухудшение гемодинамики, которое может произойти во время манипуляций с сердцем и, как следствие, потребовать экстренного подключения ИК. Конверсия при таких операциях связана с плохим прогнозом и повышением госпитальной летальности [12]. В связи с повышенным риском возникновения гемодинамических нарушений, неполной реваскуляризацией миокарда и высокой вероятностью повторных хирургических вмешательств, связанных с выполнением АКШ на работающем сердце без ИК, в качестве альтернативы была предложена техника использования ИК без окклюзии аорты.
Мы исследовали эффективность техники АКШ на работающем сердце в условиях ИК у пациентов с дисфункцией левого желудочка в сочетании с превентивной гемодинамической поддержкой. Наши результаты демонстрируют, что
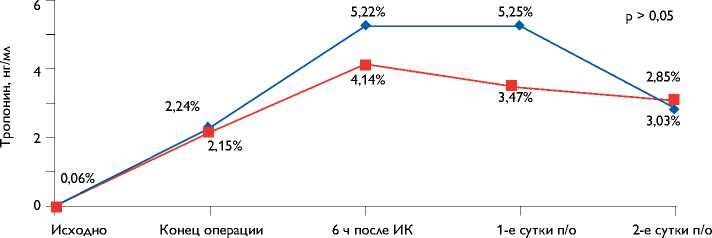
—♦- ИК + БС ■ ИК + КП
Рис. 1. Динамика тропонина I
I 32
^ 28
24 I I i
ИК + КП ИК + БС
Группа n До операции I После операции
Рис. 2. Динамика ФВ ЛЖ в раннем послеоперационном периоде в группах (25-й, 75-й процентили; p <0,05; критерий Вилкоксона)
операция АКШ, выполненная на работающем сердце в условиях ИК, не ограничивает требуемый объем хирургического вмешательства и позволяет осуществить шунтирование необходимых требуемых артерий, что особенно актуально у больных со сниженной ФВ.
В литературе существуют доказательства того, что карди-оплегически остановленное сердце может быть не так хорошо защищено от ишемии в отличие от сердца, работающего в условиях ИК [13]. В свою очередь, P. Narayan с коллегами обнаружили, что уровень кардиоспецифических ферментов при операциях на БС в условиях ИК не отличался от таковых при выполнении операции на остановленном сердце [14]. В нашем исследовании мы также не обнаружили статистически значимой разницы в послеоперационном периоде в уровне тропонина I при межгрупповом сравнении.
Представленные нами ранние послеоперационные результаты демонстрируют улучшение систолической функции левого желудочка в группе БС, что согласуется с результатами аналогичных исследований [13]. Сравнение по индексу КСО более значимо, чем ФВ, ударный (УИ) и сердечный (СИ) индексы ЛЖ, потому что КСО в меньшей степени зависит от условий нагрузки ЛЖ и, следовательно, рассматривается как лучший показатель общей геометрии ЛЖ. Полученные нами данные соотносятся с выводами других исследователей, которые показали, что после операции ИКСО ЛЖ является отличным предиктором отдаленных результатов [15].
Многие авторы отмечают, что операция на работающем сердце в условиях ИК позволяет интраоперационно снизить риск развития системной гипоперфузии, тем самым обеспечить почечную защиту, о чем свидетельствует низкая частота почечных осложнений в послеоперационном периоде. Так как большинство пациентов с дисфункцией ЛЖ имеют нестабильную гемодинамику и, как следствие, недостаточное кровоснабжение внутренних органов, необходимо обеспечить соответствующую поддержку посредством ИК для стабилизации гемодинамики и компенсации висцеральной перфузии. Таким образом техника бьющегося сердца в условиях ИК позволяет снизить риск системной гипоперфузии во время операции и обеспечить почечную защиту. В нашем исследовании значения почечной недостаточности в раннем послеоперационном периоде статистически значимо между группами не различались.
Нами не обнаружено никаких существенных различий между группами в отношении заболеваемости, в том числе острое нарушение мозгового кровообращения, кровотечения, длительности механической вентиляции, инфекционных осложнений, которые, как полагают, связаны с использованием ИК.
В нашем исследовании госпитальная летальность в группе ИК + БС составила 6,7%. Так, по данным литературы, госпитальная летальность среди пациентов, подвергшихся технике реваскуляризации миокарда на работающем сердце в условиях ИК, варьируется от 2 до 8%.
Большинство подобных исследований являются ретроспективными и включают пациентов не только с низкой ФВ ЛЖ (<35%). Нами не обнаружено аналогичных исследований, в которых проводится превентивная профилактика сердечной недостаточности посредством ВАБК и левосимендана. В исследованиях, описанных в литературе, использование дополнительных способов гемодинамической поддержки применялось в послеоперационном периоде по показаниям. Известно, что левосимендан и ВАБК эффективно улучшают функцию и выживаемость пациентов при сердечной недостаточности, обусловленной коронарной патологией. В данном исследовании оба метода рассматриваются как вспомогательная терапия, которая, по нашему мнению, обязательна при операции у пациентов с низкой ФВ ЛЖ. В целях получения достоверных результатов использование того или иного способа гемодинамической поддержки в нашем исследовании определено методом слепой рандомизации. Анализ методов вспомогательной гемодинамической поддержки будет описан в отдельной статье.
Результаты, полученные в этом исследовании, важны, так как, по нашим данным, это первое проспективное рандомизированное исследование по сравнению гибридной техники выполнения АКШ на работающем сердце в условиях ИК со стандартной техникой реваскуляризации миокарда на карди-оплегически остановленном сердце у пациентов с тяжелой формой ИБС и нарушенной функцией ЛЖ. Кроме того, уникальность данного исследования заключается в том, что с целью улучшения коронарного кровотока у пациентов данной категории применялось превентивное использование ВАБК и левосимендана.
Выводы
Операция прямой реваскуляризации миокарда на работающем сердце в условиях ИК с превентивной гемодинамической поддержкой не имеет преимуществ в структуре осложнений и длительности послеоперационного периода по сравнению со стандартной методикой АКШ с превентивной гемодинамической поддержкой. Однако АКШ на работающем сердце в условиях ИК позволяет снизить риск развития ФП в раннем послеоперационном периоде.
Коронарное шунтирование на работающем сердце в условиях искусственного кровообращения с превентивной гемодинамической поддержкой кровообращения улучшает ремоделирование сердца в ранние сроки после операции по сравнению с операцией АКШ на остановленном сердце в аналогичных условиях поддержки кровообращения.
Госпитальная летальность при реваскуляризации миокарда на работающем сердце в условиях ИК у пациентов с низкой ФВ ЛЖ при использовании превентивной гемодинамической поддержки статистически значимо не отличается от таковой при выполнении АКШ в условиях кардиоплегического ареста с превентивной гемодинамической поддержкой.
Список литературы Хирургическое лечение ишемической болезни сердца у пациентов с низкой фракцией выброса левого желудочка на работающем сердце в условиях искусственного кровообращения: непосредственные результаты
- McMurray J.J., Stewart S. et al.//Heart. 2000. Vol. 83. P. 596-602.
- Allman K.C., Shaw L.J. et al.//J. Am. Coll. Cardiol. 2002. Vol. 39. P. 1151-1158.
- Topkara V.K., Cheema F.H., Kesavaramanujam S. et al.//Circulation. 2005. Vol. 112. P. 344-350.
- John R., Rajasinghe H.A., Chen J.M. et al.//Ann. Thorac. Surg. 2001. Vol. 72. P. 440-449.
- Flack J.E., Cook J.R., May S.J. et al.//Circulation. 2000. Vol. 102. III84-III89.
- Selvanayagam J.B., Petersen S.E., Francis J.M. et al.//Circulation. 2004. Vol. 109. P. 345-350.
- Wijns W., Kolh P., Danchin N. et al.//Eur. Heart J. 2010. Vol. 31. P. 2501-2555.
- Чернявский А.М., Караськов А.М., Марченко А.В., Хапаев С.А./Реконструктивная хирургия постинфарктных аневризм левого желудочка. Новосибирск, Гео. 2003.
- Ломиворотов В.В., Бобошко В.А., Чернявский А.М. и др.//Патология кровообращения и кардиохирургия. 2011. №. 2. С. 49-54.
- Miyahara K., Matsuura A., Takemura H. et al.//J. Thorac. Cardiovasc. Surg. 2008. Vol. 135. P. 521-526.
- Khan N.E., De Souza A., Mister R. et al.//N. Engl. J. Med. 2004. Vol. 350. P. 21-28.
- Darwazah A.K., Bader V., Isleem I. et al.//J. Cardiothorac. Surg. 2010. Vol. 10. P. 109.
- Krejca M., Skiba J., Szmagala P. et al.//Eur. J. Cardiothorac. Surg. 1999. Vol. 16. P. 337-341.
- Chuan-Nan Su, Gou-Jieng Hong, Yi-Ting Tsa et al.//J. Med. Sci. 2008. Vol. 28 (4). P. 159-164.
- Senior R., Lahiri A., Kaul S.//Am. J. Cardiol. 2001. Vol. 88. P. 624-629.


