Хирургическое лечение как фактор увеличения выживаемости пациентов с печёночными олигометастазами протоковой аденокарциномы поджелудочной железы. Критерии отбора пациентов. Обзор
Автор: Шубин А.В., Казаков А.Д., Загайнов Е.В.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 4 (52), 2022 года.
Бесплатный доступ
Работа основана на анализе литературных данных, посвящённых проблеме метастатического рака поджелудочной железы, современному представлению о олигометастатической болезни, критериям отбора пациентов с печёночными олигометастазами протоковой аденокарциномы поджелудочной железы для хирургического лечения, а также оценки эффективности лечения.Цель статьи - обзор проблемы диагностики и лечения пациентов с олигометастатической болезнью поджелудочной железы в контексте современного представления о олигометастатической болезни на современном этапе путём критического и конструктивного анализа и сравнения данных отечественных и зарубежных авторов.Согласно данным Глобальной Раковой Обсерватории (Global Cancer Observatory - GLOBOCAN) в мире, за 2020 год заболеваемость раком поджелудочной железы среди мужчин и женщин составила порядка 7,2 и 5,0 на 100 тыс., при летальности в 6,7 и 4,6%, соответственно [1]. При этом в большинстве случаев заболевание диагностируется на III- IV стадии, поэтому результаты лечения остаются неудовлетворительными, 2/3 пациентов погибают в течение 1 года после установки диагноза. «Золотым стандартом» лечения данной группы пациентов сегодня является только системная противоопухолевая терапия по схеме FOLFRINOX, при которой средняя общая выживаемость составляет порядка 11,1 месяцев.Благодаря развитию представлений о механизмах опухолевой прогрессии, совершенствованию диагностических методов и противоопухолевого лечения появилась и активно изучается концепция олигометастатической болезни. Согласно современной теории, данная группа больных с IV стадией опухолевого процесса потенциально может иметь лучший прогноз. Проведён анализ современной отечественной и зарубежной литературы. По данным научных исследований тщательный отбор и проведение комбинированного лечения может значительно увеличить выживаемость данной группы больных. На основании многочисленных исследований некоторыми авторами предложены оптимальные алгоритмы диагностики и лечения пациентов с олигометастатической болезнью поджелудочной железы.
Онкология, протоковая аденокарцинома поджелудочной железы, гепатопанкреатобилиарная хирургия, олигометастатическая болезнь
Короткий адрес: https://sciup.org/142236611
IDR: 142236611 | УДК: 616.36-006-089:616.37-006.6 | DOI: 10.38181/2223-2427-2022-4-48-60
Текст научной статьи Хирургическое лечение как фактор увеличения выживаемости пациентов с печёночными олигометастазами протоковой аденокарциномы поджелудочной железы. Критерии отбора пациентов. Обзор
Впервые о способности опухоли к метастазированию утверждал ещё Клавдий Гален в III веке н.э., описывая её как «клеточный яд». Однако, первым научным шагом, приближающим понимание процессов метастазирования стало открытие Карлом Тиршем инвазии раковыми клетками вен и лимфатических сосудов лишь в 1865 г. [1,2]. В 1889 г. в журнале Lancet появилась известная работа Британского врача Стивена Педжетта «Распространение вторичных образований при раке молочной железы», в которой автор указал на важность не только самих опухолевых клеток, но и их окружения, сравнивая метастазирование с процессом посадки семени в почву («seed and soil»). Именно Стивен Педжетт высказался о возможности формирования «преметастатической ниши» [3]. О состоянии «готовности»органа к метастазированию утверждал и Джеймс Юинг, говоря о важности анатомических и механических факторов капиллярного русла,для данного процесса [4].
Согласно теории Уильяма Холстеда [5,6], метастазирование есть непрерывный последовательный процесс распространения опухолевых клеток от первичного очага в регионарные и отдаленные лимфатические узлы с дальнейшим распространением клеток с злокачественным потенциалом - данная теория лежит в основе радикального хирургического лечения молочной железы,рака шейки матки. Однако,согласно теории параллельного системного процесса, предложенной Фишером [7], выявленная опухоль — это проявление системного заболевания,и если данный вид опухоли имеет способность метастазировать, то она уже метастазировала. Вовлечение лимфатического узла — это не упорядоченное непрерывное прогрессирование заболевания, а, скорее, признак отдаленной болезни.
На сегодняшний день становится ясно,что в отдельности, каждая из теорий имеет недостатки, и в полной мере не объясняет процессы опухолевой инвазии и метастазирования. Данные факты в совокупности с многочисленными клиническими и экспериментальными иссле- дованиями, посвященными данной проблематики, привели к появлению в 1995 году теории олигометастатиче-ской болезни. C конца XX века при исследовании злокачественных новообразований различных локализаций учёные выделяют группу пациентов с олигометастатиче-скими поражениями (наличие помимо первичной опухоли единичных метастазов в другом органе).
Основная часть
В клинической рутинной практике обсуждение возможности радикального лечения данных больных рассматривалось уже давно, однако, впервые теоретическое обоснование олигометастатической болезни дали профес-соры Чикагского университета Samuel Hellman и Ralph R. Weichselbaum в 1995 году [8]. Данное состояние было описано ими как пограничное между локальной и системной метастатической стадией.Ими выделены отличительные признаки олигометастазов: ограниченное количество органов, их специфичность, количество выявленных метастазов. Авторы связывали данные факторы с ограничением преметастатических ниш,где возможно развитие данных метастазов, при этом, не исключая более широкое распространение микрометастазов не зависящее от состояния органов. Клинически значим их вывод о том, что вероятность наличия у конкретного пациента именно олигометастатической болезни коррелирует с биологией опухоли, морфологическими критериями которой для многих опухолей могут быть размер и степень злокачественности первичной опухоли.По мере прогрессирования опухоли её способность к инвазии и метастазированию увеличивается, специфичность метастазирования уменьшается.
Данная работа способствовала пересмотру имеющихся стандартов лечения пациентов с метастазами опухолей различных локализаций.В дальнейшем показаны лучшие исходы при применении хирургического и метастазна-правленного лечения в отличии от стандартной системной химиотерапии. На сегодняшний день имеются положительные результаты рандомизированных исследований эффективности местного лечения метастазов опу- холей лёгких, молочной железы, простаты, колоректального рака.
Iyengar P, Wardak Z et al. [9] при сравнении эффекта от стереотаксической лучевой терапии SBRT в комбинации с полихимиотерапией и изолированной паллиативной терапией у пациентов с EGFR-, ALK- пациентов с НМРЛ получили трёхкратное увеличение времени до прогрессирования в первой группе.
Ruers T, Van Coevorden F et al. [10] показали увеличение общей выживаемости у пациентов с нерезектабельными метастазами колоректального рака в печени при комбинированном лечении в объёме резекции возможных метастазов, дополненной радиочастотной абляцией с последующей химиотерапией по сравнению с паллиативной системной химиотерапией.
В исследовании, проведенном Gomez DR et al [11], сообщается об увеличении времени до прогрессирования и общей выживаемости у пациентов с олигометастазами немелкоклеточного рака лёгких после комбинированного метастазнаправленного лечения и системной химиотерапии по сравнению с паллиативной химиотерапией.
Palma DA et al. [12] проанализировали значение SBRT в комбинированном лечении пациентов с олигометастазами рака молочной железы, лёгких, колоректального рака и рака простаты.У данных больных отмечено увеличение медианы общей выживаемости по сравнению с пациентами, получавшими паллиативную химиотерапию.
В исследовании Ost P et al. [13] сравнивали выживаемость пациентов с олигометастатазми рака простаты после первичного метастазнаправленного лечения и первичного динамического наблюдения, выполняя андрогенную кастрацию при биохимическом и клиническом прогрессировании. Отмечено увеличение медианы общей выживаемости при активном лечении по сравнению со второй группой.
Наиболее неблагоприятный прогноз, из всех метастатических форм злокачественных новообразований остается констатировать у пациентов с протоковой аденокарциномой поджелудочной железы (ПАК ПЖ): 5летняя выживаемость больных не превышает 5-8% Piciuc-chi M, Stigliano S, Archibugi L, et al. [14]. Более 50% пациентов с первично выявленной протоковой аденокарциномой не подлежат радикальному хирургическому лечению вследствие метастатического процесса,при этом у оставшейся части пациентов в 30 % случаев операция невозможна в связи с местным распространением заболевания Stevens L, Pathak S, Nunes QM, et al. [15]. «Золотым стандартом» лечения пациентов с IV стадией ПАК ПЖ се- годня является системная терапия по схеме FOLFRINOX.
В проведенном в 2011 году Conroy T. et al. [16] исследовании при сравнении лечения в 1 линии системной полихимиотерапии учёные получили статистически значимое увеличение общей выживаемости в группе FOLFRI-NOX (11,1 месяцев) по сравнению с группой гемцитабина (6,8 месяцев) (р <0,001), а также увеличение времени до прогрессирования в группе FOLFRINOX (6,4 месяцев) по сравнению с группой гемцитабина (3,3 месяца, р <0,001).
У небольшой группы пациентов, на фоне хорошего ответа на терапию, регресса опухоли, возможно выполнение радикального лечения. В работе Frigerio I. et al. [17] авторы сообщают об эрадикации печёночных метастазов у 24 (4,5%) пациентов с IV стадией ПАК ПЖ на фоне 1 линии системной полихимиотерапии (FOLFIRINOX, гемцитабин немцитабин + nab - паклитаксел). Выполненная впоследствии радикальная операция у данной группы пациентов позволила увеличить медиану общей выживаемости до 56 месяцев, время до прогрессирования до 27 месяцев.
Целесообразность радикального хирургического лечения при IV стадии протоковой аденокарциномы сегодня оспаривается. А международными ассоциациями клинических онкологов и хирургов в настоящее время не рекомендуется резекция в случаях отдалённых метастазов ПАК ПЖ даже если возможно достичь негативного края резекции [18]. Сама по себе гастропанкреатодуоденальная резекция, в настоящее время являющаяся основным способом хирургического лечения ПАК ПЖ, даже при резек-табельном раке технически трудна и сопровождается высокой частотой послеоперационных осложнений и летальных исходов, и может увеличиваться при увеличении объёма операции [19,20,21,22,23].
На заседании Пироговского общества хирургов в 2018 г. коллективом авторов под руководством Шостка К.Г. Кузнецова И.М. было доложено о случае комбинированного радикального лечения при раке поджелудочной железы с синхронными метастазами в лёгких. Пациентка 70 лет, страдающая с 1998 г. внутрипротоковой аденокарциномой левой молочной железы, получила комбинированное лечение в объёме левосторонней мастэктомии по Маддену, 6 курсов полихимиотерапии по схеме CMF (Циклофосфамид, Метатрексат, Фторурацил)). В дальнейшем наблюдалась у онколога по месту жительства.В ноябре 2013 г. выявлены признаки опухолевого поражения правого лёгкого (во II и IV сегментах выявлены округлые новообразования размерами 0,9×1,1×1,2 см и 2,1×1,9×2,1 см соответственно, с нечёткими бугристыми контурами, тяжами к междолевой плевре).
В ходе дальнейшего обследования выявлено новообразование в головке поджелудочной железы размерами 2,5×2,5×2,2 см, с нечеткими контурами. При биопсии новообразования поджелудочной железы верифицирована низкодифференцированная аденокарцинома. Решение о выполнении симультанной операции на поджелудочной железе и лёгком было принято на основании клиникорентгенологической картины первично- множественного рака, хотя полностью не исключалось и метастатическое поражение лёгкого. В январе 2014 г. выполнена операция – симультанная расширенная гастропанкреатодуоденальная резекция, удаление средней доли правого лёгкого и атипичная резекция II сегмента. Диагноз после операции: «Первично-множественное злокачественное новообразование. 1. Рак левой молочной железы pT2NlM0, IIA стадия. 2. Рак головки поджелудочной железы pT2N0Ml (pulm), IV стадия». Гистологическое заключение: низкодифференцированная протоковая аденокарцинома головки поджелудочной железы с умеренной митотической активностью. Метастаз аденокарциномы поджелудочной железы в лёгком. Вторым этапом проведена химиотерапия по схеме «Folfirinox» (Лейковорин, 5-фторурацил, Иринотекан, Оксалиплатин), 4 курса. В феврале 2018 г., спустя 48 мес., пациентке проведено комплексное обследование. Признаков рецидива опухоли в области оперативных вмешательств, в грудной и брюшной полостях, не выявлено [24,25].
Эффективность комбинированного лечения олигоме-тастатической болезни при злокачественных новообразованиях органов ЖКТ описана в ретро-, и проспективных исследованиях (табл.1). Радикальное хирургическое лечение олигометастатической стадии ПАК ПЖ не только не сопровождалось значительным увеличением послеопера- ционных осложнений и летальности, но и способствовало улучшению онкологических результатов лечения. Высказывается возможность радикального комбинированного лечения пациентов с метастазами ПАК ПЖ в печени, аортокавальных узлах и лёгких [26,27].
T. Hackert et al в 2016 г. выполнили самое крупное на сегодняшний день проспективное исследование [28], в которое включены 85пациентов получивших комбинированное лечение по поводу печёночных и аортокавальных олигометастазов ПАК ПЖ.Медиана общей выживаемости составила 12,3 месяцев и не отличалась у пациентов с печёночными и аортокавальными метастазами.Однолет-няя выживаемость составила порядка 50% в обеих группах. 5-летняя выживаемость в группе печеночных метастазов составила 8,1%, в группе аортокавальных 10,1%, что значимо отличается от выживаемости данной группы пациентов при проведении системной противоопухолевой терапии.При этом в исследовании не установлено различий в выживаемости у пациентов с синхронными и метахронными метастазами (p = 0,210).
В китайском исследовании Jianyu Yang et al. [29] авторы сравнили эффективность хирургического, паллиативного лечения и системной химиотерапии у пациентов с метастазами ПАК ПЖ (n=453). 48 пациентов, которым выполнено хирургическое вмешательство (резекционное или РЧА) были разделены на группу с олигометастатазми (количество метастазов ≤3, n=23) и не олигометастазами (>3, n=25). Выявлено увеличение медианы общей выживаемости у пациентов с олигометастазами, по сравнению со второй группой (16,1 и 6,4 месяцев, р = 0,02). 1- и 3-летняя выживаемость в группе с ОМБ составила 43.5% и 4,3% соответственно (табл. 1).
Таблица 1.
Исследования комбинированного лечения олигометастатической ПАК ПЖ
Tab le 1.
Main studies of combined treatment of oligometastatic pancreatic cancer
|
Авторы |
N, кол-во больных |
Послеоперационные осложнения, % |
Послеоперационная летальность, % |
Медиана общей выживаемости, мес. |
Однолетняя выживаемость, % |
Пятилетняя выживаемость, % |
|
T. Hackert et. al [17] |
85 |
45,7 |
2,9 |
12,3 |
50 |
8,1 |
|
J. Yang at al. [18] |
23 |
13 |
0 |
16,1 |
43,5 |
н/д |
|
M. Tachezy et al. [19] |
69 |
68 |
1 |
14,5 |
70 |
5,8 |
|
P. Kandel et al. [20] |
6 |
н/д |
н/д |
32,4 |
80 |
0 |
|
S. Crippa et al. [24] |
11 |
27 |
0 |
39 |
н/д |
н/д |
|
J.B. Park et al. [25] |
34 |
н/д |
н/д |
14 |
55,7 |
н/д |
В исследовании Michael Tachezy, MD 2016 г. [30] комбинированные резекции ПАК ПЖ и печёночных олигометастазов выполнены 69 пациентам. Эффективность хирургического лечения сравнили с 69 пациентами, которым выполнялась системная противоопухолевая терапия. Медиана общей выживаемости в первой группе была значимо больше, чем в группе без резекции (14,5 и 7,5 месяцев, р <001). 1-летняя выживаемость в группе резекции составила порядка 70%; 5-летняя выживаемость составила 5,8% в группа резекции, в то время как в группе химиотерапии составила 0%.
Значимой в этом направлении работой стало исследование Crippa S. et al. [31]. 127 пациентам с метастатической ПАК ПЖ первично выполнялась химиотерапия: монотерапия гемцитабином, полихимиотерапия по схемам FOLFIRINOX, PEXG, PDXG, PEFG с последующей оценкой ответа на терапию. 56 пациентов (44%) имели полный (7%) или частичный ответ (37%). 11 пациентам (8,7%) на втором этапе выполнена комбинированная операция. Обязательные условия: резектабельность/по-граничная резектабельность первичной опухоли;сни-жение CA 19-9 после химиотерапии более 50%; единичные остаточные печёночные метастазы по данным МРТ и или 18ФДГ-ПЭТ/КТ. Медиана общей выживаемости оказалась достоверно выше у 11 пациентов, перенесших хирургическую резекцию, по сравнению со всеми остальными 116 пациентами (39 против 11 месяцев, р <0,0001). Время до прогрессирования было также больше в группе после операции по сравнению с остальными 116 пациентами (20 против 6 месяцев; р <0,0001).
В 2019 году M. P. Callery et. al [31] опубликовали результаты мета-анализа, посвященного сравнению хирургического и нехирургического лечения олигоме-тастатической стадии ПАК ПЖ. На основании выбранных критериев отобрано 7 исследований случай-конт-роль. В общей сложности 1248 пациентов (347 после хирургического лечения и 901 после нехирургического лечения). Отношение рисков (HR), рассчитанного для общей выживаемости, в 1 группе в сравнении со второй группой составило 2,223 ( p <0,001).
На сегодняшний день имеются оптимистичные результаты комбинированного лечения с применением методов консолидирующей метастаз-направленной терапии, таких как радиочастотная абляция (РЧА), стереотаксическая лучевая терапия, артериальная эмболи-зация.Данные методы позволяют не только улучшать онкологические результаты, уменьшать тяжесть опера- тивного вмешательства, но и осуществлять локальный продолжительный контроль над метастазами ПАК ПЖ.
Клиникой Mayo (штат Florida, США) [32] в 2018 г. опубликованы результаты хирургического лечения пациентов с олигометастазами ПАК ПЖ (≤2 в одном органе; <4 см диаметром), первично - резектабельных (M0) и системного лечения нерезектабельных метастатических ПАК ПЖ (M1) (n общее=42). В качестве лечения метастазов выполнялась радиоэмболизация,РЧА, резекции и резекции + РЧА. Медиана общей выживаемости в группах составила 2,7 года, 2,02 лет и 0,98 лет соответственно. При этом медиана выживаемости в группе пациентов с резецированными олигометастазами была достоверно выше, чем в группе M1 без операции (2.7 против 0,98 лет, р = 0,01) и статистически значимо не отличалась от группы M0 (2,7 против 2,02 лет, p = 0,6). Анализируя кривую выживаемости, 1-летняя выживаемость составила порядка 80%, 5-летняя – 0%.
В одном из самых первых исследовании эффективности РЧА при ПАК ПЖ Park J.B. et al. 2012 г. [33] 34 больным с олигометастазами (только печень,количе-ство ≤5, ≤3 см в диаметре) выполнена РЧА симультанно с резекцией первичной опухоли и в послеоперационном периоде.Авторы сообщают о медиане общей выживаемости в 14месяцев с момента обнаружения метастазов в печень. 1-, 2- и 3-летняя выживаемость составили 55,7%, 33,5% и 23,5% соответственно. При этом в одном случае (2,9%) применение РЧА для локального контроля метастазов при прогрессировании позволили увеличить выживаемость до 65 месяцев.
В более позднем ретроспективном анализе Hua Y.Q et al. [34] представлены результаты применения РЧА у 102 больных нерезектабельной ПАК ПЖ с синхронными олигометастазами печени (единичный метастаз ≤5 см или ≤3 метастазов ≤3 см). Примечательно, что при отсутствии резекции первичной опухоли 1-летняя выживаемость составила 47,1%, а медиана общей выживаемости - 11,4 месяца.
Несмотря на некоторые успехи в лечение пациентов с олигометастазами ПАК ПЖ,определить биологические характеристики такого состояния удаётся не всегда. Согласно имеющейся концепции олигометастазов, данное заболевание характеризуется менее агрессивной биологией опухоли, что улучает прогноз лечения данных пациентов.Поэтому одним из актуальных вопросов является определение прогностических факторов лучшей выживаемости при метастатической ПАК ПЖ.
В проведённом Michael Haas et al. [35] проспективном многоцентровом исследовании авторы оценили прогностическую ценность CA 19-9, CEA , CRP, LDH и уровня билирубина у 291 пациентов с местно-распространённой и метастатической стадиями ПАК ПЖ. Показано, что из перечисленных маркёров только количество CA 19-9 имело значение. Пациенты с уровнем CA 19-9 до лечения менее 1000 ЕД/мл имеют лучшие показатели общей выживаемости, чем те, у кого уровень маркёра оказался выше данного значения (10.5 против 8,0 месяцев, р = 0,006). Снижение данного маркёра после проведения химиотерапии не менее 25% также коррелировал с лучшей общей выживаемостью (11,9 против 8,2 месяцев, р = 0,003).
В исследовании Boeck S. et al [36] показано, что на прогноз значимо влияют исходный соматический статус (шкала Карнофски), маркеры CA 19-9, CEA, Cyto-keratin 19-fragments (CYFRA 21-1), оцениваемые как до начала лечения, так и динамически в процессе лечения. При этом наибольшую ценность представляет оценка прогностической значимости CYFRA 21-1 и CA 19-9. В данной работе пациентов разделили на группы в зависимости от исходных значений данных маркеров (CYFRA 21-1: менее 2,7 / от 2,7 до 10 / более 10; CA 199: до 200 / от 200 до 6600 / более 6600). Показано, что медиана выживаемости в данных группах достоверно различается (CYFRA 21-1: 14.8 / 7.1 / 4.8 месяцев, соответственно, р <0.0001; CA 19-9: 14.2 / 7.1 / 5.2 месяцев соответственно, р <0.0001).
Помимо карбоангидратного антигена (CA 19-9), прогностическое значение которого оценено также в работах Jian -Yuan Song [37], Hang J. [38], некоторыми учёными сообщается о ценности воспалительных маркёров, таких как нейтрофильно-лейкоцитарное отношение (НЛО), C-реактивный белок [39]. В некоторых исследованиях на примере лёгочных олигометастазов проанализирована роль микро-РНК в регуляция метастатического фенотипа. Установлена локализация гена данной РНК (локусе 14q32), а также сформулирована гипотеза о её роли в механизмах опухолевой миграции, адгезии и вторжения [40].
В исследовании Lussier, Y. A. et al. [41] показано, что в группе пациентов с лёгочными олигометастазами и высоким уровнем экспрессии 14q32 микро-РНК в метастазах период до прогрессирования был статистически значимо больше, чем в группе пациентов с низкой экспрессией 14q32 микро-РНК. В исследовании Oshima, G. [42] при использовании CRISPR – Cas9 осуществлена попытка метилирования локуса 14q32, что способствовало распространению метастазирования.
Помимо определения группы более благоприятного прогноза основной задачей при отборе таких пациентов является точная визуализация всех метастазов, чего не всегда удаётся добиться при использовании рутинных лучевых методов.Европейская организация по исследованию и лечению рака (EORTC) в 2017 опубликовала рекомендации по лучевой диагностике олигометастазов рака простаты, молочной железы, лёгких и колоректального рака [42], из которых следует, что при раке лёгкого целесообразно использовать 18-ФДГ ПЭТ/КТ, при раке простаты - 68Ga-PSMA, а также WB-MRI и choline ПЭТ/ КТ. При раке молочной железы и колоректальном раке методом выбора является 18F-ФДГ ПЭТ/КТ. Данные методы визуализации применяются и при диагностике ПАК ПЖ.
В 2020 году совместными усилиями Европейского общества лучевой терапии и онкологии (ESTRO) и EORTC была сделана попытка охарактеризовать и классифицировать олигометастазы и выработать алгоритм работы с ними [43]. Исследователи выделили 5 основных характеристик,от которых зависит тактика лечения пациента с олигометастазами.При подтверждённой по результатам лучевого исследования олигомета-статической болезни первый вопрос,на который необходимо ответить: первичная олигометастатическая болезнь (ОМБ)или индуцированная полихимиотерапией ОМБ. В первом случае можно прогнозировать более благоприятную биологию опухоли, во втором – менее благоприятную биологию остаточных единичных метастазов после полихимиотерапии.Следующий шаг – определить,впервые выявлены олигометастазы (denovo) или повторно (после промежутка времени без прогрессирования заболевания). Последние могут представлять рак с более благоприятной биологией и низкой метастатической способностью в течение длительного периода времени.
Для пациентов с ОМБ de-novo необходимо определить: метастазы являются синхронными (менее 6меся-цев после определения первичной опухоли) или метахронными. Большинство исследований показывают, что синхронные метастазы ассоциируются с более агрессивным фенотипом заболевания [44]. Следующим дифференциальным критерием является проведение системной терапии на момент диагностики олигомета-статического заболевания.У пациентов с первичными метахронными олигометастазами, повторно диагности- рованной ОМБ и индуцированной полихимиотерапией ОМБ процессы опухолевой прогрессии различные. Последний, наименее изученный критерий относится к па-циентам,у которых ОМБ была диагностирована после проведения системной терапии повторно и пациентам с индуцированной ОМБ. Необходимо при помощи лучевых методов оценить ответ метастазов на проводимую полихимиотерапию (олигостабилизация или олигопрогрессия).
В контексте олигометастатической болезни при ПАК ПЖ интересной представляется работа Damanakis A.I.
et al. [45]. Авторы выделяют несколько этапов отбора пациентов с ОМБ (рис. 1).
Из 128 пациентов с метастатической ПАК ПЖ отобрали 21 пациента (16,4%), имеющих не более 4 метастазов только в печени. Критериями более благоприятной биологии опухоли стал маркер CА 19-9 (<1000 ЕД/мл) и ответ на химиотерапию (монотерапия гемцитабином/ гемцитабин + Наб-Паклитакселом/ гемцитабин + Эрлотинибом/ FOLFIRINOX) как маркеры лучшей биологии. 16 пациентов (12,5%) имели CА 19-9 <1000 ЕД/мл, из которых 8 пациентов (6,25%) ответили на химиотерапию.
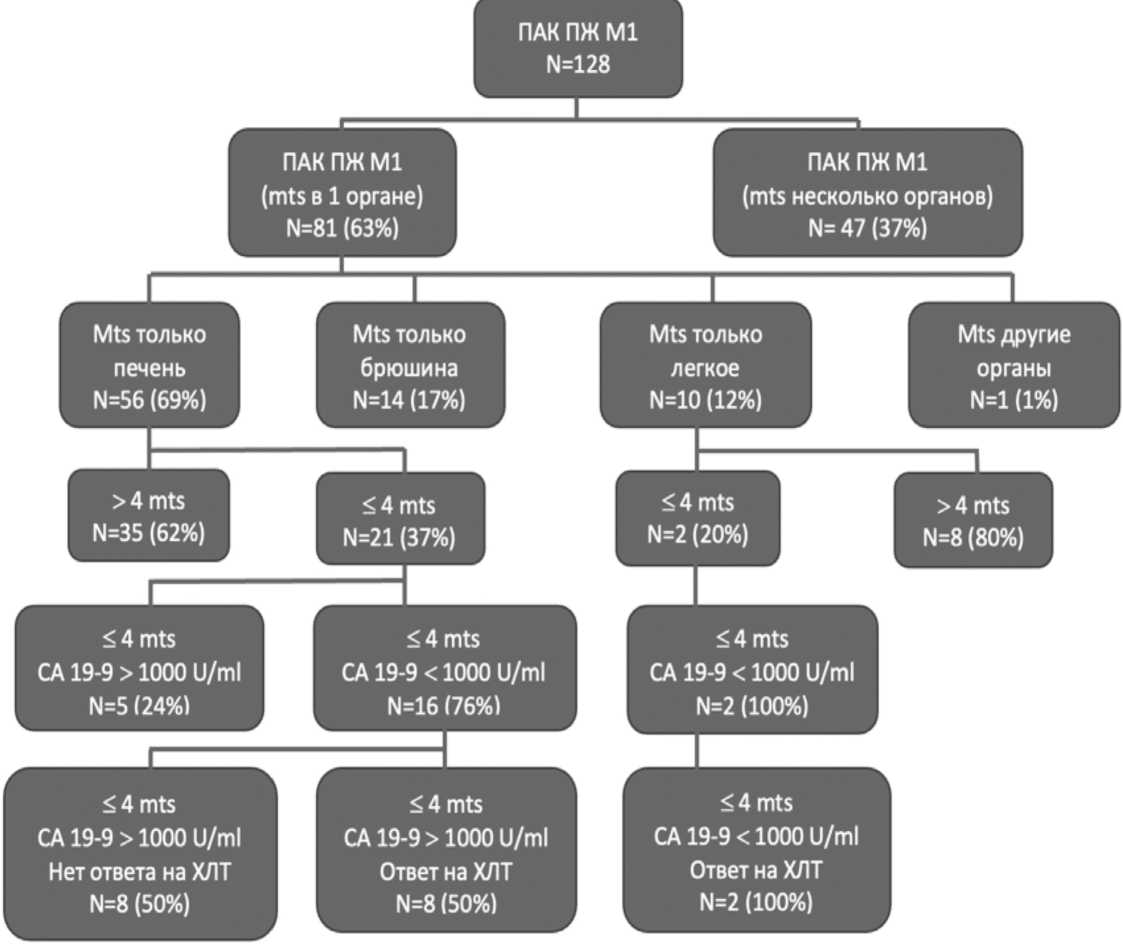
Рис. 1. Дифференциальная диагностика олигометастазов ПАК ПЖ (Damanakis A.I. et al. [45]) Fig. 1. Differential diagnosis of oligometastases of PAC of the pancreas (Damanakis A.I. et al. [45])
Данные пациенты, по соображению авторов относятся к группе ОМБ и имеют лучший прогноз, по сравнению с остальными больными М1. Пациенты, имеющие не более 4 метастазов и CA 19-9 ниже 1000 ЕД / мл имели значимо большую медиану выживаемости по сравнению с остальными (16,0 против 6,9 месяцы в пользу; р = 0,021). 8 пациентов, относящиеся к ОМБ показали также значимо большую медиану общей выживаемости по сравнению со всеми остальными (19,4 против 7,2 месяцев; р = 0,009).
В 2019 году по результатам систематического обзора Willem Niesen et al. был предложен алгоритм ведения пациентов с олигометастазами ПАК ПЖ [46]. Отбор пациентов в группу ОМБ начинается со следующих критериев: количество изолированных печёночных метастазов менее 5, а также низкие значения CA 19-9, высокий альбумин, низкий CРБ (рис. 2).
Вторым этапом проводится оценка соматического статуса и резектабельности метастазов, после чего назна-
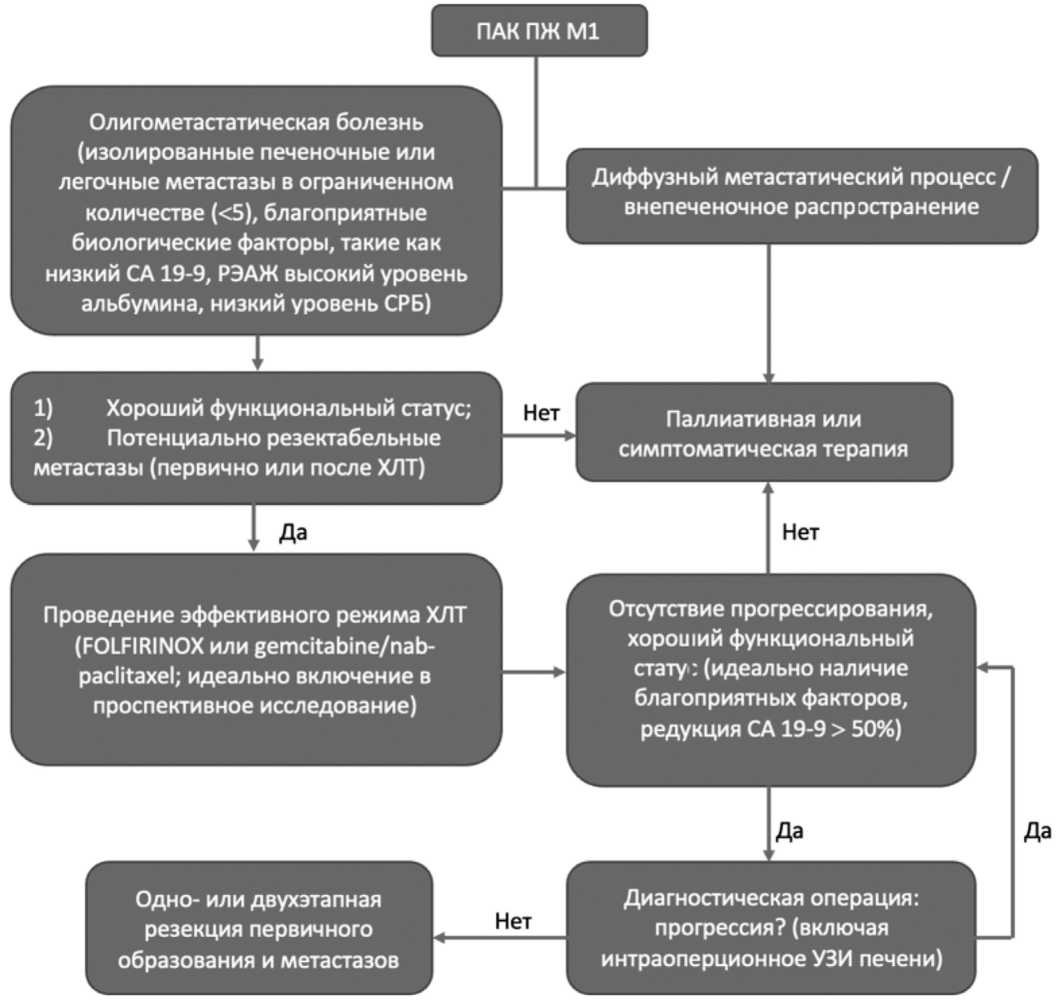
Рис. 2. Определение группы пациентов с ОМБ ПАК ПЖ, этапное комплексное лечение (Willem Niesen et al. [13]) Fig. 2. Determination of the group of patients with oligometastatic cancer, staged complex treatment (Willem Niesen et al. [13])
чается самые эффективные режимы системной химиотерапии (FOLFIRINOX / gemcitabine + nab-paclitaxel). При отсутствии прогрессирования заболевания и хорошем соматическом статусе (идеально, если CA 19-9 снижается более, чем на 50%), принимается решение об одно или двухэтапной радикальной операции на первичной опухоли и метастазах после интраоперационной оценке заболевания.
C 2018 года Китайской исследовательской группой по раку поджелудочной железы (CSPAC)-1 запущено исследование III фазы для разработки алгоритма отбора пациентов с печёночными олигометастазами ПАК ПЖ (не более трёх метастатических поражений независимо от их распределения в долях печени) [47]. Планируется отобрать порядка 1200 пациентов олигометастазами ПАК ПЖ в печени.После проведения системной противоопухолевой терапии,повторной оценки планируется отобрать 300 пациентов и рандомизировать их в соотношении 1:1 в группу симультанной резекции первичной опухоли и метастазов и группу системной противоопухолевой терапии. Первичной конечной точкой станет общая выживаемость пациентов.
Заключение
Развитие онкологии как науки в конце XX начале XXI благодаря прорывным открытиям в молекулярной генетике, иммунологии, биохимии позволяет по-новому взглянуть на традиционные подходы в диагностике и лечении «запущенных» форм рака. Переосмысление дифференциально-диагностических подходов целью которых всё также является увеличение продолжительности жизни пациентов, привело к формулированию в 1995 г. концепции олигометастатической болезни и последующему осмыслению патогенетических основ олигометастатической болезни поджелудочной железы,разработке алгоритма отбора пациентов и их лечения.И если факт активной хирургической тактики у определённой группы таких пациентов уже неоспорим, то критерии выбора, к которым относятся чувствительные и специфичные маркёры, нуждаются в дальнейшем поиске. Авторы статьи полагают, что этот путь возможно будет важным и в поиске маркёров для ранней диагностики опухолей.
Научными исследованиями показана эффективность комбинированного лечения пациентов с олиго-метастатической болезнью поджелудочной железы в сравнении с системной химиотерапией.
Список литературы Хирургическое лечение как фактор увеличения выживаемости пациентов с печёночными олигометастазами протоковой аденокарциномы поджелудочной железы. Критерии отбора пациентов. Обзор
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-249. http://doi.org/10.3322/caac.21660
- Guy B. A brief history of cancer: Age-old milestones underlying our current knowledge database nt. J. Cancer. 2015; 136: 2022–2036. http://doi.org/10.1002/ijc.29134
- Paget S. The distribution of secondary growths in cancer of the breast. Lancet. 1889; 133:571–573. https://doi.org/10.1016/S0140-6736(00)49915-0
- Ewing G. Neoplastic Diseases: A Treatise on Tumours. 1928; 3: 1127. https://doi.org/10.1002/bjs.1800166126
- Halsted W. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June, 1889 to January, 1894. Johns Hopkins Bull. 1894; 20(5): 497-555. http://doi.org/10.1097/00000658-189407000-00075
- Halsted W. The results of radical operations for the cure of carcinoma of the breast. Ann Surg. 1907; 46:1-19. http://doi.org/10.1097/00000658-190707000-00001
- Fisher B: Laboratory and clinical research in breast cancer-A personal adventure: The David A Karnovsky Memorial Lecture. Cancer Res. 1980; 40:3863-3874.
- Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol. 1995; 13(1): 8-10. http://doi.org/10.1200/JCO.1995.13.1.8
- Iyengar P, Wardak Z, Gerber DE, Tumati V, Ahn C, Hughes RS, Dowell JE, Cheedella N, Nedzi L, Westover KD, Pulipparacharuvil S, Choy H, Timmerman RD. Consolidative radiotherapy for limited metastatic non-small-cell lung cancer: a phase 2 randomized clinical trial. JAMA Oncol. 2018; 4 (1). http://doi.org/10.1001/jamaoncol.2017.3501
- Ruers T, Van Coevorden F, Punt CJ, Pierie JE, Borel-Rinkes I, Ledermann JA, Poston G, Bechstein W, Lentz MA, Mauer M, Folprecht G, Van Cutsem E, Ducreux M, Nordlinger B. Local treatment of unresectable colorectal liver metastases: results of a randomized phase II trial. J Natl Cancer Inst. 2017; 109 (9). http://doi.org/10.1093/jnci/djx015
- Gomez DR, Tang C, Zhang J, Blumenschein GR Jr, Hernandez M, Lee JJ, Ye R, Palma DA, Louie AV, Camidge DR, Doebele RC, Skoulidis F, Gaspar LE, Welsh JW, Gibbons DL, Karam JA, Kavanagh BD, Tsao AS, Sepesi B, Swisher SG, Heymach JV. Local consolidative therapy vs maintenance therapy or observation for patients with oligometastatic nonsmall-cell lung cancer: long-term results of a multi-institutional, phase II, randomized study. J Clin Oncol. 2019; 37: 1558–65. http://doi.org/10.1200/JCO.19.00201
- Palma DA, Olson R, Harrow S, Gaede S, Louie AV, Haasbeek C, Mulroy L, Lock M, Rodrigues GB, Yaremko BP, Schellenberg D, Ahmad B, Griffioen G, Senthi S, Swaminath A, Kopek N, Liu M, Moore K, Currie S, Bauman GS, Warner A, Senan S. Stereotactic ablative radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, open-label trial. Lancet. 2019; 393: 2051–58. http://doi.org/10.1016/S0140-6736(18)32487-5
- Ost P, Reynders D, Decaestecker K, Fonteyne V, Lumen N, De Bruycker A, Lambert B, Delrue L, Bultijnck R, Claeys T, Goetghebeur E, Villeirs G, De Man K, Ameye F, Billiet I, Joniau S, Vanhaverbeke F, De Meerleer G. Surveillance or Metastasis-Directed Therapy for Oligometastatic ProstateCancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J Clin Oncol. 2018; 36: 446–53. http://doi.org/10.1200/JCO.2017.75.4853
- Piciucchi M, Stigliano S, Archibugi L, Zerboni G, Signoretti M, Barucca V, Valente R, Fave GD, Capurso G. The neutrophil/ lymphocyte ratio at diagnosis is significantly associated with survival in metastatic pancreatic cancer patients. Int J MolSci. 2017;18(4):730. http://doi.org/10.3390/ijms18040730
- Stevens L, Pathak S, Nunes QM, Pandanaboyana S, Macutkiewicz C, Smart N, Smith AM. Prognostic significance of pre-operative C-reactive protein and the neutrophillymphocyte ratio in resectable pancreatic cancer: Asystematic review. HPB (Oxford). 2015;17(4): 285–91. http://doi.org/10.1111/hpb.12355
- Conroy T, Desseigne F, Ychou M, Bouché O, Guimbaud R, Bécouarn Y, Adenis A, Raoul JL, Gourgou-Bourgade S, de la Fouchardière C, Bennouna J, Bachet JB, Khemissa- Akouz F, Péré-Vergé D, Delbaldo C, Assenat E, Chauffert B, Michel P, Montoto-Grillot C, Ducreux M. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011; 364(19): 1817–25. http://doi.org/10.1056/NEJMoa1011923
- Frigerio I, Regi P, Giardino A, Scopelliti F, Girelli R, Bassi C, Gobbo S, Martini PT, Capelli P, D'Onofrio M, Malleo G, Maggino L, Viviani E, Butturini G. Downstaging in stage IV pancreatic cancer: a new population eligible for surgery? Ann Surg Oncol. 2017. 24: 2397–2403. http://doi.org/10.1245/s10434-017-5885-4
- Tempero MA, Malafa MP, Al-Hawary M, Asbun H, Bain A, Behrman SW, Benson AB 3rd, Binder E, Cardin DB, Cha C, Chiorean EG, Chung V, Czito B, Dillhoff M, Dotan E, Ferrone CR, Hardacre J, Hawkins WG, Herman J, Ko AH, Komanduri S, Koong A, LoConte N, Lowy AM, Moravek C, Nakakura EK, O'Reilly EM, Obando J, Reddy S, Scaife C, Thayer S, Weekes CD, Wolff RA, Wolpin BM, Burns J, Darlow S. Pancreatic adenocarcinoma, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2017; 15(8): 1028–61. http://doi.org/10.6004/jnccn.2017.0131
- Ducreux M, Cuhna AS, Caramella C, Hollebecque A, Burtin P, Goéré D, Seufferlein T, Haustermans K, Van Laethem JL, Conroy T, Arnold D. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015; 26(Suppl 5): 56–68. http://doi.org/10.1093/annonc/mdv295
- Казаков А.Д., Соловьева Т.С. Факторы риска несостоятельности панкреатодигестивного анастомоза после панкреатодуоденальной резекции. Известия Российской Военно-медицинской академии. 2019; 1(1): 187-190. [Kazakov A.D., Solovieva T.S. Risk factors of failure pancreatodigestive anastomosis after pancreatoduodenectomy. Izvestia of the Russian Military Medical Academy. 2019; 1(1): 187-190. (In Russ.)]
- Котив Б.Н., Дзидзава И.И., Смородский А.В. Гастропанкреатодуоденальная резекция при погранично резектабельном раке поджелудочной железы. Сборник научных работ III Петербургского международного онкологического форума "Белые ночи 2017". 2017; 216-217. [Kotiv B.N., Dzidzava I.I., Smorodsky A.V. Gastropancreatoduodenal resection for borderline resectable pancreatic cancer. Collection of scientific papers of the III St. Petersburg International Oncological Forum "White Nights 2017". 2017; 216-217. (In Russ.)]
- Park, J.B.; Kim, Y.H.; Kim, J.; Chang, H.M.; Kim, T.W.; Kim, S.C.; Kim, P.N.; Han, D.J. Radiofrequency ablation of liver metastasis in patients with locally controlled pancreatic ductal adenocarcinoma. J. Vasc. Interv. Radiol. 2012; 23: 635–641. http://doi.org/10.1016/j.jvir.2012.01.080
- Нартайлаков М.А., Галимов И.И., Шакуров Д.Ф., Логинов М.О., Мирасова Г.Х. Эффективность рентгенэндоваскулярной эмболизации ветви воротной вены при обширных резекциях печени. Хирургическая практика. 2022;(1):33-37. https://doi.org/10.38181/2223-2427-2022-1-33-37 [Nartailakov M.A., Galimov I.I., Shakurov D.F., Loginov M.O., Mirasova G.K. Efficiency portal vein x-ray vascular embolization in extended hepatic resection. Surgical practice. 2022;(1):33-37. (In Russ.) https://doi.org/10.38181/2223-2427-2022-1-33-37]
- Шостка К. Г., Кузнецов И. М., Арутюнян К. В., Ильин К. С., Кучеренко А. Д., Фёдоров К.С. Выбор лечебной тактики при раке поджелудочной железы с синхронными метастазами в легкие. Вестник хирургии им. И. И. Грекова. 2018; 178(3): 94. [Shostka K. G., Kuznetsov I. M., Arutyunyan K. V., Ilyin K. S., Kucherenko A. D., Fedorov K. S. The choice of treatment tactics for pancreatic cancer with synchronous lung metastases. Bulletin of Surgery. I. I. Grekova. 2018; 178(3): 94. (In Russ.)]
- Шостка К.Г., Кузнецов И.М., Арутюнян К.В., Ильин К.С., Кучеренко А.Д., Федоров К.С. Рак поджелудочной железы с синхронными метастазами в легкие Вестник национального медико-хирургического центра им. Н.И.Пирогова. 2018; 13(2): 166-169. [Shostka K.G., Kuznetsov I.M., Arutyunyan K.V., Ilyin K.S., Kucherenko A.D., Fedorov K.S. Pancreatic cancer with synchronous lung metastases. Bulletin of the National Medical and Surgical Center. N.I. Pirogov. 2018; 13(2): 166-169. (In Russ.)]
- Zhao Y, Li J, Li D, Wang Z, Zhao J, Wu X, Sun Q, Lin PP, Plum P, Damanakis A, Gebauer F, Zhou M, Zhang Z, Schlösser H, Jauch KW, Nelson PJ, Bruns CJ. Tumor biology and multidisciplinary strategies of oligometastasis in gastrointestinal cancers. Semin Cancer Biol. 2020; 60: 334-343. http://doi.org/10.1016/j.semcancer.2019.08.026
- Нартайлаков М.А., Галимов И.И., Шакуров Д.Ф., Логинов М.О., Мирасова Г.Х. Эффективность рентгенэндоваскулярной эмболизации ветви воротной вены при обширных резекциях печени. Хирургическая практика. 2022;(1):33-37. https://doi.org/10.38181/2223-2427-2022-1-33-37[Nartailakov M.A., Galimov I.I., Shakurov D.F., Loginov M.O., Mirasova G.K. efficiency portal vein x-ray vascular embolization in extended hepatic resection. Surgical practice. 2022;(1):33-37. (In Russ.) https://doi.org/10.38181/2223-2427-2022-1-33-37]
- Hackert T, Niesen W, Hinz U, Tjaden C, Strobel O, Ulrich A, Michalski CW, Büchler MW. Radical surgery of oligometastatic pancreatic cancer. Eur J Surg Oncol. 2017; 43(2): 358–363. http://doi.org/10.1016/j.ejso.2016.10.023
- Yang J, Zhang J, Lui W, Huo Y, Fu X, Yang M, Hua R, Wang L, Sun Y. Patients with hepatic oligometastatic pancreatic body/tail ductal adenocarcinoma may benefit from synchronous resection. HPB (Oxford). 2020; 22(1): 91-101 https://doi.org/10.1016/j.hpb.2019.05.015
- Tachezy M, Gebauer F, Janot M, Uhl W, Zerbi A, Montorsi M, Perinel J, Adham M, Dervenis C, Agalianos C, Malleo G, Maggino L, Stein A, Izbicki JR, Bockhorn M. Synchronous resections of hepatic oligometastatic pancreatic cancer: Disputing a principle in a time of safe pancreatic operations in a retrospective multicenter analysis. Surgery. 2016; 160(1): 136-144. https://doi.org/10.1016/j.surg.2016.02.019
- Crippa S, Bittoni A, Sebastiani E, Partelli S, Zanon S, Lanese A, Andrikou K, Muffatti F, Balzano G, Reni M, Cascinu S, Falconi M. Is there a role for surgical resection in patients with pancreatic cancer with liver metastases responding to chemotherapy? Eur J Surg Oncol. 2016. 42: 1533–1539. http://doi.org/10.1016/j.ejso.2016.06.398
- Ghaffarpasand E., Barrows C., Callery M.P., Moser A.J., Kent T.S. Resection of oligometastatic pancreatic ductal adenocarcinoma: a systematic review and meta-analysis. HBP. 2019; 21(1): 83-87. https://doi.org/10.1016/j.hpb.2019.03.138
- Kandel P, Wallace MB, Stauffer J, Bolan C, Raimondo M, Woodward TA, Gomez V, Ritter AW, Asbun H, Mody K. Survival of Patients with Oligometastatic Pancreatic Ductal Adenocarcinoma Treated with Combined Modality Treatment Including Surgical Resection: A Pilot Study. Journal of Pancreatic Cancer. 2018; 4(1): 88-94. https://doi.org/10.1089/pancan.2018.0011
- Hua Y, Wang P, Zhu X, Shen Y, Wang K, Shi W, Lin J, Meng Z, Chen Z., Chen H. Radiofrequency ablation for hepatic oligometastatic pancreatic cancer: An analysis of safety and efficacy. Pancreatology. 2017; 17: 967–973. https://doi.org/10.1016/j.pan.2017.08.072
- Haas M, Heinemann V, Kullmann F, Laubender R, Klose C, Bruns C, Holdenrieder S, Modest D, Schulz C, Boeck S. Prognostic value of CA 19-9, CEA, CRP, LDH and bilirubin levels in locally advanced and metastatic pancreatic cancer: Results from a multicenter, pooled analysis of patients receiving palliative chemotherapy. J Cancer Res Clin Oncol. 2013; 139(4): 681–689. https://doi.org/10.1007/s00432-012-1371-3
- Boeck S, Wittwer C, Heinemann V, Haas M, Kern C, Stieber P, Nagel D, Holdenrieder S. Cytokeratin 19- fragments (CYFRA 21-1) as a novel serum biomarker for response and survival in patients with advanced pancreatic cancer. Br J Cancer. 2013; 108(8): 1684–1694. https://doi.org/10.1038/bjc.2013.158
- Song J, Chen M, Guo J, Lian S, Xu B. Combined pretreatment serum CA19- 9 and neutrophil-to-lymphocyte ratio as a potential prognostic factor in metastatic pancreatic cancer patients. Medicine (Baltimore). 2018; 97(4). https://doi.org/10.1097/MD.0000000000009707
- Hang J, Wu L, Zhu L, Sun Z, Wang G, Pan J, Zheng S, Xu K, Du J, Jiang H. Prediction of overall survival for metastatic pancreatic cancer: Development and validation of a prognostic nomogram with data from open clinical trial and real-world study. Cancer Med. 2018; 7(7): 2974–2984. https://doi.org/10.1002/cam4.1573
- Kim H, Lee J, Paik K, Lee Y, Hwang J, Kim J. Initial metastatic site as aprognostic factor in patients with stage IV pancreatic ductal adenocarcinoma. Medicine (Baltimore). 2015; 94(25). https://doi.org/10.1097/MD.0000000000001012
- Uppal A, Wightman S, Mallon S, Oshima G, Pitroda S, Zhang Q, Huang X, Darga T, Huang L, Andrade J, Liu H, Ferguson M, Greene G, Posner M, Hellman S, Khodarev N, Weichselbaum R. 14q32-encoded microRNAs mediate an oligometastatic phenotype. Oncotarget. 2015; 6: 3540–3552. https://doi.org/10.18632/oncotarget.2920
- Lussier Y, Khodarev N, Regan K, Corbin K, Li H, Ganai S, Khan S, Gnerlich J, Darga T, Fan H, Karpenko O, Paty P, Posner M, Chmura S, Hellman S, Ferguson M, Weichselbaum R. Oligo- and polymetastatic progression in lung metastasis(es) patients is associated with specific microRNAs. PLoS One. 2012; 7(12). https://doi.org/10.1371/journal.pone.0050141
- Oshima G, Poli E, Bolt M, Chlenski A, Forde M, Jutzy J, Biyani N, Posner M, Pitroda S, Weichselbaum R, Khodarev N. DNA Methylation Controls Metastasis-Suppressive 14q32- Encoded miRNAs. Cancer Res. 2019; 79(3): 650-662. https://doi.org/10.1158/0008-5472
- deSouza N, Liu Y, Chiti A, Oprea-Lager D, Gebhart G, Van Beers B, Herrmann K, Lecouvet F. Strategies and technical challenges for imaging oligometastatic disease: Recommendations from the European Organisation for Research and Treatment of Cancer imaging group. Eur J Cancer. 2018; 91: 153-163. https://doi.org/10.1016/j.ejca.2017.12.012
- Guckenberger M, Lievens Y, Bouma A, Collette L, Dekker A, deSouza N, Dingemans A, Fournier B, Hurkmans C, Lecouvet F, Meattini I, Méndez Romero A, Ricardi U, Russell N, Schanne D, Scorsetti M, Tombal B, Verellen D, Verfaillie C, Ost P. Characterisation and classification of oligometastatic disease: a European Society for Radiotherapy and Oncology and European Organisation for Research and Treatment of Cancer consensus recommendation. Lancet Oncol. 2020; 21(1): 18-28. https://doi.org/10.1016/S1470-2045(19)30718-1
- Damanakis A, Ostertag L, Waldschmidt D, Kütting F, Quaas A, Plum P, Bruns C, Gebauer F, Popp F. Proposal for a definition of "Oligometastatic disease in pancreatic cancer". BMC Cancer. 2019; 19(1): 1261. https://doi.org/10.1186/s12885-019-6448-9
- Niesen W, Primavesi F, Gasteiger S, Neoptolemos J, Hackert T, Stättner S. Surgical and local therapeutic concepts of oligometastatic pancreatic cancer in the era of effective chemotherapy. European Surgery. 2019; 51: 153–164, https://doi.org/10.1007/s10353-019-0589-6
- Wei M, Shi S, Hua J, Xu J, Yu X. Simultaneous resection of the primary tumour and liver metastases after conversion chemotherapy versus standard therapy in pancreatic cancer with liver oligometastasis: protocol of a multicenter, prospective, randomised phase III control trial (CSPAC-1). BMJ Open 2019; 9. https://doi.org/10.1136/ bmjopen-2019-033452


