Хирургическое лечение редкого сочетания ревматического порока митрального клапана и миксомы левого предсердия: клинический случай
Автор: Евтушенко В. В., Жилина А. Н., Черных Ю. Н., Катков В. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Наиболее характерным кардиальным доброкачественным новообразованием является миксома сердца с наиболее типичной ее локализацией в левом предсердии (ЛП). Это патология с неспецифической клинической картиной, требующая применения инструментальных методов исследования для верификации диагноза. В данной статье описан клинический случай редкого сочетания миксомы сердца, проявляющейся симптомами динамической обструкции митрального клапана (МК), с ревматической болезнью сердца и хронической обструктивной болезнью легких (ХОБЛ). Трудности в первичной постановке диагноза новообразования сердца были обусловлены схожестью клинической симптоматики вышеуказанных заболеваний.
Миксома сердца, миксома левого предсердия, новообразования в сердце, ревматическая болезнь сердца, хирургическое лечение миксомы, динамическая обструкция митрального клапана, клинический случай
Короткий адрес: https://sciup.org/149142843
IDR: 149142843 | УДК: 616.126.42-002.77:616.125.2-006.325.03]-039.42-089 | DOI: 10.29001/2073-8552-2023-38-2-281-285
Текст научной статьи Хирургическое лечение редкого сочетания ревматического порока митрального клапана и миксомы левого предсердия: клинический случай
Кардиальные новообразования – довольно редко встречающаяся в практике врача патология. Часто отсутствие патогномоничных симптомов делает постановку диагноза затруднительным без использования инструментальных методов диагностики. Ранее по причине недоступности параклинических методов исследования опухоли сердца являлись в основном патологоанатомической находкой с частотой обнаружения 0,001–0,3% [1]. С развитием визуализирующих методов диагностики заболеваний сердечно-сосудистой системы кардиальные новообразования перешли из случайной находки на ау-топсийном столе в заболевание, с которым каждый врач может столкнуться в своей практике.
Из новообразований, локализующихся в полостях сердца, наиболее часто встречаются миксомы, составляя более половины доброкачественных образований данной локализации [1, 2].
Сложность рутинной диагностики новообразований сердца может усугубляться наличием сопутствующей структурной кардиальной или иной патологии, имеющей схожую симптоматику, особенно если пациент наблюдается у кардиолога нерегулярно.
В данной статье описан клинический случай миксомы сердца, ассоциированной с ревматической болезнью сердца и осложненной тромбозом левого предсердия (ЛП), сочетающейся с хронической обструктивной болезнью легких (ХОБЛ).
Клинический случай
Пациент З., 56 лет, поступил в кардиохирургическое отделение НИИ кардиологии Томского НИМЦ в мае 2022 г. в плановом порядке с жалобами на одышку при быстрой ходьбе, перебои в работе сердца.
Из анамнеза заболевания выяснено, что указанные жалобы появились в апреле 2022 г., в связи с чем пациент обратился к пульмонологу. Установлено, что пациент курит в течение 30 лет по 1 пачке в день, индекс курящего человека составил 30 пачка/лет. Исходя из длительного стажа курения, а также по результатам обследования выставлен диагноз: Хроническая обструктивная болезнь легких, бронхитический тип. Назначена комбинация ти-отропия бромида и олодатерола дозировкой 2,5 мкг + 2,5 мкг на одну дозу в виде ингалятора.
Терапии придерживался, однако после проведенного лечения одышка сохранялась, что послужило причиной для направления пациента к кардиологу. При сборе анамнеза жалоб, характерных для перенесенной острой рев- матической лихорадки, выявлено не было: симптомы со стороны опорно-двигательного аппарата отсутствовали, у ревматолога в детстве не наблюдался, лабораторные изменения неясной этиологии не зафиксированы, медицинского освобождения от выполнения физических нагрузок не имел, в армии служил.
При аускультации выявлен систолический шум, характеристики которого приведены далее в тексте статьи. Выполнена трансторакальная эхокардиография (ЭхоКГ): в полости ЛП обнаружено новообразование с динамической обструкцией левого атриовентрикулярного отверстия в сочетании с митральной недостаточностью 3-й степени, выявлена дилатация предсердий, недостаточность трикуспидального клапана (ТК) 2-й степени. Также обнаружена пароксизмальная форма фибрилляции предсердий, тахисистолический вариант, в связи с чем назначены бисопролол 5 мг в сутки и ривароксабан 5 мг в сутки. Направлен к сердечно-сосудистому хирургу для определения дальнейшей тактики лечения.
На амбулаторном приеме при физикальном обследовании аускультативно определялся систолический шум на верхушке сердца с проведением его в левую подмышечную область, жесткое дыхание с единичными сухими хрипами по всем легочным полям, также имелась пастозность в области голеней. Пациенту предложена госпитализация в профильное отделение НИИ кардиологии Томского НИМЦ для дообследования и хирургического лечения.
После госпитализации выполнена повторная трансторакальная ЭхоКГ: в полости ЛП выявлено подвижное плотное образование 36 × 22 × 20 мм, крепящееся к межпредсердной перегородке (МПП), с обтурацией митрального клапана (МК) в диастолу желудочков; створки МК уплотнены, хорды укорочены, глубина коаптации 12 мм; умеренные подклапанные сращения; пиковый градиент на МК 11 мм рт. ст., средний градиент на МК 3,6 мм рт. ст., митральная недостаточность 2–3-й степени, объем митральной регургитации 39 мл, эффективная площадь отверстия регургитации (ERO) МК – 36 мм2; дилатация предсердий (ЛП – 50 × 60 мм, правое предсердие (ПП) 46 × 58 мм); фиброзное кольцо ТК – 38 мм, недостаточность ТК 2-й степени, систолическое давление в правом желудочке (СДПЖ) – 78 мм рт. ст.; фракция выброса левого желудочка (ФВ ЛЖ) – 69%, нарушений локальной сократимости нет.
По данным селективной коронароангиографии, атеросклеротического поражения коронарных артерий не выявлено. По данным спирометрии – бронхиальная об- струкция средней степени тяжести, снижение жизненной емкости легких (ЖЕЛ) до 53%, функциональной ЖЕЛ до 54%. Из лабораторных находок: тромбоцитопения неясной этиологии (141 × 109/л), дислипидемия.
Пациент был проконсультирован сердечно-сосудистым хирургом, определены абсолютные показания к хирургическому лечению заболевания сердца. В июне 2022 г. в НИИ кардиологии Томского НИМЦ пациенту выполнено удаление новообразования ЛП с ушиванием ушка ЛП и радиочастотной аблацией эндокардиальных миксоматозных наложений и площадки прикрепления опухоли, протезирование МК механическим протезом, радиочастотная аблация легочных вен по типу «Box», ан-нулопластика ТК опорным кольцом-протезом в условиях искусственного кровообращения и антеградной холодовой кардиоплегии.
Интраоперационно выявлено подвижное новообразование на тонкой ножке размером 6 × 2 см с кальцинозом и распадом (рис. 1), крепящееся к нижней трети МПП, определялись миксоматозные наложения в области устьев легочных вен с переходом на ушко ЛП и МК. Створки МК утолщены, малоподвижны, сращены по комиссурам, приращены к папиллярным мышцам, хорды резко утолщены, спаяны в конгломераты (рис. 2), в связи с чем сохранение нативного клапана признано нецелесообразным, принято решение о протезировании МК. При ревизии ТК изменений створок не выявлено, фиброзное кольцо ТК расширено до 42 мм.
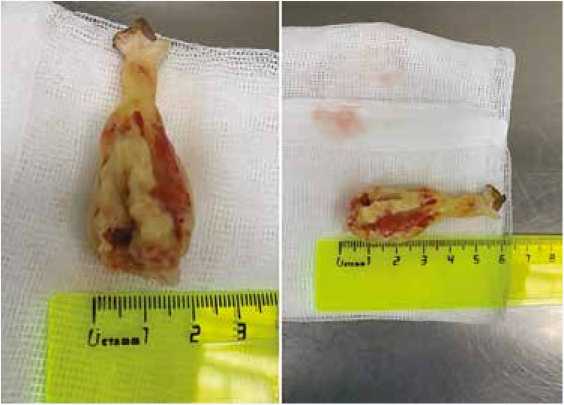
Рис. 1. Новообразование левого предсердия
Fig. 1. Neoplasm of the left atrium
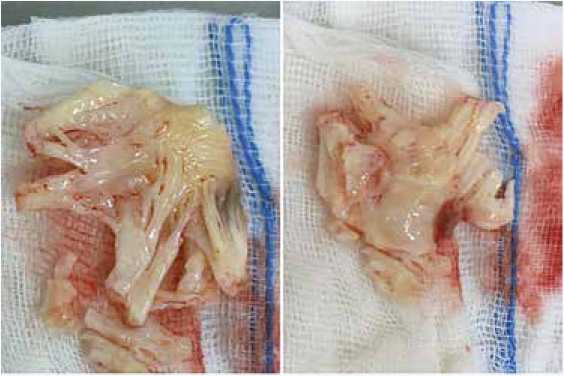
Рис. 2. Иссеченные створки митрального клапана с хордами
Fig. 2. Removed mitral valve leaflets with chordae
По результатам гистологического исследования, новообразование является миксомой ЛП, наложения в полости ЛП – свежими тромботическими массами, морфологическая картина изучаемых иссеченных створок МК соответствует фибробластическому варианту хронического ревматического эндокардита.
В послеоперационном периоде развился постпери-кардиотомный синдром в виде двустороннего гидроторакса, купированного медикаментозно. Кроме того, из средней трети раны на груди на 3-й день послеоперационного периода однократно получено гнойно-геморрагическое отделяемое без роста микрофлоры при бактериологическом исследовании. До получения результатов бактериологического посева пациент получал антибактериальную терапию линезолидом, левофлоксацином. Швы сняты в срок, заживление раны первичным натяжением. Выписался в удовлетворительном состоянии.
Обсуждение
Считается, что миксома образуется из мультипотент-ных мезенхимальных клеток, персистирующих в субэндокардиальной ткани сердца с момента его септации и способных к дифференцировке [3]. Микроскопически миксома состоит из клеток звездчатой, полигональной и других форм, имеющих оксифильную цитоплазму и располагающихся в богатом мукополисахаридами матриксе. Также могут встречаться и вторичные изменения новообразования: фиброз, тромбоз, кальциноз, оссификация, тельца Гамна – Ганди [4].
Макроскопически выделяют солидные и папиллярные миксомы [4]. В нашем случае миксома солидная, однако множественные мелкие очаги миксоматоза в ЛП не позволяют однозначно говорить только о солидной консистенции опухоли. Выполненное хирургическое лечение является радикальным, все очаги миксоматоза подвергнуты хирургическому удалению и радиочастотной дисфункции. Тем не менее, возможные рецидивы опухоли требуют дальнейшего динамического наблюдения [2, 5].
Миксома может дебютировать в любом возрасте, однако наиболее часто новообразование обнаруживается в 30–60 лет [6]. Симптоматика может варьировать от ее полного отсутствия до широкого спектра симптомов [7, 8], что делает дифференциальную диагностику в некоторых случаях затруднительной [6]. В целом можно выделить 3 группы симптомов, связанных с кардиальными новообразованиями, в том числе и с миксомой: симптомы системной эмболии, симптомы динамической обструкции левого атриовентрикулярного отверстия, общие (конституциональные) симптомы [3, 6, 7, 9] при секреции клетками миксомы провоспалительных цитокинов [9].
При изучении литературы конкретных особенностей сочетания миксомы и другой кардиальной патологии найдено не было. Сопутствующие заболевания сердца могут изменять, потенциировать или маскировать вышеуказанные симптомы новообразования, что может привести к постановке неверного диагноза и ошибочной тактике ведения.
Пациент, оперированный в нашей клинике, попадает в вышеуказанный возрастной диапазон, однако наличие у него ревматического порока МК говорит о том, что тот, скорее всего, сформировался в более молодом возрасте. При этом отсутствие четкого ревматического анамнеза не позволяет точно установить возраст, когда развился порок МК.
Также невозможно точно установить сроки появления миксомы, однако именно сочетание двух структурных патологий привело к нарушениям гемодинамики с выражен- ными клиническими проявлениями. Схожесть симптоматики не позволила сразу клинически выявить сочетание двух патологий, но ультразвуковое исследование сердца, выполненное для верификации диагноза, позволило их правильно определить. Тот факт, что пациент ранее систематически не наблюдался у врача, а заболевание сердца было выявлено несвоевременно, привел к осложненному течению болезни – развитию фибрилляции предсердий и легочной гипертензии.
Стоит отметить, что подобные случаи сосуществования миксомы и порока МК ревматической этиологии достаточно редки. В литературе встречаются единичные описания, последние зафиксированные случаи датируются 2009 г. [10, 11].
Как уже упоминалось ранее, основную роль в верификации диагноза миксомы играют именно визуализирующие инструментальные методы диагностики. Широко распространенным неинвазивным методом, позволяющим поставить диагноз новообразования сердца, является трансторакальная ЭхоКГ.
В данном случае новообразование манифестировало симптомами порока МК, а именно сложного ревматического порока, включающего истинное сужение левого атриовентрикулярного отверстия и его динамической обструкции опухолью ЛП, а также недостаточности МК. Сопутствующая патология со стороны дыхательной системы, а именно ХОБЛ, обусловила трудности в первичной постановке диагноза. Благодаря схожести клинической симптоматики при вышеуказанных заболеваниях, а также вариабельности симптомов при новообразованиях сердца и его ревматических пороках, установить правильный диагноз получилось только после проведенной терапии по поводу ХОБЛ и при отсутствии регрессии перечисленных симптомов.
Заключение
Данный клинический случай иллюстрирует, что постановка диагноза новообразования в сердце может быть ассоциирована со значительными трудностями в связи с вариабельностью клинической картины. Стоит отметить, что миксома сердца не так часто встречается в практике врача, поэтому в большинстве случаев в дифференциальном диагнозе опухоли сердца нет, а симптомы приписываются другому сопутствующему заболеванию, как это было и у вышеописанного пациента. Кроме того, возможно сочетание новообразования с другой патологией сердечно-сосудистой системы, например, с приобретенным пороком МК ревматической этиологии, что обусловливает выраженность кардиальных симптомов.
Список литературы Хирургическое лечение редкого сочетания ревматического порока митрального клапана и миксомы левого предсердия: клинический случай
- Butany J., Nair V., Naseemuddin A., Nair G.M., Catton C., Yau T. Cardiac tumours: diagnosis and management. Lancet Oncol. 2005;6(4):219-228. https://doi.org/10.1016/S1470-2045(05)70093-0.
- Elbardissi A.W., Dearani J.A., Daly R.C., Mullany C.J., Orszulak T.A., Puga F.J. et al. Survival after resection of primary cardiac tumors: a 48-year experience. Circulation. 2008;118(14):7-15. https://doi.org/10.1161/CIRCULATIONAHA.107.783126.
- Wang J.G., Li Y.J., Liu H., Li N.N., Zhao J., Xing X.M. Clinicopathologic analysis of cardiac myxomas: Seven years ҆ experience with 61 patients. J. Thorac. Dis. 2012;4(3):272-283. https://doi.org/10.3978/j.issn.2072-1439.2012.05.07.
- Garatti A., Nano G., Canziani A., Gagliardotto P., Mossuto E., Frigiola A. et al. Surgical excision of cardiac myxomas: twenty years experience at a single institution. Ann. Thorac. Surg. 2012;93(3):825-831. https://doi.org/10.1016/j.athoracsur.2011.11.009.
- Shah I.K., Dearani J.A., Daly R.C., Suri R.M., Park S.J., Joyce L.D. et al. Cardiac Myxomas: A 50-year experience with resection and analysis of risk factors for recurrence. Ann. Thorac. Surg. 2015;100(2):495-500. https://doi.org/10.1016/j.athoracsur.2015.03.007.
- Thyagarajan B., Kumar M.P., Patel S., Agrawal A. Extracardiac manifestations of atrial myxomas. J. Saudi Heart Assoc. 2017;29(1):37-43. https://doi.org/10.1016/j.jsha.2016.07.003.
- Cho J., Quach S., Reed J., Osian O. Case report: left atrial Myxoma causing elevated C-reactive protein, fatigue and fever, with literature review. BMC Cardiovasc. Disord. 2020;20(119). https://doi.org/10.1186/s12872-020-01397-1.
- Цой Е.И., Фальковская А.Ю., Евтушенко В.В., Мордовин В.Ф. Случай быстропрогрессирующей миксомы сердца со злокачественным клиническим течением после инфекции COVID-19. Кардиология. 2022;62(9):74-78. https://doi.org/10.18087/cardio.2022.9.n1624.
- Mendoza C.E., Rosado M.F., Bernal L. The role of interleukin-6 in cases of cardiac myxoma. Clinical features, immunologic abnormalities, and a possible role in recurrence. Tex. Heart Inst. J. 2001;28(1):3-7. URL: https://pubmed.ncbi.nlm.nih.gov/11330738 (12.01.2023).
- Seagle R.L., Nomeir A.M., Watts L.E. Left atrial myxoma associated with rheumatic mitral stenosis. Clin. Cardiol. 1984;7(6):370-372. https://doi.org/10.1002/clc.4960070609.
- Moustafa S., Bégin L.R., Souliere V. Image. Inadvertent coexistence of atrial myxoma and mitral stenosis. Arch. Cardiovasc. Dis. 2009;102(6-7):583-584. https://doi.org/10.1016/j.acvd.2009.02.010.


