Хирургическое лечение солитарного метастатического поражения надпочечника при немелкоклеточном раке легкого
Автор: Мурадян Аветик Гагикович, Костин Андрей Александрович, Толкачев Александр Олегович, Воробьев Николай Владимирович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Введение. Надпочечники (НП) являются местом солитарного синхронного и метахронного метастатического поражения при немелкоклеточном раке легкого (НМРЛ). Наличие солитарного поражения дает преимущество в выживаемости пациентов, однако в настоящее время нет точных алгоритмов лечения таких пациентов. Цель исследования - оценка непосредственных и отдаленных результатов лечения пациентов с метастатическим поражением НП при НМРЛ. Материал и методы. Выполнялся ретроспективный анализ историй болезни и результатов лечения пациентов, которым проводилась адреналэктомия при НМРЛ. результаты. С 1993 по 2014 г. в исследование включено 13 пациентов (11 мужчин и 2 женщины; медиана возраста - 58 лет), которым проводилась адреналэктомия, по поводу солитарного метастатического поражения НП: в 7 - аденокарциномы, в 4 - плоскоклеточного рака, в 2 наблюдениях - крупноклеточный рак; синхронное поражение - 5 (38,5%), метахронное поражение -8 (61,5%) случаев. Лапароскопический доступ использовался в 10 (76,9 %), открытый доступ -в 3 (23,1 %) случаях. Средний диаметр опухоли надпочечника составил 74,6 ± 13,3 мм (25-170 мм). В раннем послеоперационном периоде наблюдалось 2 случая летального исхода. Медиана времени наблюдения после адреналэктомии составила 20 мес (от 3 до 267 мес), среднее время наблюдения - 51,5 ± 23,5 мес. Трехлетняя общая выживаемость в группе синхронного поражения составила 25,0 ± 2,2 %, в группе метахронного поражения - 57,1 ± 1,9 %, различия статистически не значимы (p=0,63; Log Rank). Объем хирургического вмешательства, морфологический тип опухоли, статус регионарных лимфатических узлов, сторона поражения НП не явились факторами, влияющими на выживаемость (p>0,05). Выводы. Нами не выявлено факторов, влияющих на выживаемость пациентов с солитарным метастатическим поражением НМ при НМРЛ.
Солитарные метастатические опухоли надпочечника, немелкоклеточный рак легкого
Короткий адрес: https://sciup.org/140254358
IDR: 140254358 | УДК: 616.45-006.6-02-089:616.24-006.6-033.2 | DOI: 10.21294/1814-4861-2020-19-4-105-111
Текст научной статьи Хирургическое лечение солитарного метастатического поражения надпочечника при немелкоклеточном раке легкого
Рак легкого занимает первое место в структуре онкологической заболеваемости и смертности в мире, в 2018 г. зарегистрировано более 2 млн новых случаев [1, 2]. В Российской Федерации в 2018 г. рак легкого выявлен у 55 717 пациентов, при этом у 41 % на момент постановки диагноза была IV стадия заболевания, что сопоставимо с мировыми данными, согласно которым 40–50 % больных на момент диагностики немелкоклеточного рака легкого (НМРЛ) имеют отдаленные метастазы [3, 4]. Однако у 7 % пациентов имеются солитарные или олигометастатические очаги, что и привело к выделению отдельной категории M1b как одиночного отдаленного метастатического очага в классификации TNM 8-го издания, так как данная группа пациентов имеет более благоприятный прогноз [4, 5]. Опираясь на теорию S. Hellman и R.R. Weichselbaum об олигометастазах (количество очагов, по различным данным, варьирует от 3 до 5) как о промежуточном состоянии между локализованными и диссеминированными опухолями, можно рассматривать возможное преимущество методов локального воздействия (хирургическое лечение, лучевая терапия и аблативные технологии) при солитарном или олигометастатическом опухолевом процессе. Другим фактором, оправдывающим воздействие на солитарные метастатические очаги, является возможная профилактика вторичных метастазов, возникающих из уже существующих [4, 6, 7].
При выявлении синхронной (до 6 мес от момента постановки диагноза) или метахронной опухоли в надпочечнике (НП) необходима дифференциальная диагностика между метастатическим поражением, первичными злокачественными и доброкачественными опухолями НП, несмотря на общепризнанную вероятность вторичного поражения, равную 50 % [8]. В настоящее время для оценки распространенности опухоли при НМРЛ все чаще используется ПЭТ/КТ всего тела с 18F-фтордезоксиглюкозой (18F-ФДГ) и МРТ головного мозга с внутривенным контрастированием [4]. Обязательным в диагностике является исключение гормональной активности опухоли
НП, что особенно важно для проведения биопсии, при этом необходимо отметить уменьшение роли предоперационной морфологической верификации при вторичном поражении НП, так как ПЭТ/ КТ с 18F-ФДГ в последние годы используется как эффективный инструмент для выявления злокачественных опухолей НП с чувствительностью 74–100 % и специфичностью 66–100 % при дифференциальной диагностике доброкачественных и злокачественных новообразований у пациентов с известной первичной локализацией опухоли [9].
В рандомизированном исследовании, сравнивающем выживаемость пациентов с олигомета-статическим поражением (не более 3 очагов) при применении методов локального воздействия и без них после первой линии лекарственной терапии, авторы пришли к выводу, что их использование является эффективным и увеличивает выживаемость без прогрессирования (ВБП) – 11,9 против 3,9 мес (p=0,005) [10]. При этом показания к применению локального воздействия окончательно не определены.
В качестве факторов, влияющих на эффективность хирургического лечения, выступают категория Т, поражение регионарных лимфатических узлов, местнораспространенные опухоли НП, наличие тромба в нижней полой вене [11]. Кроме того, указывают на высокие показатели выживаемости при ипсилатеральном поражении НП по сравнению с контралатеральным [12]. Однако до сих пор, учитывая малое количество пациентов с солитарным метастатическим поражением надпочечника, остается нерешенным вопрос о необходимости метастазэктомии.
Целью исследования явился анализ непосредственных и отдаленных результатов лечения пациентов с синхронными и метахронными метастатическими поражениями НП при НМРЛ.
Материал и методы
Нами проанализированы истории болезни пациентов отделения онкоурологии и торакальной хирургии МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России с клиническим диагнозом НМРЛ и солитарными метастатическими очагами, которым в период с 1993 по 2014 г. проводились хирургическое вмешательство на первичной опухоли и адреналэктомия. Одному пациенту дополнительно проводилась стереотаксическая лучевая терапия в связи с метастатическим поражением головного мозга. При прогрессировании заболевания после хирургического вмешательства пациентам назначалась лекарственная терапия. Стадирование проводилось согласно классификации TNM 7-го издания.
Синхронным метастатическим поражением считалось наличие вторичных очагов на момент диагностики или их выявление в течение 6 мес после постановки диагноза. Данные о последующем наблюдении были собраны путем телефонной связи с пациентами или их семьями.
Согласно определению, период времени от момента выявления заболевания до момента смерти пациента считается общей выживаемостью. Под выживаемостью без прогрессирования понимается время от момента первичного лечения пациента до момента выявления рецидива или прогрессирования заболевания.
Статистический анализ проводился при помощи программы SPSS Statistics 23 (IBM, США). Для оценки достоверности различий в двух группах использовался критерий Стьюдента. Уровень достоверности был принят как достаточный при р<0,05. Анализ выживаемости в группах больных в определенный период времени осуществлялся с применением метода Каплана – Мейера.
Результаты
В исследование включены 13 пациентов (11 мужчин и 2 женщины) с НМРЛ и солитарным метастатическим поражением надпочечника, которым в период с 1993 по 2014 г. проводилась адреналэктомия. Медиана возраста – 58 лет (44–78 лет). Морфологическая структура опухолей в 7 (53,8 %) случаях была представлена аденокарциномой, в 5 (30,8 %) – плоскоклеточным раком, в 2 (15,4 %) наблюдениях – крупноклеточным раком. У 12 (92,3 %) пациентов метастатическая болезнь проявлялась в виде солитарного метастатического поражения надпочечника, у 1 пациента наблюдалось сочетание вторичного поражения надпочечника и головного мозга (два очага). Синхронное поражение было выявлено в 5 (38,5 %), метахронное – в 8 (61,5 %) случаях. Поражение левого легкого встречалось чаще, чем правого, с соотношением 2,25:1 (9 и 4 случая). Локализация первичной опухоли в верхней доле наблюдалась в 9 (69 %) случаях. Ипсилатеральная сторона поражения надпочечника относительно локализации опухоли в легком была выявлена у 7 (53,8 %) пациентов, контралатеральное поражение – у 4 (30,8 %), билатеральное поражение – у 2 (15,4 %) больных. Средний диаметр опухоли надпочечника – 74,6 ± 13,3 мм (25–170 мм). Распределение больных по категориям T и N, согласно классификации TNM, 7-е издание, представлено в табл. 1.
Объем хирургического вмешательства на легком в 6 (46,2 %) случаях был представлен лобэктомией, в 5 (38,5 %) – пневмонэктомией, в 2 (15,4 %) – резекцией одной доли. Адреналэктомия выполнялась лапароскопическим доступом в 10 (76,9 %) наблюдениях (конверсия в 1 (7,7 %) случае), в 3 (23,1 %) – открытым доступом. В 5 случаях поражение надпочечника выявлено синхронно, при этом двум больным хирургическое вмешательство проводилось симультанно, в 2 случаях – после таблица 1/table1
распределение пациентов по категориям t и n distribution of patients by t and n categories
категориальные переменные и их достоверность Categorical variables and their significance (p-value)
Одному пациенту с метастазом в головном мозге проводилась стереотаксическая лучевая терапия. Неоадъювантная терапия назначалась 1 больному в объеме 2 курсов с последующим хирургическим вмешательством, 2 пациента получали лекарственную терапию в адъювантном режиме.
В раннем послеоперационном периоде умерло 2 (15,4 %) пациента в связи с развитием панкрео-некроза и разлитого фибринозно-гнойного перитонита. Данные пациенты не входили в анализ при расчете общей выживаемости и выживаемости без прогрессирования.
Медиана времени наблюдения после адреналэктомии за всеми пациентами составила 20 мес (от 3 до 267 мес), среднее время наблюдения – 51,5 ± 23,5 мес. В группе синхронного поражения медиана составила – 16,0 мес (6,0–44,0), среднее время наблюдения – 20,5 ± 8,3 мес; в группе метахронного поражения – 37,0 мес (3,0–267,0) со средним временем наблюдения – 69,3 ± 35,8 мес. На момент анализа 5 (38,5 %) пациентов живы без признаков прогрессирования заболевания (4 пациента из группы метахронного, 1 пациент из группы синхронного поражения). У 6 (46,1 %) больных наступила смерть от прогрессирования заболевания, 2 (15,4 %) пациента умерли в раннем послеоперационном периоде. Трехлетняя общая выживаемость (ОВ) в группе синхронного поражения составила 25,0 ± 2,2 %, в группе метахронного поражения – 57,1 ± 1,9 % (рис. 1), однако различия статистически не значимы (p=0,63; Log Rank). Медиана выживаемости без прогрессирования составила 11,0 мес (от 1 до 267), среднее время наблюдения – 51,1 ± 24,3 мес. В группе синхронного поражения медиана – 8,5 мес (3,0–44,0), среднее время наблюдения – 16,0 ± 9,5 мес; в группе метахронного поражения – 37,0 мес (1,0–267,0) со средним временем наблюдения – 71,1 ± 36,6 мес. При однофакторном анализе значимых факторов, влияющих на выживаемость, нами не выявлено (табл. 2).
Обсуждение
В настоящее время возрастает интерес к проблеме лечения пациентов с солитарными и олигометастатическими очагами при НМРЛ, что связано с улучшением диагностики при первичном обращении и последующем динамическом наблюдении после лечения. В крупном метаанализе, проведенном под руководством S. Li et al., включавшем 1935 пациентов с олигометастатическим НМРЛ, при однофакторном анализе выявлены такие факторы благоприятного прогноза, как женский пол (ОР 1,21, 95 % ДИ: 1,02–1,45, p=0,03), (y)pN0-категория (ОР 1,82, 95 % ДИ: 1,40–2,36, p<0,00001), аденокарцинома (ОР 1,44, 95 % ДИ:
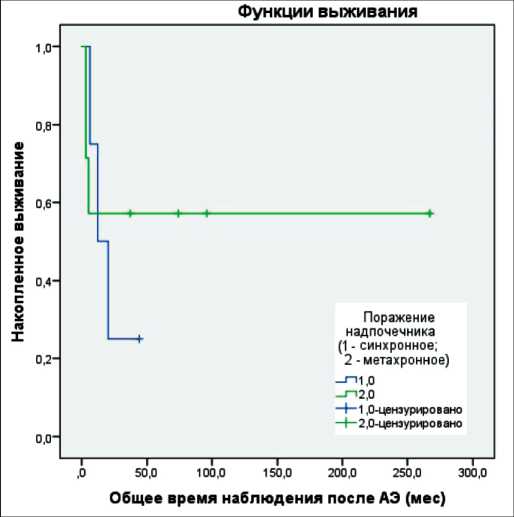
Рис. 1. Кривые общей выживаемости в группах синхронного и метахронного метастатического поражения надпочечника при НМРЛ
Fig. 1. Curves of overall survival in patients with synchronous and metachronous adrenal metastases from NSCLC
1,10–1,88, p=0,008). Однако при многофакторном анализе статистически значимая разница в общей выживаемости выявлена лишь в подгруппах N0 и N1 (ОР 1,63, 95 % ДИ: 1,27–2,10, p=0,001), но не при N2 [13]. В метаанализе, включавшем 757 пациентов с медианой общей выживаемости 26 мес, где хирургическое вмешательство было основным методом локального воздействия на очаги (от 1 до 5), авторы выделили такие факторы благоприятного прогноза, как метахронное поражение (p<0,001), N0-категория (p=0,002) и морфологический тип, представленный аденокарциномой (p=0,036). В исследовании удалось выделить три группы риска: пациенты с метахронными очагами, относящиеся к благоприятному прогнозу с 5-летней ОВ, – 47,8 %, промежуточный прогноз – пациенты с синхронными метастазами и отсутствием поражения регионарных лимфатических узлов (5-летняя ОВ – 36,2 %), группа неблагоприятного прогноза – синхронное метастатическое поражение, в том числе и регионарных лимфатических узлов (N1, N2) – 5-летняя ОВ составила 13,8 % [4, 14]. В нашем исследовании не выявлено взаимосвязи между различными факторами (пол, синхронное или метахронное поражение НП, объем операции, морфологический типа опухоли, категория N, сторона поражение НП в зависимости от локализации первичной опухоли), что, возможно, связано с малой выборкой пациентов.
Опираясь на то, что прогрессирование опухолевого процесса у пациентов с олигометастатиче-ским НМРЛ (≤3 очагов) происходит за счет уже известных на момент первичной диагностики очагов, в 2012 г. начато проспективное рандомизированное исследование (n=49), оценивающее время без прогрессирования у пациентов после первой линии лекарственной терапии (дуплет на основе платины, эрлотиниб или кризотиниб – в случае наличия активирующей мутации EGFR или транслокации гена ALK), в группе локального воздействия (хирургическое лечение и/или лучевая терапия), с/без поддерживающей терапии (пеме-трексед и бевацизумаб (для неплоскоклеточного НМРЛ), эрлотиниб, кризотиниб (для пациентов с перестройкой ALK)), в группе только наблюдения с/без поддерживающей терапии [10]. Среднее время наблюдения составило 12,39 мес (5,52–20,30), суммарная четырехлетняя выживаемость пациентов в группе локального воздействия составила 12,6 %, в группе наблюдения – 2,0 %. К аналогичным выводам пришли О.В. Пикин и соавт. при анализе результатов лечения 139 больных НМРЛ с резектабельными отдаленными метастазами, в том числе 11 (8,0 %) пациентов с метастазами в надпочечнике. Авторы отметили преимущество лишь в группе хирургического лечения метастазов в головной мозг (5-летняя выживаемость – 25,6 %). При оценке результатов лечения в группе вторичного поражения надпочечника медиана общей выживаемости составила 10 мес [15].
В случае выявления солитарного синхронного или метахронного метастатического поражения надпочечника при категории N0/N1, отсутствии других очагов по данным ПЭТ/КТ всего тела и КТ/МРТ головного мозга, согласно рекомендациям Американской коллегии торакальных врачей (American College of Clinical Pharmacy – ACCP), возможно проведение адреналэктомии с последующей адъювантной лекарственной терапией. При этом рекомендуется проводить инвазивную оценку состояния регионарных лимфатических узлов при помощи эндобронхиального ультразвукового исследования (EBUS) или медиастиноскопии, так как категория N2 связана с худшим прогнозом заболевания [4].
Заключение
Несмотря на то, что в нашем исследовании не выявлено факторов, влияющих на прогноз заболевания, необходимо дальнейшее изучение эффективности локальных методов воздействия, особенно в эпоху применения иммунотерапии и ингибиторов тирозинкиназы в лечении немелкоклеточного рака легкого.
Список литературы Хирургическое лечение солитарного метастатического поражения надпочечника при немелкоклеточном раке легкого
- Ferlay J., Colombet M., Soerjomataram I., Mathers C., ParkinD.M., PinerosM., Znaor A., Bray F. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019 Apr 15; 144(8): 1941-1953. doi: 10.1002/ijc.31937.
- Cancer Today. Estimated number of new cases in 2018, worldwide, both sexes, all ages [Internet]. URL: https://gco.iarc.fr/today/ online-analysis-table?v=2018&mode=cancer&mode_population=con tinents&population=900&populations=900&key=asr&sex=0&cancer =39&type=0&statistic=5&prevalence=0&population_group=0&ages_ group%5B%5D=0&ages_group%5B%5D=17&nb_items=5&group_ cancer=1&include_nmsc=1&include_nmsc_other=1 (cited 10.11.2019).
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2018 году. М., 2019. 250 с. [Kaprin A.D., Starinsky V.V., Petrova G.V. The status of cancer care for the population of Russia in 2018. Moscow, 2019. 250 p. (in Russian)].
- Fernandez R.A.S., Lau R.W.H., Ho J.Y.K., Yu P.S.Y., Chow S.C.Y., Wan I.Y.P., Ng C.S.H. Evidence for surgical resections in oligometa-static lung cancer. J Thorac Dis. 2019 Apr; 11(Suppl 7): S969-S975. doi: 10.21037/jtd.2019.04.09.
- Lim W., Ridge C.A., Nicholson A.G., Mirsadraee S. The 8th lung cancer TNM classification and clinical staging system: review of the changes and clinical implications. Quant Imaging Med Surg. 2018 Aug;8(7): 709-718. doi: 10.21037/qims.2018.08.02.
- Смоленов Е.И., Рагулин Ю.А., Пикин О.В. Классификация легочных метастазов: возможности применения в клинической практике. Сибирский онкологический журнал. 2018; 17(2): 34-40. [Smolenov E.I., Ragulin Yu.A., Pikin O.V. Classification of pulmonary metastases: potential application in clinical practice. Siberian Journal of Oncology. 2018; 17(2): 34-40. (in Russian)]. doi: 10.21294/1814-48612018-17-2-34-40
- Klein C.A. Parallel progression of primary tumours and metastases. Nat Rev Cancer. 2009 Apr; 9(4): 302-12. doi: 10.1038/nrc2627.
- Mansmann G., Lau J., Balk E., Rothberg M., Miyachi Y., Bornstein S.R. The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev. 2004 Apr; 25(2): 309-40. doi: 10.1210/ er. 2002-0031.
- Stone W.Z., Wymer D.C., Canales B.K. Fluorodeoxyglucose-positron-emission tomography/computed tomography imaging for adrenal masses in patients with lung cancer: review and diagnostic algorithm. J Endourol. 2014 Jan; 28(1): 104-11. doi: 10.1089/end.2013.0380.
- Gomez D.R., Blumenschein G.R.Jr., Lee J.J., Hernandez M., YeR., CamidgeD.R., DoebeleR.C., SkoulidisF., GasparL.E., GibbonsD.L., Karam J.A., Kavanagh B.D., Tang C., Komaki R., Louie A.V., Palma D.A., Tsao A.S., Sepesi B., William W.N., Zhang J., Shi Q., Wang X.S., Swisher S.G., Heymach J.V. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy: a multicentre, randomised, controlled, phase 2 study. Lancet Oncol. 2016 Dec; 17(12): 1672-1682. doi: 10.1016/S1470-2045(16)30532-0.
- Thomsen B., Fairchild A. Adrenal oligometastases secondary to nonsmall cell lung cancer-What is the optimal treatment approach? Oncol Hematol Rev. 2017; 13(2): 117-29. doi: 10.17925/0HR.2017.13.02.117.
- Raz D.J., Lanuti M., GaissertH.C., Wright C.D., Mathisen D.J., Wain J.C. Outcomes of patients with isolated adrenal metastasis from non-small cell lung carcinoma. Ann Thorac Surg. 2011; 92(5): 1788-92. doi: 10.1016/j.athoracsur.2011.05.116.
- Li S., Zhu R., Li D., Li N., ZhuX. Prognostic factors of oligometastatic non-small cell lung cancer: a meta-analysis. J Thorac Dis. 2018 Jun; 10(6): 3701-3713. doi: 10.21037/jtd.2018.05.105.
- AshworthA.B., Senan S., Palma DA, RiquetM., Ahn Y.C, Ricardi U., Congedo M.T., Gomez D.R., Wright G.M., Melloni G., Milano M.T., Sole C.V., De Pas T.M., Carter D.L., Warner A.J., Rodrigues G.B. An individual patient data metaanalysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer. Clin Lung Cancer. 2014 Sep; 15(5): 346-55. doi: 10.1016/j.cllc.2014.04.003.
- Пикин О.В., КартовещенкоА.С., БолотинаЛ.В., ТепляковВ.В., Королева Л.А., Зайцев А.М., Колбанов К.И., Глушко В.А., Вурсол ДА. Хирургическое лечение больных немелкоклеточным раком легкого с резектабельными отдаленными метастазами. Онкология. Журнал им. П.А. Герцена. 2013; 6(1): 48-50. [Pikin O.V., Kartoveshchenko A.S., BolotinaL.V., Tepliakov V.V., KorolevaL.A., ZaitsevA.M., KolbanovK.I., Glushko V.A., VursolD.A. Treatment for Stage IV non-small cell lung cancer metastatic to the brain and humerus. P. A. Herzen Journal of Oncology. 2013; 6(1): 48-50. (in Russian)].


