Хирургическое удаление первичной опухоли в составе комплексного лечения у больных раком молочной железы IV стадии
Автор: Зикиряходжаев А.Д., Болотина Л.В., Сухотько А.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (73), 2016 года.
Бесплатный доступ
Статья посвящена основным методам комплексного лечения генерализованного рака молочной железы. Во введении представлен анализ международных исследований, посвященных эффективности хирургического этапа комплексного лечения больных раком молочной железы IV стадии. Рассмотрена роль современной лекарственной терапии как фактора, увеличивающего общую выживаемость. В исследование включено 196 больных, получивших лечение в МНИОИ им. П.А. Герцена в период с 2000 по 2012 г. Первую группу составили 124 больных диссеминированным раком молочной железы, которым выполнялось хирургическое вмешательство на этапах комплексного лечения, во вторую группу были включены 72 пациентки, получавшие консервативное лечение. Изучены факторы, влияющие на прогноз и качество жизни больных генерализованным раком молочной железы: гормоночувствительность опухоли, гиперэкспрессия Her2/neu, состояние репродуктивной функции (возраст, наличие менопаузы).
Диссеминированный рак молочной железы, комплексное лечение, паллиативная мастэктомия, факторы прогноза
Короткий адрес: https://sciup.org/14056635
IDR: 14056635 | УДК: 618.19-006.6-089 | DOI: 10.21294/1814-4861-2016-15-1-19-25
Текст научной статьи Хирургическое удаление первичной опухоли в составе комплексного лечения у больных раком молочной железы IV стадии
Рак молочной железы (РМЖ) на сегодняшний день занимает лидирующее место среди злокачественных заболеваний у женщин во всем мире и составляет одну из наиболее важных медицинских и социально-экономических проблем. В России средний уровень заболеваемости РМЖ регистрируется на значении 45,75 на 100 тыс. женщин, что составляет 19,7 % от всех случаев злокачественных опухолей. Следует отметить, что наблюдается высокий удельный вес больных с поздними стадиями заболевания (III–IV), который приближается к 40 % из числа взятых под наблюдение с впервые в жизни установленным диагнозом. При этом удельный вес РМЖ IV стадии не имеет тенденции к снижению и на протяжении многих лет сохраняется на уровне 10 % [1].
Больные РМЖ IV стадии представляют неоднородную клиническую группу. У одних болезнь быстро прогрессирует, поражая жизненно важные органы, что приводит к смерти через несколько месяцев после возникновения метастазов. У других наблюдается медленное прогрессирование, при этом некоторые пациентки живут без проведения специального лечения более 10 лет. В большинстве случаев больные обращаются за медицинской помощью лишь при появлении вторичных симптомов основного заболевания. Отдаленные гематогенные метастазы чаще всего встречаются в костях, которые в 70–80 % случаев проявляются возникновением патологического перелома, а также легких и плевре, печени, головном мозге [2–4].
Проблема лечения диссеминированного РМЖ (ДРМЖ) приобретает в сложившейся ситуации особую актуальность, так как не существует единого стандарта лечения. В большинстве случаев оно носит паллиативный характер, поэтому основная задача заключается в максимальном продлении жизни и улучшении ее качества [5–7]. При планировании специальной терапии больных ДРМЖ приоритетом остается системное лечение (химиотерапия, гормонотерапия, в определенных случаях применение таргетных препаратов) [8–10], которое может быть дополнено локальными методами. В течение длительного времени существовало мнение, что хирургическое вмешательство при ДРМЖ не только не повышает общую выживаемость в связи с наличием отдаленных метастазов, а, наоборот, может стимулировать прогрессирование заболевания [11, 12]. Поэтому хирургическое лечение больных применяют только для предотвращения и/или устранения местных осложнений (изъязвление, распад опухоли, кровотечение) [13, 14].
Однако результаты многих ретроспективных исследований свидетельствуют об обоснованности хирургического удаления первичного очага в составе комплексного лечения этой категории больных [15–22]. Анализ мировой литературы демонстрирует возрастающий интерес к проблеме лечения больных РМЖ IV стадии. Это связано с накоплением клинических наблюдений и экспериментальных данных об особенностях возникновения и течения различных форм дис-
семинированного рака молочной железы [23–28]. Отсутствие единого подхода к выбору лечебной тактики диссеминированного рака молочной железы диктует необходимость научного исследования для ответа на многие нерешенные вопросы.
Материал и методы
В исследование включены результаты обследования и лечения 196 больных с впервые диагностированным раком молочной железы IV стадии, госпитализированных в МНИОИ им. П.А. Герцена в период с января 2000 г. по декабрь 2012 г. Диагноз устанавливали согласно Международной классификации TNM (7-е издание, 2011): любое Т, любое N и М1 – наличие отдаленных метастазов. Для оценки эффективности хирургического удаления первичной опухоли при раке молочной железы IV стадии все больные были разделены на две группы:
– в первую группу были включены 124 пациентки, которым выполнялось оперативное вмешательство в составе комплексного лечения;
– во вторую (контрольную) группу вошли 72 больные, которым проводилась системная противоопухолевая терапия.
Возраст больных варьировал от 29 до 80 лет, в среднем – 56,5 года. Значимых различий в обеих группах в зависимости от возраста пациенток и менструальной функции не выявлено (p>0,05). По менструальной функции больные распределились следующим образом: у 69 (35,2 %) менструальная функция была сохранена, у 127 (64,8 %) имелась менопауза.
Больные также были поделены в зависимости от биологических характеристик опухоли, локализации метастазов и их количества, ответа опухоли на первичное лечение. Наиболее часто диагностировался инвазивный протоковый рак – 77 %, гораздо реже инвазивный дольковый рак – 6,6 %, комбинированные формы протокового и долькового рака – 3,1 %. Согласно данным иммуногистохимического исследования у оперированных больных чаще встречался положительный рецепторный (РЭ/РП+) и отрицательный Her2/neu статус (p<0,05). Молекулярный подтип опухоли удалось оценить у 85 (43,4 %) пациенток. В обеих группах значительно преобладали больные с трижды негативным подтипом опухоли.
В зависимости от вида отдаленного метастазирования пациентки были поделены на 4 подгруппы. Изолированные метастазы в кости выявлены у 59 (30,1 %) больных, метастазы в легкие – у 43 (21,9 %), метастазы в печень – у 39 (19,9 %). У 55 (28,1 %) пациенток отмечалось сочетание различных вариантов отдаленного метастазирования.
Для определения величины ответа опухоли на лечение в работе использованы критерии эффективности терапии солидных опухолей по шкале RECIST. Под объективным лечебным эффектом подразумевается полный или частичный регресс опухоли, а также стабилизация опухолевого процесса более 6 мес. Для анализа общей выживаемости больных учитывали прошедшее время в месяцах с момента установления диагноза (начало наблюдения) до наступления смерти (критическое событие) в результате прогрессирования РМЖ. Пациенты, которые погибли от других причин, были цензурированы в момент смерти. Сроки наблюдений составили от 8 до 144 мес (медиана – 34 мес). Общая 1-, 3- и 5-летняя выживаемость рассчитана по методу Kaplan – Meier для всех больных. Для сравнения общей выживаемости использовался критерий log-rank.
Результаты и обсуждение
При анализе отдаленных результатов, в зависимости от выполненного хирургического вмешательства, общая 1-, 3- и 5-летняя выживаемость в группе оперированных пациенток составила 97,3, 51,3 и 34,1 % соответственно. Медиана выживаемости – 42 мес. Отмечено достоверное увеличение общей выживаемости в группе пациентов с хирургическим этапом лечения (p=0,00002), тогда так в группе неоперированных больных 1-, 3- и 5-летняя выживаемость составила 89,5, 39,7 и 15,1 % соответственно. Медиана выживаемости – 31 мес.
Одной из главных задач исследования явилось определение места удаления первичной опухоли. В основной группе (n=124) оперативное лечение на первом этапе выполнено у 27 (21,8 %) пациенток, при этом показатели 1-, 3- и 5-летней общей выживаемости составили 83,4, 32,7 и 10,9 % соответственно, медиана выживаемости – 32 мес. В 97 (78,2 %) случаях на первом этапе комплексного лечения проводилась системная терапия. Предоперационное системное лечение включало проведение паллиативных курсов химиотерапии, которое впоследствии приводило к положительной динамике и повышению резектабельности первичной опухоли. Это явилось показанием к выполнению операции с целью дополнительной редукции опухолевого процесса. В итоге, уровень 1-, 3- и 5-летней общей выживаемости у пациенток данной подгруппы равнялся 98,8, 59,3 и 37,9 % соответственно. Медиана выживаемости – 44 мес. Таким образом, можно утверждать, что общая выживаемость значимо выше в группе пациенток, получивших на первом этапе лечения эффективную лекарственную терапию с последующим удалением первичной опухоли (p=0,02 log-rank).
Нами проанализированы результаты лечения больных в зависимости от объема хирургического вмешательства. В основной группе пациентки были поделены на 2 подгруппы. В первую подгруппу (n=115) вошли больные, которым, помимо удаления первичной опухоли, выполнялась трехуровневая лимфодиссекция, во вторую подгруппу (n=9) включены больные, которым выполнена простая мастэктомия без лимфодиссекции. Медиана продолжительности жизни составила 39 и 17 мес соответственно. Однако значимых различий не выявлено (p=0,9 log-rank), что, возможно, связано с небольшой выборкой больных во второй подгруппе. Тем не менее мы считаем, что этот фактор имеет важное прогностическое значение и требует более тщательного изучения на большем числе клинических наблюдений.
Проведенный анализ показал, что статистически значимым фактором, влияющим на показатели общей выживаемости при генерализованном РМЖ, является иммуногистохимический подтип опухоли. Так, при анализе отдаленных результатов, в зависимости от рецепторного статуса опухоли, значения 1-, 3- и 5-летней выживаемости в группе оперированных пациенток с люминальным подтипом равнялись 97,7, 54,1 и 32,6 % соответственно и были значительно выше, чем в группе с РЭ/РП-, у которых аналогичные показатели составили 91,5, 30,2 и 23,3 % соответственно (p=0,02). Значимое увеличение общей продолжительности жизни также наблюдалось у неоперированных больных с РЭ/РП+ в отличие от пациенток с нелюминальным подтипом РМЖ. Медиана продолжительности жизни в подгруппах составила 36,5 и 27,6 мес соответственно (p<0,05).
При анализе отдаленных результатов в зависимости от Her-2/neu статуса опухоли в группе оперированных пациенток были получены следующие результаты: общая 1-, 3- и 5-летняя выживаемость при Her-2/neu-негативном статусе составила 98,3, 50,3 и 39,4 % соответственно, в то время как при опухолях с Her-2/neu-позитивным статусом аналогичные показатели зарегистрированы на уровне 92,2, 38,2 и 0 % (p<0,05). Однако анализ общей продолжительности жизни в зависимости от Her-2/ neu статуса в группе неоперированных пациенток не выявил значимых различий (p=0,4). Медиана продолжительности жизни составила 21,2 и 17 мес соответственно. Возможно, это связано с тем, что пациентки получали таргетную терапию трастузумабом, что существенно улучшило онкологические результаты, несмотря на прогностически неблагоприятный подтип опухоли.
На наш взгляд, отдаленные результаты удаления первичной опухоли при РМЖ IV стадии значительно отличаются в зависимости от локализации отдаленных метастазов. Поэтому мы сочли целесообразным изучить общую выживаемость отдельно в каждой подгруппе больных. Среди всех пациенток, включенных в исследование, общая 1-, 3- и 5-летняя выживаемость больных с метастазами в костях составила 98,3, 49,5 и 26,7 % соответственно, а медиана продолжительности жизни – 35 мес (рис. 1). Лучшие отдаленные результаты получены при солитарных или единичных метастазах по сравнению со множественными (5-летняя выживаемость – 41,1 и 24,6 % соответственно).
У больных обеих подгрупп с метастазами в легкие общая 1-, 3- и 5-летняя выживаемость была равна 97,5, 47,2 и 14,9 % соответственно, медиана жизни – 31 мес. В нашем исследовании при метастатическом поражении легких также отмечена тенденция к увеличению выживаемости больных, которым одним из этапов комплексного лечения выполнялось удаление первичного очага. В этом случае общая 1-, 3- и 5-летняя выживаемость составила 98,2, 51,1 и 17,9 % соответственно (рис. 2). Медиана жизни – 34 мес. У неоперированных больных с этой локализацией метастазов общая 1-, 3- и 5-летняя выживаемость – 92,3, 15,3 и 0 % соответственно, медиана жизни – 24 мес. Различия статистически значимы (p=0,01). Лучшие показатели выживаемости наблюдались у больных с солитарными или единичными метастазами в легких по сравнению со множественными (5-летняя выживаемость – 29,2 и 6,6 % соответственно).
Метастатическое поражение печени является одной из наиболее неблагоприятных форм прогрессирования рака молочной железы. В про-
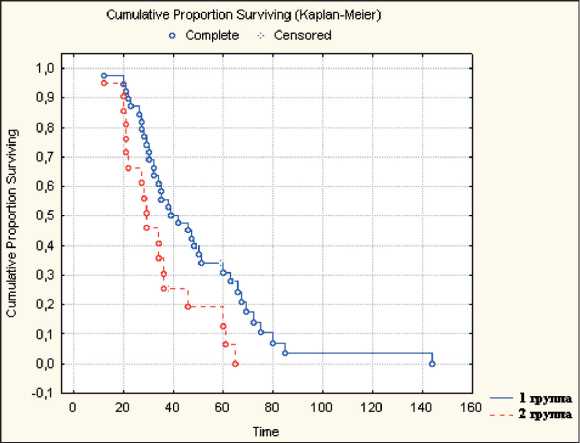
Рис. 1. Показатели общей выживаемости больных РМЖ IV стадии с метастазами в костях в зависимости от метода лечения (1 группа – паллиативная мастэктомия + системная терапия, 2 группа – консервативное лечение)
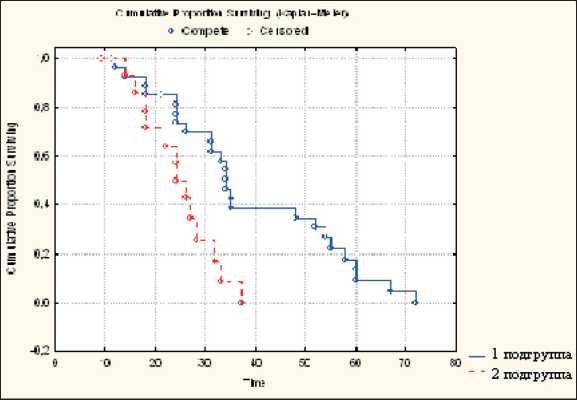
Рис. 2. Показатели общей выживаемости больных РМЖ IV стадии с метастазами в легкие в зависимости от метода лечения (1 группа – паллиативная мастэктомия + системная терапия, 2 группа – консервативное лечение)
веденном исследовании общая 1-, 3- и 5-летняя выживаемость у всех больных с метастазами в печень составила 89,4, 22,3 и 0 % соответственно, медиана продолжительности жизни не превысила 24 мес. Однако даже у такой сложной категории больных отмечена тенденция к увеличению показателей выживаемости при удалении первичного очага на одном из этапов комплексного лечения. При этом общая 1-, 3- и 5-летняя выживаемость составила 92, 31,8 и 0 % соответственно, медиана продолжительности жизни – 28 мес, тогда как у неоперированных больных эти показатели равнялись 84,6, 11,2 и 0 % (рис. 3). Медиана продолжительности жизни – 19 мес (p=0,01). Одним из факторов прогноза у больных РМЖ с метастазами в печень является число метастатических очагов. В нашем исследовании лучшие результаты получены при солитарных или единичных метастазах по сравнению со множественными (3-летняя выживаемость составила 37,1 и 0 % соответственно, 5 лет после лечения никто из больных обеих подгрупп не пережил).
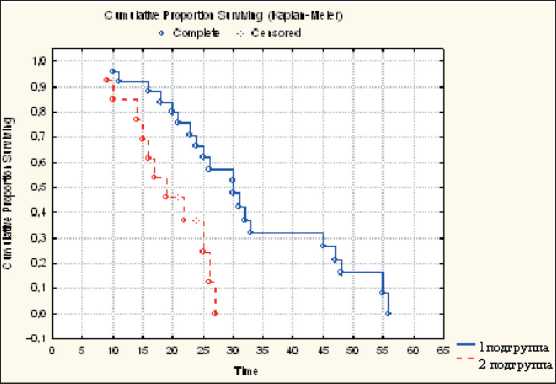
Рис. 3. Показатели общей выживаемости больных РМЖ IV стадии с метастазами в печени в зависимости от метода лечения (1 группа – паллиативная мастэктомия + системная терапия, 2 группа – консервативное лечение)
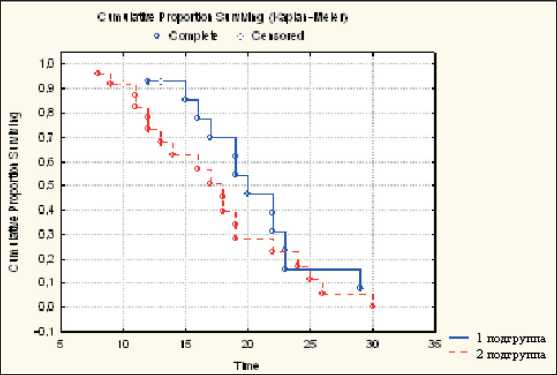
Рис. 4. Показатели общей выживаемости больных РМЖ IV стадии с сочетанными метастазами в зависимости от метода лечения (1 группа – паллиативная мастэктомия + системная терапия, 2 группа – консервативное лечение)
Группа с сочетанными метастазами включала больных с поражением нескольких органов на момент установления диагноза. Учитывая, что эти пациенты составили довольно многочисленную когорту, мы сочли необходимым включение их в исследование, несмотря на крайне неблагоприятный прогноз. Удалось оценить 1-, 2- и 3-летние результаты, так как 5 лет не пережила ни одна из пациенток, находившихся под наблюдением. Общая 1-, 2- и 3-летняя выживаемость составила 86,7, 19,5 и 0 % соответственно. Медиана продолжительности жизни – 18 мес. Не выявлено существенных различий в выживаемости после паллиативной мастэктомии по сравнению с системной терапией. Общая 1-, 2- и 3-летняя выживаемость у оперированных больных составила 88,4, 20,5 и 0 %, медиана продолжительности жизни – 19 мес. У неоперированных больных эти показатели были схожими – 84,2, 18,5 и 0 % соответственно (рис. 4). Медиана продолжительности жизни – 16 мес (p=0,2 log-rank).
Выводы
-
1. Паллиативная мастэктомия при генерализованном раке молочной железы у ряда пациенток оправдана и позволяет повысить показатели 3-летней выживаемости до 51,3 %, уровень 5-летней выживаемости равнялся 34,1 %.
-
2. Удаление первичной опухоли в плане комплексного лечения у больных генерализованным раком молочной железы позволяет улучшить результаты 5-летней выживаемости с солитарными или единичными метастазами в кости и в легкие по сравнению со множественным поражением этих органов – 41,1 vs 24,6 % и 29,2 vs 6,6 % соответственно. Множественные метастазы в пределах одного органа ухудшают прогноз, однако не являются абсолютным противопоказанием к паллиативной мастэктомии.
-
3. Показатели общей выживаемости при сочетанных метастазах, в зависимости от метода лечения не отличаются. Общая 1-, 2- и 3-летняя выживаемость у оперированных больных составила 88,4, 20,5 и 0 %, а у неоперированных больных – 84,2, 18,5 и 0 % соответственно (p=0,2).
-
4. Удаление первичного очага необходимо проводить после системной лекарственной терапии. У больных, которым на первом этапе выполняли паллиативную мастэктомию, общая 1-, 3- и 5-летняя выживаемость составила 83,4, 32,7 и 10,9 %, тогда как у пациенток, получавших предоперационное системное лечение, эти показатели были значимо выше – 98,8, 59,9 и 37,9 % соответственно (p=0,02).
-
5. Лучшие результаты общей 5-летней выживаемости у больных генерализованным РМЖ (52,7 %) получены при люминальном типе, Her-2/ neu-негативном подтипе, наихудший прогноз у опухолей с Her-2/neu-позитивным (29,6 %) подтипом (p=0,008).
Список литературы Хирургическое удаление первичной опухоли в составе комплексного лечения у больных раком молочной железы IV стадии
- Злокачественные новообразования в России в 2013 году/Под ред А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2015. 250 с.
- Пак Д.Д., Болотина Л.В., Сухотько А.С. Современные принципы комплексного лечения генерализованного рака молочной железы (обзор литературы и анализ собственного наблюдения)//Сибирский онкологический журнал. 2013. № 5. С. 54-58.
- Сухотько А.С., Зикиряходжаев А.Д., Болотина Л.В., Сидоров Д.Б., Тыщенко Е.В. Хирургический этап лечения в комплексной терапии больных генерализованным раком молочной железы//Онкология. Журнал им. П.А. Герцена. 2014. Т. 2, № 1. С. 24-29.
- Чиссов В.И., Солодкий В.А., Пак Д.Д., Рожкова Н.И., Ермощенкова М.В., Киреева М.Н. Скрининг рака молочной железы: история и перспективы//Онкология. Журнал им. П.А. Герцена. 2013. № 2. С. 46-51.
- Andreopoulou E., Hortobagyi G.N. Prognostic factors in metastatic breast cancer: successes and challenges toward individualized therapy//J. Clin. Oncol. 2008. Vol. 26 (22). P. 3660-3662. doi: 10.1200/JCO.2008.16.1026.
- Babiera G.V., Rao R., Feng L., Meric-Bernstam F., Kuerer H.M., Singletary S.E., Hunt K.K., Ross M.I., Gwyn K.M., Feig B.W., Ames F.C., Hortobagyi G.N. Effect of primary tumor extirpation in breast cancer patients who present with stage IV disease and an intact primary tumor//Ann. Surg. Oncol. 2006. Vol. 13 (6). P. 776-782.
- Bafford A.C., Burstein H.J., Barkley C.R., Smith B.L., Lipsitz S., Iglehart J.D., Winer E.P., Golshan M. Breast surgery in stage IV breast cancer: impact of staging and patient selection on overall survival//Breast Cancer Res. Treat. 115 (1). Vol. 2009. P. 7-12 DOI: 10.1007/s10549-008-0101-7
- Baum M., Demicheni R., Hrushesky W., Retsky M. Does surgery unfavourably perturb the «natural history» of early breast cancer by accelerating the appearance of distant metastases?//Eur. J. Cancer. 2005. Vol. 41 (4). P. 508-515.
- Bernard-Marty C., Cardoso F., Piccart M.J. Facts and controversies in systemic treatment of metastatic breast cancer//Oncologist. 2004. Vol. 9 (6). Р. 617-632.
- Blanchard D.K., Shetty P.B., Hilsenbeck S.G., Elledge R.M. Association of surgery with improved survival in stage IV breast cancer patients//Ann. Surg. 2008. Vol. 247 (5). P. 732-738. doi: 10.1097/SLA.0b013e3181656d32.
- Burzykowski T., Buyse M., Piccart-Gebhart M.J., Sledge G., Car-michael J., Lück H.J., Mackey J.R., Nabholtz J.M., Paridaens R., Biganzoli L., Jassem J., Bontenbal M., Bonneterre J., Chan S., Basaran G.A., Therasse P. Evaluation of tumor response, disease control, progression-free survival, and time to progression as potential surrogate end points in metastatic breast cancer//J. Clin. Oncol. Vol. 2008. 26 (12). P. 1987-1992 DOI: 10.1200/JCO.2007.10.8407
- Cady B., Nathan N.R., Michaelson J.S., Golshan M., Smith B.L. Matched pair analyses of stage IV breast cancer with or without resection of primary breast site//Ann. Surg. Oncol. 2008. Vol. 15 (12). P. 3384-3395 DOI: 10.1245/s10434-008-0085-x
- Coffey J.C., Wang J.H., Smith M.J., Bouchier-Hayes D., Cotter T.G., Redmond H.P. Excisional surgery for cancer cure. Therapy at a cost//Lancet Oncol. 2003. Vol. 4 (12). P. 760-768.
- Field R.C., Jeffe D.B., Trinkaus K., Zhang Q., Arthur C., Aft R., Dietz J.R., Eberlein T.J., Gillanders W.E., Margenthaler J.A. Surgical resection of the primary tumor is associated with increased long-term survival in patients with stage IV breast cancer after controlling for site metastasis//Ann. Surg. Oncol. 2007. Vol. 14 (12). P. 3345-3351.
- Gnerlich J., Jeffe D.B., Deshpande A.D., Beers C., Zander C., Margenthaler J.A. Surgical removal of the primary tumor increases overall survival in patients with metastatic breast cancer: analysis of the 1988-2003 SEER data//Ann. Surg. Oncol. 2007. Vol. 14 (8). P. 2187-2194.
- Hazard H.W., Gorla S.R., Scholtens D., Kiel K., Gradishar W.J., Khan S.A. Surgical resection of the primary tumor, chest wall control, and survival in women with metastatic breast Cancer//Cancer. 2008. Vol. 113 (8). P. 2011-2019.
- Khan S.A. Does resection of an intact breast primary improve survival in metastatic breast cancer?//Oncology. 2007. Vol. 21 (8). P. 924-931.
- Lang J.E., Babiera G.V. Locoregional resection in stage IV breast cancer tumor biology, molecular and clinical perspectives//Surg. Clin. North Am. 2007. Vol. 87 (2). P. 527-538.
- Leung A.M., Vu H.N., Nguyen K.A., Thacker L.R., Bear H.D. Effects of surgical excision on survival of patients with stage IV breast cancer//J. Surg. Res. 2010. Vol. 161 (1). P. 161-183. doi: 10.1016/j. jss.2008.12.030.
- Lopez-Tarruella S., Puente J., Lluch A., Climent M., Pastor M., Alba E. Impact on survival of primary tumor resection in woman with metastatic breast cancer at initial diagnosis. The Alamo Project//Cancer Res. 2009. Vol. 69 (24 Suppl.). P. 3104. 09-3104 DOI: 10.1158/0008-5472.SABCS-
- Ly B.H., Nguyen N.P., Vinh-Hung V., Rapiti E., Vlastos G. Locoregional treatment in metastatic breast cancer patients: is there a survival benefit?//Breast Cancer Res. Treat. 2010. Vol. 119 (3). P. 537-545.
- Olson J.A., Marcom P.K. Benefit or bias? The role of surgery to remove the primary tumor in patients with metastatic breast cancer//Ann. Surg. 2008. Vol. 247 (5). P. 739-740. doi: 10.1097/SLA.0b013e3181706140.
- Rao R., Feng L., Kuerer H.M., Singletary S.E., Bedrosian I., Hunt K.K., Ross M.I., Hortobagyi G.N., Feig B.W., Ames F.C., Babiera G.V. Timing of surgical intervention for the intact primary in stage IV breast cancer patients//Ann. Surg. Oncol. 2008. Vol. 15 (6). P. 1696-1702 DOI: 10.1245/s10434-008-9830-4
- Rapiti E., Verkooijen H.M., Vlastos G., Fioretta G., Neyroud-Caspar I., Sappino A.P., Chappuis P.O., Bouchardy C. Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis//J. Clin. Oncol. 2006. Vol. 24 (18). P. 2743-2749.
- Ruiterkamp J., Ernst M.F., van de Poll-Franse L.V., Bosscha K., Tjan-Heijnen V.C., Voogd A.C. Surgical resection of the primary tumor is associated with improved survival in patients with distant metastatic breast cancer at diagnosis//Eur. J. Surg. Oncol. 2009. Vol. 35 (11). P. 1146-1151 DOI: 10.1016/j.ejso.2009.03.012
- Shien T., Kinoshita T., Shimizu C., Hojo T., Taira N., Doihara H., Akashi-Tanaka S. Primary tumor resection improves the survival of younger patients with metastatic breast cancer//Oncol. 2009. Vol. 21 (3). P. 827-832.
- Sinha P., Clements V.K., Miller S., Ostrand-Rosenberg S. Tumor immunity: a balancing act between T cell activation, macrophage activation and tumor-induced immune suppression//Cancer Immunol. Immunother. 2005. Vol. 54 (11). P. 1137-1142.
- Soran A., Ozbas S., Kelsey S.F., Gulluoglu B.M. Randomized trial comparing locoregional resection of primary tumor with no surgery in stage IV breast cancer at the presentation (ProtocolMF07-01): a study of Turkish Federation of the National Societies for Breast Diseases//Breast J. 2009. Vol. 15 (4). P. 399-403.


