Хирургия повреждений сухожилий сгибателей пальцев кисти (обзор литературы)
Автор: Самодай В.Г., Магомедов руС.М., Магомедов роМ.М.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 1 (43), 2021 года.
Бесплатный доступ
Обзорная статья посвящена современному состоянию проблемы хирургического лечения повреждений сухожилий сгибателей пальцев кисти. Сухожилия сгибателей пальцев имеют ключевое значение для нормальной функции кисти. Их повреждение может приводить к нарушению сгибания пальцев и последующей потере общей функции кисти. Лечение подобных травм является сложной задачей для хирургов-травматологов, что обусловлено уникальностью анатомии сухожилий сгибателей на уровне кисти и особенностями процессов заживления. За последние несколько десятилетий были усовершенствованы как хирургические методы восстановления, так и протоколы послеоперационной реабилитации данной категории пациентов. Однако, несмотря на достижения в хирургии кисти, при восстановлении целостности данных сухожилий частота осложнений и неудовлетворительных функциональных результатов лечения остается достаточно высокой. Одной из острых проблем остается формирование в послеоперационном периоде сухожильных спаек, ограничивающих скольжение сухожилий и препятствующих полному функциональному восстановлению. Кроме того, единое мнение относительно оптимальной техники восстановления сухожилий сгибателей в каждой анатомической зоне отсутствует. Недостаточное количество исследований высокого качества и гетерогенный дизайн исследований ограничивает возможность сравнения их результатов, что порождает много спорных вопросов. Таким образом, результаты проведенного анализа литературы свидетельствуют о необходимости продолжения исследований в данной области.
Короткий адрес: https://sciup.org/142229997
IDR: 142229997 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2021.1.42-52
Текст обзорной статьи Хирургия повреждений сухожилий сгибателей пальцев кисти (обзор литературы)
Восстановление функции пальцев кисти после разрыва сухожилий сгибателей является одним из самых сложных вопросов в хирургии кисти. Травмы сухожилий представляют собой серьезную проблему для хирургов-травматологов по ряду причин. Во-первых, необходимым условием для заживления поврежденного сухожилия является соединение двух его отрезков, поэтому без хирургического вмешательства восстановление сухожилий невозможно. Во-вторых, уникальность анатомии сухожилий сгибателей пальцев кисти в виде прохождения через фиброзносиновиальные влагалища диктует необходимость предотвращения увеличения объема сухожилия при его реконструкции, что является трудно выполнимой задачей. В-третьих, достаточно сложным является и выбор оптимального режима послеоперационной реабилитации данной категории пациентов, поскольку, с одной стороны, раннее возобновление движений сухожилия является необходимой мерой профилактики спаечного процесса, от степени выраженности которого зависит функция пальца, с другой стороны – чрезмерная нагрузка на восстановленное сухожилие может привести к его разрыву. Об актуальности проблемы и наличии нерешенных вопросов свидетельствует повышенное внимание современных исследователей к данной теме: только за последние 5 лет в рецензируемом медицинском журнале «Journal of Hand Surgery» было опубликовано более 100 научных статей, посвященных повреждениям кисти. Подобные травмы являются достаточно распространенным явлением: 10 % всех обращений в отделение неотложной помощи и 20 % всех видов травм приходится на повреждения кисти. У пациентов с неглубокими ранами кисти частота сопутствующего повреждения сухожилий сгибателей пальцев составляет около 50 %, в то время как глубокие раны сопровождаются повреждением сухожилий в 90 % случаев [1].
Хирургическое лечение повреждений сухожилий сгибателей пальцев кисти
При принятии решения об оперативном восстановлении целостности сухожилий сгибателей пальцев кисти необходимо учитывать множество факторов. Хирургическая тактика и выбор оперативной техники зависят, прежде всего, от уровня повреждения сухожилия, характера и давности травмы, возраста пациента [2, 3].
Стандартной хирургической практикой при повреждении сухожилий сгибателей пальцев кисти является наложение первичного сухожильного шва (в течение первых 24 часов с момента травмы), поскольку он обладает такими преимуществами, как проведение хирургических манипуляций на неизмененных спаечным процессом тканях, что позволяет восстановить все поврежденные анатомические структуры, более благоприятное течение послеоперационного периода, высокая вероятность хороших функциональных результатов лечения и относительно короткий период нетрудоспособности [4]. Условиями для хирургического восстановления сухожилий сразу после обращения пациента являются наличие в лечебном учреждении хирурга, прошедшего специальную подготовку по хирургии кисти, и возможность проведения ранней послеоперационной реа- билитации в течение 4-6 недель под контролем специалиста. Операция на сухожилиях сгибателей пальцев не является экстренной, поэтому при отсутствии условий для ее проведения вмешательство следует отложить из-за высокой вероятности неудовлетворительных результатов лечения и необходимости повторной восстановительной операции на рубцово-измененных тканях [5]. Если с момента травмы прошло более 24 часов, но менее 10 суток, накладывают отсроченный первичный сухожильный шов. Существует мнение, что восстановление сухожилий сгибателей пальцев в течение 72 часов после травмы не оказывает существенного влияния на результаты хирургического лечения [6]. По истечении 10 дней с момента травмы проксимальный конец поврежденного сухожилия отекает, сокращается, формируется фиброз мышц, что делает невозможным наложение первичного сухожильного шва. Для хирургического восстановления сухожилий в эти сроки применяют вторичный сухожильный шов, что ассоциировано с высоким риском инфекционных осложнений, необходимостью иссечения мягких тканей и, соответственно, с худшими функциональными результатами лечения. В некоторых ситуациях хирургическое восстановление сухожилия проводят через 4 недели и более с момента травмы путем наложения отсроченного вторичного сухожильного шва [5].
Важное значение для проведения качественного хирургического восстановления целостности поврежденного сухожилия имеет тип разреза. Адекватная оценка повреждений всех анатомических структур, наложение сухожильного шва и сохранение васкуляризации возможны при оптимальном хирургическом доступе, выбор которого осуществляет хирург. Наиболее часто используемыми являются зигзагообразный разрез Bruner и разрез Bunnell. Каждый из этих вариантов обладает своими преимуществами: первый позволяет избежать нарушений в сосудистой сети и обеспечивает широкий доступ к сухожилиям и сосудисто-нервным пучкам, второй ассоциирован с меньшей болезненностью в послеоперационном периоде [7].
Хирургические техники восстановления сухожилий сгибателей пальцев кисти
Данные современной литературы свидетельствуют о значительных различиях оперативных техник восстановления сухожилий сгибателей на уровне кисти, применяемых хирургами во всем мире [8]. Однако основными компонентами большинства методик являются основной и эпитендинозный швы.
При наложении основного шва шовный материал пропускается через ткань сухожилия, а узел либо погружается между концами восстанавливаемого сухожилия, либо располагается на его поверхности. В настоящее время описано и изучено множество техник наложения сухожильного шва, в том числе Kessler, Tsuge, Tajima-Kessler, Bunnell, Indiana/Strickland, Gelberman, Lock Cruciate и их многочисленные модификации. Однако на сегодняшний день не существует общепринятого «золотого стандарта», используемого для восстановления сухожилий сгибателей пальцев кисти. Тем не менее, наиболее часто специалисты отдают предпочтение способам Kessler, Tsuge и их модификациями.
Шов Kessler и его модификации являются одними из самых ранних и широко используемых видов основных сухожильных швов. В оригинальном шве Kessler через восстанавливаемый участок сухожилия проходят две нити, а также по всему сухожилию проходит эпитендинозный шов, сглаживающий поверхность. Восстановление швом Kessler подразумевает наложение двойной восьмиобразной петли в обеих культях сухожилия с формированием узла, погружаемого в область разрыва, что позволяет сухожилию хорошо скользить. Поперечные стежки шва располагаются примерно на один диаметр сухожилия от линии разрыва. (Рис.1) [8]. Важно отметить, что сухожильный шов Kessler практически идентичен шву Розова, однако информация о последнем в иностранной литературе не встречается.
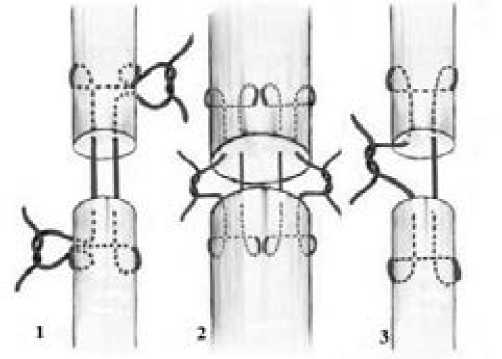
Рис. 1: Сухожильный шов Kessler и его модификации: 1) классический шов Kessler; 2) двойной шов Kessler; 3) шов Tajima-Kessler
Эти швы хорошо выполняли свою функцию восстановления целостности сухожилия до внедрения в клиническую практику режима ранней активной мобилизации, который был предложен позже для профилактики образования околосухожильных спаек и раннего восстановления функции пальцев. Считалось, что использование двухниточной пластики в хирургии кисти сопряжено с высоким риском разрывов восстановленного сухожилия в послеоперационном периоде [9]. С началом применения протокола ранней активной реабилитации перед исследователями была поставлена задача разработки новых модификаций основного сухожильного шва, которые имели бы более высокую прочность и были способны выдержать повышенную нагрузку, создаваемую во время активной мобилизации. Прочностные характеристики шва улучшали за счет увеличения количества нитей, проходящих через восстанавливаемый участок сухожилия, до четырех, шести, восьми и более [10]. Ö.B. Güntürk и соавторы (2018) в своем исследовании проанализировали результаты применения четырехниточного модифицированного основного шва Kessler с полидиоксаноновой нитью и эпитендинозного блокирующего нейлонового шва для восстановления сухожилий сгибателей пальцев на уровне кисти. Согласно авторам, использование данной хирургической техники ассоциировано с низкой частотой повторных разрывов восстановленного сухожилия (2,3 %) и хорошими функциональными результатами лечения (91,4 %) [11].
В последние годы стали появляться результаты исследований, свидетельствующих о том, что большее количество прядей шовного материала не обладает преимуществами в отношении снижения риска разрыва восстановленного сухожилия. Так, в 2019 году A.V. Georgescu и соавторы опубликовали результаты своего исследования, посвященного модифицированной технике Brunelli. Данный способ восстановления сухожилий характеризуется наличием двух прядей шовного материала, проходящих через восстанавливаемый участок сухожилия, перемещением точки максимального напряжения к месту прикрепления сухожилия, минимизацией риска образования зазора за счёт более тесного контакта культей сухожилия. Авторы сообщают о том, что данная оперативная техника была использована у 58 пациентов, и в 100 % случаев имел место хороший и отличный результат [12]. Однако результаты опроса практикующих травматологов показал, что 75,9 % из них по-прежнему отдают предпочтение сухожильным швам как минимум с четырьмя нитями [13].
Достаточно популярен среди практикующих хирургов-травматологов сухожильный шов Tsuge, одним из преимуществ которого является минимальное нарушение кровоснабжения за счет расположения в бессосудистой зоне сухожилия. Техника наложения сухожильного шва Tsuge подразумевает, что после выко-ла иглу проводят через петлю, которую затем затягивают, после следующего вкола иглу проводят через центр пересеченного конца сухожилия, а затем ее вкалывают в центр противоположного конца сухожилия и выводят на 1 см дистальнее. Одну из нитей пересекают, а нитью, оставшейся в игле, сухожилие прошивают еще раз. Концы поврежденного сухожилия сближают, концы нити завязывают [14]. В настоящее время разработаны многочисленные модификации существующих методов восстановления Tsuge (рис.2). J. Chen и соавторы (2014) разработали одну из модификаций и проанализировали ее клиническую эффективность в сравнении с четырех- и шестипрядным швом Savage, двухпетлевыми швами, модифицированным фиксирующим швом Kessler. Результаты исследования свидетельствуют о том, что разработанная авторами новая модификация шва Tsuge обладает более высокой прочностью на разрыв в сравнении с другими четырехниточными техниками наложения сухожильных швов и имеет хороший функциональный результат (90 %). Применение данного шва является альтернативой для восстановления сухожилий сгибателей в клинической практике [15].
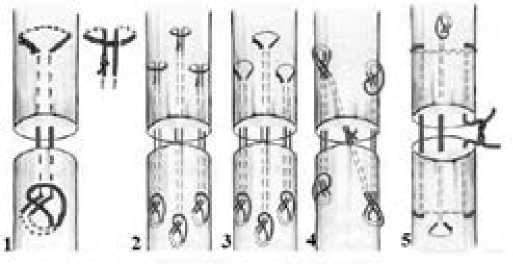
Рис. 2: Сухожильный шов Tsuge и его модификации: 1) оригинальный шов Tsuge; 2) шов Labana-Tang (тройной Tsuge); 3) шов Labana-Tang с петлей Tsuge; 4) модифицированный (двойной косой) шов Tsuge; 5) шов Kessler-Tsuge
Сухожильный шов Tsuge обладает хорошими прочностными характеристиками, однако его наложение является технически сложным [14]. Ch. Renner и соавторы (2015) предложили использование комбинированного шва Kessler-Tsuge для восстановления сухожилий сгибателей, который, по мнению авторов, технически более прост и по прочности не уступает шву Tsuge [16].
В настоящее время общепринятым является дополнение основного сухожильного шва эпитендинозным. Его функциями являются увеличение прочности восстановленного сухожилия на разрыв, уменьшение вероятности образования зазора между концами сухожилия в послеоперационном периоде, придание гладкости восстанавливаемому участку сухожилия [17]. Правильнее такой шов называть циркулярным адаптационным швом, поскольку в настоящее время его накладывают с глубокими прикусами, что ассоциировано лучшими клиническими результатами. Самыми надежными методами эпитендинозного шва являются непрерывный шов с фиксирующей петлей, непрерывный горизонтальный матрацный шов Halsted, восьмиобразный шов и узловой циркулярный шов Роттера (рис.3). Согласно данным B. Wieskötter и соавторов (2018), всеми необходимыми для достижения хорошего результата качествами обладает матрацный шов Halsted. Он биомеханически прочный и достаточно прост в исполнении [18].
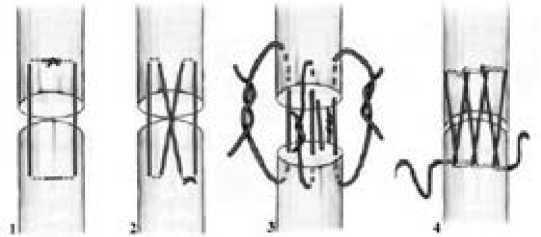
Рис. 3: Эпитендинозные швы: 1) матрацный; 2) восьмиобразный; 3) циркулярный узловой шов Роттера; 4) непрерывный шов с фиксирующей петлей
Признаками адекватного восстановления сухожилия сгибателя является достаточная прочность, номинальный зазор, комфортное скольжение и смещение сухожилия [19].
Таким образом, хирургическое восстановление целостности поврежденного сухожилия является не самой сложной задачей для врачей-травматологов. Основная проблема лечения данной категории пациентов заключается в том, что в послеоперационном периоде необходимо обеспечить движение восстановленного сухожилия с целью профилактики спаечного процесса и улучшения качества заживления. Следовательно, сухожильный шов должен быть негромоздким, но в то же время достаточно прочным, чтобы позволить проведение ранней мобилизации.
Зоны сухожилий сгибателей пальцев кисти
Существенное влияние на выбор оперативной техники и результаты хирургического лечения травм сухожилий сгибателей пальцев кисти оказывают особенности анатомии зон, в пределах которых локализуются повреждения. В настоящее время выделяют 5 зон сухожилий сгибателей пальцев кисти (Рис.4) [20].
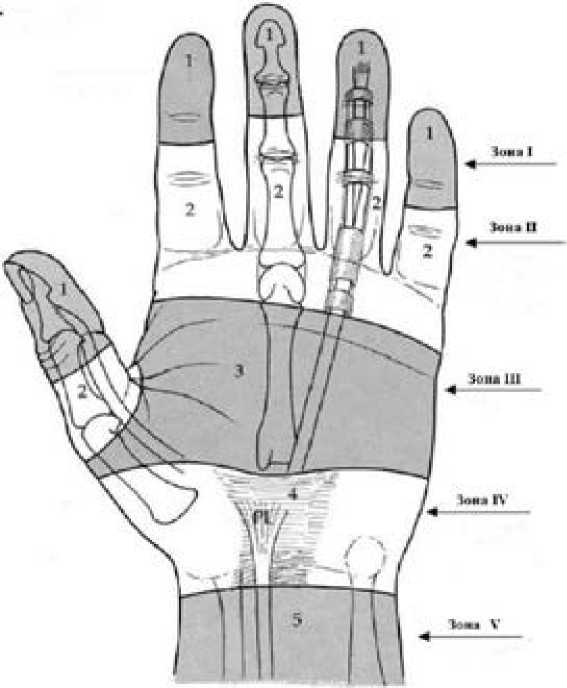
Рис. 4: Зоны сухожилий сгибателей пальцев кисти
Зона I расположена дистальнее уровня дистального межфалангового сустава и включает в себя часть фиброзно-синовиального влагалища от места дистального прикрепления ножек сухожилия поверхностного сгибателя к средней фаланге пальца до места прикрепления сухожилия глубокого сгибателя к дистальной фаланге. В ее пределах в костно-фиброзном канале проходит лишь сухожилие глубокого сгибателя пальца, поэтому его повреждения всегда бывают изолированными. Если дистальный отрезок поврежденного сухожилия имеет достаточную длину (более 1 см), то реконструкция может быть выполнена с использованием стандартных оперативных техник, таких как модифицированная методика Kessler или методика Tsuge. Однако травмы кисти в данной области могут приводить к образованию дистальной культи сухожилия глубокого сгибателя длиной менее 1 см, что требует ее удаления и подшивания проксимального отрезка непосредственно к кости (реинсерция). В таких ситуациях традиционным методом хирургического восстановления поврежденного сухожилия является оперативная техника с использованием пуговки, к которой фиксируют концы нитей-держалок сухожилия на поверхности кожи [21]. В положении сгибания пальца в рану выводят центральный и периферический отрезки поврежденного сухожилия. Центральный отрезок сухожилия прошивают тонкой проволокой или капроновой нитью. Подтягивая нити-держалки, концы сухожилия сопоставляют и соединяют 2-3 узловыми швами. Концы нитей-держалок с помощью иглы проводят дистально через кожу на расстоянии
2-3 см от краев раны и на поверхности кожи фиксируют к специальным пуговкам. Таким образом достигают фиксации проксимального отрезка поврежденного сухожилия, предупреждая разрыв швов. Данная хирургическая техника была впервые описана Bunnell еще в 1940 году и в настоящее время не утратила своей актуальности [22].
Частота послеоперационных хирургических осложнений при использовании данной методики невысокая. Тем не менее, функциональные результаты такого способа реконструкции относительно неудовлетворительные: средний диапазон движений в дистальном межфаланговом суставе составляет 37,50, что значительно снижает функциональность пальца и удовлетворенность пациента [23]. Согласно данным N. Kang и соавторов (2008), из 23 пациентов, которым была осуществлена пластика сухожилия глубокого сгибателя пальцев в зоне I с использованием пуговки, у 10 человек имели место осложнения, напрямую связанные с используемым хирургическим методом фиксации основного шва на дистальной фаланге: деформации ногтей, сгибательные контрактуры пальца, инфицирование и длительная гиперчувствительность. Авторы рекомендуют избегать данной оперативной техники или использовать ее со строгим соблюдением всех правил и повышенным вниманием к деталям выполнения [24].
Несмотря на недостатки вышеописанной оперативной техники, она все еще широко используется в хирургии кисти. Однако в последние годы происходит активное развитие и усовершенствование альтернативных методов фиксации отрезков поврежденных сухожилий сгибателей пальцев. Одним из активно применяемых способов фиксации поврежденного сухожилия при его хирургическом восстановлении является использование К-образной проволоки вместо классической пуговки. Преимуществами данной методики являются динамическое поддержание натяжения и прилегания сухожилия к кости, что уменьшает вероятность его разрыва, предотвращает некроз кожи под давлением и повреждение ногтевого комплекса. Хирургический метод восстановления целостности поврежденного сухожилия с использованием фиксирующей проволоки имеет и существенные недостатки, среди которых высокий риск инфицирования и трудности соблюдения режима лечения пациентом [25]. Важно отметить, что некоторые исследователи высказывают мнение, согласно которому использование данного способа фиксации сухожилия сопряжено с высоким риском провисания швов [26]. Однако подобные предположения носят теоретический характер. Достоверные клинические данные об исходах и осложнениях при использовании К-образной проволоки в хирургии кисти в настоящее время отсутствуют.
Альтернативным методом реинсерции сухожилий при отрыве их от кости является использование шовных анкеров, с помощью которых осуществляют фиксацию сухожилий и лигатур. Согласно данным W.V. McCallister и соавторов (2006), статистически значимые различия в клинических исходах после восстановления сухожилия сгибателя с использованием анкеров и техники вытягивания пуговкой отсутствуют. Однако авторы отмечают более короткое время нетрудоспособности пациентов, у которых с целью фиксации сухожилий были применены шовные анкеры. Кроме того, использование анкеров, помещенных в дистальную фалангу, позволяет избежать возможных осложнений, связанных непосредственно с оперативной техникой вытягивания пуговкой [27].
В 2013 году S. Huq и соавторы (2013) провели крупное исследование, посвященное анализу результатов применения шовных анкеров для фиксации поврежденных сухожилий сгибателей. Согласно их данным, в 56 % случаев был отмечен хороший и отличный результат восстановления объема движений пальцев, в то время как неудовлетворительный результат имел место в 23 % случаев. При применении оперативной техники с использованием пуговки неудовлетворительные функциональные результаты составили 38 % [28]. В более позднем исследовании, проведенном E.M. Polfer и соавторами (2019), отмечено, что метод реинсерции с помощью шовных анкеров обеспечивает прочность фиксации сухожилия, достаточную для проведения ранней активной мобилизации в период реабилитации, и, соответственно, ассоциирован с лучшими функциональными результатами лечения [29]. Основным недостатком костных анкеров является их высокая стоимость, однако это компенсируется более низкой частотой послеоперационных осложнений, лучшими функциональными результатами и более коротким периодом восстановления. Кроме того, механические свойства шовных анкеров зависят как от шовного материала, так и от качества костной ткани, что может ограничивать применение данного способа фиксации у пациентов старше 75 лет [30]. Однако клинические данные о взаимосвязи прочности конструкции костных анкеров и остеопороза в настоящее время отсутствуют.
Зона II расположена между первой кольцевидной связкой (вход в костно-фиброзный канал на уровне дистальной ладонной борозды) и дистальным межфаланговым суставом. В данной зоне расположен перекрест сухожилий сгибателей пальцев кисти: сухожилие поверхностного сгибателя делится на две ножки и переходит в более глубокое по отношению к сухожилию глубокого сгибателя положение. Повреждения сухожилий сгибателей пальцев чаще всего происходят именно в этой зоне, получившей название «критической», и являются наиболее неблагоприятными в отношении реконструкции, послеоперационной реабилитации и достижения функционального результата [31]. Поскольку здесь сухожилия проходят в плотном костно-фиброзном канале, то достижение нормализации их скольжения становится еще более сложной задачей. Анатомические особенности данной зоны делают весьма острой проблему образования послеоперационной сухожильной адгезии между скользящими поверхностями, что объясняет частоту неудовлетворительных результатов хирургического лечения. При травмах, локализующихся в зоне II, могут быть повреждены сухожилия и глубокого, и поверхностного сгибателей. Ранее считалось, что поврежденное в зоне II сухожилие поверхностного сгибателя восстановлению не подлежит [32]. Однако в настоящее время среди хирургов-травматологов имеются разногласия относительно данного вопроса. Одни специалисты хирургическое восстановление поврежденного сухожилия поверхностного сгибателя пальца считают обязательным независимо от сложности клинической ситуации, другие – видят необходимость его сшивания только вне перекрестка Кемпера, а ряд хирургов не восстанавливают сухожилие поверхностного сгибателя в «критической» зоне вовсе [33]. В отношении повреждений сухожилия глубокого сгибателя специалисты придерживаются единого мнения: во всех ситуациях его целостность необходимо восстанавливать с помощью прочного основного шва, дополняемого адаптирующим швом. При восстановлении поврежденного сухожилия в «критической» зоне к хирургическому шву предъявляются особенно строгие требования: прочность, минимальная деформация конца сухожилия, внутриствольное расположение основной фиксирующей нити, идеальное сопоставление концов сухожилия, минимизация нарушения кровообращения в концах сухожилия [34]. Одним из дискуссионных вопросов остается необходимость хирургического восстановления целостности фиброзно-синовиального влагалища сухожилий сгибателей. С одной стороны, оно служит барьером для образования внешних спаек, обеспечивает более быстрое восстановление синовиального питания и способствует лучшей биомеханике. С другой стороны, хирургическое восстановление фиброзного канала может уменьшить его просвет, что ограничит скольжение сухожилий и приведет к неудовлетворительному функциональному исходу лечения [33].
Зона III начинается от дистального края поперечной связки запястья и заканчивается у первой кольцевидной связки. В пределах данной зоны сухожилия поверхностных сгибателей лежат на сухожилиях глубоких сгибателей. Сухожилия соседних пальцев разделены между собой сосудисто-нервными пучками и червеобразными мышцами, играющими важную роль в биомеханике сухожильного аппарата кисти [20]. Травмы в области зоны III относительно редки и, как правило, представляют собой открытые раны. Благодаря благоприятным анатомическим характеристикам зоны, результаты хирургического лечения чаще удовлетворительные при условии отсутствия сопутствующего повреждения сосудов и нервов. Общепризнанным считается мнение, что при повреждении поверхностного и глубокого сгибателей оба из них подлежат хирургическому восстановлению. Однако в некоторых ситуациях изолированные повреждения сухожилия поверхностного сгибателя не приводят к изменению функции пальца и, соответственно, не диагностируются. Наилучшие результаты дает прочное соединение концов сухожилия погружным основным швом, наложение дополнительного обвивного шва, повышающего качество восстановления скользящей поверхности сухожилия, и применение прецизионной техники [35].
Зона IV расположена на протяжении поперечной связки запястья, под которой сухожилия сгибателей пальцев кисти проходят в карпальном канале. В пределах зоны поверхностные сухожилия расположены над глубокими, имеют максимальную амплитуду перемещений и проходят вместе со срединным нервом, занимающим более поверхностное положение. Травма-тизация сухожилий сгибателей достаточно редко происходит в этой зоне, поскольку здесь они защищены плотной соединительной тканью поперечной связки запястья. Однако, если повреждения сухожилий локализуется в данной анатомической области, то, как правило, они носят множественный характер и сопровождаются повреждением сосудов и срединного нерва и имеют неблагоприятный прогноз. В связи с этим зону IV, также как и зону II, называют «критической» [36]. Оперативная тактика при повреждениях сухожилий сгибателей пальцев на уровне зоны IV является предметом дискуссий среди травматологов: одна группа хирургов придерживается мнения, что целостность всех поврежденных сухожилий должна быть восстановлена, другая – рекомендует сшивать только глубокие. Неоднозначным является и отношение к рассечению карпальной связки: не все врачи-хирурги видят необходимость в сохранении ее целостности при обеспечении доступа к поврежденным сухожилиям [37].
Зона V расположена проксимальнее карпальной связки. Несмотря на то, что анатомически она относится не к кисти, а к запястью, данная зона имеет тесную функциональную взаимосвязь с зоной IV за счет амплитуды перемещения сухожилий сгибателей на уровне запястья. Анатомическими особенностями зоны V является то, что здесь расположены двенадцать сухожилий, срединный и локтевой нервы, что доставляет хирургам значительные трудности при множественных повреждениях. Требования к используемому сухожильному шву менее строгие, чем в зоне II и зоне IV, нет необходимости в наложении циркулярного адаптирующего шва [37]. Повреждения сухожилий на этом уровне имеют благоприятный прогноз за счет хорошей васкуляризации и меньшей частоты послеоперационной сухожильной адгезии. Тем не менее, изолированные травмы сухожилий сгибателей пальцев кисти в зоне V встречаются редко, зачастую они сопровождаются повреждением артерий и нервов [38].
Осложнения хирургического лечения повреждений сухожилий на уровне кисти
Несмотря на усовершенствование оперативной техники восстановления сухожилий сгибателей пальцев кисти, внедрение в практику современных шовных материалов, разработку протоколов реабилитации, частота послеоперационных осложнений и неудовлетворительных результатов лечения остается достаточно высокой.
Наиболее тяжелое послеоперационное осложнение – это разрыв восстановленных сухожилий. Распространенность данного явления составляет около 10 % [39]. В большинстве случаев разрыв сухожилия происходит в течение первых двух недель послеоперационного периода, так как именно в это время область восстановления обладает наименьшей прочностью. Большую часть механической прочности сухожилия в этот период обеспечивает хирургический шов [40]. Таким образом, создание прочной конструкции является одним из факторов профилактики послеоперационного разрыва сухожилий сгибателей пальцев кисти.
Более высокой прочности на разрыв способствует использование сухожильного шва с большим количеством прядей шовного материала, проходящих через восстанавливаемый участок сухожилия. Результаты исследований A. Wichelhaus и соавторов (2016) свидетельствуют о том, что идеальная хирургическая техника восстановления сухожилий содержит как минимум четыре пряди [41]. Сухожильные швы с шестью, восьмью и десятью прядями обеспечивают достаточную прочность сухожилия. Однако такие существенные недостатки, как трудоемкость наложения, громоздкость, чрезмерные манипуляции с мягкими тканями при наложении, ограничивают их применение в клинической практике. Кроме того, существует мнение, что по мере увеличения количества прядей усиливается трение и давление в синовиальной оболочке, что приводит к отрицательному эффекту.
Известно, что прочность конструкции при восстановлении поврежденных сухожилий сгибателей пальцев зависит от шовного материала. Современные синтетические нити, к которым относят этибонд, капрон, пролен, нейлон, супрамид, обладают такими качествами, как прочность, гибкость, минимальная растяжимость, надежная фиксация узла [42]. Однако, у них имеются и существенные недостатки, поэтому поиски идеального шовного материала для реконструкции сухожилий кисти продолжаются и сегодня.
Одним из способов увеличения прочности восстановленного сухожилия и, соответственно, профилактики его разрыва в послеоперационном периоде служит обеспечение плотного прилегания проксимального и дистального отрезков. Известно, что диастаз отрезков более 3 мм является фактором риска несостоятельности сухожильного шва [43].
Наложение периферического эпитендинозного шва в дополнение к основному шву также способствует более высокой прочности восстановленного сухожилия. Результаты исследований свидетельствуют о том, что данный вид шва уменьшает вероятность образования ранних послеоперационных зазоров и увеличивает прочность восстановленного сухожилия на разрыв на 20-50 % [44].
Еще одним из способов профилактики разрыва восстановленного сухожилия сгибателя в послеоперационном периоде является адекватная нагрузка во время реабилитационных мероприятий. Чрезмерная нагрузка на сухожилие может негативно отразиться на процессе заживления и привести к его разрыву [45]. Иммобилизация пальцев кисти предотвращает повторное повреждение сухожилия, но в то же время способствует формированию перитендиновых спаек и, как следствие, нарушению функций пальца в будущем [46]. Таким образом, баланс между защитой восстановленного сухожилия от чрезмерных усилий и ранней его мобилизацией является одним из условий хороших результатов хирургического лечения повреждений сухожилий сгибателей пальцев кисти.
Самым частым осложнением хирургического лечения травм сухожилий кисти являются сухожильные спайки. Согласно данным литературы, частота формирования сухожильной адгезии, требующей проведения тенолиза или пересадки сухожилия, достигает 20 % [47]. Функциональный результат заживления поврежденных сухожилий сгибателей пальцев кисти зависит не только от степени восстановления целостности коллагеновых волокон, но и от нормализации скольжения сухожилия в фиброзно-синовиальном канале [48]. Известно, что процесс регенерации сухожилий происходит по двум механизмам: внутреннему и внешнему. Внутренний механизм заживления обеспечивают клетки эндотенона и эпитенона, во внешнем механизме прини- мают участие клетки тканей, окружающих поврежденное сухожилие [49]. Перитендиновые спайки, препятствующие свободному скольжению сухожилия внутри фиброзно-синовиального влагалища, являются результатом активации синтеза коллагена поврежденными клетками из окружающих тканей [50]. Таким образом, формирование сухожильных спаек является этапом процесса заживления, и исключить действие «внешних» воспалительных клеток и, соответственно, избежать спаечного процесса невозможно. Общепризнано, что с помощью атравматичной хирургической техники, предотвращения разрыва в месте восстановления путем прочного восстановления и использования протокола ранней мобилизации можно свести его к минимуму. Тем не менее, учитывая высокую частоту данного рода осложнений, подобных мероприятий недостаточно.
В настоящее время активно проводят исследования, посвященные применению адгезионных барьеров в целях профилактики спаечного процесса сухожилий. По мнению ученых, изменение физических свойств сухожилия при нанесении определенных веществ на его поверхность может способствовать более плавному скольжению и, как следствие, предотвращению или уменьшению образования спаек. Однако изученные на сегодняшний день фармакологические средства и механические барьеры не нашли широкого применения в клинической практике из-за недостаточного клинического эффекта или его непродолжительности, а также из-за отрицательного влияния на процесс регенерации тканей сухожилия [51]. Ch. Liu и соавторы (2019) в своем клиническом исследовании использовали лиофилизированную амниотическую мембрану для ускорения заживления сухожилия сгибателя в зоне II и предотвращения формирования спаек. Согласно данным авторов, в группе с использованием мембран в качестве адгезионного барьера частота осложнений была значительно ниже, чем в контрольной группе. На основании полученных результатов они сделали вывод, что данный метод является перспективным в отношении решения проблемы сращения сухожилий с окружающими тканями после хирургического восстановления [52].
Ch. Chen и соавторы (2019) в экспериментальном исследовании с целью предотвращения послеоперационной адгезии сухожилий применяли нановолоконную мембрану с содержанием гиалуроновой кислоты и ибупрофена. Согласно ожиданиям авторов, многофункциональные мембраны должны действовать как физический барьер для предотвращения проникновения фибробластов, гиалуроновая кислота уменьшит прикрепление фибробластов и выполнит роль смазки для скольжения сухожилий, ибупрофен окажет противовоспалительное действие. Исследования in vivo на модели разрыва сухожилия сгибателя кролика продемонстрировали эффективность подобного барьера в уменьшении местного воспаления и предотвращении сращения сухожилий с окружающими тканями [53].
Попытки поиска методов профилактики сухожильных спаек среди физических факторов не увенчались успехом. Например, результаты исследования C. Ermutlu и соавторов (2020), посвященного изучению влияния лучевой терапии на формирование внутрисиновиальных сухожильных спаек, показали, что рентгеновское облучение в дозе 3 Грей не только не уменьшает спа- ечный процесс, но и приводит к усилению околосухожильной посттравматической адгезии [54].
В исследованиях последних лет основное внимание уделено изучению путей внедрения или модуляции факторов роста, способных изменить молекулярную среду поврежденного сухожилия и улучшить его заживление. Предположение о возможности управления процессом регенерации с помощью этих факторов возникло благодаря более глубокому пониманию сложных биохимических процессов, происходящих в поврежденном сухожилии. Установлено, что тромбоцитарный фактор роста, фактор роста фибробластов, трансформирующий фактор роста бета и костные морфогенетические белки играют центральную роль в заживлении сухожилий сгибателей. Доставка факторов роста к поврежденному сухожилию путем переноса кодирующих их генов в геном клеток в области повреждения должен привести к тому, что эти клетки возьмут на себя функцию производства определенного фактора [55]. Однако, пока эти исследования носят лишь экспериментальный характер.
Таким образом, несмотря на повышенное внимание современных исследователей к проблеме послеоперационных осложнений реконструкции поврежденных сухожилий сгибателей пальцев кисти и внедрение в хирургическую практику все новых методов профилактики, их частота остается достаточно высокой и не имеет тенденции к снижению.
Реабилитация пациентов после хирургического лечения травм сухожилий сгибателей кисти
Послеоперационная реабилитация при травмах сухожилий сгибателей пальцев кисти оказывает существенное влияние на функциональный результат лечения. Согласно мнению ряда исследователей, адекватное ведение послеоперационного периода и качественная оперативная техника имеют одинаково важное значение для получения хороших результатов. Целью реабилитации после хирургического лечения данной категории пациентов является нормализация движений сухожилий, восстановление функции пальцев и предотвращение разрыва сухожилия. Результаты современных исследований свидетельствуют о том, что раннее возобновление движений восстановленного сухожилия активирует процессы заживления, уменьшает вероятность выраженного спаечного процесса и улучшает свойства сухожилия при растяжении [56].
Выделяют три основных вида движений оперированного пальца: ранние активные неконтролируемые движения, контролируемые движения за счет нагрузки на сухожилия мышц-антагонистов с помощью специальной шины и резиновых тяг (активное разгибание-пассивное сгибание), пассивные движения (изменение положения пальца с помощью другой руки или однократное в течение суток изменение положения пальца с полной амплитудой с использованием специальных шин) [57].
Чрезмерная нагрузка, также как и длительная иммобилизация, может негативно отразиться на процессе заживления сухожилия. Однако найти «золотую середину» между ранней дозированной нагрузкой и полным покоем сложно. При определении режима восстановительного послеоперационного лечения необходимо учитывать общие принципы заживления тканей су- хожилия. Первые 3-4 недели после операции восстановленное сухожилие обладает очень низкой прочностью на разрыв. Через 4-6 недель происходит ремоделирование волокон сухожилия и увеличение его прочности: в этот период возможны умеренные нагрузки на сухожилие согласно протоколу реабилитации. На 6-8 неделе возможно возобновление повседневной активности [8].
В литературе описан целый ряд реабилитационных режимов, применяемых после хирургического восстановления сухожилий сгибателей пальцев кисти. Все многообразие протоколов послеоперационной реабилитации можно разделить на три группы. В первую группу входят протоколы, согласно которым в течение 3-4 недель после операции показана полная иммобилизация восстановленного сухожилия. Вторую группу составляют протоколы раннего пассивного движения через 48 часов после операции (протокол Kleinert, протокол Duran-Houser). Третья группа протоколов подразумевает возобновление раннего активного движения (протокол Gratton, протокол Strickland) [58]. Выбор протокола реабилитации основан преимущественно на практическом опыте травматолога.
В настоящее время все больше специалистов отдают предпочтение протоколам раннего контролируемого активного сгибания пальцев [59]. Однако данные современных исследований свидетельствуют о том, что протоколы контролируемых пассивных движений также могут быть эффективными в отношении профилактики спаечного процесса и защиты восстановленного сухожилия от разрыва [60].
Анализ литературы, посвященной протоколам реабилитации при повреждении сухожилий сгибателей кисти во всех зонах, показал, что ранняя активная мобилизация ассоциирована с лучшими функциональными результатами и более высоким риском разрыва сухожилия в сравнении с ранней пассивной мобилизацией. При хронологическом анализе публикаций выявлена тенденция к снижению частоты послеоперационных разрывов сухожилий с течением времени при использовании обоих методов реабилитации [61]. Вероятно, это связано с усовершенствованием оперативной техники и используемого шовного материала. Тем не менее, единого мнения об интервале времени с момента операции до момента возобновления движений сухожилия, необходимых нагрузках и ходе перемещения сухожилия до сих пор нет.
Вывод
Таким образом, в хирургии сухожилий сгибателей пальцев кисти много спорных вопросов. Несмотря на то, что сегодня существует множество хирургических и реабилитационных методик, частота неудовлетворительных результатов лечения остается высокой, а взгляды исследователей на частные вопросы противоречивыми, что свидетельствует об актуальности темы и необходимости продолжения исследований в данной области.
Финансирование: исследование не имело спонсорской поддержки
Funding: the study had no sponsorship
Список литературы Хирургия повреждений сухожилий сгибателей пальцев кисти (обзор литературы)
- De Jong J.P., Nguyen J.T., Sonnema A.J., Nguyen E.C., Amadio P.C., Moran S.L. The Incidence of Acute Traumatic Tendon Injuries in the Hand and Wrist: A 10-Year Population-based Study. Clin. Orthop. Surg. 2014. Vol. 6. № 2. pp. 196-202. DOI: 10.4055/cios.2014.6.2.196
- Ackerman J.E., Bah I., Jonason J.H., Buckley M.R., Loiselle A.E. Aging does not alter tendon mechanical properties during homeostasis, but does impair flexor tendon healing. J. Orthop. Res. 2017. Vol. 35. № 12. pp. 2716-2724. DOI: 10.1002/jor.23580
- Результаты и перспективы лечения повреждений сухожилий сгибателей трехфаланговых пальцев кисти / А.М. Гурьянов, А.А. Сафронов, В.В. Захаров, Н.М. Рудель // Кафедра травматологии и ортопедии. 2016. № 1(17). С. 16-20. [Gurianov A.M., Safronov A.A., Zakharov V.V., Rudel N.M. The results and perspectives of the tendons trauma treatment in triphalangeal fingers flexor. The Department of Traumatology and Orthopedics, 2016, № 1(17), pp. 16-20. (In Russian)]
- Tang J.B. Tendon injuries across the world: treatment. Injury. 2006. Vol. 37. № 11. pp. 1036-42. DOI: 10.1016/j.injury.2006.07.027
- Cannon D.L. Campbell’s Operative Orthopaedics [Flexor and Extensor tendon injuries]. Philadelphia, Elsevier, 2017. 4251 p.
- Elliot D. Secondary surgery of the flexor tendons. Indian Journal of Plastic Surgery. 2005. № 38. pp. 9-15. DOI: 10.4103/0970-0358.16488
- Sari E. Tendon Injuries of the Hand in Kirikkale, Turkey. World J. Plast. Surg. 2016. Vol. 5. № 2. pp. 160-167
- Наконечный Д.Г., Киселева А.Н. Эволюция хирургического шва при восстановлении поврежденных сухожилий сгибателей пальцев кисти // Вестник хирургии им. И.И. Грекова. 2018. Т. 177. № 6. С. 91-95. [Nakonechnyi D.G., Kiseleva A.N. Evolution of surgical suture in case of repairing the damaged flexor tendons of the fingers. Bulletin of surgery I.I. Grekov, 2018, Vol.177, № 6, pp. 91-95. (In Russian)]
- Osada D., Fujita S., Tamai K., Yamaguchi T., Iwamoto A., Saotome K. Flexor tendon repair in zone II with 6-strand techniques and early active mobilization. J. Hand Surg. Am. 2006. Vol. 31. № 6. pp. 987-92. DOI: 10.1016/j.jhsa.2006.03.012 Winters S.C., Gelberman R.H., Woo S.L., Chan S.S., Grewal R., Seiler J.G. The effects of multiple-strand suture methods on the strength and excursion of repaired intrasynovial flexor tendons: a biomechanical study in dogs. J. Hand Surg. Am. 1998. Vol. 23. № 1. pp. 97-104. DOI: 10.1016/s0363-5023(98)80096-8
- Güntürk Ö. B., Kayalar M., Kaplan I., Uludağ A., Özaksar K., Keleşoğlub B. Results of 4-strand modified Kessler core suture and epitendinous interlocking suture followed by modified Kleinert protocol for flexor tendon repairs in Zone 2. Acta Orthop. Traumatol. Turc. 2018. Vol. 52. № 5. pp. 382-386. DOI: 10.1016/j.aott.2018.06.003
- Valentin Georgescu A.V., Matei I.R., Olariu O. Zone II Flexor Tendon Repair by Modified Brunelli Pullout Technique and Very Early Active Mobilization. J. Hand Surg. Am. 2019. Vol. 44. № 9. рр. 804.e1-804.e6. DOI: 10.1016/j.jhsa.2019.03.014
- Bigorre N., Delaquaize F., Degez F., Celerier S. Primary flexor tendons repair in zone 2: Current trends with GEMMSOR survey results. Hand Surg. Rehabil. 2018. Vol. 37. № 5. pp. 281-288. DOI: 10.1016/j.hansur.2018.05.005
- Dündar N, Güneri B., Uzel M., Doğaner A. Biomechanical comparison of Bunnell, modified Kessler, and Tsuge tendon repair techniques using two suture types. Acta Orthop. Traumatol. Turc. 2020. Vol. 54. № 1. pp. 104-113. DOI: 10.5152/j.aott.2020.01.411
- Chen J., Wang K., Katirai F., Chen Z. A new modified Tsuge suture for flexor tendon repairs: the biomechanical analysis and clinical application. J. Orthop. Surg. Res. 2014. № 9. p.136. DOI: 10.1186/s13018-014-0136-x
- Renner C., Corella F., Fischer N. Biomechanical evaluation of 4-strand flexor tendon repair techniques, including a combined Kessler-Tsuge approach. J. Hand Surg. Am. 2015. Vol. 40. № 2. pp. 229-35. DOI: 10.1016/j.jhsa.2014.10.055
- Микрохирургический шов сухожилия сгибателей пальцев кисти и периферических нервов при острой травме / Н.А. Баранов, И.А. Салов, В.В. Масляков, Г.А. Коршунова // Анналы пластической, реконструктивной и эстетической хирургии. 2018. № 4. С. 55. [Baranov O.N., Salov I.A., Maslyakov V.V., Korshunova G.A. Microsurgical suture of the flexor tendon of the fingers of the hand and peripheral nerves in acute trauma. Annals of Plastic, Reconstructive and Aesthetic Surgery, 2018, № 4, pp. 55. (In Russian)]
- Wieskötter B., Herbort M., Langer M., Raschke M.J., Wähnert D. The impact of different peripheral suture techniques on the biomechanical stability in flexor tendon repair. Arch Orthop. Trauma Surg. 2018. Vol. 138. № 1. pp. 139-145. DOI: 10.1007/s00402-017-2836-2
- Kamal R.N., Yao J. Evidence-Based Medicine: Surgical Management of Flexor Tendon Lacerations. Plast. Reconstr. Surg. 2017. Vol. 140. № 1. pp. 130e-139e. DOI: 10.1097/PRS.0000000000003476
- Золотов А.С., Зеленин В.Н., Соровиков В.А. Хирургическое лечение повреждений сухожилий сгибателей пальцев кисти. Иркутск: РИО НЦ РВХ ВСНЦ СО РАМН, 2006. 110 с. [Zolotov A.S., Zelenin V.N., Sorovikov V.A. Surgical treatment of injuries of the flexor tendons of the fingers of the hand. Irkutsk, Scientific Center for Reconstructive and Reconstructive Surgery, Siberian Branch of the Russian Academy of Medical Sciences, 2006, 110 p. (In Russian)]
- Huq S., George S., Boyce D.E. Zone 1 flexor tendon injuries: a review of the current treatment options for acute injuries. J. Plast. Reconstr. Aesthet. Surg. 2013. Vol. 66. № 8. pp. 1023-31. DOI: 10.1016/j.bjps.2013.04.026
- Zeplin P. H. Bunnell technique and bidirectional barbed suture for flexor tendon repair. J. Hand Surg. Am. 2015. Vol. 40. № 4. p. 859. DOI: 10.1016/j.jhsa.2015.02.021
- Bidwai A.S.C., Feldberg L. The button-over-nail technique for Zone I flexor tendon injuries. Hand Surg. 2012. Vol. 17. № 3. pp. 365-9. DOI: 10.1142/S0218810412500323
- Kang N., Marsh D., Dewar D. The morbidity of the button-overnail technique for zone 1 flexor tendon repairs. Should we still be using this technique? J. Hand Surg. Eur. Vol. 2008. Vol. 33. № 5. pp. 566-70. DOI: 10.1177/1753193408090118
- De Spirito D., Giunchi D. The Pull-out K-wire Anchorage: The “Shepherd’s Crook” Technique. Tech. Hand Up. Extrem. Surg. 2017. Vol. 21. № 3. pp. 85-90. DOI: 10.1097/BTH.0000000000000160
- Karslioglu B., Tekin A.C., Tasatan E. The Weakest Point of “The Shepherd’s Crook” Technique: Suture Tension. Tech. Hand Up. Extrem. Surg. 2018. Vol. 22. № 1. p. 35. DOI: 10.1097/BTH.0000000000000180
- McCallister W.V., Ambrose H.C., Katolik L.I., Trumble T.E. Comparison of pullout button versus suture anchor for zone I flexor tendon repair. J. Hand Surg. Am. 2006. Vol. 31. № 2. pp. 246-51. DOI: 10.1016/j.jhsa.2005.10.020
- Huq S., George S., Boyce D.E. The outcomes of zone 1 flexor tendon injuries treated using micro bone suture anchors. J. Hand Surg. Eur. Vol. 2013. Vol. 38. № 9. pp. 973-8. DOI: 10.1177/1753193413475748
- Polfer E.M., Sabino J.M., Katz R.D. Zone I Flexor Digitorum Profundus Repair: A Surgical Technique. J. Hand Surg. Am. 2019. Vol. 44. № 2. pp. 164.e1-164.e5. DOI: 10.1016/j.jhsa.2018.08.015
- Matsuzaki H., Zaegel M.A., Gelberman R.H., Silva M.J. Effect of Suture Material and Bone Quality on the Mechanical Properties of Zone I Flexor Tendon–Bone Reattachment With Bone Anchors. J. Hand Surg. Am. 2008. Vol. 33. № 5. pp. 709-717. DOI: 10.1016/j.jhsa.2008.01.025
- Особенности восстановления сухожилий сгибателей пальцев кисти в зоне фиброзно-синовиальных каналов у детей / А.В. Александров, В.В. Рыбченок, Н.В. Львов, А.М. Палинкаш // Анналы пластической, реконструктивной и эстетической хирургии. 2018. №1. С.56. [Alexandrov A.V., Rybchenok V.V., Lvov N.V., Palinkash A.M. Features of the restoration of the flexor tendons of the fingers of the hand in the zone of fibro-synovial canals in children. Annals of Plastic, Reconstructive and Aesthetic Surgery, 2018, № 1, p. 56. (In Russian)]
- Grobbelaar A.O., Hudson D.A. Flexor tendon injuries in children. J. Hand Surg. Br. 1994. Vol. 19. № 6. pp. 696-8. DOI: 10.1016/0266-7681(94)90237-2
- Griffin M., Hindocha S., Jordan D., Saleh M., Khan W. An Overview of the Management of Flexor Tendon Injuries. Open Orthop. J. 2012. № 6. pp. 28-35. DOI: 10.2174/1874325001206010028
- Gibson P.D., Sobol G.L., Ahmed I.H. Zone II Flexor Tendon Repairs in the United States: Trends in Current Management. J. Hand Surg. Am. 2017. Vol. 42. № 2. pp. e99-e108. DOI: 10.1016/j.jhsa.2016.11.022
- S Usami S., Yamamoto M., Okazaki M. Intraoperative ultrasound-assisted repair of zone III flexor tendon rupture with a minimal incision. J. Hand Surg. Eu.r Vol. 2016. Vol. 41. № 9. pp. 1003-1004. DOI: 10.1177/1753193415603017
- Whitehouse H., Chan J.C.Y., James M.. Spontaneous closed zone IV rupture of flexor digitorum profundus tendon to the fifth finger. Case Reports Plast. Surg. Hand Surg. 2018. Vol. 5. № 1. pp. 59-61. DOI: 10.1080/23320885.2018.1522960
- Klifto C.S., Capo J.T., Sapienza A., Yang S.S., Paksima N. Flexor Tendon Injuries. J. Am. Acad. Orthop. Surg. 2018. Vol. 26. № 2. pp. e26-e35. DOI: 10.5435/JAAOS-D-16-00316
- Bal S., Oz B., Gurgan A., Memis A., Demirdover C., Sahin B., Oztan Y. Anatomic and functional improvements achieved by rehabilitation in Zone II and Zone V flexor tendon injuries. Am. J. Phys. Med. Rehabil. 2011. Vol. 90. № 1. pp. 17-24. DOI: 10.1097/PHM.0b013e3181fc7a46
- Wong J.K.F., Peck F. Improving results of flexor tendon repair and rehabilitation. Plast. Reconstr. Surg. 2014. Vol. 134. № 6. pp. 913e-25e. DOI: 10.1097/PRS.0000000000000749
- Manning C.N., Havlioglu N., Knutsen E., Sakiyama-Elbert S.E., Silva M.J., Thomopoulos S., Gelbermana R.H. The early inflammatory response after flexor tendon healing: A gene expression and histological analysis. J. Orthop. Res. 2014. Vol. 32. № 5. pp. 645-652. DOI: 10.1002/jor.22575
- Wichelhaus A., Beyersdoerfer S.T., Vollmar B., Mittlmeier T., Gierer P. Four-Strand Core Suture Improves Flexor Tendon Repair Compared to Two-Strand Technique in a Rabbit Model. Biomed. Res. Int. 2016. № 2016. p. 4063137. DOI: 10.1155/2016/4063137
- Gulihar A., Whitehead-Clarke T., Hajipour L., Dias J.J. A Comparison of Two Monofilament Suture Materials for Repair of Partial Flexor Tendon Lacerations: A Controlled In-vitro Study. J. Hand Surg. Asian Pac. Vol. 2017. Vol. 22. № 1. pp. 18-22. DOI: 10.1142/S0218810417500034
- Thomopoulos S., Parks W.C., Rifkin D.B., Derwin K.A. Mechanisms of tendon injury and repair. J. Orthop. Res. 2015. Vol. 33. № 6. pp. 832-9. DOI: 10.1002/jor.22806
- Moriya T., Zhao C., An K., Amadio P.C. The effect of epitendinous suture technique on gliding resistance during cyclic motion after flexor tendon repair: a cadaveric study. J. Hand Surg. Am. 2010. Vol. 35. № 4. pp. 552-8. DOI:10.1016/j.jhsa.2009.12.025
- Овсянникова А.Д. Реабилитация и тактика ведения пациентов после хирургического восстановления сухожилий сгибателей пальцев кисти // Вопросы реконструктивной и пластической хирургии. 2018. Т.
- № 2(65). С.62-73. [Ovsyannikova A.D. Rehabilitation and management of patients after surgical restoration of the flexor tendons of the fingers of the hand. Questions of reconstructive and plastic surgery, 2018, Vol. 21, № 2 (65), pp. 62-73. (In Russian)]
- Titan A.L., Foster D.S., Chang J., Longaker M.T. Flexor Tendon: Development, Healing, Adhesion Formation, and Contributing Growth Factors. Plast. Reconstr. Surg. 2019. Vol. 144. № 4. pp. 639e-647e. DOI: 10.1097/PRS.0000000000006048
- Uçkun A.Ç., Yurdakul F.G., Ergani H.M., Güler T. Factors predicting reoperation after hand flexor tendon repair. Ulus Travma Acil Cerrahi Derg. 2020. Vol. 26. № 1. pp. 115-122. DOI: 10.14744/tjtes.2019.92590
- Результаты лечения пациентов с повреждениями сухожилия сгибателей пальцев кисти / А.Н. Киселева [и др.] // Современные достижения травматологии и ортопедии. 2018. С. 118-120. [Kiseleva A.N., Finally D.G., Weber E.V., Lomaya M.P., Markina E.V., Sudyakova M.Y., Kalashnikova M.R. Treatment results for patients with finger flexor tendon injuries. Modern achievements of traumatology and orthopedics, 2018, pp. 118-120. (In Russian)]
- Matthews P., Richards H. The repair potential of digital flexor tendons. An experimental study. J. Bone. Joint Surg. Br. 1974. Vol. 56-B. № 4. pp. 618-25.
- Wong J.K.F., Lui Y.H., Kapacee Z., Kadler K.E., Ferguson M.W.J., McGrouther D.A. The cellular biology of flexor tendon adhesion formation: an old problem in a new paradigm. Am. J. Pathol. 2009. Vol. 175. № 5. pp. 1938-51. DOI: 10.2353/ajpath.2009.090380
- Zhao C., Hashimoto T., Kirk R.L., Thoreson A.R., Jay G.D., Moran S.L., An K., Amadio P.C. Resurfacing with chemically modified hyaluronic acid and lubricin for flexor tendon reconstruction. J. Orthop. Res. 2013. Vol. 31. № 6. pp. 969-75. DOI: 10.1002/jor.22305
- Liu C., Bai J., Yu K., Liu G., Tian S., Tian D. Biological Amnion Prevents Flexor Tendon Adhesion in Zone II: A Controlled, Multicentre Clinical Trial. Biomed. Res. Int. 2019. № 2019. p. 2354325. DOI: 10.1155/2019/2354325
- Chen C., Chen C., Sheu C., Chen J. Ibuprofen-Loaded Hyaluronic Acid Nanofibrous Membranes for Prevention of Postoperative Tendon Adhesion through Reduction of Inflammation. Int. J. Mol. Sci. 2019. Vol. 20. № 20. p. 5038.DOI: 10.3390/ijms20205038
- Ermutlu C, Kaleli T., Yalcinkaya U., Cetintas S., Atici T. Efficacy of Single-Dose Radiotherapy in Preventing Posttraumatic Tendon Adhesion. Cureus. 2020. Vol. 12. № 6. p. e8410. DOI: 10.7759/cureus.8410
- Titan A.L., Foster D.S., Chang J., Longaker M.T. Flexor Tendon: Development, Healing, Adhesion Formation, and Contributing Growth Factors. Plast. Reconstr. Surg. 2019. Vol. 144. № 4. pp. 639e-647e. DOI: 10.1097/PRS.0000000000006048
- Moriya K., Yoshizu T., Maki Y., Tsubokawa N., Narisawa H., Endo N. Clinical outcomes of early active mobilization following flexor tendon repair using the six-strand technique: short- and long-term evaluations. J. Hand Surg. Eur. Vol. 2015. Vol. 40. № 3. pp.250-8. DOI: 10.1177/1753193414551682
- Neiduski R.L., Powell R.K. Flexor tendon rehabilitation in the 21st century: A systematic review. J. Hand Ther. 2019. Vol. 32. № 2. pp. 165-174. DOI: 10.1016/j.jht.2018.06.001
- Elliot D., Giesen T. Avoidance of unfavourable results following primary flexor tendon surgery. Indian J. Plast. Surg. 2013. Vol. 46. № 2. pp. 312-324. DOI: 10.4103/0970-0358.118610
- Moriya K., Yoshizu T., Maki Y. Early active mobilization after primary repair of the flexor pollicis longus tendon. J. Orthop. Sci. 2020. S0949-2658(20). pp. 30251-7. DOI: 10.1016/j.jos.2020.08.003 59. Chung B., Chiu D.T.W., Thanik V. Relative Motion Flexion Splinting for Flexor Tendon Lacerations: Proof of Concept. Hand (N. Y.). 2019. Vol. 14. № 2. pp. 193-196. DOI: 10.1177/1558944717732063
- Starr H.M., Snoddy M., Hammond K.E., Seiler J.G. Flexor tendon repair rehabilitation protocols: a systematic review. J. Hand Surg. Am. 2013. Vol. 38. № 9. pp. 1712-7.e1-14. DOI: 10.1016/j.jhsa.2013.06.025


