Хлорид и аренсульфонаты тетраорганилфосфония
Автор: Шарутин В.В., Шарутина О.К., Механошина Е.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств дихлорида трифенилфосфора с пентафенилфосфором в бензоле синтезирован хлорид тетрафенилфосфония (1), который реагирует с аренсульфоновыми кислотами с образованием аренсульфонатов тетрафенилфосфония [Ph4P][OSO2C6H3(OH-4)(COOH-3]∙H2O (2), [Ph4P][OSO2C10H5(OH-1)(NO2)2-2,4] (3) с выходом до 93 %. Подобная реакция хлорида циклогексилтрифенилфосфония с 2-сульфобензойной кислотой сопровождалась синтезом 2-карбоксибензолсульфоната циклогексилтрифенилфосфония (4) с выходом 92 %. Особенности строения комплексов 2-4 установлены методом РСА. Показано, что в катионах 2-4 атомы фосфора имеют искаженную тетраэдрическую координацию, а для аренсульфонатных анионов наблюдается обычная геометрия с тетраэдрическим атомом серы.
Синтез, хлорид тетрафенилфосфония, аренсульфонат органилтрифенилфосфония, рентгеноструктурные исследования
Короткий адрес: https://sciup.org/147244624
IDR: 147244624 | УДК: 546.185+547.53.024+548.312.5 | DOI: 10.14529/chem240212
Текст научной статьи Хлорид и аренсульфонаты тетраорганилфосфония
Вопросы получения солей тетраорганилфосфония активно исследуются прежде всего из-за широких возможностей их практического применения. Так, они используются в качестве пластификаторов, инсектицидов, фунгицидов, дефолиантов, гербицидов [1], важнейших промежуточных продуктов в синтетической химии [2], органокатализаторов в асимметрическом межфазном катализе [3], реагентов для транс -металлирования [4] и метатезиса σ -связей [5]. Следует отметить огромное значение солей тетраорганилфосфония в создании новых материалов, каталитических систем, ионных жидкостей, проявляющих уникальные свойства [6‒8]. Наиболее распространенным способом синтеза фосфониевых солей является кватернизация соответствующего фосфина в результате реакции с электрофилом или кислотой Бренстеда [9‒12]. В дальнейшем полученные галогениды тетраорганилфосфония могут служить источником катионов при синтезе различных соединений.
Экспериментальная часть
Элементный анализ на С, Н проведен на анализаторе Carlo-Erba 1106.
ИК-спектры соединений записывали на ИК-Фурье спектрометре Shimadzu в таблетках KBr.
РСА проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (графитовый монохроматор) при 293 К. Сбор, редактирование данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проведены по программам [13 - 15]. Структуры 2 - 4 определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур 2 - 4 приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных [ССDC 2179561 ( 2 ), 2168618 ( 3 ), 2171917 ( 4 )].
Реакция сольвата пентафенилфосфора (Ph 5 P ∙ ½ PhH) с дихлоридом трифенилфосфора. Смесь 456 мг (0,1 ммоль) сольвата пентафенилфосфора с бензолом [16] и 333 мг (0,1 ммоль) дихлорида трифенилфосфора [17] в 10 мл бензола перемешивали при 20 °С 1 ч, удаляли растворитель. Остаток перекристаллизовывали из воды. Получили 690 мг (92 %) бесцветных кристаллов хлорида тетрафенилфосфония c t пл = 273 °С. Обработка водного раствора полученного хлорида тетрафенилфосфония насыщенным раствором иодида натрия приводила к образованию с количественным выходом светло-желтого осадка иодида тетрафенилфосфония, который после высушивания имел t пл = 333 °С (333 °С [18]).
Реакция хлорида тетрафенилфосфония с сульфосалициловой кислотой. К раствору 254 мг (0,1 ммоль) дигидрата сульфосалициловой кислоты в 10 мл воды прибавляли водный раствор 374 мг (0,1 ммоль) хлорида тетрафенилфосфония и перемешивали при 20 °С 1 ч. Остаток перекристаллизовывали из воды. Получили 523 мг (91 %) бесцветных кристаллов гидрата сульфосалицилата тетрафенилфосфония Ph 4 POSO 2 C 6 H 3 (OH-4)(COOH-3) ∙ H 2 O ( 2 ) c t пл = 221 °С. ИК-спектр ( ν , см–1): 3341 c, 3065 ср, 1995 с, 1663 оч. с., 1607 оч. с., 1587 оч. с, 1479 оч. с, 1441 оч. с, 1329 оч. с, 1287 с, 1248 с, 1223 оч. с, 1184 с, 1121 ср, 1107 с, 1076 с, 1030 оч. с, 997 с, 885 ср, 839 с, 804 с, 789 ср, 756 ср, 721 оч.с, 689 с, 665 с, 596 оч. с, 529 оч. с, 446 ср, 422 сл. Найдено, %: С 64,68; Н 7,34. C 31 H 27 O 7 PS. Вычислено, %: С 64,75; Н 7,26.
Аналогично получали неизвестные ранее аренсульфонаты тетраорганилфосфония, которые перекристаллизовывали из воды.
(1-Окси)(2,4-динитро)нафталин-7-сульфонат тетрафенилфосфония ( 3 ) ( t пл = 229 °С, 93 %). ИК-спектр ( ν , см–1): 3063 сл, 1614 ср, 1580 оч. с, 1514 с, 1437 оч. с, 1398 с, 1373 сл, 1339 ср, 1308 с, 1250 с, 1161 ср, 1130 ср, 1105 с, 1082 ср, 1030 оч. с, 993 с, 945 ср, 910 сл, 843 с, 814 ср, 760 с, 721 оч. с, 691 с, 640 с, 615 ср, 586 ср, 561 ср, 525 оч. с, 494 ср, 455 сл, 436 сл. Найдено, %: С 62,43; Н 3,95. C 34 H 25 N 2 O 8 PS. Вычислено, %: С 62,52; Н 3,83.
2-Карбоксибензолсульфонат циклогексилтрифенилфосфония (4) ( t пл = 192 °С, 92 %). ИК-спектр, ν , см-1: 3410 ср, 3057 сл, 2949 ср, 2893 ср, 1724 оч. с, 1589 ср, 1487 ср, 1439 оч. с, 1294 с, 1260 оч. с, 1175 оч. с, 1157 ср, 1138 ср, 1107 с, 924 сл, 883 ср, 854 ср, 822 сл, 800 ср, 768 с, 746 с, 721 оч. с, 692 оч. с, 644 сл, 619 оч. с, 570 с, 544 ср, 527 ср, 515 с, 494 сл, 470 сл, 419 ср. Найдено,%: C 68,22; H 5,73. C 31 H 31 O 5 PS. Вычислено, %: C 68,30; H 5,67.
Кристаллографические данные, параметры эксперимента и уточнения структур 2 - 4
|
Параметр |
Значение |
||
|
2 |
3 |
4 |
|
|
М |
574,56 |
652,59 |
546,59 |
|
Сингония |
Триклинная |
Триклинная |
Моноклинная |
|
Пр. группа |
P– 1 |
P– 1 |
P 2 1 / n |
|
a , Å |
10,840(6) |
9,97(3) |
12,321(10) |
|
b , Å |
11,006(7) |
11,39(3) |
15,444(11) |
|
c, Å |
13,659(10) |
13,31(4) |
14,829(11) |
|
а , град |
110,81(3) |
82,34(17) |
90,00 |
|
β, град |
103,92(3) |
78,99(13) |
103,74(3) |
|
Y , град |
102,45(2) |
80,50(8) |
90,00 |
|
V , Å3 |
1394,8(16) |
1456(7) |
2741(4) |
|
Z |
2 |
2 |
4 |
|
р выч , г/см |
1,368 |
1,489 |
1,325 |
|
-1 ц , мм |
0,221 |
0,226 |
0,216 |
|
F (000) |
600,0 |
676,0 |
1152,0 |
|
Размер кристалла, мм |
0,35 × 0,21 × 0,13 |
0,43 × 0,28 × 0,05 |
0,25 × 0,25 × 0,23 |
|
Область сбора данных по 2 0 , град |
5,96 - 64,74 |
5,94 - 57,2 |
6,28 - 56,78 |
|
Интервалы индексов отражений |
- 16 < h < 16, - 16 < к < 16, - 20 < l < 20 |
- 13 < h < 13, - 15 < к < 15, - 17 < l < 17 |
- 16 < h < 16, - 20 < к < 20, - 19 < l < 19 |
|
Измерено отражений |
80925 |
37231 |
58239 |
|
Независимых отражений |
9840 ( R int = 0,0672) |
7347 ( R int = 0,1387) |
6855 ( R int = 0,0626) |
|
Переменных уточнения |
368 |
416 |
344 |
|
GOOF |
1,015 |
1,010 |
1,011 |
|
R -факторы по F 2 > 2 с ( F 2 ) |
R 1 = 0,0662, wR 2 = 0,1490 |
R 1 = 0,0760, wR 2 = 0,1643 |
R 1 = 0,0452, wR 2 = 0,1016 |
|
R -факторы по всем отражениям |
R 1 = 0,1376, wR 2 = 0,1792 |
R 1 = 0,1700, wR 2 = 0,2033 |
R 1 = 0,0781, wR 2 = 0,1169 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,86/ - 0,52 |
0,74/ - 0,46 |
0,33/ - 0,53 |
Обсуждение результатов
Известно, что эффективным способом получения ониевых соединений сурьмы Ar4SbX (Х – электроотрицательный лиганд) является метод, основанный на реакции пентаарилсурьмы с производными сурьмы симметричного строения Ar 3 SbX 2 [19 - 25], однако реакции подобного типа для производных фосфора почти не известны.
Мы предположили, что протекание подобных реакций перераспределения лигандов может наблюдаться и для пентафенилфосфора, который является аналогом пентафенилсурьмы. Действительно, мы показали, что реакция сольвата пентафенилфосфора (Ph 5 P∙½PhH [16]) с дихлоридом трифенилфосфора [17] в бензоле (24 ° С, 1 ч) приводит к образованию хлорида тетрафенилфосфония ( 1 ) с выходом 92 %.
PhH
Ph 5 P ∙ ½PhH + Ph 3 PCl 2 2 Ph 4 PCl
Отметим, что ранее был описан синтез ряда аренсульфонатов органилтрифенилфосфония из галогенидов органилтрифенилфосфония и аренсульфоновых кислот, содержащих различные функциональные группы в ареновом кольце [26 - 30].
В продолжение работы в этом направлении нами показано, что полученный хлорид тетрафенилфосфония реагирует с сульфосалициловой кислотой в воде с образованием гидрата сульфоса- лицилата тетрафенилфосфония [Ph4P][OSO2С6H3(OH-4)(COOH-3)]∙H2O (2), выделенного из реакционной смеси с выходом 91 %.
H 2 О
Ph 4 PCl + HOSO 2 С 6 H 3 (OH-4)(COOH-3) —► [Ph 4 P][OSO 2 С 6 H 3 (OH-4)(COOH-3)] ∙H 2 O
Мы нашли, что по аналогичной схеме реагирует хлорид тетрафенилфосфония с 1-окси-2,4-динитро-7-сульфонафталином с образованием (1-окси)(2,4-динитро)нафталин-7-сульфоната тетрафенилфосфония ( 3 ), выделенного с выходом 93 %.
H 2 О
Ph 4 PCl + HOSO 2 C 10 H 5 (OH-1)(NO 2 ) 2 -2,4 [Ph 4 P][OSO 2 C 10 H 5 (OH-1)(NO 2 ) 2 -2,4]
В настоящей работе также сообщается о синтезе по аналогичной схеме 2-карбоксибензол-сульфоната циклогексилтрифенилфосфония ( 4 ), содержащего карбоксильную группу в аренсульфонатном анионе.
H 2 О
[Ph 3 P(С 6 H 11 - цикло )]Cl + HOSO 2 C 6 H 4 (СОOH-2) —* [Ph 3 P(С 6 H 11 - цикло )][OSO 2 C 6 H 4 (СОOH-2)]
Достоинствами данного одностадийного способа являются мягкие условия проведения эксперимента и высокие выходы комплексов, которые представляют собой устойчивые на воздухе прозрачные кристаллы, хорошо растворимые в хлороформе, аренах, тетрагидрофуране, ацетонитриле, этаноле, четыреххлористом углероде и плохо - в воде при комнатной температуре.
В ИК-спектрах соединений 2 - 4 наблюдаются характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1607‒1480 см–1. Валентным колебаниям связей C Ar –H отвечают полосы поглощения средней интенсивности при 3082‒3065 см–1; внепло-скостным деформационным колебаниям этих же связей – полосы при 865‒800 см–1, плоскостным деформационным колебаниям – полосы при 1138‒1105 см–1 [31]. Также содержатся характерные полосы поглощения: 1260-1223 см-1 (полосы высокой интенсивности) и 1082-1043 см-1 (полосы средней интенсивности), которые относятся к асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Полосы поглощения, относящиеся к валентным колебаниям S‒O, проявляются в области 692‒689 см–1. Интенсивные полосы поглощения в области 525‒524 см‒1 соответствуют валентным колебаниям связей C Ar –S, полосы высокой интенсивности при ∼ 721 см–1 отвечают валентным колебаниям связей CAr–P. В ИК-спектре 3 ассиметричным колебаниям NO 2 -группы соответствуют интенсивные полосы поглощения при 1580, 1514 см–1, симметричным колебаниям – 1339 и 1308 см–1. Валентным колебаниям С=О в спектрах структур 2 и 4 отвечают полосы сильной интенсивности при 1663 и 1724 см–1. Присутствие гидратной молекулы воды в комплексе 2 подтверждается наличием в его ИК-спектре широкой полосы при 3341 см–1.
По данным РСА, кристаллы соединений 2 ‒ 4 состоят из тетраэдрических катионов органилтри-фенилфосфония и аренсульфонат-анионов с четырехкоординированными атомами серы (рис. 1‒3). Комплекс 2 кристаллизуется в виде гидрата состава [Ph 4 P][OSO 2 С 6 H 3 (OH-4)(COOH-3)]∙H 2 O. Катионы органилтрифенилфосфония в структурах 2 ‒ 4 имеют незначительно искаженную тетраэдрическую конфигурацию. Длины связей Р-С изменяются в интервалах 1,780(5)-1,813(2) Å [1,794(2)-1,805(2) Å ( 2 ); 1,780(5)–1,799(5) Å ( 3 ); 1,791(2)–1,813(2) Å ( 4 ), что меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å) [32]. В 2 , 3 , 4 валентные углы СРС принимают значения 107,97(11)°-111,16(10)°; 107,4(3)°-114,4(2)°; 106,24(10)°-111,16(10)° соответственно.
В аренсульфонат-анионах соединений 2 - 4 связи S–О практически выровнены, что свидетельствует о равномерном распределении электронной плотности в SO 3 ‒ группах. Расстояния S‒O изменяются в интервалах 1,409(2)‒1,4583(17) Å: 1,409(2)‒1,433(3) Å ( 2 ),
1,422(4)‒1,454(5) Å ( 3 ), 1,4331(19)‒1,4583(17) Å ( 4 ). Расстояния S-C близки между собой и лежат в пределах 1,764(5)-1,781(2) Å. Валентные углы OSC в сульфонатных группах (103,51(10)°-107,68(10)°) меньше, чем углы OSO (109,6(2)°-114,8(3)°), что полностью согласуется с теорией отталкивания электронных пар валентных оболочек [33]. В аренсульфонатном анионе комплекса 3 плоскости орто- и пара -нитрогруппы не совпадают со средней плоскостью ароматического кольца (соответствующие двугранные углы равны 10,35° и 13,46°). В кристалле 2 гидратные молекулы воды связывают между собой аренсульфонатные анионы (рис. 4).
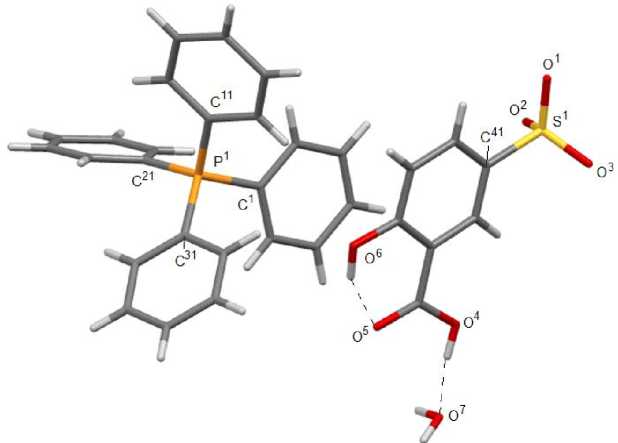
Рис. 1. Общий вид комплекса [Ph 4 P][OSO 2 С 6 H 3 (OH-4)(COOH-3)] ∙H 2 O (2)
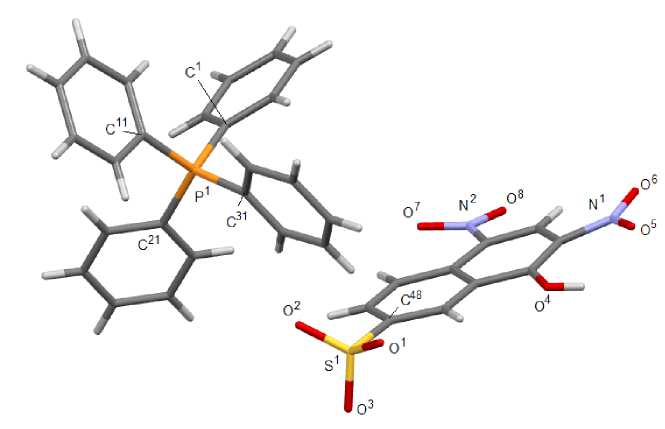
Рис. 2. Общий вид комплекса [Ph 4 P][OSO 2 C 10 H 5 (OH-1)(NO 2 ) 2 -2,4] (3)
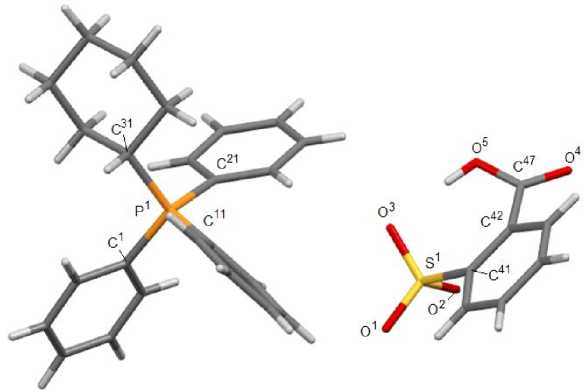
Рис. 3. Общий вид комплекса [Ph 3 P(С 6 H 11 - цикло )][OSO 2 C 6 H 4 (СОOH-2)] (4)
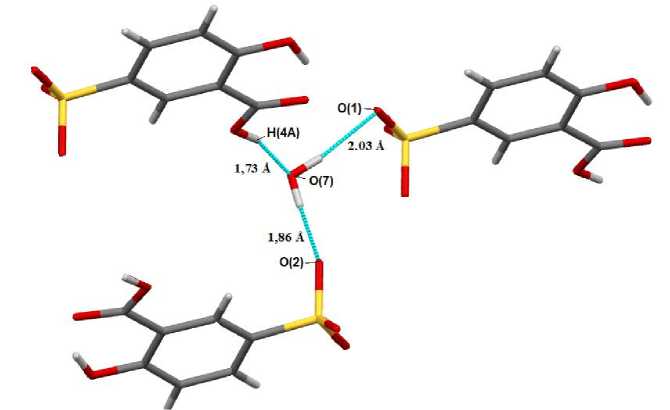
Рис. 4. Связывание аренсульфонатных анионов и молекулы воды в кристалле 2
Катионы и анионы в кристаллах 2 - 4 связаны слабыми водородными связями типа S=O∙∙∙Н(Рh) (2,03–2,69 Å).
Заключение
Таким образом, взаимодействие пентафенилфосфора с дихлоридом трифенилфосфора приводит к образованию с выходом 92 % хлорида тетрафенилфосфония, реакция которого с аренсульфоновой кислотой в воде сопровождается синтезом аренсульфонатов тетрафенилфосфония с выходом до 93 %. Продуктом аналогичной реакции хлорида циклогексилтрифенилфосфония с 2-сульфобензойной кислотой является 2-сульфобензоат циклогексилтрифенилфосфония. По данным РСА, полученные аренсульфонаты тетраорганилфосфония, представляющие собой бесцветные кристаллы, растворимые в большинстве органических растворителей и горячей воде, состоят из тетраэдрических катионов тетраорганилфосфония и аренсульфонатных анионов.
Список литературы Хлорид и аренсульфонаты тетраорганилфосфония
- Hartley F.R. The Chemistry of Organophosphorus Compounds. V. 3. Phosphonium Salts, Ylides and Phosphoranes / F.R. Hartley. John Wiley & Sons, Ltd., 1983. 458 p.
- Moritz R., Wagner M., Schollmeyer D. et al. // Chem. Eur. J. 2015. V. 21. P. 9119. DOI: 10.1002/chem.201406370.
- Werner T. // Adv. Synth. Catal. 2009. V. 351. P. 1469. DOI: 10.1002/adsc.200900211.
- Cordovilla C., Bartolome C., Martinez-Ilarduya J.M. et al. // ACS Catal. 2015. V. 5. P. 3040. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H., Kinjo R. // Angew. Chem. Int. Ed. 2015. V. 127. P. 192. DOI: 10.1002/ange.201408760.
- Zhu Ch.-L., Zhang F.-G., Meng W. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 5869. DOI: 10.1002/anie.201100283.
- Cassity C.G., Mirjafari A., Mobarrez N. et al. // Chem. Commun. 2013. V. 49, No. 69. P. 7590. DOI: 10.1039/c3cc44118k.
- Canac Y., Duhayon C., Chauvin R. // Angew. Chem. Int. Ed. 2007. V. 46. P. 6313. DOI: 10.1002/anie.200701490.
- Sodano F., Rolando B., Spyrakis F. et al. // ChemMedChem. 2018. V. 13. P. 1238. DOI: 10.1002/cmdc.201800088.
- Mironov V.F., Nemtarev A.V., Tsepaeva O.V. et al. // Molecules. 2021. V. 26. P. 6350. DOI: 10.3390/molecules26216350.
- Khasiyatullina N.R., Gubaidullin A.T., Shinkareva A.M. et al. // Russ. Chem. Bull., Int. Ed. 2020. V. 69. P. 2140. DOI: 10.1007/s11172-020-3012-3.
- Romanov S., Aksunova A., Bakhtiyarova Y. et al. // J. Organomet. Chem. 2020. V. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130.
- SMART and SAINT-Plus. Version 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
- SHELXTL/PC. Version 5.10. An Integrated System for Solving, Refining and Displaying Crys-tal Structures from Diffraction Data. Bruker AXS Inc., Madison: (WI, USA), 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J., Howard J.A.K., Puschmann H. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Boyarkina E.A. // Russ. J. Gen. Chem. 2009. V. 79, No. 1. P. 78. DOI: 10.1134/S1070363209010125.
- Godfrey S.M., McAuliffe C.A., Pritchard R.G., Sheffield J.M. // Chem. Commun. 1998. P. 921. DOI: 10.1039/C4SC02357A
- Пурдела Д., Вылчану Р. Химия органических соединений фосфора. М.: Химия, 1972. 276 с.
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 1996. Т. 66, № 10. С. 1755.
- Шарутин В.В., Шарутина О.К., Панова Л.П., Бельский В.К. // Коорд. химия. 1997. Т. 23, № 7. С. 513.
- Шарутин В.В., Шарутина О.К., Пакусина А.П., Бельский В.К. // Журн. общ. химии. 1997. Т. 67, № 9. С. 1536.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2009. Т.79, № 10. С. 1636.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н., Артемьева Е.В. // Журн. неорган. химии. 2020. Т. 65, № 4. С. 482. DOI: 10.31857/S0044457X20040170.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2013. Т. 58, № 11. С. 1454. DOI: 10.1134/S0036023613110181.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общей химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структ. химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 55. DOI: 10.14529/chem230204.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J. 33. Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир, 1992. 75 c.


