Хроматографический анализ факторов апоптоза в растительных объектах
Автор: Павловская Н.Е., Гагарина А.Ю.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Методические вопросы развития сельскохозяйственной биотехнологии
Статья в выпуске: 3 (30), 2011 года.
Бесплатный доступ
Показано, что идентификация фактора апоптоза клеточного сока растений при помощи хроматографического анализа позволяет предполагать природу действующего вещества, входящего в состав исследуемых индукторов запрограммированной клеточной гибели.
Хроматографический анализ, апоптоз, вэжх
Короткий адрес: https://sciup.org/147123706
IDR: 147123706 | УДК: 57.081.22
Текст научной статьи Хроматографический анализ факторов апоптоза в растительных объектах
коэффициент экстинкции ( ε ), причем чаще рассматривается так называемая полуширина полосы , т . е . ширина полосы на уровне половины высоты пика поглощения . Величины λ и ε претерпевают заметные изменения под влиянием pH среды , полярности растворителя , соседних молекул и ориентации соседних хроматофоров [1, 7].
Хроматограмма - графический результат хроматографического процесса . Это зависимость прохождения элюента через ячейку детектора . Ряд пиков при полном разделении соответствует одному компоненту анализируемой пробы . Площадь или высота пика должна быть пропорциональна концентрации компонента в элюенте [6].
Важной характеристикой для идентификации исследуемой смеси является время удерживания вещества в хроматографе (t R ). Время удерживания определяют от момента ввода пробы вещества в хроматограф от момента регистрации максимума детектора . Каждое вещество при одних и тех же хроматографических условиях имеет свое время удерживания . Как отмечает С . Н . Сычев (2000 г .), это положение является основой идентификации ( качественного анализа ) компонентов разделяемой смеси при жестком соблюдении постоянства условий эксперимента , состава элюента , расхода элюента ( объемная скорость подачи элюента ), использование одной и ой же колонки , минимальных колебаниях температуры окружающей среды , сравнимых количеств вещества в хроматографическом пике анализируемой смеси и стандарта .
Целью наших исследований является идентификация фактора апоптоза клеток растений методом ВЭЖ Х .
Материалы и методика исследований
В работе использован ВЭЖХ Милихром -5, с обращено - фазной колонкой КФХ 6-80-4, сорбент - сепарон С 18, элюент ацетонитрил и вода (35:65). Смесь в количестве 100 мкл наносилась в элюенте . Удерживаемый объем колонки 80 х 2 1000-1300 мкл . Количество элюента , необходимого для проведения всего анализа , обычно в 1,3 раза больше оптимального , т . е . 1700 мкл . Время анализа 17 минут .
Анализировался клеточный сок колеоптилей пшеницы ( Triticum aestivum L.) сорта " Московская 39", ячменя ( Hordeum sativum L. ) сорта « Скарлет » и молодых листьев монстеры ( Monstera deliciosa L.).
Для подготовки проб колеоптилей , семена пшеницы и ячменя этиолировали в кювете на влажной фильтровальной бумаге , при температуре 25°C в течение 4 дней в программируемой климатокамере . Колеоптили отделяли от прочих органов проростка , и дальнейший эксперимент вели с навеской колеоптилей равной 2 грамма . Из колеоптилей брали вытяжку клеточного сока , равную 1 мл , и центрифугировали в течении 15 минут при 15000 об ./ мин .
Для подготовки проб монстеры , из молодых листьев растения брали пробы в местах предполагаемой перфорации лопастей листа , и дальнейший эксперимент вели с измельченной навеской , равной 2 грамма . Измельченный лист монстеры растирали в ступке с 1 мл воды , затем центрифугировали в течение 15 минут при 15000 об / мин .
Результаты и их обсуждение
Известно , что белковые препараты поглощают в УФ - области 230-300 нм с пиком около 280 нм , причем интегральное поглощение спектрального контура определяется в подавляющем количестве вкладом остатков ароматических аминокислот фенилаланина , тирозина и триптофана . Вклад серосодержащих аминокислот цистеина , цистина и метионина в долю общего УФ - спектра пренебрежимо мал .
Предварительные данные показали , что максимум поглощения анализируемых клеточных соков находится в области 280 нм . В связи с этим качественный анализ проводили путем детектирования при длине волны 220, 240, 260 и 280 нм . Использование спектрофотометрического детектора вместе с компьютером позволяют получить хроматограмму на нескольких длинах волн одновременно и рассчитать дополнительный параметр для идентификации – спектральное отношение . Спектральным отношением называется отношение высот хроматографического пика на разных длинах волн .
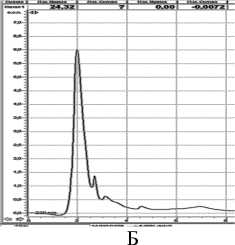
Рисунок 1 – Хроматограмма клеточного сока при длине волны 220 нм: А – колеоптиль пшеницы, Б- колеоптиль ячменя
На хроматограмме (рис.1А) у пшеницы путем детектирования при длине волны 220 нм обнаружены 4 пика. Пики 1 и 2 – с площадью под пиками 483 мм2 и 160 мм2 соответственно. Время удерживания на колонке составляет 2,2 мин и 4,0 мин. Маленькие пики 3 и 4 имеют площади 76,5 и 46 мм2 соответственно, с временем удерживания 4 и 7,8 мин.
На хроматограмме ( рис .1 Б ) у ячменя обнаружен один преобладающий пик ( № 1) с площадью под пиком 355 мм 2 и временем удерживания на колонке 2 мин . Пики 2,3,4,5 не существенны .
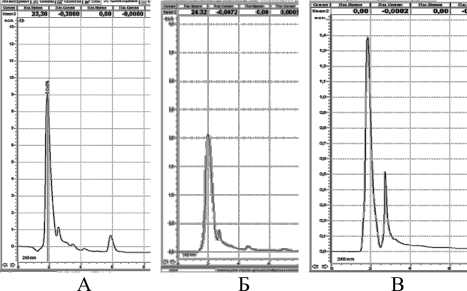
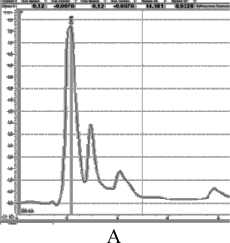
Рисунок 2 – Хроматограмма клеточного сока при длине волны 240 нм: А – колеоптиль пшеницы, Б- колеоптиль ячменя, В- лист монстеры
При детектировании при 240 нм ( рис .2 А ) у пшеницы наблюдаются 5 пиков , из которых 1- ый с площадью под пиком 516 мм 2 и временем удерживания 2 мин соответствует максимальному пику при 220 нм . 2- ой и 5- ый пики имеют соответственно площади под пиками 15 и 56 мм 2 , с временем удерживания 2 и 6 мин ., а два других ничтожно малы .
У ячменя в тех же условиях детектирование при 240 нм . ( рис .2 Б ) первый пик имеет площадь под пиком 54,6 мм 2 с временем удерживания 2 мин . 3- им и 4- ым пиками можно пренебречь .
У монстеры ( рис . 2 В ) детектирование при 240 нм . выявило аналогичный для всех культур пик № 1 с площадью под пиком 67,2 мм 2 и временем удерживания 2 мин . 2- ой пик имеет площадь 18,1 мм 2 и время удерживания 3 мин .
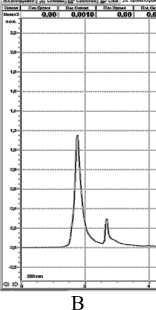
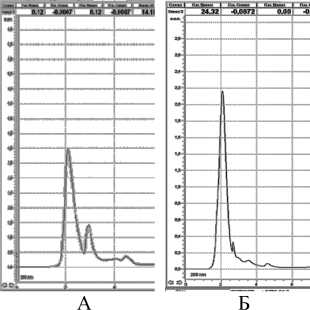
Рисунок 3 – Хроматограмма клеточного сока при длине волны 260 нм: А – колеоптиль пшеницы, Б- колеоптиль ячменя, В- лист монстеры
Выявленный детектированием пик №1 при 220 и 240 нм у пшеницы, ячменя и монстеры при длине волны 260 нм. (рис.3) имеют площади под пиками соответственно 335 мм2 ; 164,8 мм2 и64,5 мм2 и временем удерживания 2 мин. 2-ой пик оказался существенным только у пшеницы (53,5 мм2), время удерживания 3,8 мин.
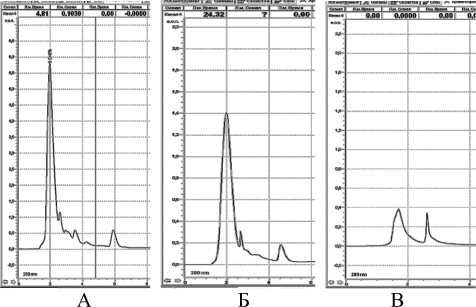
Рисунок 4 – Хроматограмма клеточного сока при длине волны 280 нм: А – колеоптиль пшеницы, Б – колеоптиль ячменя, В- лист монстеры
Детектирование при длине волны 280 нм выявило , что у пшеницы ( рис .4 А ) пик № 1 имеет площадь 363,5 мм 2, время удерживания 2 мин ., а 4- ый 32 мм 2 , время удерживания 6 мин . Для ячменя существенным оказался 1- й пик ( рис .4 Б ) с площадью 99,2 мм 2, а у монстеры ( рис . 4 В ) 1- й пик имеет площадь 28,5 мм 2 с временем удерживания 1,5 мин . Полученные результаты сведены в таблицу .
Таблица 1 – Детекция пиков клеточного сока растений
У колеоптиля ячменя максимальная площадь под пиком (355 мм 2) детектируется при времени удерживания на хроматограмме 2 мин при 220 нм и 164,8 мм 2 при 260 нм . Остальными пиками можно пренебречь .
В формирующихся листьях монстеры максимальная площадь под пиком (64,5 мм 2) со временем удержания 2 мин . Обнаружена при детектировании 260 нм .
Таким образом , на основании данных хроматографического анализа можно предполагать , что индуктор апоптоза , входящий в состав клеточного сока , выделенного из колеоптилей пшеницы , ячменя и формирующихся листьев монстеры , является веществом белковой природы .
Из данных таблицы следует , что в клеточном соке колеоптилей злаков и формирующегося листа монстеры в области 220-280 нм обнаружен идентичный для всех объектов пик с временем удерживания 2,0 мин . Максимальная площадь под пиком у колеоптилей пшеницы равна 516 мм 2 и
ОрелГАУ
Список литературы Хроматографический анализ факторов апоптоза в растительных объектах
- Бурштейн Э.А. Собственная люминесценция белка/Биофизика. М.,1977, т.7, 187с
- Ванюшин, Б. Ф. Апоптоз у растений/Б. Ф. Ванюшин//Успехи биологической химии -2001. -Т. 41. -С. 3-38
- Павловская Н.Е., Гагарина А.Ю. Индуцирование апоптоза в проростках гороха./Вестник Орел ГАУ -2011-№6 с.128-131
- Павловская Н.Е., Гринблат А.И. Активные формы кислорода и апоптоз у пшеницы и гороха/Сельскохозяйственная биология, 2010,№1, с.51-55
- Сааков В.С., Данилов А.Ф., Монтьев В.Г. Спектрофотометрический анализ ароматических аминокислот, белков и биологически активных веществ методом второй производной./Спектрофотометрические методы исследования в физиологии и биохимии. Сб. Научных трудов.Ленинград: «наука», 1987, с. 76-96
- Сычев С.Н. Методы совершенствования хроматографических систем и механизмы удерживания в ВЖЭХ. Орел.-2000 -212с
- Фрайфельдер Д. Физическая биохимия. М. Мир. 1980, 582с
- Levine B. Eating oneself and uninvited guests: autophagyrelated pathways in cellular defense. Cell.2005. 120: 159-162


