Хроматографическое определение силильных производных кодеина и морфина
Автор: Михеева Лариса Алексеевна, Пимонова Полина Николаевна, Еникеева Любовь Федоровна, Фролова Ольга Валентиновна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
В работе рассмотрен метод получения силильных производных кодеина и морфина с помощью реактива ВSTFA для их количественного определения методом газовой хро- матографии. Сделаны выводы о возможности и целесообразности использования данной методики в дальнейшем. Рассмотрены преимущества получения производных, а также проанализированы недостатки использованного метода.
Морфин, кодеин, дезоморфин, лекарственные средства, деривация, си- лильные производные, вstfa
Короткий адрес: https://sciup.org/14112800
IDR: 14112800 | УДК: 543.544:543.84:615.78
Текст научной статьи Хроматографическое определение силильных производных кодеина и морфина
Введение. В настоящее время препараты из группы агонистов опиоидных рецепторов, например морфин и кодеин, широко применяются как лекарственные средства [1].
Термином «опиаты» обозначают природные и синтетические вещества с морфиноподобными анальгезирующими свойствами, влияющими на центральную нервную систему и гладкие мышцы [2, 5].
Опий представляет собой сложную смесь алкалоидов, получаемую из млечного сока снотворного мака [4].
В состав опия входит свыше 20 алкалоидов. Под алкалоидами понимают большую группу азотсодержащих органических оснований сложного состава, встречающихся в растительных (реже в животных) организмах и обладающих, как правило, сильным фармакологическим действием [9] (табл. 1).
Таблица 1
Основные алкалоиды опия
|
Алкалоид |
Содержание в опии, % |
|
Морфин |
42 |
|
Кодеин |
12 |
|
Носкапин (наркотин) |
21 |
|
Тебаин |
6,5 |
|
Папаверин |
18 |
В зависимости от сорта и места произрастания снотворного мака в опии содержится от 2 - 3 до 15 - 20 % алкалоидов, главными из которых являются морфин, кодеин, наркотин, тебаин и папаверин.
В медицине опий применяется в виде порошка и галеновых препаратов (экстракты, настойки, таблетки и др.). Из алкалоидов, выделяемых из опия, в медицине применяются морфин, кодеин и др. [5].
Особое влияние опиатов на центральную нервную систему (эйфория и развивающаяся толерантность при повторном применении) приводит к возникновению физической и психической зависимости (наркомании) у потребителей. Эта особенность опиатов объясняет ограниченность их медицинского применения и показаний к немедицинскому использованию [2].
В последнее время значительно участились случаи приема препаратов из группы агонистов опиоидных рецепторов, таких как морфин и кодеин, в немедицинских целях в качестве наркотических средств. Активное изъятие этих препаратов службой по контролю за оборотом наркотиков вынуждает нар-козависимых лиц искать их заменители. Одним из них стал дезоморфин, который известен среди наркоманов как «крокодил».
При его кустарном получении образуется смесь из кодеина, морфина и дезоморфина, вследствие чего в экспертном заключении требуется указание точного процентного содержания каждого из этих компонентов. Существует целый ряд методов количественного анализа содержания кодеина и морфина [3, 7, 8] в исследуемых препаратах, но наиболее перспективным в настоящее время является метод газовой хроматографии с масс-селек-тивным детектором (ГХ-МС) [9, 10]. Однако практическое использование данного метода осложняется тем, что из-за высокой активности гидроксильных групп исследуемые вещества адсорбируются в инжекторе и хроматографической колонке, вследствие чего происходит трансформация веществ, их потеря и искажение результатов количественного определения.
Во избежание этого при количественном определении кодеин и морфин подвергают дериватизации – преобразованию полярных гидроксильных групп в неполярные без затрагивания основной структуры вещества. Наиболее перспективным методом деривати-зации является силилирование. Преимущества получаемых силильных производных состоят в том, что они более летучи, дают хорошее разделение на хроматограмме, интенсивные пики в масс-спектре, обеспечивают высокую чувствительность при определении. При этом дериват можно непосредственно вводить в хроматограф, что помогает избежать потерь при выпаривании.
Утвержденная методика силилирования уже устарела, и в настоящее время появились новые реактивы, которые могут значительно упростить этот процесс [11]. Одним из таких реактивов является BSTFA (N,O-Bis(trimethyl-silyl)trifluoroacetamide).
Цель исследования. Получение силильных производных кодеина и морфина на основе BSTFA для их количественного определения методом газовой хроматографии.
Материалы и методы. Исследования проводились в химической лаборатории Федеральной службы Российской Федерации по контролю за оборотом наркотиков по Ульяновской области.
Для проведения анализов использовались хроматограф Agilent Technologies 6890 N Network GC System; масс-селективный детектор Agilent Technologies 5973 N Network; термостат фирмы Binder серии FD (диапазон температур от +50 до +300 ºС).
Для пробоподготовки и хроматографического анализа применялись следующие реактивы: морфин гидрохлорид х.ч., кодеин фосфат х.ч., метилстеарат х.ч. (в качестве внутреннего стандарта), ацетонитрил х.ч. (в качестве растворителя), BSTFA (в качестве сили-лирующего агента), триэтиламин х.ч. (в качестве средообразующего агента), дистиллированная вода.
В качестве силилирующего агента был использован BSTFA:
CH3 CF 3 CH 3
CH3 Si Si CH
C3SN O 3
CH3 CH3
Количественное определение кодеина и морфина проводили с использованием внут- реннего стандарта, которым являлся метил-стеарат.
Для получения силильных производных брали точную навеску 0,005 г морфина гидрохлорида или кодеина фосфата. К пробе в виале добавляли 0,4 мл ацетонитрила. Смесь энергично встряхивали. При этом соли морфина и кодеина выпадают в осадок. Для того чтобы разрушить их и получить растворы чистых веществ, подщелачивали среду 1 каплей три-этиламина. Добавляли 0,4 мл реактива BSTFA. Получившуюся смесь грели в термостате при температуре 60 ºС в течение 15 мин. Затем добавляли 0,005 г метилстеарата.
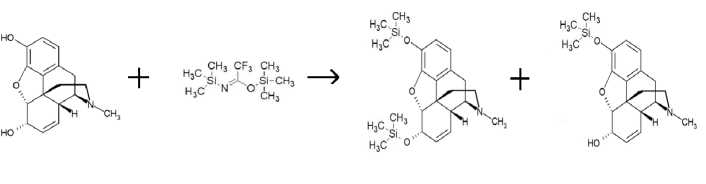
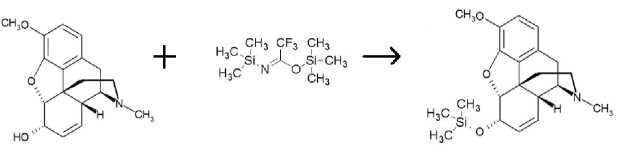
Полученные силильные производные с помощью BSTFA качественно определялись методом газовой хроматографии с масс-селективным детектором, а количественно – методом газовой хроматографии.
Пробоподготовку проводили по указанной выше методике, вводя в приборы непосредственно 2 мкл деривата.
Хроматографирование осуществляли в следующих условиях: колонка капиллярная кварцевая длиной 12 - 25 м, заполненная ме-тилсиликоновой фазой (например, OV-101), детектор пламенно-ионизационный, температура испарителя – 280 ºС, детектора – 290 ºС, температура колонки меняется от 200 до 280 ºС со скоростью 10 град/мин. Газ-носитель – гелий (азот).
Зная точные навески кодеина и морфина, которые использовались для хроматографического анализа, определили их относительный массовый коэффициент к метил-стеарату. Расчет производили по следующей формуле:
л х т --т- X K х 100,
Scm Х mn где Sx – площадь пика силильного производного морфина; Sст – площадь пика внутреннего стандарта (метилстеарата); mст – масса внутреннего стандарта, мг; mп – масса исходной пробы, мг; K – относительный массовый коэффициент.
Данные по хроматографическому определению кодеина и морфина подвергали статистической обработке с определением критерия значимости по Стьюденту.
Результаты и обсуждение. Полученные значения площадей пиков при хроматографическом определении морфина и кодеина приведены в табл. 2 и 3.
В табл. 4 приведен перерасчет относительных массовых коэффициентов кодеина и морфина к метилстеарату.
При получении силильных производных с помощью BSTFA относительный массовый коэффициент получается больше (0,99 для кодеина и 0,97 для морфина), чем при получении их по утвержденной методике (0,96 для кодеина и 0,94 для морфина). Это показывает, что силилирование проходит более полно, а значит, и чувствительность определения значительно выше.
Таблица 2
Средняя площадь пиков при хроматографическом определении морфина
|
Вещество |
Повторность, n |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
Морфин |
3273,2 |
3301,9 |
3245,4 |
3174,9 |
3290,6 |
3256,9 |
3203,7 |
3261,3 |
|
Метилстеарат |
2506,3 |
2456,3 |
2521,2 |
2503,6 |
2428,7 |
2569,4 |
2399,9 |
2530,6 |
Таблица 3
Средняя площадь пиков при хроматографическом определении кодеина
Пересчет относительных массовых коэффициентов
|
Вещество |
Повторность, n |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
Кодеин |
3427,6 |
3357,9 |
3245,4 |
3400,9 |
3394,5 |
3230,9 |
3422,7 |
3395,3 |
|
Метилстеарат |
2059,5 |
2090,4 |
2020,9 |
2072,6 |
2040,7 |
2039,9 |
2093,3 |
2032,6 |
Таблица 4
|
Вещество |
Повторность, n |
Среднее значение, m |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
Морфин |
0,97 |
0,96 |
0,98 |
0,97 |
0,96 |
0,99 |
0,96 |
0,97 |
0,97 |
|
Кодеин |
1,005 |
1,01 |
0,94 |
1,04 |
0,96 |
0,97 |
1,07 |
0,93 |
0,99 |
Заключение. По результатам проведенных исследований сделаны выводы о возможности и целесообразности использования разработанной методики получения силильных производных кодеина и морфина.
Были выявлены преимущества разработанного метода получения силильных производных:
-
1. Относительный массовый коэффициент получается больше, чем при получении их по утвержденной методике. Это показывает, что силилирование проходит более полно, а значит, и чувствительность определения повышается.
-
2. Время, затрачиваемое на проведение пробоподготовки, сокращается более чем в 3 раза.
-
3. Уменьшение количества реагентов, используемых в получении силильных производных, увеличивает чистоту получаемых хроматограмм, которые не засоряются лишними пиками.
Недостатком данного метода можно считать то, что реактив BSTFA, будучи активным силилирующим агентом, силилирует все задержавшиеся в колонке вещества. Поэтому после его применения необходимо чистить колонку, вводя холостую пробу, и проверять остаточную память колонки перед проведением каждого анализа.
-
1. Веселовская, Н.В. Наркотики / Н.В. Веселовская, А.Е. Коваленко. – М. : Триада – Х, 2000. – 204 с.
-
2. Голиков, С.Н. Общие механизмы токсического действия. / С.Н. Голиков, И.В. Саноцкий, Л.А. Тиунов. – Л. : Медицина, 1986. – 279 с.
-
3. Катаев, С.С. Определение дезоморфина в моче / С.С. Катаев, Н.Б. Зеленинин, Е.А. Шилова // Проблемы экспертизы в медицине. – 2007. – №1. – С. 32–36.
-
4. Криминалистическое исследование опийного и масличного маков / А.В. Гаевский и др. – М. : Высш. шк., 1991. – 248 с.
-
5. Лужников, Е.А. Клиническая токсикология / Е.А. Лужников. – М. : Медицина, 1999. – 416 с.
-
6. Мелентьев, А.Б. Определение морфина и кодеина в крови в виде их пропионовых эфиров методом газовой хроматографии – масс-спектрометрии / А.Б. Мелентьев // Журн. аналитической химии. – 2004. – Т. 59, №6. – С. 637–641.
-
7. Методические рекомендации по исследованию веществ не установленной природы на принадлежность к наркотическим средствам, психотропным, сильнодействующим и ядовитым веществам с использованием методов капельных аналитических (цветных химических) реакций и тонкослойной хроматографии. – Ульяновск : Отдел специальных экспертиз ЭКЦ УВД, 2007. - 35 с.
-
8. Нестерова, Е.Н. Основы токсикологии : учебное пособие для студентов / Е.Н. Нестерова. – Брянск : Изд-во Брянской гос. инженерно-технологической академии, 2006. – 51 с.
-
9. Савчук, С.А. Разработка и применение унифицированных методов хроматографического анализа в системе химико-токсикологических и судебно-химических лабораторий / С.А. Савчук. – М. : ЭКУ Госнаркоконтроля России, 2003. – 21 с.
-
10. Сборник методических рекомендаций по криминалистическому исследованию наркотических средств и психотропных веществ. – М. : ЭКЦ МВД, 2004. – 200 с.
-
11. Симонов, Е.А. Метод тонкослойной хроматографии в исследовании наркотиков / Е.А. Симонов. – М. : ЭКУ Госнаркоконтроля России, 2003. – 20 с.
CHROMATOGRAPHIC DETERMINATION OF SILYLIC DERIVATIVES OF CODEINE AND MORPHINE
L.A. Mikheeva, P.N. Pimonova, L.F. Enikeeva, O.V. Frolova
Ulyanovsk State University
Список литературы Хроматографическое определение силильных производных кодеина и морфина
- Веселовская, Н.В. Наркотики/Н.В. Веселовская, А.Е. Коваленко. -М.: Триада -Х, 2000. -204 с.
- Голиков, С.Н. Общие механизмы токсического действия./С.Н. Голиков, И.В. Саноцкий, Л.А. Тиунов. -Л.: Медицина, 1986. -279 с.
- Катаев, С.С. Определение дезоморфина в моче/С.С. Катаев, Н.Б. Зеленинин, Е.А. Шилова//Проблемы экспертизы в медицине. -2007. -№1. -С. 32-36.
- Криминалистическое исследование опийного и масличного маков/А.В. Гаевский и др. -М.: Высш. шк., 1991. -248 с.
- Лужников, Е.А. Клиническая токсикология/Е.А. Лужников. -М.: Медицина, 1999. -416 с.
- Мелентьев, А.Б. Определение морфина и кодеина в крови в виде их пропионовых эфиров методом газовой хроматографии -масс-спектрометрии/А.Б. Мелентьев//Журн. аналитической химии. -2004. -Т. 59, №6. -С. 637-641.
- Методические рекомендации по исследованию веществ не установленной природы на принадлежность к наркотическим средствам, психотропным, сильнодействующим и ядовитым веществам с использованием методов капельных аналитических (цветных химических) реакций и тонкослойной хроматографии. -Ульяновск: Отдел специальных экспертиз ЭКЦ УВД, 2007. -35 с.
- Нестерова, Е.Н. Основы токсикологии: учебное пособие для студентов/Е.Н. Нестерова. -Брянск: Изд-во Брянской гос. инженерно-технологической академии, 2006. -51 с.
- Савчук, С.А. Разработка и применение унифицированных методов хроматографического анализа в системе химико-токсикологических и судебно-химических лабораторий/С.А. Савчук. -М.: ЭКУ Госнаркоконтроля России, 2003. -21 с.
- Сборник методических рекомендаций по криминалистическому исследованию наркотических средств и психотропных веществ. -М.: ЭКЦ МВД, 2004. -200 с.
- Симонов, Е.А. Метод тонкослойной хроматографии в исследовании наркотиков/Е.А. Симонов. -М.: ЭКУ Госнаркоконтроля России, 2003. -20 с.


