Хроническая ишемия головного мозга: от факторов риска до цереброваскулярных осложнений
Автор: Юсупов Фуркат Абдулахатович, Нурматов Шароф Жумабаевич, Абдыкалыкова Нургуль Сулаймановна, Юлдашев Акмал Акбарович, Абдыкадыров Мухаммадюсуф Шкуратович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 6 т.7, 2021 года.
Бесплатный доступ
Хроническая ишемия головного мозга представляют собой полиэтиологическое, хроническое прогрессирующие нарушение функции головного мозга обусловленное диффузным и/или мелкоочаговым повреждением мозговой ткани в условиях длительной недостаточности церебрального кровоснабжения. В обзоре отражены современные представления о хронической ишемии головного мозга. Изложены основные патогенетические механизмы возникновения хронической ишемии головного мозга у пациентов с артериальной гипертензией, атеросклерозом и курением.
Хроническая ишемия головного мозга, сосуды, перфузия, когнитивные нарушения
Короткий адрес: https://sciup.org/14121007
IDR: 14121007 | УДК: 616-005.4.616-005.8 | DOI: 10.33619/2414-2948/67/30
Текст обзорной статьи Хроническая ишемия головного мозга: от факторов риска до цереброваскулярных осложнений
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-005.4.616-005.8
Сосудистые поражения головного мозга по-прежнему занимают ведущее место в структуре заболеваемости и смертности во всех странах мира. На сегодняшний день более 9 млн. человек в мире страдают цереброваскулярными болезнями [1, 2]. В настоящее время большинство клиницистов используют термин «хроническая ишемия головного мозга» код I67.8. Согласно литературным данным, под хронической ишемией головного мозга подразумевают медленно прогрессирующие нарушения функции головного мозга, резвившиеся вследствии диффузного и/или мелкоочагового повреждения мозговой ткани в условиях длительно существующей недостаточности церебрального кровоснабжения [3]. Важно помнить, что цереброваскулярные болезни являются собирательным понятием, включающим в себя различные нозологические единицы, в связи с чем не используются в качестве клинического диагноза [4]. Использование при формулировке клинического диагноза сборных понятий недопустимо. Практическим врачам важно знать основные факторы риска развития и прогрессирования хронической ишемии головного мозга. Так как, многие хронические неинфекционные заболевания сопровождаются расстройством когнитивной функции головного мозга. По данным международной классификации болезней-10, выделяют:
I 67. Другие цереброваскулярные болезни.
I 67.2 Церебральный атеросклероз.
I 67.3 Прогрессирующая сосудистая лейкоэнцефалопатия (болезнь Бинсвангера).
I 67.5 Болезнь Мойа-мойа.
I 67.8 Хроническая ишемия головного мозга.
I 67.9 Цереброваскулярная болезнь неуточненная.
По мере увеличения средней продолжительности жизни изучение вопросов хронической ишемии головного мозга становится все более актуальным. Эпидемиологические данные свидетельствуют о том, что сегодня в мире у каждого девятого человека имеется хотя бы один фактор риска хронической ишемии головного мозга [1]. Проблема хронической ишемии головного мозга приобрел медико-социальную значимость. Отмечается тенденция к омоложению сосудистых заболеваний головного мозга. При наличии хронической ишемии головного мозга риск инсульта становится в разы больше. Социальные аспекты хронической ишемии головного мозга заключается в том, что она заканчивается инвалидизацией пациента и сосудистой деменцией. К факторам риска развития хронической ишемии головного мозга относятся возраст (старше 45 лет), избыточная масса тела и ожирение, артериальная гипертензия, атеросклероз, курение, гиперхолестеринемия, сахарный диабет, хроническая обструктивная болезнь легких, подагра, системные болезни соединительной ткани, фибрилляция предсердий, хроническая сердечная недостаточность, хроническая болезнь почек и т.д. Особое место среди этих факторов отводится артериальной гипертензии, атеросклерозу и курению.
Артериальная гипертензия. Стойкое повышение систолического и/или диастолического артериального давления ≥ 140/90 мм рт. ст. является ведущим фактором риска хронической ишемии головного мозга. Широко известно, что артериальная гипертензия часто протекает бессимптомно и обнаруживается при случайном измерении артериального давления. По данным зарубежных авторов, частота встречаемости артериальной гипертензии превышает 20% среди взрослого населения, причем у лиц старшего возраста распространенность артериальной гипертензии достигает 50% и более [5]. Согласно результатам российских исследователей, стандартизированной по возрасту, распространенность артериальной гипертензии у мужчин составляет 37,2%, у женщин — 40,4% [6].
По данным А. Г. Полупанова и соавторами, в нашей стране распространенность артериальной гипертензии составляет среди лиц 18–65 лет 44%: 33,2% у мужчин и 46,7% у женщин. Причем, среди коренных жителей Республики частота артериальной гипертензии достоверно ниже, чем среди русских по национальности участников исследования — 36,8% из 46,2%. Как подчеркивают исследователи, распространенность артериальной гипертензии в Кыргызстане за последние 20 лет выросла практически на 40–50% [7].
По сведениям Европейского общества кардиологов, распространенность артериальной гипертензии колеблется от 30% до 45% общей популяции, однако эти цифры могут значительно различаться в разных странах [8].
Так, в Республике Казахстан, распространенность артериальной гипертензии у лиц старше 18 лет составляет 25,6% [9]. До 50% пациентов с артериальной гипертензией, осложненной сердечной недостаточностью, погибает в ближайшие 4 года, а в случае тяжелой формы — в течение одного года [10]. В одномоментном исследовании Л. Ю. Соколовой и Д. С. Нугманова, артериальная гипертензия выявлена у 27,8% обследованных, большинство из них (67%) — с повышением артериального давления I степени. Наиболее часто повышение артериального давления зафиксировано у мужчин — 41,7% случаев. В рамках данного исследования представлены результаты опроса лиц с повышенным артериальным давлением: осведомлены о повышении артериального давления только четверть лиц с выявленной артериальной гипертензией, наблюдаются у врача и регулярно принимают лечение только 13,8% опрошенных [10].
При артериальной гипертензии головной мозг является «органами-мишенями». У лиц с высоконормальным артериальным давлением риск развития инсульта составляет в 2,7 раз. Ежегодно около 7% пациентов с артериальной гипертензией переносят инсульт. В процессе развития и прогрессирования артериальной гипертензии формируется сложный комплекс изменений сосудистой системы головного мозга. Такими являются [11]:
-
1. Деструктивные изменения, выражающиеся в плазмо- и геморрагиях в стенки мелких сосудов, первичном некрозе миоцитов средней оболочки;
-
2. Гипертонический стеноз и облитерации артерий среднего калибра;
-
3. Разрыв стенок, потеря тонуса и образованию перегибов интрацеребральных артерий;
-
4. Внечерепных артерих развивается гипертрофия средней оболочки, истончение и ригидность стенок, удлинение и извитость артерий;
-
5. Преобладание очагов утолщения внутренней оболочки, локальные фиброзные бляшки и деформации в виде удлинения сосудов;
-
6. В крупных мозговых артериях отмечается прогрессирующая утрата эластических волокон, что приводит к повышению жесткости и появлению извитости, перегибов сосудов;
-
7. Утрата мышечных и эластических элементов стенок сосудов;
-
8. Мелкоочаговые и/или диффузные изменения преимущественно глубоких отделов головного мозга;
-
9. Нарушение резорбции ликвора, обусловленное резко выраженным фиброзом капилляров и венул;
-
10. Лейкоареоз.
У пациентов с артериальной гипертензией наблюдается неспецифическая симптоматология в виде головных болей, головокружения, снижение внимания и памяти. Если указанные симптомы сохраняются на протяжении более трех месяцев, повторяющихся с определенным постоянством, связанных с повышенной нагрузкой и регрессирующих после отдыха свидетельствуют развитие начальных проявлений недостаточности кровоснабжения головного мозга. Весьма важным критерием диагностики начальных проявлений недостаточности кровоснабжения головного мозга является отсутствие объективной неврологической симптоматики. Неконтролируемое течение артериальной гипертензии при наличии сахарного диабета, хронической болезни почек, хронической сердечной недостаточности многократно повышают шансы появления хронической ишемии головного мозга [12].
Адекватный контроль артериального давления у пациентов с артериальной гипертензией достоверно снижают риск не только хронической ишемии головного мозга, но и инсульта [13]. Ранее показано, что снижение диастолического артериального давления даже на 5,8 мм рт. ст. уменьшает риск инсульта на 42%, а снижение систолического артериального давления на 12-13 мм рт. ст. — на 37% [14].
Отсутствие контроля артериального давления главный фактор – хронической ишемии головного мозга и инсульта. Так, чем выше уровень артериального давления, тем выше риск инсульта. Повышение диастолического артериального давления на 7,5 мм рт. ст. увеличивает риск инсульта на 46% [14].
Накопленные труды исследователей показывают, что у пациентов с артериальной гипертензией выявляются изменения мелких внутримозговых артерий. Повышение артериального давления вызывает острое набухание стенок сосудов и сужение просвета приводящей артериолы с последующим развитием малого глубинного (лакунарного) инфаркта мозга. Здесь стоит заметить, что лакунарный инсульт развивается, как правило, у пациента, длительное время страдающего артериальной гипертензией. Важным дифференцированным признаком этого подтипа инсульта является своеобразный феномен отсутствия нарушений высших корковых функций при локализации очага в доминантном полушарии. Не менее важным морфологическим проявлением когнитивных расстройств при артериальной гипертензии считается диффузное поражение белого вещества, кортикальная атрофия и мозговая гипоперфузия вследствие структурно-функциональных изменений мелких интрацеребральных артериол [15].
При гипоперфузии головного мозга отмечаются прежде всего дефицит кислорода и глюкозы, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза. Наряду с этим наблюдаются накопление лактата, повышается осмолярность в микроциркуляторном русле, адгезия тромбоцитов в сосудистую стенку провоцирует изменение клеточной мембраны эндотелиоцитов, что приведет к активации микроглии. Что сопровождается продукцией нейротоксинов и усилением апоптоза. Кортикальная атрофия полушарий это результат гибели нейронов коркового вещества мозга, что и объясняет возникающие при этом функциональные нарушения [16].
Функциональные последствия мембранных нарушений проявляется в виде снижения работоспособности человека. В случае множественного мелкоочагового поражения глубоких отделов мозга, спонгиоза белого вещества нарушения высших психических функций обусловлены разобщением структур головного мозга, в частности, повреждением связей лобных отделов с височными, теменными, а также структурами лимбико-ретикулярного комплекса. Давно известно, что капиллярная часть сосудистого русла головного мозга имеет структурно-функциональное отличие. Так, церебральные капилляры имеют тесные связи с глиальными клетками и астроцитами. Ведущим механизмом изменения диаметра капилляров головного мозга является сократительная активность перицита и этот процесс контролируется уровнем кальция. При хронической ишемии головного мозга дефицит макроэргических соединений приводят к стойкой дилатации капилляра и развитию феномена функциональной гиперемии [15, 16].
Надо сказать, что перициты самые чувствительные клетки к гипоксии. Предполагаются, что нарушение феномена функциональной гиперемии лежит в основе возникновения когнитивных расстройств. Вместе с тем, нарушение нейрон-глиальноперицитарное взаимодействие все больше усиливает когнитивный дефицит при хронической ишемии головного мозга.
Атеросклероз вне- и внутричерепных артерий. В международных рекомендациях по сердечно-сосудистой профилактике предусмотрен единый показатель нормальной толщины комплекса интима-медиа 0,9 мм [17]. Атеросклеротическая бляшка определяется как локальное образование внутренней стенки артерии размерами ≥0,5 мм (или >50% просвета сосуда) или любое утолщение комплекса интима-медиа ≥1,5 мм. Характеристики бляшек включают их эхоплотность (эхоположительные или кальцифицированные), наличие изъязвлений на поверхности. Риск развития инсульта достоверно повышается при перекрытии ≥50% просвета артерии [18]. Многочисленные исследование показывают, что каждый пятый ишемический инсульт развивается в результате стенозирующего атеросклероза сонных артерий, особенно в зоне бифуркации [19].
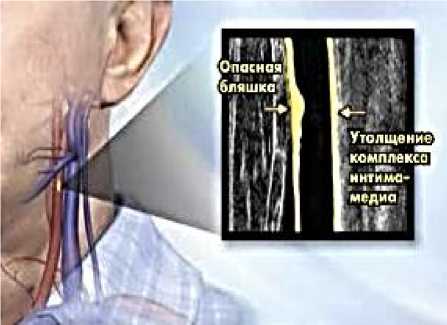
Рисунок 1. Ультразвуковое сканирование сонных артерий
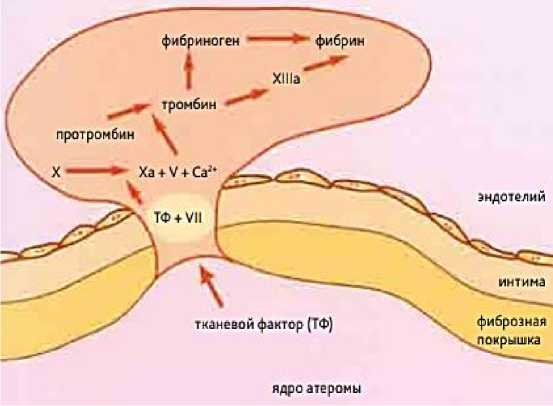
Рисунок 2. Механизм развития тромбоза на фоне атеросклероза
Разрыв фиброзной покрышки атеромы приводит к контакту содержимого ядра с плазмой крови. В результате тканевой фактор (тканевой тромбопластин), в большом количестве содержащийся в ядре, образует с фактором VII комплекс, который взаимодействует с фактором Х и активирует его. Тромбин, образующийся под влиянием активированных факторов Х и V из протромбина, запускает образование фибрина [20].
Ранее проведенные наблюдательные исследования показывают, что при наличии инсульта или транзиторной ишемической атаки в анамнезе эндартерэктомия снижает пятилетний абсолютный риск инсульта и смерти на 4,6% при стенозах сонных артерий 5069% и на 16% у пациентов со стенозами 70-99% [21]. В обзорном исследовании Н. Е. Гаврилова, М. В. Жаткина, В. А. Метельская, Б. А. Руденко и О. М. Драпкина описывают морфологические критерий «нестабильности» атероскеротической бляшки. Согласно исследователям, выделяют следующие признаки ранимости атероскеротической бляшки [22].
-
- размер липидного ядра >40% от объема атероскеротической бляшки;
-
- толщина покрышки атероскеротической бляшки <65 мкм;
-
- степень и характер кальциноза атероскеротической бляшки;
-
- признаки воспаления атероскеротической бляшки;
-
- инфильтрация атероскеротической бляшки воспалительными клетками;
-
- активность металлопротеиназ покрышки атероскеротической бляшки;
-
- эрозии интимы непосредственно над атероскеротической бляшки / надрыв покрышки атероскеротической бляшки;
-
- локальная выработка оксида азота, анти-и прокоагуляционных соединений;
-
- поверхностная агрегация тромбоцитов и отложение фибрина (пристеночный тромбоз);
-
- повышенная неоваскуляризация интимы и адвентиции, прорастание vasavasorum;
-
- внутриатеромные геморрагии в атероскеротической бляшки.
Всеми исследователями признается, что наличие повышенного артериального давления служит причиной периферического атеросклероза. В частности, наличие артериальной гипертензии увеличивает риск развития периферического атеросклероза у мужчин в 2,5 раза, у женщин — в 3,9 раза [23].
По данным литературы, нередко коронарный атеросклероз сочетается с поражениями сосудов почек особенно при резистентном течении у них синдрома артериальной гипертензии [24].
В публикации Е. М. Евсикова и соавторами подчеркнуто, что у пациентов с атеросклеротическим поражением периферических артерий имеется высокий риск развития инфаркта миокарда, инсульта и т.д. [24].
По другим данным, у пациентов с ангиографическими признаками периферического атеросклероза и клинической симптоматикой хронической ишемии нижних конечностей также диагностировались признаки коронарного атеросклероза и ишемической болезни сердца — в 90% случаев, а данные о наличии церебрального атеросклероза и хронической ишемии головного мозга были получены у ~50% из них [25].
В ранее опубликованном исследовании продемонстрировано, что атеросклероз с кальцинозом аорты и ее крупных ветвей является распространенной патологией в современной популяции взрослого населения в Европе и США. Распространенность кальциноза аорты и ее крупных ветвей в общей популяции колеблется от 18% до 95-98% [26]. У пациентов с артериальной гипертензией как правило имеются и другие факторы, ускоряющие атеросклероз. Так, О. Д. Остроумова, М. Л. Максимов, О. В. Дралова и А. С. Ермолаева сообщают, что частое сочетание артериальной гипертензии и дислипидемии объясняется непосредственным влиянием гипер- и дислипидемии на тонус сосудов и, следовательно, уровень артериального давления [27]. Негативное влияние артериальной гипертензии на сосудистую стенку реализуется через повышение активности ренин-ангиотензин-альдостероновой системы (РААС). Ангиотензин II, как основной эффектор РААС, способствует развитию атеросклероза через стимуляцию ангиотензина 1 типа рецепторов. С другой стороны, ангиотензин II стимулирует окислительный стресс, поддерживает вазоконстрикторную роль пептидов путем увеличения биологического распада оксида азота, что может способствовать развитию атеросклероза путем окисления холестерина липопротеинов низкой плотности [28]. Вместе с тем, окислительный стресс частично запущенный ангиотензином II, усиливает экспрессию молекул адгезии, хемоаттрактантных соединений и провоспалительных цитокинов [29].
Дополнительно альдостерон увеличивает количество ангиотензина 1 типа рецепторов в сердечно-сосудистой системе и потенцирует эффекты РААС. Альдостерон играет немаловажную роль в развитии гипертрофии стенки сосудов и прогрессировании атеросклероза. Гиперактивация РААС стимулирует атерогенез, вазоконстрикцию и увеличивает содержание свободных радикалов, что способствует развитию как артериальной гипертензии, так и атеросклероза [28]. У лиц с артериальной гипертензией наблюдается активация ферментов липидного окисления. В свою очередь, окисленные формы липопротеинов низкой плотности участвуют в образовании из моноцитов и макрофагов пенистых клеток, формирующих вместе с липидными включениями ядро атеросклеротической бляшки. При наличии артериальной гипертензии и дислипидемии отмечается активация синтеза коллагена и фибронектина эндотелиальными клетками сосудов [30].
Следовательно, риск хронической ишемии головного мозга увеличивается. Ранее в целенаправленных публикациях сообщалось, что патоморфология атеросклеротической бляшки внутричерепных артерий имеет ряд особенностей. В частности у них выявляются фиброзные и фиброзно-липидные бляшки нередко с отложением ионов кальция и кровоизлияниями. Атеросклеротические бляшки локализуются в местах деления артерий, однако они могут обнаруживаться и по ходу основного ствола артерии [31].
Если атеросклеротическая бляшка нестабильна частые перепады артериального давления приводят к окклюзии главного ствола среднемозговой артерии с развитием ишемии корковых и подкорковых отделов [31]. У этой категории пациентов высокий риск отека головного мозга и нередко заканчивается неблагоприятным исходом. В случаи субклинического атеросклероза внутренней сонной артерии гипоперфузия головного мозга развивается медленно. Важно подчеркнуть, что при уменьшении церебрального кровотока вследствие субклинического каротидного атеросклероза успевают включаться коллатерали между корковыми ветвями среднемозговой, переднемозговой и заднемозговой артерии. В этих случаях очаги инфаркта локализуется в подкорковых зонах, при сохранности корковых отделов, и протекает без тяжелого отека головного мозга. Развитие более тяжелых проявлений ишемии может быть вызвано снижением системного артериального давления особенно у пожилых пациентов. В настоящее время явление хронической ишемии головного мозга можно заметить среди пациентов молодого и среднего возраста. Как правило, это пациенты уронефрологического профиля, где артериальная гипертензия протекает злокачественно, а проводимая антигипертензивная терапия не всегда обеспечивает достижение целевого уровня артериального давления. Накопленные результаты исследований в этой области демонстрируют тот факт, что лица с хронической болезнью почек часто имеют сочетанные факторы риска хронической ишемии головного мозга [32].
Ранее было показано, что у пациентов с хроническим гломерулонефритом структурные изменения каротидных артерий выявляются еще на додиализной стадии заболевания [33]. Отмечено, что лица мужского пола характеризовались гипо-протеинемией, субнефротической протеинурией, клинически значимой гипертриглицеридемией и более высокими показателями толщины каротидных артерий по сравнению с пациентами женского пола. В то же время лица женского пола демонстрировали достоверно худшие показатели периферической крови и почечной функции по сравнению с мужским. Установлена отрицательная корреляционная связь скорости клубочковой фильтрации с толщиной общей и внутренней сонной артерии в общей группе и в отдельно взятой группе мужчин. Результаты исследования свидетельствуют о том, что в целях предупреждения сосудистых осложнений в будущем, пациенты с хроническим гломерулонефритом на додиализной стадии хронической болезни почек нуждаются в исследовании каротидных артерий, а также во всестороннем анализе функции почек [33, 34]. Часто при субклиническом атеросклерозе каротидных артерий находит лакунарные инсульты, расположенный в глубинных отделах полушарий, а не в коре или ближайшем к ней подкорковом белом веществе.
Курение. По данным Всемирной организации здравоохранения загрязнение атмосферы городов взвешенными твердыми и жидкими частицами одним из факторов, способствующим развитию инсульта, а также росту осложнений от него [35, 36]. Общепризнанный значимый фактор риска в отношении хронической ишемии головного мозга. Никотин влияет на хеморецепторы синокаротидной зоны с рефлекторным возбуждением дыхания и повышением артериального давления, возбуждает Н-холинреактивные структуры надпочечников, увеличивая секрецию катехоламинов и, как правило, стимулирует симпатические ганглии [37]. В аналитическом обзоре Л. С. Манвелова и В. Е. Смирнова описываются отрицательное влияние курение на цереброваскулярную систему [38]. Так, патогенный эффект курения на клетки головного мозга заключается прежде всего изменения в составе крови. После вдыхания табачного дыма примерно через семь секунд никотин достигает клеток головного мозга, оказывая на них специфическое действие. Под влиянием табачного дыма и окиси углерода повышается артериальное давление, увеличивается частота сердечных сокращений, растет концентрация катехоламинов и свободных жирных кислот [39, 40]. Не менее важным является то, что курение может усилить агрегацию форменных элементов крови, тем самым ухудшить газотранспортную систему крови. У курящих женщин часто регистрируется эритроцитоз, тогда как, у курящих мужчин – гиперфибриногенемия. По данным различных авторов, при длительном курении снижается локальный церебральный кровоток и нарушается сердечная деятельность [41]. Курение приводит к стойкому сокращению мышечного слоя артерий, что способствует возникновению артериальной гипертензии и атеросклероза [42]. Вместе с тем, длительное курения провоцирует повышение концентрации общего холестерина и холестерина липопротеинов низкой плотности. Вызванная курением гипоксия замедляет деградацию холестерина липопротеинов низкой плотности в лизосомах, а также способствует пролиферации гладкомышечных клеток артерий. У пациентов с артериальной гипертензией и дислипидемией табакокурение значительно ухудшает общий прогноз. Хотя, взаимосвязь активного и пассивного курения остается не ясной. Исследования демонстрируют устойчивую связь между увеличением интенсивности воздействия табачного дыма и более высокими показателями развития атеросклероза сонной артерии [43]. Как отмечают исследователи, результат влияния курения на развитие атеросклероза может быть кумулятивным, пропорциональным уровню воздействия табачного дыма в течение всей жизни и, возможно, необратимым. При прекращении курения результат в отношении развития атеросклероза заключается в предотвращении процесса последующего накопления факторов воздействия. Долговременная экспозиция табачного дыма приводит к снижению синтеза оксида азота эндотелиальными клетками с одной стороны, и нарушению регуляции базального тонуса сосудов — с другой. В результате чего, у курильщиков значительно ослабляется эндотелий-зависимый вазодилатирующий эффект и антиатеросклеротическая защита сосудов. Наиболее чувствительным сегментом сосудистой системы к воздействиям курения является артериальная система. По отдельным данным, показана прямая связь между выраженностью поражения периферических сосудов: аорты, бедренной артерии, сонных артерий – с длительностью курения и количеством выкуренных сигарет [44]. Хотя все мы знаем, что чем раньше человек отказывается от курения, тем благоприятнее прогноз. Однако в реальной жизни человека, далеко не всегда бросают люди курить. Более интересным является тот факт, что после отказа от курения риск развития сердечнососудистых заболеваний снижается быстрее, чем риск развития болезни органов дыхания [45, 46]. Несколько лет назад, в территории Германии проведено исследование, целью которой являлось оценка влияния табачного дыма (пассивного курения) на риск развития инсульта. Показано, что каждый год пассивное курение может быть одной из причин 774 смертей вследствие инсульта и 1837 инсультов в Германии. Обращает на себя внимание тот факт, что в данном исследовании большее количество инсультов вследствие пассивного курения наблюдалось у женщин, чем у мужчин [47]. Надо сказать, что при длительном курении наиболее велик риск развития атеротромботического ишемического инсульта. Этот риск прямо зависит от количества выкуриваемых сигарет [42]. Примечательно, что риск ишемического инсульта у бросивших курить значительно снижался через 2–4 года после отказа от курения [48-50].
Риск развития стеноза каротидных артерий вследствие атеросклероза многократно повышается если имеется одновременное присутствие артериальной гипертензии, гиперхолестеринемии и курения. Не исключается, что у пациентов с хронической ишемией головного мозга количество циркулирующих эндотелиоцитов в крови повышается. Считается, что повреждения эндотелия сосудов сопровождается ростом уровня циркулирующих (десквамированных) эндотелиоцитов в крови. Совокупное влияние этих факторов риска на развитие инсульта продолжает изучаться. Обзор накопленной литературы свидетельствует о том, что, несмотря на широкое применение методов борьбы сосудистыми заболеваниями головного мозга, проблемы хронической ишемии головного мозга остается краеугольным камнем клинической неврологии. Прогноз пациентов с хронической ишемией головного мозга на всех этапах развития патологического процесса зависит, прежде всего, от коррекции артериальной гипертензии, прекращение курение и замедление прогрессирование системного атеросклероза.
Список литературы Хроническая ишемия головного мозга: от факторов риска до цереброваскулярных осложнений
- Virani S. S. et al. Heart disease and stroke statistics—2021 update: a report from the American Heart Association // Circulation. 2021. V. 143. №8. P. e254-e743. https://doi.org/10.1161/CIR.0000000000000950
- Скворцова В. И., Евзельман М. А. Ишемический инсульт. Орел, 2006.
- Антипенко Е. А., Густов А. В. Хроническая ишемия головного мозга современное состояние проблемы // Медицинский совет. 2016. №19. 38-43. https://doi.org/10.21518/2079-701X-2016-19-38-43
- Юсупов Ф. А., Нурматов Ш. Ж., Эрматова Ж. Б., Реджапова Н. А., Юлдашев А. А. Цереброваскулярные заболевания и коморбидность: проблемы нейропротекции // The Scientific Heritage. 2021. №61-2. С. 38-44. https://doi.org/10.24412/9215-0365-2021-61-2-38-44
- Huo Y., Li W., Webb R., Zhao L., Wang Q., Guo W. Efficacy and safety of sacubitril/valsartan compared with olmesartan in Asian patients with essential hypertension: A randomized, double-blind, 8-week study // The Journal of Clinical Hypertension. 2019. V. 21. №1. P. 67-76. https://doi.org/10.1111/jch.13437
- Ерина А. М., Ротарь О. П., Солнцев В. Н., Шальнова С. А., Деев А. Д., Баранова Е. И., Конради А. О., Бойцов С. А., Шляхто Е. В. Предгипертензия и кардиометаболические факторы риска (по материалам исследования ЭССЕ-РФ) // Артериальная гипертензия. 2017. Т. 23. №3. https://doi.Org/10.18087/cardio.2019.6.2595
- Полупанов А. Г., Концевая А. В., Халматов А. Н., Алтымышева А. Т., Суворова Е. И., Романова Т. А., Худяков М. Б., Шальнова С. А., Джумагулова А. С. Полупанов А. Г. и др. Распространенность артериальной гипертензии среди жителей малых городов и сельской местности Кыргызской республики: этнические особенности (по данным международного исследования "ИНТЕРЭПИД") // Кардиоваскулярная терапия и профилактика. 2013. Т. 12. №6. С. 4-8.
- Mancia G., Fagard R., Narkiewicz K., Redan J., Zanchetti A., Böhm M., Zannad F. 2013 Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the Management of Arterial Hypertension // Journal of hypertension. 2013. V. 31. №10. P. 1925-1938. https://doi.org/10.1097/HJH.0b013e328364ca4c
- Джунусбекова Г. А., Джусипов А. К., Ибакова Ж. О., Тундыбаева А. М., Сармасаева А. М. Скрининг артериальной гипертонии в сочетании с хронической обструктивной болезнью легких, стратификационных факторов риска их развития в репрезентативной выборке населения г. Алматы // Вестник АГИУВ. 2011. №2. С. 26-30.
- Соколова Л. Ю., Нугманов Д. С. Распространенность артериальной гипертензии у молодых по результатам обследования жителей Атырау // Medicus. 2017. Т. 3. №15. С. 36-39.
- Wang D., Wang J., Jin C., Ji R., Wang A., Li X., Zhao X. Asymptomatic extracranial artery stenosis and the risk of cardiovascular and cerebrovascular diseases // Scientific reports. 2016. V. 6. №1. P. 1-6. https://doi.org/10.1038/srep33960
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Муркамилова Ж. А., Юсупов Ф. А., Райимжанов З. Р., Счастливенко А.И. Факторы риска развития инсульта у пациентов с терминальной стадией хронической болезни почек: современное состояние проблемы // Казанский медицинский журнал. 2020. Т. 101. №6. C. 825-833. https://doi.org/10.17816/KMJ2020-825
- Остроумова О. Д., Ролик Н. Л., Ищенко К. А. Артериальная гипертония и первичная профилактика инсульта // Кардиоваскулярная терапия и профилактика. 2005. Т. 4. №4. С. 1620.
- Collins R., Peto R., MacMahon S., Godwin J., Qizilbash N., Hebert P., Fiebach N. H. Blood pressure, stroke, and coronary heart disease: part 2, short-term reductions in blood pressure: overview of randomised drug trials in their epidemiological context // The Lancet. 1990. V. 335. №8693. P. 827-838. https://doi.org/10.1016/0140-6736(90)90878-9
- Liu P., Wang Y., Hu H., Mao Y., Huang D., Li L. Change of muscle architecture following body weight support treadmill training for persons after subacute stroke: evidence from ultrasonography // BioMed research international. 2014. V. 2014. https://doi.org/10.1155/2014/270676
- Lehmann N., Villringer A., Taubert M. Colocalized White matter plasticity and increased cerebral blood flow mediate the beneficial effect of cardiovascular exercise on long-term motor learning // Journal of Neuroscience. 2020. V. 40. №12. P. 2416-2429. https://doi.org/10.1523/JNEUR0SCI.2310-19.2020
- Qi G., Zhang Y., Li Z., Mo H., Chen J. Detection of carotid intima and media thicknesses based on ultrasound B-mode images clustered with Gaussian mixture model // Eleventh International Conference on Graphics and Image Processing (ICGIP 2019). International Society for Optics and Photonics, 2020. V. 11373. P. 113730Q. https://doi.org/10.1117/12.2557259
- Aboyans V., Bjorck M., Brodmann M., Collet J. P., Czerny M., De Carlo M., Ricco J. B. Questions and answers on diagnosis and management of patients with Peripheral Arterial Diseases: a companion document of the 2017 ESC Guidelines for the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS) Endorsed by: the European Stroke Organisation (ESO) The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS) // European heart journal. 2018. V. 39. №9. P. e35-e41. https://doi.org/10.1093/eurheartj/ehx499
- Mach F., Baigent C., Catapano A. L., Koskinas K. C., Casula M., Badimon L., Wiklund O. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) // European heart journal. 2020. V. 41. №1. P. 111-188.
- Ойноткинова О. Ш., Дедов Е. И. Дислипидемия и ассоциированые метаболические заболевания // Архив внутренней медицины. 2011. Т. 1. №1. С. 67-73. https://doi.org/10.20514/2226-6704-2011-0-1-67-73
- Badawi N., Kurinczuk J. J., Keogh J. M., Alessandri L. M., O'Sullivan F., Burton P. R., Stanley F. J. Intrapartum risk factors for newborn encephalopathy: the Western Australian case-control study // Bmj. 1998. V. 317. №7172. P. 1554-1558. https://doi.org/10.1136/bmj.317.7172.1554
- Гаврилова Н. Е., Жаткина М. В., Метельская В. А., Руденко Б. А., Драпкина О. М. Методы оценки и возможности инструментальной диагностики субклинического атеросклероза коронарных артерий // Кардиоваскулярная терапия и профилактика. 2019. V. 18 №6. C. 136-141. https://doi.org/10.15829/1728-8800-2019-6-136-141
- TASC Steering Committee*, Jaff M. R., White C. J., Hiatt W. R., Fowkes G. R., Dormandy J., Norgren L. An update on methods for revascularization and expansion of the TASC lesion classification to include below-the-knee arteries: a supplement to the Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // Vascular Medicine. 2015. V. 20. №5. P. 465-478. https://doi.org/10.1177/1358863X15597877
- Евсиков Е. М., Вечорко В. И., Теплова Н. В., Жапуева М. Х., Артамонова Н. Г. Факторы и механизмы в развитии артериальной гипертензии у больных атеросклерозом артерий нижних конечностей // Кардиоваскулярная терапия и профилактика. 2019. V. 18. №1. C. 150-155. https://doi.org/10.15829/1728-8800-2019-1-150-155
- Norgren L., Hiatt W. R., Dormandy J. A., Nehler M. R., Harris K. A., Fowkes F. G. R. Inter-society consensus for the management of peripheral arterial disease (TASC II) // Journal of vascular surgery. 2007. V. 45. №1. P. S5-S67. https://doi.org/10.1016/jjvs.2006.12.037
- Wong N. D., Lopez V. A., Allison M., Detrano R. C., Blumenthal R. S., Folsom A. R., Criqui M. H. Abdominal aortic calcium and multi-site atherosclerosis: the Multiethnic Study of Atherosclerosis // Atherosclerosis. 2011. V. 214. №2. P. 436-441. https://doi.org/10.1016/j.atherosclerosis.2010.09.011
- Остроумова О. Д., Максимов М. Л., Дралова О. В., Ермолаева А. С. Артериальная гипертония и атеросклероз: как правильно выбрать антигипертензивные препараты // Трудный пациент. 2013. V. 7. №11. C. 16-20.
- Wang Y., Tikellis C., Thomas M. C., Golledge J. Angiotensin converting enzyme 2 and atherosclerosis // Atherosclerosis. 2013. V. 226. №1. P. 3-8. https://doi.org/10.1016/j.atherosclerosis.2012.08.018
- Айтбаев К. А., Муркамилов И. Т., Фомин В. В. Молекулярные механизмы старения: роль окислительного стресса и эпигенетических модификаций // Успехи геронтологии. 2019. V. 32. №1-2. C. 20-28.
- Kostov K., Halacheva L. Role of magnesium deficiency in promoting atherosclerosis, endothelial dysfunction, and arterial stiffening as risk factors for hypertension // International journal of molecular sciences. 2018. V. 19. №6. P. 1724. https://doi.org/10.3390/ijms19061724
- Сорокоумов В. А., Савелло А. В. Атеросклероз внутричерепных артерий: причины ишемического инсульта, диагностика и лечение // Неврология, нейропсихиатрия, психосоматика. 2014. №2. C. 50-55. https://doi.org/10.14412/2074-2711-2014-2S-50-55
- Муркамилов И. Т., Айтбаев К. А., Юсупов Ф. А. Скорость распространения пульсовой волны как новый фактор риска прогрессирования хронической болезни почек // Кардиоваскулярная терапия и профилактика. 2017. V. 16. №4. C. 83-87. https://doi.org/10.15829/1728-8800-2017-4-83-87
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Юсупов Ф. А. Субклиническое ремоделирование каротидных артерий при хроническом гломерулонефрите // Архивъ внутренней медицины. 2017. V. 7. №4. C. 300-305. https://doi.org/10.20514/2226-6704-2017-7-4-300-305
- Муркамилов И. Т. Роль ингибиторов ангиотензинпревращающего фермента в снижении сердечно-сосудистых и церебральных осложнений при хронической болезни почек: в фокусе периндоприл // Клиницист. 2020. V. 14. №3-4. C. 78-85. https://doi.org/10.17650/1818-8338-2020-14-3-4-K601
- Lim S. S., Vos T., Flaxman A. D., Danaei G., Shibuya K., Adair-Rohani H., Pelizzari P. M. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010 // The lancet. 2012. V. 380. №9859. P. 2224-2260. https://doi.org/10.1016/S0140-6736(12)61766-8
- Колпакова А. Ф. О связи между инсультом и загрязнением воздуха взвешенными частицами. Меры профилактики // Кардиоваскулярная терапия и профилактика. 2017. V. 16. №1. C. 96-99. https://doi.org/10.15829/1728-8800-2017-1-96-99
- Кваша Е. А. Курение и сердечно-сосудистые заболевания // Украинский кардиологический журнал. 2004. №6.
- Манвелов Л. С., Смирнов В. Е. Курение и нарушения мозгового кровообращения // Лечащий врач. 1998. №6. С. 22.
- Messner B., Bernhard D. Smoking and cardiovascular disease: mechanisms of endothelial dysfunction and early atherogenesis // Arteriosclerosis, thrombosis, and vascular biology. 2014. V. 34. №3. P. 509-515. https://doi.org/10.1161/ATVBAHA.113.300156
- Cheng Y. C., Sheen J. M., Hu W. L., Hung Y. C. Polyphenols and oxidative stress in atherosclerosis-related ischemic heart disease and stroke // Oxidative medicine and cellular longevity. 2017. V. 2017. https://doi.org/10.1155/2017/8526438
- Kubota K., Yamaguchi T., Abe Y., Fujiwara T., Hatazawa J., Matsuzawa T. Effects of smoking on regional cerebral blood flow in neurologically normal subjects // Stroke. 1983. V. 14. №5. P. 720-724. https://doi.org/10.1161/01.STR.14.5.720
- Неверовский Д. В. Курение и ишемический инсульт // Неврология, Нейропсихиатрия, Психосоматика. 2010. №4. C. 42-47.
- Парахонский А. П. Влияние курения на развитие атеросклероза // Успехи современного естествознания. 2009. №.9. С. 165-166.
- Арутюнов Г. П. Курение как фактор риска у пациентов с сердечно-сосудистыми заболеваниями. Что делать практикующему врачу сегодня и как формировать стандарт назавтра // Сердце. 2003. V. 4. №.4. C. 176-186.
- Davis J. W., Shelton L., Eigenberg D. A., Hignite C. E., Watanabe I. S. Effects of tobacco and non-tobacco cigarette smoking on endothelium and platelets // Clinical Pharmacology & Therapeutics. 1985. V. 37. №5. P. 529-533. https://doi.org/10.1038/clpt.1985.83
- Краликова Е., Кметова А. Влияние курения на здоровье, роль врачей в лечении табачной зависимости // Профилактическая медицина. 2010. V. 13. №6. C. 34-36.
- Heuschmann P. U., Heidrich J., Wellmann J., Kraywinkel K., Keil U. Stroke mortality and morbidity attributable to passive smoking in Germany // European Journal of Preventive Cardiology. 2007. V. 14. №6. P. 793-795. https://doi.org/10.7326/ACPJC-1993-119-1-027
- Kawachi I., Colditz G. A., Stampfer M. J., Willett W. C., Manson J. E., Rosner B., Hennekens C. H. Smoking cessation and decreased risk of stroke in women // Jama. 1993. V. 269. №2. P. 232-236. https://doi.org/10.1001/jama.1993.03500020066033
- Casano H. M., Tadi P., Ciofoaia G. A. Anterior cerebral artery stroke // StatPearls [Internet]. 2021. https://www.ncbi.nlm.nih.gov/pubmed/30726018
- Levin M. G., Klarin D., Assimes T. L., Freiberg M. S., Ingelsson E., Lynch J., Damrauer S. M. Genetics of smoking and risk of atherosclerotic cardiovascular diseases: a Mendelian randomization study // JAMA Network Open. 2021. V. 4. №1. P. e2034461-e2034461. https://doi.org/10.1001/jamanetworkopen.2020.34461


