Хроническая почечная недостаточность и ишемическая болезнь сердца.Медико-социальные аспекты
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов Ф.А., Райимжанов З.Р., Юсупова Т.Ф., Абдыкадыров М.Ш., Солижонов Ж.И., Боймуродов Й.Р., Абдибалиев И.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 6 т.11, 2025 года.
Бесплатный доступ
Хроническая почечная недостаточность (ХПН) представляет собой клинико-лабораторный и инструментальный комплекс, возникающий на фоне медленной и необратимой гибели нефронов. Ключевым лабораторным признаком ХПН является снижение скорости клубочковой фильтрации (СКФ) ≤ 60 мл/мин/1,73 м2. Анемия, гиперурикемия, гиперфосфатемия и артериальная гипертензия наиболее часто сопровождают течение ХПН. В этиологической структуре ХПН ведущие места занимают сахарный диабет 2-го типа (СД2), гипертоническая болезнь, хроническая сердечная недостаточность (ХСН) и интерстициальные нефропатии. Пациенты с ХПН входят в группу высокого и очень высокого сердечно-сосудистого риска. Распространенными клиническими вариантами поражения сердечно-сосудистой системы при ХПН являются: диастолическая дисфункция и гипертрофия левого желудочка, аритмии высоких градаций, ишемическая болезнь сердца (ИБС) и ХСН. Особенности патогенеза ИБС при ХПН заключаются в нарушении метаболизма липидов, фосфорно-кальциевого и пуринового обменов. У пациентов с ХПН анемия, протеинурия и артериальная гипертензия ускоряют развитие ИБС. При ХПН частые эпизоды ишемии миокарда сопровождаются накоплением в нём коллагена и развитием фиброза, что приводит к увеличению жесткости левого желудочка и диастолической дисфункции. При ангиографии пациентов с ХПН часто находят многососудистое, диффузное поражение коронарных артерий. На терминальной стадии ХПН отмечается выраженный кальциноз коронарных артерий. Морфологическим субстратом ИБС при ХПН является атеро- и артериосклеротическое поражение коронарных артерий. Тяжелый кальциноз коронарных артерий затрудняет процесс установки в них стента, а увеличенный миокард становится очень чувствительным к снижению уровня гемоглобина. В статье представлен клинический пример сочетания ХПН и ИБС на фоне СД2 у пожилого пациента.
Хроническая почечная недостаточность, ишемическая болезнь сердца, ишемия миокарда, анемия, фосфор, кальций, окислительный стресс
Короткий адрес: https://sciup.org/14132814
IDR: 14132814 | УДК: 616-06;616-01/09 | DOI: 10.33619/2414-2948/115/40
Текст научной статьи Хроническая почечная недостаточность и ишемическая болезнь сердца.Медико-социальные аспекты
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №6 2025
УДК 616-06;616-01/09
Стойкое снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73м2 рассматривается как начальная стадия хронической почечной недостаточности (ХПН), распространённость которой неуклонно растёт [1, 2].
Синдром ХПН сопровождает течение различных заболеваний внутренних органов и ассоциируется с повышенным риском развития неблагоприятных осложнений. Наличие ХПН ограничивает возможности применения ряда лекарственных препаратов и проведения отдельных методов рентгеновской визуализации в клинической практике. За последние пять лет значительно увеличилось число публикаций, подчёркивающих роль ХПН как независимого фактора неблагоприятного прогноза при сердечно-сосудистых, респираторных, ревматических и неврологических заболеваниях. Согласно данным литературы, в 2010 г распространённость ХПН возросла с 5% до 12% [3].
В настоящее время у отдельных популяций частота встречаемости синдрома ХПН достигает 27–30%.
Особенно высокая распространённость синдрома ХПН отмечается среди пациентов с сахарным диабетом 2-го типа (СД2), гипертонической болезнью (ГБ) и ишемической болезнью сердца (ИБС) [4, 5].
ХПН широко распространена среди лиц пожилого и старческого возраста. Клиникофункциональные особенности течения ХПН в сочетании с хроническими неинфекционными заболеваниями были освещены в ранее опубликованном нами исследовании [6, 7]. По имеющимся в настоящее время данным, в Кыргызской Республике численность пациентов с терминальной стадией ХПН превышает 3000 человек, при этом основным методом лечения остаётся программный гемодиализ. Только в 2024 г расходы Фонда обязательного медицинского страхования (ФОМС) Кыргызской Республики на обеспечение регулярных сеансов гемодиализа составили 2 230 800 000 сомов.
Ожидаемая продолжительность жизни пациентов, находящихся на программном гемодиализе, определяется совокупностью медицинских, социальных и экономических факторов. Многочисленные исследования демонстрируют, что пациенты с ХПН подвержены высокому риску сердечно-сосудистых заболеваний (ССЗ), включая стабильную и нестабильную стенокардию, инфаркт миокарда, злокачественные аритмии и/или блокады проводящей системы сердца, а также хроническую сердечную недостаточность (ХСН) [8, 9].
У пациентов с терминальной стадией ХПН существенно возрастает риск развития инсульта, преимущественно геморрагического типа. Согласно опубликованным данным, ХПН и ИБС являются важными причинами общей заболеваемости, смертности, утраты трудоспособности и снижения качества жизни [10, 11].
Несмотря на показания к реваскуляризации миокарда у больных с терминальной стадией почечной недостаточности, риск летального исхода и развития интра- и послеоперационных осложнений у данной категории пациентов остаётся значительно высоким.
По данным Российского кардиологического общества (РКО), в 2021 году в России от ССЗ умерли 933 986 человек, что составило 640,3 случая на 100 тыс. населения, или 38% всех летальных исходов [12].
Более половины этих случаев (54,4%) были обусловлены ИБС. Согласно оценкам исследователей, среди умерших от ИБС 15% составляли лица трудоспособного возраста, причём доля мужчин и женщин в этой группе составила 27% и 3% соответственно. По последним данным, в среднем каждая четвёртая смерть в России связана с осложнениями ИБС [12].
ИБС особенно часто регистрируется у мужчин в возрасте 40–65 лет. В развитых странах распространённость данного заболевания составляет 30–40 тыс. случаев на 1 млн населения [13].
Необходимо отметить, что в рутинной клинической практике диагноз ИБС у пациентов с ХПН устанавливается преимущественно на основании оценки сердечнососудистых факторов риска, а также общеклинических, инструментальных и лабораторных данных. Проведение селективной коронароангиографии с целью подтверждения диагноза ИБС и определения тактики медикаментозной коррекции проходимости инфаркт-связанной артерии у пациентов с ХПН осуществляется не всегда и не во всех специализированных центрах.
Использование нагрузочных тестов, таких как тредмил-тест и велоэргометрия, у данной категории больных ограничено вследствие наличия устойчивой к терапии артериальной гипертензии, анемии и нарушений минерально-костного обмена. В то же время, для пациентов с ХПН, находящихся на программном гемодиализе, проведение визуализирующих методов диагностики с использованием контрастных средств стало технически возможным. Медицинские и социальные аспекты ХПН и ассоциированной с ней ИБС представляют собой актуальную проблему XXI века для здравоохранения всех стран.
Клинический пример. Пациент А., 67 лет (1958 г.р.), житель сельской местности. В анамнезе — сахарный диабет 2 типа (СД2), диагностированный 4 года назад. Пероральные сахароснижающие препараты (производные сульфонилмочевины II поколения) принимает нерегулярно. Ранее эпизодов повышения артериального давления не отмечал.
Результат опросника по Роузе в течение последнего года — положительный. Ухудшение общего состояния стал отмечать в течение последних трёх месяцев.
В конце 2024 г перенёс кратковременный эпизод потери сознания. За короткий промежуток времени произошло значительное снижение массы тела: индекс массы тела (ИМТ) снизился с 30,9 до 20,3 кг/м². Сопутствующими симптомами стали общая мышечная слабость, повышенная утомляемость, боли в эпигастральной области и суставах. При плановом обследовании по данным гастроскопии выявлены признаки хронического неатрофического гастрита. При эхокардиографии (ЭхоКГ) острых (очаговых) патологических изменений не обнаружено. Аллергологический анамнез не отягощён. Эпидемиологический анамнез — без особенностей (Рисунок 1, 2, 3).
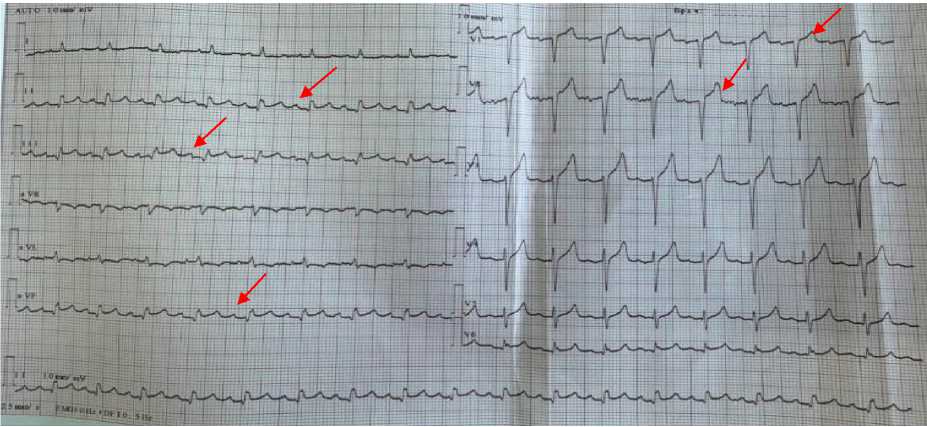
Рисунок 1. Электрокардиография пациента А., 67 лет. Ритм сердца синусовый, ЧСС 96 в минуту. Признаки гипертрофии левого предсердия. Гипертрофия правого желудочка S тип. Признаки рубцовых изменений перегородочной стенки и субэпикардиального повреждения нижней стенки левого желудочка
Пациент был госпитализирован в отделение реанимации, терапии и диагностики многопрофильного медицинского центра «DOC UNIVERSITY CLINIC» 25. 03. 2025 г. При объективном осмотре: положение активное, сознание ясное, на вопросы отвечает адекватно. Кожа и видимые слизистые сухие, бледные; отмечается сниженный тургор кожи. Частота дыхательных движений — 19 в минуту, сатурация кислорода в покое на атмосферном воздухе — 95%. Периферические отёки отсутствуют. Аускультативно дыхание над лёгкими жёсткое, хрипы не выслушиваются. Тоны сердца приглушены, ритм правильный, частота сердечных сокращений — 108 уд/мин, артериальное давление — 100/70 мм рт. ст. Живот мягкий, безболезненный при пальпации; печень и селезёнка не пальпируются.
При лабораторном обследовании: группа крови — 0 (I), резус-фактор положительный. Показатели общего анализа крови: гемоглобин (Hb) — 100 г/л, гематокрит (Ht) — 31,4%, эритроциты — 3,7×10¹²/л, тромбоциты — 599×10⁹/л, лейкоциты — 12,6×10⁹/л, лимфоциты — 22,9%, эозинофилы — 1,5%, скорость оседания эритроцитов (СОЭ) — 5 мм/ч. В динамике отмечено снижение Hb до 88 г/л, Ht — до 27,0%, эритроцитов — до 3,26×10¹²/л; тромбоциты — 561×10⁹/л, лейкоциты — 9,8×10⁹/л, лимфоциты — 32,6%, эозинофилы — 2,9%, СОЭ увеличилась до 68 мм/ч.
С учётом выявленной анемии и в соответствии с рекомендациями Научного общества нефрологов России были исследованы микроэлементы, участвующие в кроветворении. Уровень железа составил 7,35 мкмоль/л (референсные значения: 9,50–31,20 мкмоль/л), витамина B₁₂ — 988 пг/мл (180,0–900,0 пг/мл), фолиевой кислоты — 1,54 нг/мл (3,10–20,00 нг/мл).
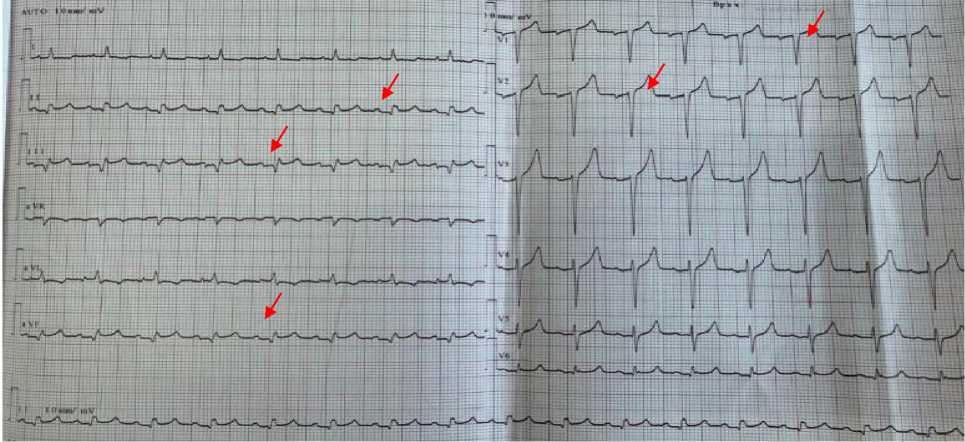
Рисунок 2. Электрокардиография пациента А., 67 лет в динамике лечения
Титр иммуноглобулина M оказался отрицательным, в то время как уровень иммуноглобулина G — повышенным (6,38 ед.). Активность печёночных трансаминаз оставались в пределах нормы, однако уровень гамма-глутамилтранспептидазы (ГГТП) был значительно повышен и составил 92 Ед/л (норма — до 49 Ед/л).
Активность щелочной фосфатазы также приближалась к верхней границе нормы — 153,7 Ед/л (референсные значения: 40,0–150,0 Ед/л).
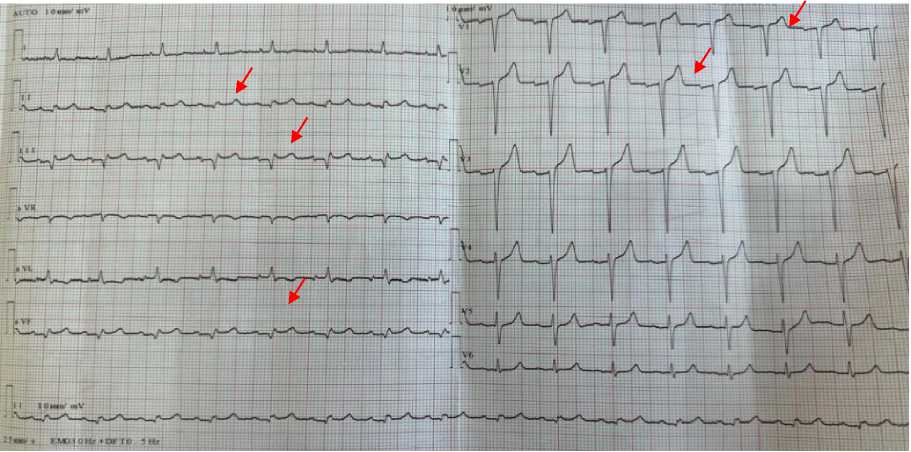
Рисунок 3. Электрокардиография пациента А., 67 лет в динамике лечения
Параметры липидного спектра крови: общий холестерин — 3,08 ммоль/л, холестерин липопротеинов высокой плотности (ЛПВП) — 0,65 ммоль/л, холестерин липопротеинов низкой плотности (ЛПНП) — 1,24 ммоль/л, триглицериды — 1,86 ммоль/л.
С-реактивный белок — 30,2 мг/л (норма до 8 мг/л), глюкоза венозной крови натощак — 7,38 ммоль/л, креатинин крови — 179 мкмоль/л, гомоцистеин — 18,9 мкмоль/л (референсные значения 3,40–20,40 мкмоль/л).
Расчётная СКФ: по формулам CKD-EPI — 33 мл/мин, MDRD — 35 мл/мин; клиренс креатинина по формуле Cockcroft–Gault — 26 мл/мин.
Электролитный состав крови: калий — 5,90 ммоль/л (3,60–5,50), кальций — 2,68 ммоль/л (2,20–2,55), натрий — 137 ммоль/л (130–155), фосфор — 1,61 ммоль/л (0,68–1,81).
Гормональный профиль щитовидной железы: ТТГ — 0,079 мМЕ/мл (0,40–4,00), тироксин — 0,72 нмоль/л (0,62–3,10), трийодтиронин — 115 нмоль/л (65,0–138), антитела к тиреоидной пероксидазе — 17,8 МЕ/мл (0,00–34,00).
В связи с изменениями на электрокардиограмме (Рисунок 1) был проведён анализ на кардиоспецифические тропонины: уровень тропонина I составил менее 0,1 нг/мл (норма 0,40–3,00 нг/мл).
Содержание D-димера — 0,34 мкг/мл (0,00–0,55), маркеры вирусов гепатита B, C и D — не обнаружены. Суточная экскреция белка с мочой составила 0,37 г.
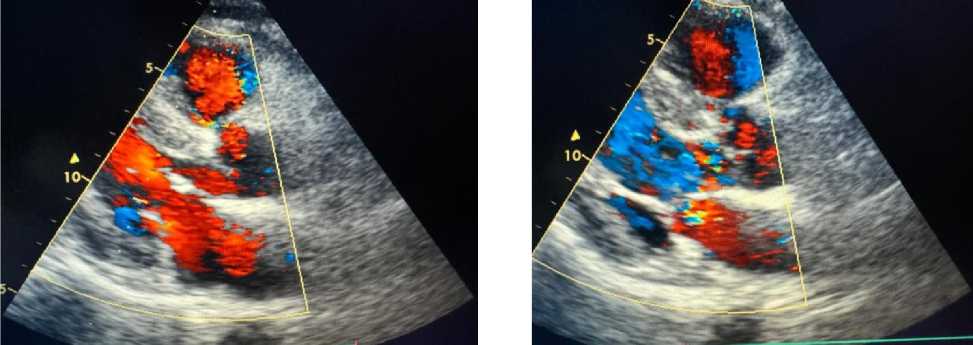
Рисунок 4. Эхокардиография пациента А., 67 лет
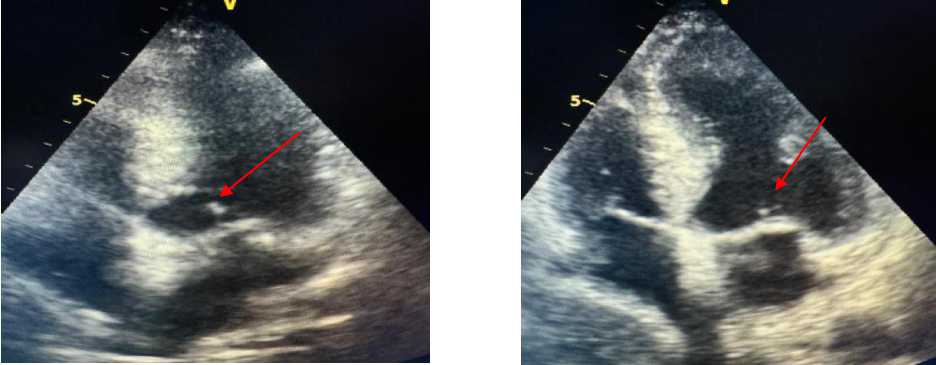
Рисунок 5. Эхокардиография пациента А., 67 лет
ЭхоКГ пациента А., 67 лет: выявлены увеличение линейного размера левого предсердия, атеросклеротические поражения аортального и митрального клапанов сердца, а также ассимметрическая гипертрофия левого желудочка и нарушение ее диастолической функции (Рисунок 4, 5‒8).
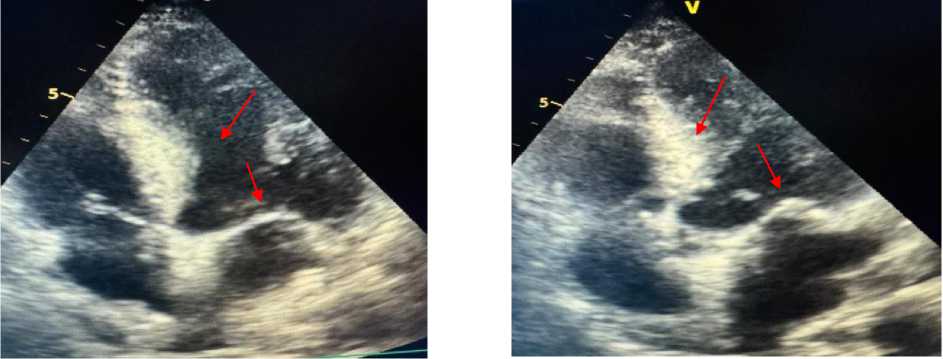
Рисунок 6. Эхокардиография пациента А., 67 лет
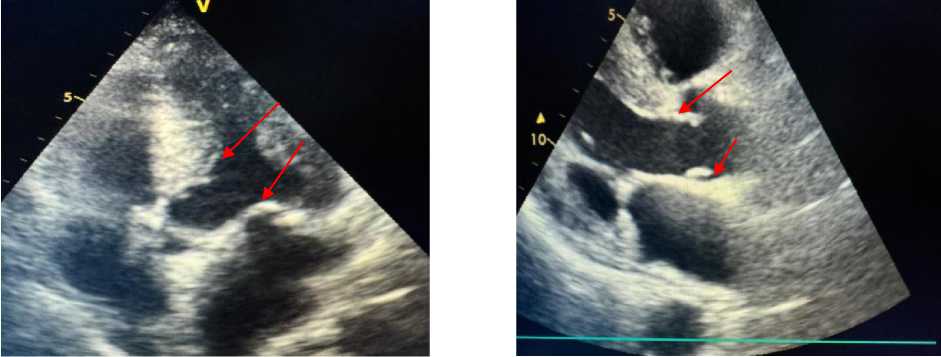
Рисунок 7. Эхокардиография пациента А., 67 лет
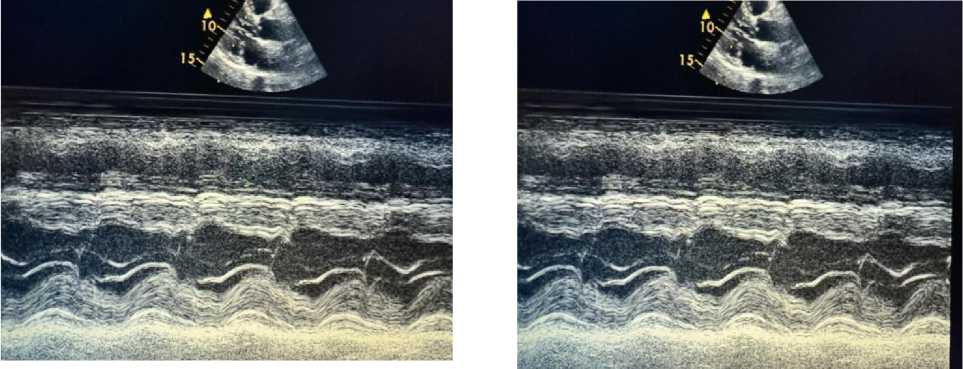
Рисунок 8. Эхокардиография пациента А., 67 лет
Инструментальные исследования. По данным ультразвуковой допплерографии каротидных и бедренных артерий выявлены признаки атеросклеротического поражения сосудов (Рисунок 9, 10–14).
При ультразвуковом исследовании органов брюшной полости визуализированы эхографические признаки желчнокаменной болезни (отключённый жёлчный пузырь), хронического панкреатита и хронического пиелонефрита. Кроме того, установлены наличие конкрементов в левой почке, аденоматоз и гиперплазия щитовидной железы, а также признаки хронического простатита.
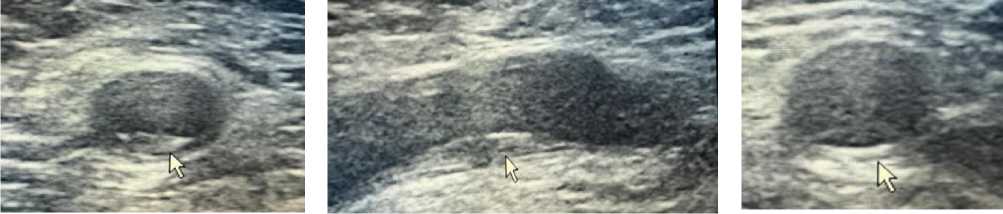
Рисунок 9. Атеросклеротические поражения общей сонной артерии пациента А., 67 лет
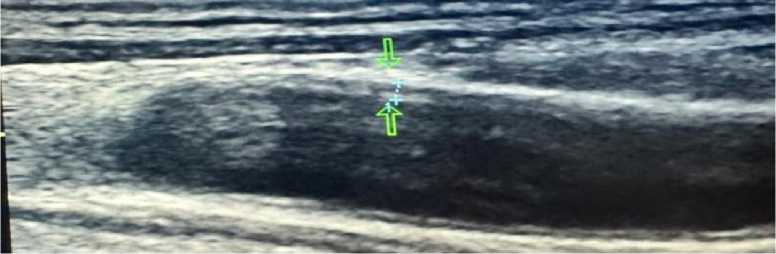
Рисунок 10. Атеросклеротические поражения общей бедренной артерии пациента А., 67 лет
Клинический диагноз: Хроническая почечная недостаточность, субклиническая стадия. ИБС. Нестабильная стенокардия. Постинфарктный кардиосклероз. Мультифокальный атеросклероз. Хронический гастрит в фазе неполной ремиссии.
Хронический панкреатит в фазе неполной ремиссии. Желчнокаменная болезнь. Хронический калькулёзный холецистит. Мочекаменная болезнь. Хронический вторичный пиелонефрит. Сахарный диабет 2-го типа, целевой уровень гликозилированного гемоглобина <7,5%. Хроническая болезнь почек (ХБП) смешанной этиологии.
Проведённое лечение: Изосорбида динитрат, β-адреноблокаторы, статины, антиагреганты, антикоагулянты, препараты железа, адеметионины. На фоне терапии отмечено улучшение показателей азотовыделительной функции почек.
Уровень креатинина крови снизился до 115 мкмоль/л. СКФ, рассчитанная по формулам CKD-EPI и MDRD, составила 56 мл/мин и 58 мл/мин соответственно.
Клиренс креатинина по формуле Cockcroft–Gault — 41 мл/мин. Калий — 4,90 ммоль/л, остаточный азот — 16,4 ммоль/л, мочевина — 4,50 ммоль/л, С-реактивный белок — 30,2 мг/л.
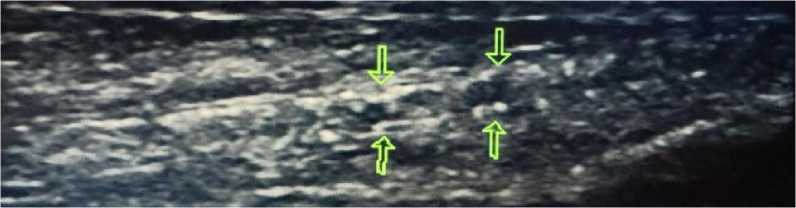
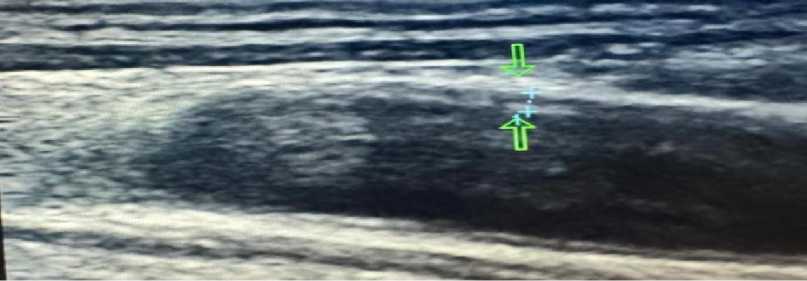
Рисунок 11. Атеросклеротические поражения артерий нижних конечностей пациента А., 67 лет
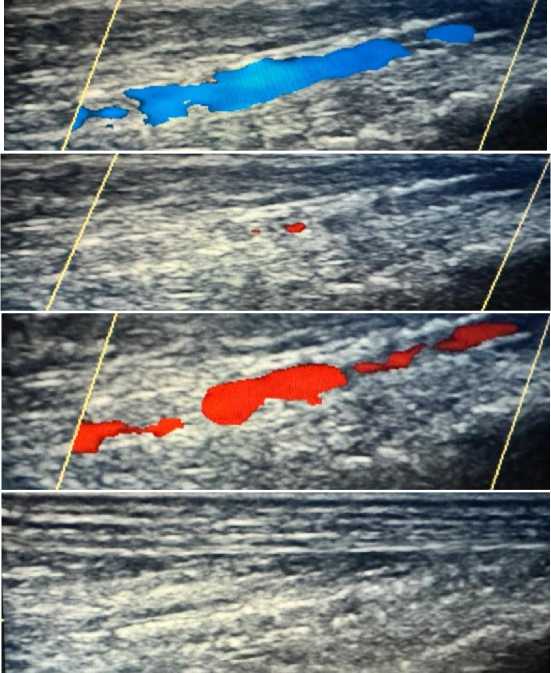
Рисунок 12. Атеросклеротические поражения артерий нижних конечностей пациента А., 67 лет
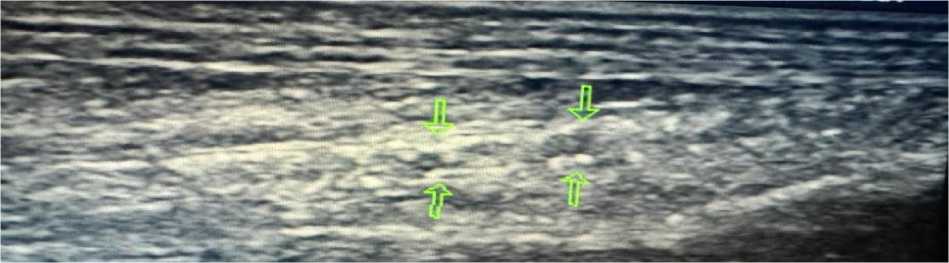
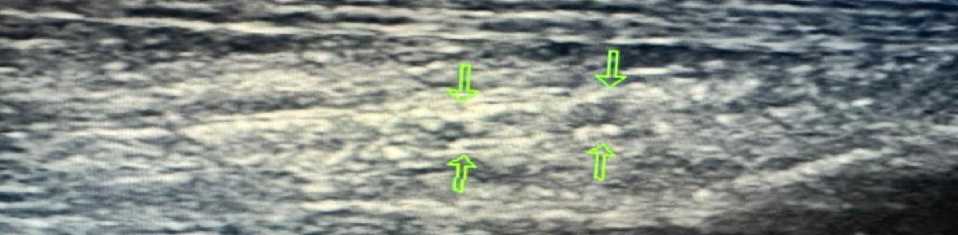
Рисунок 13. Атеро- и артериосклеротические поражения общей бедренной артерии пациента А., 67 лет
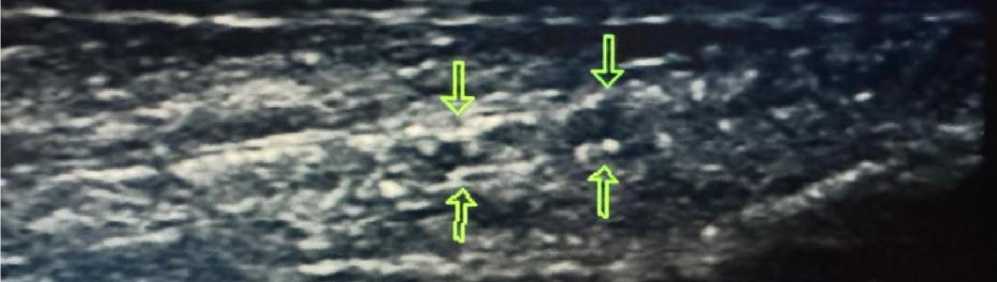
Рисунок 14. Атеро- и артериосклеротические поражения общей бедренной артерии пациента А., 67 лет
Обсуждение
В 1965 году Всемирная организация здравоохранения признала ИБС самостоятельным заболеванием. По данным исследований, развитие ИБС на фоне сопутствующих соматических состояний, таких как СД2, ХБП, анемия и артериальная гипертензия, утяжеляет клиническое течение заболевания, а также создает дополнительные трудности в диагностике и выборе тактики лечения данной группы пациентов вне зависимости от их возраста [14-16].
Согласно клиническим рекомендациям РКО, ИБС представляет собой поражение миокарда, обусловленное нарушением кровотока по коронарным артериям [12].
Ведущими причинами развития ИБС являются анатомический атеросклеротический и/или функциональный стеноз эпикардиальных сосудов, а также микрососудистая дисфункция [12].
Отмечается, что у пациентов с ХБП часто выявляются диффузные, многососудистые поражения коронарных артерий [17].
Как правило, течение ИБС у пациентов с терминальной стадией ХБП более тяжелое, а признаки ишемии миокарда по данным ЭКГ сохраняются длительное время. В большинстве случаев ишемические изменения на ЭКГ развиваются на фоне нарушений конечной части комплекса QRS, что связано с электролитными нарушениями, анемией и гипертрофией левого желудочка. В подобных ситуациях оправдано проведение динамического контроля сывороточной концентрации сердечных тропонинов и активности лактатдегидрогеназы.
Коронароангиография у пациентов с ИБС и ХБП выявляет уменьшение диаметра коронарных артерий по сравнению с пациентами, страдающими ИБС без почечной патологии. У нашего пациента к факторам риска развития ИБС относились мужской пол, возраст, ожирение, анемия, хронический стресс и ХБП.
Снижение коронарного резерва и первичное уменьшение кровотока вследствие атеросклеротического стеноза артерий лежат в основе патогенеза ишемии миокарда. У больных с ХБП часто наблюдается артериальная гипертензия, устойчивая к проводимой гипотензивной терапии.
Кроме того, анемия, развивающаяся на фоне ХБП, способствует увеличению частоты сердечных сокращений, что в сочетании с повышенным артериальным давлением усиливает метаболические потребности миокарда. Однако при наличии атеросклеротических изменений сосудистой стенки повышение коронарного кровотока невозможно, что приводит к возникновению эпизодов ишемии миокарда.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №6 2025
Клиницистам следует учитывать, что коронарный кровоток зависит от частоты сердечных сокращений (ЧСС), сопротивления коронарных сосудов и перфузионного давления, представляющего собой разность между диастолическим давлением в аорте и диастолическим давлением в полости левого желудочка. Потребность миокарда в кислороде определяется, в свою очередь, уровнем ЧСС, сократительной способностью миокарда и напряжением стенки левого желудочка [12].
Очевидно, что повышение любого из этих показателей приводит к увеличению кислородного потребления миокардом.
У пациента факторами риска сердечно-сосудистых осложнений являлись тахикардия (ЧСС 108 уд/мин в покое) и анемия (гемоглобин 100–88 г/л). С учётом выявленных изменений на ЭКГ (Рисунок 1–3) была проведена динамическая оценка уровня сердечных тропонинов, при этом концентрация тропонина I оказалась невысокой.
Следует отметить, что в клинической практике у пациентов с ХБП ЧСС нередко остается вне должного контроля. Более того, некоторые пациенты бесконтрольно принимают β-адреноблокаторы, и при их кумуляции в организме может быстро развиться брадиаритмия, что приводит к ухудшению ренального кровотока и снижению СКФ.
Вопросы остаточного сердечно-сосудистого риска у пациентов с ХБП остаются до конца не решёнными, что обусловлено вариабельностью и нестабильностью их метаболического профиля. У нашего пациента липидный спектр, за исключением гипоальфа-холестеринемии, существенных отклонений от нормы не выявил. Это могло бы служить ограничением к применению статинов, учитывая, что их основное фармакологическое действие направлено на коррекцию гиперхолестеринемии и атерогенной дислипидемии. Тем не менее, при назначении статинов в данном случае были также приняты во внимание их плейотропные эффекты, в частности, способность замедлять прогрессирование ХБП за счёт положительного влияния на сосудистый эндотелий.
Как уже отмечалось, в медицинской практике пациентам с ХБП на консервативно-курабельной стадии коронароангиография с целью верификации атеросклеротического стеноза коронарных артерий проводится не всегда. Между тем, использование коронароангиографического исследования у лиц с высоким и очень высоким сердечнососудистым риском, к которым относятся и пациенты с ХБП, позволяет установить наличие и степень обструкции коронарных артерий, а также определить целесообразность и адекватность различных тактических подходов к лечению. Кроме того, данный метод даёт возможность оценить эффективность проводимой терапии — в частности, выявить прогрессирование либо регрессирование атеросклеротических изменений коронарных сосудов.
Следует напомнить, что на стадии выраженного снижения СКФ у пациентов с ХБП в патогенез атеросклеротического стеноза коронарных артерий значительный вклад вносят минерально-костные нарушения. Повышение уровня фосфора в сыворотке крови и снижение синтеза кальцитриола приводят к структурной перестройке сосудистой стенки, включая коронарные артерии. Согласно отечественным и международным рекомендациям по ведению пациентов с нарушениями минерального обмена при ХБП (МКН-ХБП), потеря эластичности сосудов способствует ускорению пульсовой волны, что, в свою очередь, нарушает оксигенацию в капиллярном русле, повышает систолическое артериальное давление и способствует формированию гипертрофии и диастолической дисфункции миокарда левого желудочка [18].
Эти механизмы вполне объясняют изменения, выявленные при эхокардиографии у нашего пациента. Кроме того, при ХБП отложение фосфата кальция в атеросклеротических бляшках способствует стенозированию и тромбозу сосудов, увеличивая риск развития инфаркта миокарда и инсульта. Особенности патогенеза ИБС при ХБП включают в себя частые эпизоды так называемой «немой» ишемии миокарда. У пациентов с ХБП более длительные эпизоды ишемии способствуют накоплению коллагена и развитию миокардиального фиброза, преимущественно в стенках желудочков [19].
Это нарушает эластические свойства левого желудочка, затрудняет его наполнение и приводит к диастолической дисфункции. В дальнейшем прогрессирующая ишемия может вызвать гибернацию миокарда и развитие систолической дисфункции левого желудочка. Следует учитывать, что на терминальной стадии ХБП клинические проявления ИБС могут отсутствовать: ишемия миокарда нередко маскируется за проявлениями артериальной гипотонии и нарушениями ритма. Эти кардиальные изменения обуславливают необходимость восстановления коронарного кровотока, что может потребовать проведения чрескожного коронарного вмешательства.
Приведённые выше особенности патогенеза ИБС при ХБП существенно осложняют проведение стентирования коронарных артерий у таких пациентов, а отдалённые результаты аортокоронарного шунтирования оказываются менее благоприятными. По данным ряда исследователей, выраженный кальциноз значительно затрудняет имплантацию и фиксацию стента в просвете артерии, а диффузное обызвествление сосудистой стенки создаёт серьёзные технические препятствия при наложении дистальных анастомозов [20].
В работе Шенгелия Л. Д. и соавт. (2023) подробно рассмотрены патофизиологические особенности ИБС у пациента с терминальной стадией ХБП, а также продемонстрирована эффективность аортокоронарного шунтирования как метода лечения у данной категории больных [17].
Допустимые уровни сывороточного фосфора на консервативно-курабельной стадии ХБП составляют 0,87–1,49 ммоль/л, а щелочной фосфатазы — 53–128 Ед/л у мужчин и 42–98 Ед/л у женщин [21].
При этом практикующим врачам следует ориентироваться на референтные значения, установленные конкретной лабораторией, поскольку именно они являются целевыми для контроля минерального обмена у пациентов с ХБП на доконечном этапе. У нашего пациента был зафиксирован повышенный уровень общего кальция, скорректированного на альбумин (2,68 ммоль/л), что превышает референсные значения (2,1–2,5 ммоль/л или 8,4–10,0 мг/дл).
Повышение концентрации ионов кальция в миоплазме кардиомиоцитов в условиях ишемии и гипоксии может активировать мембраносвязанные фосфокиназы, что приводит к изменению фосфолипидного состава мембран и их проницаемости. Массовый вход ионов кальция в клетки миокарда рассматривается как один из ключевых патогенетических механизмов, вызывающих необратимые нарушения сократительной функции сердца на фоне коронарного атеросклероза и ишемии миокарда [22–26].
Даже у здоровых лиц кальциевая перегрузка кардиомиоцитов может провоцировать вазоспазм и эпизоды ишемии миокарда, регистрируемые при суточном мониторировании ЭКГ. Это связано с ролью кальция в поддержании высокого миогенного тонуса коронарных артерий и в функционировании кальций-зависимого механизма электромеханического сопряжения.
Согласно опубликованным данным, у пациентов с ИБС нередко выявляется повышенный уровень ионизированной фракции кальция в плазме крови, при этом прослеживается определённый параллелизм между концентрацией кальция и тяжестью клинического течения заболевания [27].
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №6 2025
Отмечается взаимосвязь между факторами риска ИБС и уровнем кальция: в частности, повышение ионизированного кальция коррелирует с интенсивностью окисления липидов [28, 29].
У пациентов с ХБП наблюдается выраженный окислительный стресс и активация продукции свободных радикалов, что играет важную роль в патогенезе как атеросклеротических, так и артериосклеротических поражений сосудистой стенки, способствуя ускоренному росту атеросклеротических бляшек и увеличению риска их разрыва. Снижение Hb <120 г/л у женщин и <130 г/л у мужчин считается диагностическим критерием нефрогенной анемии при наличии протеинурии и/или азотемии [30].
Обсуждая данные литературы и приведённый нами клинический случай, следует подчеркнуть, что анемия при ХПН оказывает значительное влияние не только на развитие ИБС, но и сохранение эпизодов ишемии миокарда, регистрируемых на ЭКГ и/или ЭхоКГ. Нарушение кислород-транспортной функции крови при нефрогенной анемии увеличивает риск развития систолической дисфункции левого желудочка. В ряде целенаправленных исследований показано, что при многососудистом поражении коронарных артерий наблюдаются наиболее низкие значения Hb, Ht, количества эритроцитов и их морфологических индексов [31].
Также установлено, что снижение уровня Hb на каждые 10 г/л является независимым и статистически значимым фактором риска развития ИБС и летального исхода [32], что указывает на повышенную чувствительность миокарда, изменённого при ХПН, к гипоксии.
Таким образом, сочетание ишемической болезни сердца и хронической почечной недостаточности представляет собой междисциплинарную проблему, требующую комплексного подхода к диагностике и лечению.
Двунаправленная патогенетическая связь между рено-метаболическими нарушениями и поражением сердечно-сосудистой системы сопровождается не только высоким риском кардиальных осложнений и значительными затратами на диагностику и лечение, но и ухудшением качества жизни и социальной адаптации пациентов. В этом контексте своевременное выявление и коррекция нарушений минерального обмена у пациентов с ХБП может способствовать замедлению прогрессирования ИБС и снижению риска сердечнососудистой смертности.
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.


