Хроническая тромбоэмболическая легочная гипертензия у пациента с ожирением и сахарным диабетом 2-го типа
Автор: Кливер Е.Н., Васильцева О.Я., Едемский А.Г., Гранкин Д.С., Зейналов Д.Ф., Чернявский А.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 3 т.36, 2021 года.
Бесплатный доступ
Метаболические нарушения представляют серьезную медико-социальную проблему и являются факторами риска развития тромбоэмболических осложнений. Нарушения как углеводного, так и жирового обмена способствуют повышению вязкости крови, создавая протромботические состояния, которые далеко не всегда объективно оцениваются медицинским персоналом. При этом множественная коморбидная патология обычно значительно утяжеляет прогноз. В статье представлен клинический случай рецидивирующего тромбоза правого предсердия (ПП) и устьев верхней (ВПВ) и нижней полых вен (НПВ) у пациента 39 лет с сахарным диабетом (СД) 2-го типа, ожирением, гипертонической болезнью, варикозной болезнью вен нижних конечностей.
Ожирение, сахарный диабет 2-го типа, тромбоэмболия легочной артерии, легочная эндартерэктомия, противотромботическая терапия
Короткий адрес: https://sciup.org/149139347
IDR: 149139347 | УДК: 616-056.257:616.379-008.64]-06:616.131-008.331.1-005 | DOI: 10.29001/2073-8552-2021-36-3-154-160
Текст научной статьи Хроническая тромбоэмболическая легочная гипертензия у пациента с ожирением и сахарным диабетом 2-го типа
Активный поиск факторов риска развития тромбоэмболии легочной артерии (ТЭЛА) продолжается. Рекомендации ESC 2014 г. были дополнены новыми параметрами, среди которых появились сахарный диабет (СД) и артериальная гипертония (АГ) [1]. Они сохранили cвои позиции и в Рекомендациях 2019 г. [2]. Накоплены убедительные данные, позволяющие утверждать, что влияние СД на развитие тромботических и тромбоэмболических событий не ограничивается артериальным руслом большого круга кровообращения, СД способствует развитию и венозной тромбоэмболии.
Ожирение – известный фактор риска развития ТЭЛА. Оно создает предпосылки для развития как АГ, так и нарушений углеводного обмена, в том числе СД 2-го типа [3–5].
В статье представлено клиническое наблюдение тромбоза правого предсердия (ПП) и устьев верхней (ВПВ) и нижней полых вен (НПВ) у пациента с ожирением и СД 2-го типа, рецидивировавшим после выполнения операции легочной эндартерэктомии [6, 7].
Клиническое наблюдение
Пациент М., 39 лет, в январе 2021 г. госпитализирован в ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России с жалобами на одышку при подъеме до 3-го этажа, периодически учащенное сердцебиение, отеки до середины голеней.
Anamnesis morbi
С 2018 г. наблюдался у эндокринолога по поводу ожирения 3-й степени и СД 2-го типа, принимал метформин. В анамнезе длительный стаж курения (около 20 лет). В 2019 г. впервые зафиксирована АГ. Работает водителем и грузчиком. Прием антигипертензивной терапии (пре-стариум 8 мг) и контроль артериального давления (АД) – регулярные. С этого же времени наблюдался амбулаторно у хирурга по поводу варикозной болезни вен нижних конечностей. В июле 2020 г. впервые отметил появление одышки при выполнении обычной нагрузки – подъеме на 3-й этаж, а также при ускорении ходьбы, снижение толерантности к физической нагрузке и учащенное сердцебиение при ее выполнении, появление отечности в области голеностоп к вечеру. Пациент обратился за медицинской помощью по месту жительства. В процессе обследования по данным эхокардиографии (ЭхоКГ) было выявлено повышение систолического давления в легочной артерии (СДЛА) до 65 мм рт. ст. Однако по данным ультразвукового дуплексного сканирования вен нижних конечностей признаков тромбоза не выявлено. С целью дообследо- вания была проведена мультиспиральная компьютерная томография с контрастированием легочной артерии (МСКТ-ангиопульмонография), где были выявлены признаки ТЭЛА. Медицинские документы пациента были направлены на заочную консультацию в НМИЦ им. акад. Е.Н. Мешалкина Минздрава России для решения вопроса о дальнейшей тактике ведения. На момент госпитализации он принимал варфарин (целевые уровни МНО достигнуты), лизиноприл, ивабрадин, верошпирон.
Данные физикального исследования:
Пациент повышенного питания (рост – 169 см, вес – 133 кг; индекс массы тела (ИМТ) – 46,5 кг/м2), подкожно-жировая клетчатка развита избыточно, больше в области живота. Температура тела 36,5 °C. Кожные покровы обычного цвета, умеренный цианоз губ и ногтевых пластин. Варикозное расширение вен на ногах. В области голеней умеренно выраженные трофические изменения кожи. При аускультации легких дыхание везикулярное, проводится по всем полям, хрипов нет. На момент госпитализации частота дыхательных движений (ЧДД) – 20 в минуту, сатурация кислорода (при атм. воздухе) – 95%.
Тоны сердца ритмичные, патологические шумы над областью сердца и сосудами шеи не выслушиваются. АД при измерении в положении сидя справа – 130/90 мм рт. ст., слева – 130/85 мм рт. ст. Живот увеличен в размерах за счет выраженного подкожно-жирового слоя, при пальпации мягкий, безболезненный во всех отделах. Печень перкуторно – по краю реберной дуги, пальпация недоступна ввиду выраженного абдоминального ожирения. Селезенка не пальпируется. Отеки до середины голеней. Физиологические отправления не нарушены.
Результаты комплексного клинико-инструментального обследования при госпитализации (общий и биохимический анализы крови, анализы крови на генетические полиморфизмы – генетическая панель и фолатный цикл) представлены ниже. При поступлении по данным общего анализа крови – гематокрит: 47,9%; гемоглобин: 168 г/л; эритроциты: 5,25 × 1012; тромбоциты: 269 × 109; лейкоциты: 10,22 × 109; нейтрофилы: 46,0%; нейтрофилы (палочкоядерные): 0%; лимфоциты: 44,4%; моноциты: 7,0%; эозинофилы: 1,9%; базофилы: 0,6%; лейкоцитарный индекс: 0,9. Биохимический анализ крови – АЛТ: 25,7 Ед/л; АСТ: 34,8 Ед/л ; глюкоза: 7,81 ммоль/л; креатинин: 98 мкмоль/л; мочевина: 4,7 ммоль/л; билирубин общий: 17,0 мкмоль/л. Д-димер не определялся, учитывая хроническое течение заболевания.
Гликемический профиль – 8.00 ч – 9,8 ммоль/л, 12.00 ч – 13,0 ммоль/л; 17.00 ч –16,4 ммоль/л; 21.00 ч – 21,4 ммоль/л.
Генетические полиморфизмы
Генетическая панель: Протромбин F2: 20210 G > A: нормальная гомозигота GG; Мутация Лейдена F5: 1691 G > A (Arg506Gln): нормальная гомозигота GG; Фактор XIII F13: G > T (Val34Leu): гетерозигота GT; Фибриноген FGB: -455 G>A: нормальная гомозигота GG; Альфа 2-интегрин ITGA2: 807 C > T (Phe224 Phe): нормальная гомозигота CC; Тромбоцитарный гликопротеин IIIA ITGB3: 1565 T > C (Leu33Pro): нормальная гомозигота TT; Ингибитор активатора плазминогена SERPINE1 (PAI-1): -675 5G > 4G: гетерозигота 4G5G.
Фолатный цикл: MTHFR: 677 C > T (Ala222Val): гетерозигота CT; MTHFR: 1298 A > C (Glu429Ala): нормальная гомозигота AA; MTR: 2756 A > G (Asp919Gly): нормальная гомозигота AA; MTRR: 66 A > G (lle22Met): гетерозигота AG. Гомоцистеин: 6,12 (норма: 5,4616,2)
Таким образом, у пациента выявлены генетические полиморфизмы по 13-му фактору (фактор Лаки - Лоранда) и PAI-1 в виде гетерозиготного носительства; по фо-латному циклу – по метилентетрагидрофолатредуктазе и метионин-синтазе-редуктазе. Указанные полиморфизмы являются маркерами нарушений системы фибринолиза и предрасположенности к венозным тромбозам.
Электрокардиограмма: ритм синусовый, правильный, частота сердечных сокращений - 74 в минуту; электрическая ось сердца: не отклонена. Неполная блокада правой ножки пучка Гиса. Признаки перегрузки ПП (рис. 1).
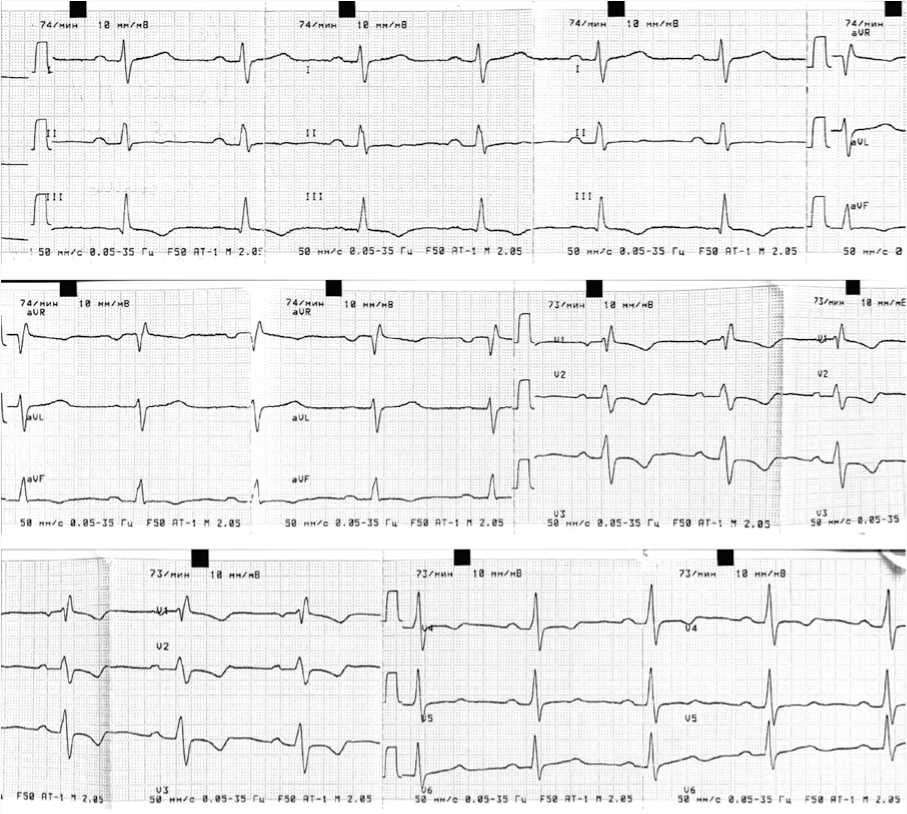
Рис. 1. Электрокардиограмма
Fig. 1. Electrocardiogram
По данным ЭхоКГ – увеличены правые отделы сердца. Гипертрофия миокарда левого желудочка (ЛЖ). Глобальная сократимость ЛЖ не нарушена. Фракция выброса -63%. Зон нарушения кинеза не выявлено. Диастолическая функция ЛЖ не нарушена. В полости ПП лоцируется подвижное эхогенное образование размерами ~1,4 х 1,6 х 2,5 см, возможно, исходящее из ВПВ - (тромб?). Пра вый желудочек (ПЖ): Конечный диастолический объем -57 мл, фракционное изменение площади (ФИП) является прогностическим предиктором - 39%, TAPSE (систолическая экскурсия плоскости трикуспидального кольца) -1,9 см. Хирургические риски возрастают при снижении ФИП и TAPSE менее 1,6 см. У пациента по данным ЭхоКГ -ФИП в норме (39%), TAPSE – норма (1,9 см.) Аорта не расширена. Стенки и корень аорты плотные. Створки аортального и митрального клапанов уплотнены неравномерно, хорошо подвижны. Митральная регургитация 1-й степени, незначительная по объему. Трикуспидальная регургитация 1-й степени, незначительная по объему. Расчетное среднее давление в легочной артерии – 53,4 мм рт. ст. Свободная жидкость в плевральных полостях и полости перикарда не определяется (рис. 2).
По данным ангиопульмонографии с тензиометрией малого круга кровообращения, – окклюзия сегмен- тарных ветвей нижнедолевой левой легочной артерии. Устьевые стенозы А4 сегментарных ветвей с обеих сторон.
Пристеночный, подострый, эксцентричный тромб в правой легочной артерии, сразу дистальнее устья верхнедолевой ветви, стенозирование просвета до 50%. Давление в легочной артерии – 63/25/36 мм рт. ст. Сердечный выброс 6,87 л/мин, сердечный индекс – 2,9 л/мин/м2, легочное сосудистое сопротивление – 314 дин*с/см5 (рис. 3).
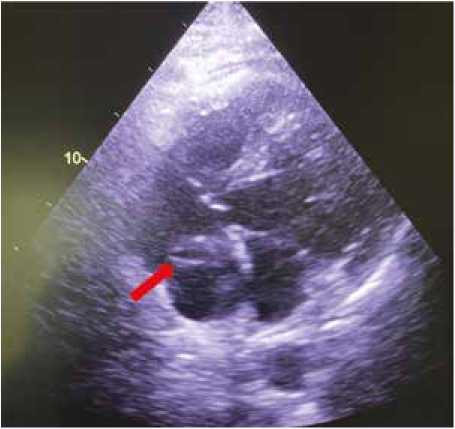
Рис. 2. Тромб в правом предсердии по данным трансторакальной эхокардиографии. Указан стрелкой Fig. 2. Transthoracic echocardiography image with the red arrow indicating thrombus in the right atrium
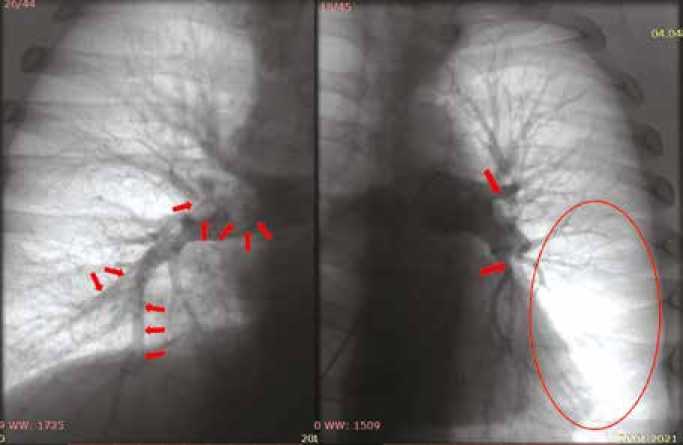
Рис. 3. Ангиопульмонография. Окклюзионно-стенотическое поражение легочной артерии указано стрелками
Fig. 3. Pulmonary angiography. Occlusive-stenotic lesion of the pulmonary artery is indicated by the arrows
Учитывая полученные клинико-инструментальные и лабораторные данные, пациенту выставлен диагноз. Основное заболевание: Хроническая тромбоэмболическая легочная гипертензия. ТЭЛА от 07.2020 г. Фоновое заболевание: 1. Варикозная болезнь нижних конечностей. Посттромбофлебитический синдром. Хроническая венозная недостаточность 2-й степени. 2. Гипертониче- ская болезнь 3-й стадии, достигнутая степень АГ 1. Ожирение 3-й степени.
Сахарный диабет 2-го типа, целевой HbА1с менее 7,5%, фактический HbA1c 12,5%. Риск 4. ХСН IIА стадии, функциональный класс 2 (NYHA).
Сопутствующее заболевание: Хронический гастрит, ремиссия.
С учетом полученных клинико-инструментальных данных обследования пациенту было выполнено хирургическое лечение в объеме легочной эндартерэктомии и тромбэктомии из полости ПП и ВПВ [6].
Ранний послеоперационный (п/о) период протекал с явлениями сердечно-легочной недостаточности, постгипоксической энцефалопатии. Зафиксированы пароксизмы фибрилляции предсердий, ритм восстановлен с использованием кордарона. На фоне комплексной терапии в отделении реанимации и интенсивной терапии состояние пациента было стабилизировано, что позволило перевести его в общее отделение. В палате проводилась инсуффляция увлажненного кислорода, терапия сердечной недостаточности, а также лечение, направленное на восстановление дренажной функции бронхов, коррекцию АГ и уровня гликемии, антитромботическая терапия. В динамике явления дыхательной недостаточности уменьшились, сатурация без инсуффляции увлажненным кислородом – 96%. Гемодинамика стабильная, нарушения ритма сердца далее не повторялись. В стационаре пациенту назначена диета, соответствующая наличию СД 2-го типа, однако он не придерживался рекомендаций. С целью коррекции повышенного уровня гликемии в послеоперационном периоде проводилась инсулинотерапия по согласованию с эндокринологом. Пациент получал антикоагулянтную терапию. Учитывая высокий риск тромбоза ввиду обширной легочной эндартерэктомии, пациенту в раннем п/о периоде был назначен фраксипарин в лечебной дозе 0,6 п/к утро и вечер, после отключения пациента от искусственной вентиляции легких (ИВЛ) – начало приема варфарина с коррекцией дозы препарата на фоне фраксипарина по достижению целевого МНО (целевое МНО 2,5–3,5). После достижения целевого МНО фраксипарин был отменен. [4, 5, 8]. Уровень азотемии сохранялся в пределах референсных значений, выделительная функция почек на фоне стимуляции диуретиками сохранялась.
В динамике, по данным п/о ЭхоКГ контроля, зафиксированы признаки тромбов в полости ПП и устьях ВПВ и НПВ на 11-е сут после операции, несмотря на проводимую антикоагулянтую терапию. Показатели МНО колебались в пределах целевых значений (2,5–3,5). Учитывая флотирующие тромбы в ПП из ВПВ и НПВ с высоким риском тромбоэмболических осложнений, через 20 дней после первой операции пациенту по жизненным показаниям выполнено повторное хирургическое вмешательство – тромбэктомия из ПП и устьев полых вен в условиях искусственного кровообращения. П/о период протекал в дальнейшем без осложнений. Продолжена антикоагулянтная терапия фраксипарином, дополненная антиагрегантной терапией, по согласованию с гемостазиологом – клопидо-грел 75 мг 1 р/д. При выписке рекомендовано продолжить длительный прием варфарина в подобранной по уровню целевого МНО (2,5–3,5) дозе – 5 мг, клопидогрела – 75 мг 1 р/д в течение 6 мес. после операции. Дальнейшая коррекция антиагрегантной и антикоагулянтной терапии под контролем гемостазиолога по месту жительства.
Инсулинотерапия впоследствии была отменена в связи с нормализацией гликемии на фоне соблюдения пациентом рекомендаций по диете и возобновления приема метформина. При неоднократном контроле ЭхоКГ (рис. 4) в динамике данных за дополнительные образования в правых отделах сердца и устьях ВПВ и НПВ не обнаружено, пограничные значения давления в легочной артерии п/о (среднее давление в легочной артерии – 24,6 мм рт. ст.).
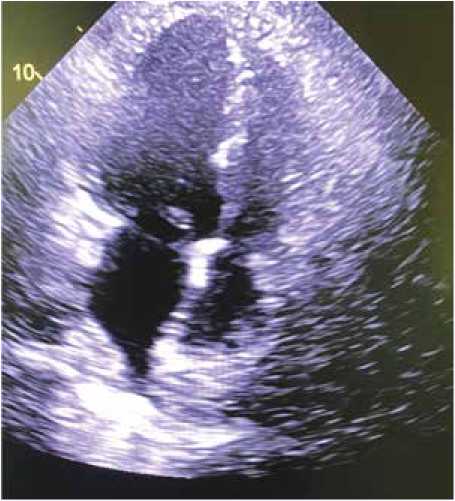
Рис. 4. Эхокардиография перед выпиской из стационара Fig. 4. Echocardiography before hospital discharge
Постепенное расширение двигательной нагрузки в пределах отделения переносил удовлетворительно. На 19-е сут после операции пациент был выписан в стабильном состоянии с рекомендациями продолжения регулярной анатикоагулянтной терапии, динамического контроля гликемии и приема сахароснижающей терапии.
Выводы
Ожирение и СД, наряду с другими факторами риска ТЭЛА, создают условия для развития тромбозов различной локализации и ТЭЛА с формированием в ряде случаев хронической тромбоэмболической легочной гипертензии. Наиболее вероятными причинами развития тромбоза ВПВ и ПП могут являться наличие коагулопатии, обширная легочная эндартерэктомия, центральный венозный катетер. Назначение непрямого орального антикоагулянта при выполнении легочной эндартерэктомии предпочтительно ввиду возможности строгого контроля гипокоагуляции (достижение целевого значения МНО 2,5–3,5), препятствующее образованию тромбина, формированию фибринового сгустка и, следовательно, развитию и прогрессированию тромбообразования, особенно в раннем п/о периоде. Согласно Евразийским рекомендациям по диагностике и лечению хронической тромбоэмболической легочной гипертензии, препаратом выбора для длительной антикоагулянтной терапии является антагонист витамина К – варфарин. Новые антикоагулянты не рекомендуются в связи с отсутствием доказательной базы.
В связи с этим важно своевременное назначение оптимальной медикаментозной терапии, включающей антитромботические препараты, с достижением необходимого уровня коагуляции, а также устранение и/или коррекция имеющихся факторов риска. Особое значение в отношении прогноза имеет приверженность пациентов к проводимому лечению.
Список литературы Хроническая тромбоэмболическая легочная гипертензия у пациента с ожирением и сахарным диабетом 2-го типа
- Konstantinides S.V., Torbicki A., Agnelli G., Danchin N., Fitzmaurice D., Galie' N. et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur. Heart J. 2014;35(43):3033-3080. DOI: 10.1093/eurheartj/ehu283
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.-J., Harjola V.-P., Huisman M.V. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur. Heart J. 2020;41(4):543-603. DOI: 10.1093/eurheartj/ehz405
- Васильцева О.Я., Ворожцова И.Н., Карпов Р.С. Многогранность факторов риска венозной тромбоэмболии. Врач. 2014;8:5-9.
- Galie' N., Humbert M., Vachieryc J.-L., Gibbs S., Lang I., Torbicki A. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur. Heart J. 2016;37(1)1:67-119. DOI: 10.1093/eurheartj/ehv317
- Мордовин В.Ф., Пекарский С.Е., Семке Г.В., Рипп Т.М., Фальковская А.Ю., Ситкова Е.С. и др. Использование современных медицинских технологий для диагностики и лечения больных артериальной гипертонией. Сибирский журнал клинической и экспериментальной медицины. 2015;30(2):29-35. DOI: 10.29001/2073-8552-2015-30-229-35
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., Азизов В.А., Акчурин Р.С., Аншелес А.А. и др. Евразийские рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (2020). Евразийский кардиологический журнал. 2021;(1):6-43. DOI: 10.38109/2225-1685-2021-1-6-43
- Едемский А.Г., Иванов С.Н., Кливер Е.Н., Новикова Н.В., Галстян М.Г., Севастьянов В.В. и др. Путь пациента от острой тромбоэмболии легочной артерии до хронической тромбоэмболической легочной гипертензии: вопросы диагностики и лечения. Терапевтический архив. 2019;91(8):108-114. DOI: 10.26442/00403660.2019.08.000316
- Венгеровский А.И. Фармакология: учебник. М.: ГЭОТАР-Медиа; 2020:848.


