Идентификация патогенных грибов в луковицах чеснока при хранении и в корневой сфере в период роста растений резюме
Автор: Филюшин Михаил Александрович, Данилова Ольга Александровна, Середин Тимофей Михайлович
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 3 (59), 2021 года.
Бесплатный доступ
Актуальность, материал и методика. Потери урожая сельскохозяйственных культур связаны не только с развитием болезней в процессе вегетации, но и при послеуборочном хранении. Чеснок является популярной овощной и пряно-ароматической культурой во многих странах мира. Значительные потери урожая чеснока при выращивании и хранении связаны с грибными патогенами, наиболее вредоносными из которых являются представители рода Fusarium. В Московской области поражение посевов чеснока фузариозом проявляется ежегодно, но с различной интенсивностью. В Федеральном научном центре овощеводства (ФНЦО) было показано, что гнили и увядание растений чеснока вызывается комплексом патогенных грибов, включающим преимущественно различные виды Fusarium. При этом соотношение видов Fusarium в патогенном комплексе изменяется от года к году, регистрируются новые виды Fusarium и их расы. Целью данной работы было определение грибных фитопатогенов, вызывающих сухую гниль зубков чеснока при послеуборочном хранении. Для проведения работы из хранилища ФНЦО были взяты луковицы чеснока сортов Дубковский и Стрелец. Результаты. В результате визуального осмотра были выявлены зубки с симптомами сухой гнили. Пораженные ткани зубков были помещены на картофельно-декстрозный агар для получения грибных колоний. Анализ морфолого-культуральных признаков грибных изолятов, а также нуклеотидных последовательностей четырех участков ДНК (спейсеры ITS, гены EF1а, RPB1 и RPB2) показал, что возбудителем сухой гнили зубков чеснока является патогенный гриб Fusarium proliferatum. Дополнительно в полевых условиях была проведена идентификация на основе анализа последовательностей спейсеров ITS и гена EF1 афитопатогенных грибов, обитающих в корневой зоне растений чеснока. В результате в корневой сфере сортов чеснока были обнаружены два вида грибов рода Fusarium (F. proliferatum и F. oxysporum f. sp. oepae), а также виды Rhizoctonia solani, Volutella rosea и Ceratobasidium sp.
Чеснок, фузариозная гниль, сухая гниль
Короткий адрес: https://sciup.org/140257587
IDR: 140257587 | УДК: 632.4:635.262 | DOI: 10.18619/2072-9146-2021-3-105-109
Текст научной статьи Идентификация патогенных грибов в луковицах чеснока при хранении и в корневой сфере в период роста растений резюме
Forcitations: Filyushin M.A., Danilova O.A., Seredin T.M. Identification of pathogenic fungi in garlic bulbs during storage and in the root zone during plant growth. Vegetable crops of Russia. 2021;(3):105-109. (In Russ.)
Ч еснок ( Allium sativum L.) – одна из важнейших овощных культур рода Allium L. (сем.
A maryllidaceae). Ежегодное мировое производство чеснока составляет более 30 млн т,при этом большая часть чеснока (28 млн т) выращивается в Азии . В России чеснок также является популярной овощной и пряно-ароматической культурой, ежегодно производится около 200 тыс. т .
Значительные потери урожая чеснока при выращивании и хранении связаны с грибными патогенами, наиболее вредоносными из которых являются грибы рода Fusarium Link. К роду Fusarium относятся разнообразные по типу питания виды грибов, способные поражать культурные и дикорастущие растения на любом этапе развития [1,2]. Эти грибы широко распространены в почвах во всех климатических зонах и вызывают корневые гнили и/или увядание у многих сельскохозяйственных культур [3]. Также виды Fusarium продуцируют различные типы микотоксинов, представляющее опасность для здоровья человека [4].
Грибы рода Fusarium вызывают гниль луковиц и/или увядание листьев чеснока [5]. Потери урожая от данных заболеваний могут составлять до 100% [6]. Ранее считалось, что у чеснока и других видов Allium гниль луковиц и увядание вызывается специфичным изолятом F. oxysporum f. sp. cepae . Однако в настоящее время известно,что данное заболевание могут вызывать и другие виды Fusarium – F. acu-tatum, F. anthophilium и F. proliferatum [2,7]. При послеуборочном хранении потери урожая чеснока связаны с развитием на зубках сухой гнили (dry rot), вызываемой патогенным грибом F. proliferatum [8,9].
В Московской области поражение посевов чеснока фузариозом проявляется ежегодно, но с различной интенсивностью [6]. Сотрудниками Федерального научного центра овощеводства (ФНЦО) было показано, что число и соотношение видов грибов рода Fusarium в патогенном комплексе изменяется от года к году, регистрируются новые виды и расы патогена,ранее не отмеченные в Московской области [6,10]. Наличие в фитопато-генном комплексе в посевах чеснока грибов других родов ( Botrytis, Alternaria и др.) усиливает вредоносность видов Fusarium [6].
Сухая гниль зубков чеснока при послеуборочном хранении в ФНЦО отмечается ежегодно, однако видовая идентификация патогенов, вызывающих данное заболевание, ранее не проводилась. Поэтому целью работы была морфологическая и молекулярная идентификация грибных фитопатоге-нов,вызывающих гниль зубков чеснока при послеуборочном хранении в Федеральном научном центре овощеводства (Московская обл.).
Материалы и методы
Для проведения исследования в январе 2020 года из лукового хранилища Федерального научного центра овощеводства (55.6549 45, 37.200148; Московская обл.) были взяты по 4 луковицы чеснока озимого сортов Дубковский и Стрелец. Для идентификации грибных фитопатогенов в корневой зоне растений чеснока в июле 2020 года на опытном участке ФНЦО (55.654945, 37.200148 ) было выкопано по два растения чеснока сортов
Поднебесный, Сармат, Дубковский и Стрелец. По данным многолетних полевых наблюдений в ФНЦО, сорта чеснока Дубковский и Стрелец восприимчивы к фузариозной гнили в процессе вегетации, в годы эпифитотий гибель растений составляет 15-30%.При послеуборочном хранении на зубках чеснока сортов Дубковский и Стрелец отмечено развитие сухой гнили. Сорта чеснока Поднебесный и Сармат относятся к группе относительно устойчивых к фузариозной гнили сортов,при послеуборочном хранении развитие сухой гнили обнаруживается редко.
Для получения грибных колоний ткани с признаками гнили дезинфицировали 70% этанолом (3 мин), промывали стерильной водой, помещали в чашки Петри с картофельно-декстрозным агаром (PDA) с добавлением ампициллина (1 мг/мл) и инкубировали при 22°C в темноте; через 6 дней анализировали морфологию грибных колоний. Морфологическая характеристика грибных колоний и микрофотографии конидиеносцев и конидий выполнены на световом микроскопе Jenaval (Германия) c фотоприставкой CarlZ eiss426126 сотрудниками Группы экспериментальной микологии ФИЦ Биотехнологии РАН. Тест на патогенность выделенного грибного изолята проводили согласно [11]. Эксперимент проводили в двух повторах. После инокуляции зубки инкубировали на чашках Петри с PDA в темноте при 23°C и относительной влажности 100%, через 5 дней проводили оценку состояния зубков чеснока.
Для оценки влияния выделенного грибного изо-лята на рост и развитие растений чеснока зубки чеснока сорта Стрелец были высажены в стерильный грунт и помещены в экспериментальную установку искусственного климата (ЭУИК, ФИЦ Биотехнологии РАН) со следующими условиями: день/ночь – 16/8 ч, 22/16°С, освещенность – 19 0 мкМ/(м2 с).
Для определения видового состава грибных фитопатогенов на препаратах ДНК из грибных изо-лятов амплифицировали и секвенировали последовательности внутренних транскрибируемых рибосомальных спейсеров (ITS), генов фактора элонгации трансляции 1α (EF1а) и субъединиц 1 и 2 ДНК-зависимой РНК полимеразы II (RPB1 и RPB2). Для амплификации и секвенирования использовали стандартные праймеры ITS1/ITS4 [12], EF1/EF2 [13], RPB1-F5/RPB1-R8 [14] и fRPB2-5F/fRPB2-7cR [15]. Полученные ПЦР-продукты ожидаемой длины очищали с помощью QIAEX® II Gel Extraction kit (QIAGEN, Германия), клонировали в плазмидный вектор pAL2T (набор Quick-TA kit, ЗАО «Евроген») и секве-нировали на капиллярном секвенаторе A BI Prism 3700 D NA A nalyzer (ЦКП Биоинженерия, ФИЦ Биотехнологии РАН). Выравнивание и анализ полученных нуклеотидных последовательностей проводили в программе MEGA7.0 . Видовую идентификацию грибных патогенов проводили на основе анализа нуклеотидных последовательностей в программе M LST .
Результаты и обсуждение
В результате визуального осмотра взятых из хранилища ФНЦО луковиц чеснока сортов Дубковский и Стрелец на отдельных зубках (1-4 зубка в каждой луковице)обоих сортов были обнаружены коричне-
SOjjm
. 50 ym
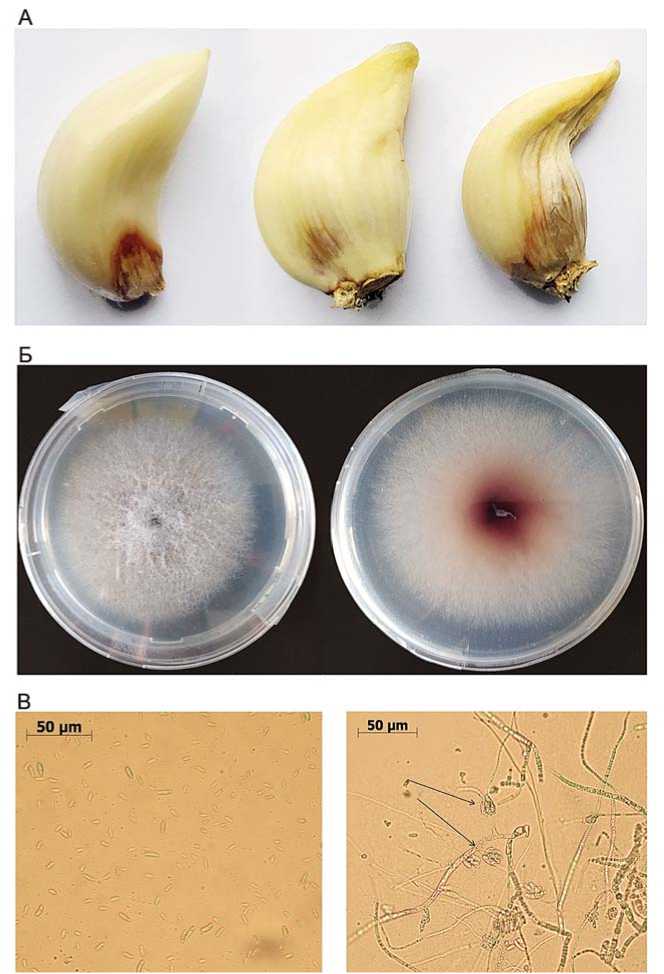
Рис. 1. А – Зубки чеснокас признаками фузариозной гнили из хранилища Федерального научного центра овощеводства; Б – морфология колонии гриба Fusarium proliferatum на среде PDA (10 суток,слева – вид сверху,справа – вид снизу);В – микроконидии (слева) и конидиеносцы (справа)с собранными в ложные головки микроконидиями (указано стрелками). Fig. 1. A –Garlic cloves exhibiting symptom caused byFusarium proliferatum infection during storage in FederalScientific Vegetable Center;Б – 10-days old F. proliferatum colonyon PDA including upper(left)and reverse surface (on the right);В – The F. proliferatum microconidia (left)and hyphae with microconidia collected in false heads (indicatedbyarrows).

Рис.2. Внешний вид зубков чеснока (слева)сорта Стрелец после проведения теста на патогенность выделенного нами изолята гриба F. proliferatum из хранилища ФНЦО. Справа – зубок через 14 дней теста на патогенность с обильной колонизацией мицелием F. proliferatum на корнях.
Fig. 2. Garlic cv. Strelets cloves (left)afterthe pathogenicitytestofthe F. proliferatum isolate from FSVC storage.
Right– a clove after14 days ofpathogenicitytestwith abundantcolonization ofF. proliferatum mycelium on the roots.

Рис. 3. Внешний вид растений чеснока сорта Стрелец,зараженных патогенным грибом
F. proliferatum (слева)и продольный разрез нижней части растения (справа)
Fig. 3. Garlic plants cv. Strelets after infected the pathogenic fungus F. proliferatum (left)and a longitudinal section ofthe lowerpartofthe garlic plant(right)
вые пятна (рис. 1А), характерные при поражении чеснока фузариозной сухой гнилью [8,11]. Ткани с признаками гнили были вырезаны с четырех зубков чеснока (2 – сорт Дубковский, 2 – сорт Стрелец) и помещены на среду PDA. После 6 дней инкубации все четыре изолята продуцировали обильный воздушный белый мицелий, выделяя в среду пурпурный пигмент (рис. 1Б). Грибные изоляты формировали многочисленные одноклеточные микроконидии (длина 4.1-11.6 мкм, ширина 1.3-3.4 мкм) (рис. 1С) и малочисленные макроконидии с 3-4 перегородками (длина 21-26 мкм, ширина 3-4 мкм). Культурально-морфологические признаки изолятов соответствуют представителям рода Fusarium [16].
Для точной видовой идентификации выделенных грибных патогенов на препаратах ДНК, выделенных из
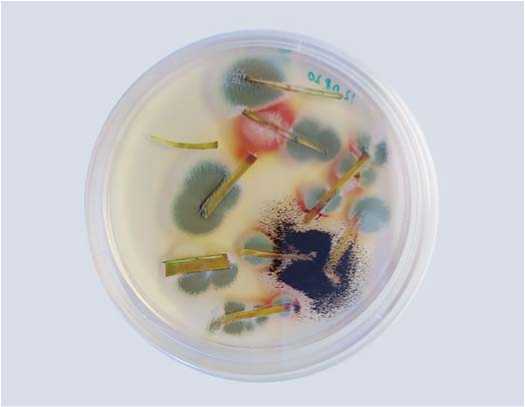
Рис. 4. Колонии грибов,выросшие из тканей листа больных фузариозом растений чеснока сорта Стрелец
Fig. 4. Colonies offungigrown from leaftissues ofFusarium – infected garlic plants (cv. Strelets)
всех четырех изолятов были амплифицированы и сек-венированы последовательности спейсеров ITS, участки генов EF1а, RPB1 и RPB2. Данные последовательности наиболее часто используются для молекулярной идентификации видов Fusarium [14]. Полученные первичные последовательности ДНК всех трех генови ITS спейсеров у анализируемых четырех изолятов были идентичны, что свидетельствует о том, что данные изоляты принадлежат одному виду. Проведенный последующий анализ полученных последовательностей в программе MLST выявил высокое сходство (98.8-99.8%) с различными изолятами вида Fusarium proliferatum (NRRL 13582, 13598 и др.).
Был проведен тест на патогенность выделенного нами изолята F. proliferatum . Тест на патогенность проводили согласно [11] путем замачивания 10 здоровых зубков чеснока (сорт Стрелец) в суспензии конидий гриба в течение 24 ч. Через 5 дней инкубации у зубков, обработанных суспензией конидий, появились желто-коричневые пятна и белый мицелий (в области донца), что является характерными симптомами фузариозной гнили (рис. 2). На контрольных зубках симптомов фузариоза не наблюдалось.
Оставшиеся после теста на патогенность зубки чеснока сорта Стрелец, инфицированные конидиями F. proliferatum, были высажены в стерильный грунт и помещены в теплицу с целью оценки влияния F. prolife-ratum на рост и развитие растений чеснока. Через 30 дней наблюдали практически полное усыхание надземной части растений и значительное разрушение тканей луковицы и корней, донце имело рыхлую структуру и желто-коричневую окраску (рис. 3). На листьях больных растений было заметно развитие вторичных грибных инфекций.Ткани листьев были помещены на среду PDA. Выросшие из тканей листьев больных растений чеснока грибные колонии на основе анализа нуклеотидных последовательностей спейсеров ITS и гена EF1а были идентифицированы как F. proliferatum
(белый мицелий, выделяющий красный пигмент в среду), Aspergilus niger (черные колонии) и Penicillium sp. (зеленые колонии) (рис. 4).
Дополнительно в полевых условиях была проведена идентификация фитопатогенных грибов, обитающих в корневой зоне растений чеснока. Для этого в июле 2020 года на опытном поле ФНЦО (55.654945, 37.200148) было выкопано по два растения чеснока сортов Поднебесный, Сармат, Дубковский и Стрелец.
Из корней растений каждого сорта были выделены препараты общей ДНК, на которых были амплифици-рованы, а затем клонированы спейсеры ITS и фрагмент гена EF1а. По пять клонов для каждого анализируемого локуса у всех четырех сортов были секвени-рованы. Анализ полученных последовательностей с помощью программы BLASTn позволил выявить в корневой сфере анализируемых сортов чеснока два вида Fusarium (F. proliferatum и F. oxysporum f. sp. сepae), а также грибы Rhizoctonia solani, Volutella rosea и Ceratobasidium sp. Последовательности спей-серов ITS и гена EF1а гриба F. proliferatum из корневой зоны сортов чеснока были идентичны последовательностям изолята F. proliferatum, выделенного нами из больных зубков чеснока из хранилища ФНЦО.
Сухая гниль чеснока во всем мире является проблемой послеуборочного хранения, потери урожая от этого заболевания могут достигать 30% [9 ]. Патогенный гриб F. proliferatum идентифицирован как основной возбудитель сухой гнили зубков чеснока во многих странах мира [8 ,9 ]. Эффективных средств защиты чеснока против F. proliferatum к настоящему времени не существует [9]. В данной работе было определено, что гниль зубков чеснока при хранении в Федеральном научном центре овощеводства также вызывается грибом F. proliferatum . Нами была опубликована заметка о первой идентификации гриба F. proliferatum на культуре чеснока в России [17]. Анализ растений чеснока, собранных в период вегетации,позволил определить,что грибы F. proliferatum и F. oxysporum присутствует в растениях чеснока в процессе роста, а при послеуборочном хранении в очагах сухой гнили детектируется только F. proliferatum . Интересно отметить, что в чесночных хозяйствах в Италии также наблюдается сходная картина распространения видов Fusarium : в посевах были выявлены виды F. proliferatum и F. oxysporum , а при послеуборочном хранении возбудителем сухой гнили зубков является F. proliferatum [18].
Об авторах:
Aboutthe authors:
Mikhail A. Filyushin – Cand. Sci. (Biology), Senior Researcher lab. Systems Biology of Plants, Federal Research Center of Biotechnology RAS, ,
Olga A. Danilova – Cand. Sci. (Biology), Senior Researcher group
[Seredin T.M., Gerasimova L.I., Kozar E.G., Engalycheva I.A., Baranova E.V. Harmfulness of mycosiss on culture of garlic winter-annual in the conditions of Moscow region. Vegetable crops of Russia. 2018;(6):84-90. (In Russ.) ]
Список литературы Идентификация патогенных грибов в луковицах чеснока при хранении и в корневой сфере в период роста растений резюме
- Ma L.J., Geiser D.M., Proctor R.H., Rooney A.P., O'Donnell K., Trail F., Gardiner D.M., Manners J.M., Kazan K. Fusarium pathogenomics. Annu Rev Microbiol. 2013;(67):399-416. https://doi.org/10.1146/annurev-micro-092412-155650.
- Kalman B., Abraham D., Graph S., Perl-Treves R., Meller Harel Y., Degani O. Isolation and Identification of Fusarium spp., the Causal Agents of Onion (Allium cepa) Basal Rot in Northeastern Israel. Biology (Basel). 2020;9(4):69. https://doi.org/10.3390/biology9040069
- Summerell B.A. Resolving Fusarium: Current Status of the Genus. Annu Rev Phytopathol. 2019;(57):323-339. https://doi.org/10.1146/annurev-phyto-082718-100204
- Gagkaeva T., Gavrilova O., Orina A., Lebedin Y., Shanin I., Petukhov P., Eremin S. Analysis of Toxigenic Fusarium Species Associated with Wheat Grain from Three Regions of Russia: Volga, Ural, and West Siberia. Toxins (Basel). 2019;11(5):252. https://doi.org/10.3390/toxins11050252.
- Rout E., Nanda S., Joshi R.K. Molecular characterization and heterologous expression of a pathogen induced PR5 gene from garlic (Allium sativum L.) conferring enhanced resistance to necrotrophic fungi. EurJPlantPathol. 2016;(144):345–360. https://doi.org/10.1007/s10658-015-0772-y
- Середин Т.М., Герасимова Л.И., Козарь Е.Г., Енгалычева И.А., Баранова Е.В. Распространение и вредоносность микозов на культуре чеснока озимого в условиях Московской области. ОвощиРоссии. 2018;(6):84-90. https://doi.org/10.18619/2072-9146-2018-6-84-90 [Seredin T.M., Gerasimova L.I., Kozar E.G., Engalycheva I.A., Baranova E.V. Harmfulness of mycosiss on culture of garlic winter-annual in the conditions of Moscow region. Vegetable crops of Russia. 2018;(6):84-90. (In Russ.) https://doi.org/10.18619/2072-9146-2018-6-84-90]
- Gálvez L., Urbaniak M., Waśkiewicz A., Stępień L., Palmero D. Fusarium proliferatum – Causal agent of garlic bulb rot in Spain: Genetic variability and mycotoxin production. Food Microbiology. 2017;(67):41-48. https://doi.org/10.1016/j.fm.2017.05.006
- Moharam M.H.A., Farrag E.S.H., Mohamed M.D.A. Pathogenic fungi in garlic seed cloves and first report of Fusarium proliferatum causing cloves rot of stored bulbs in upper Egypt. Archives of Phytopathology and Plant Protection. 2013;(46):2096-2103. https://doi.org/10.1080/03235408.2013.785122
- Mondani L., Chiusa G., Battilani P. Chemical and biological control of Fusarium species involved in garlic dry rot at early crop stages. European Journal of Plant Pathology. 2021;(7). https://doi.org/10.1007/s10658-021-02265-0
- Тимина Л.Т., Енгалычева И.А. Комплекс патогенов на овощных культурах в условиях Центрального региона РФ. ОвощиРоссии. 2015;(3-4):123-129. https://doi.org/10.18619/2072-9146-2015-3-4-123-129 [Timina L.T., Engalicheva I.A. Complex of pathogenes on vegetable crops in condition of central region of Russia. Vegetable crops of Russia. 2015;(3-4):123-129. (In Russ.) https://doi.org/10.18619/2072-9146-2015-3-4-123-129]
- Leyronas C., Chrétien P.L., Troulet C., Duffaud M., Villeneuve F., Morris C.E., Hunyadi H. First Report of Fusarium proliferatum Causing Garlic Clove Rot in France. Plant Disease. 2018;(102):2658 https://doi.org/10.1094/PDIS-06-18-0962-PDN
- White T.J., Bruns T., Lee S., Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, pp. 315–322 in M.A. Innis, D.H. Gelfand, J.J. Sninsky (Eds):PCR Protocols. A Guide to Methods and Applications. Academic Press, San Diego (USA) 1990.
- O'Donnell K., Kistler H.C., Cigelnik E., Ploetz R.C. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies. Proc Natl Acad Sci USA. 1998;95(5):2044-2049. https://doi.org/10.1073/pnas.95.5.2044
- O'Donnell K., Sutton D.A., Rinaldi M.G., Sarver B.A., Balajee S.A., Schroers H.J., Summerbell R.C., Robert V.A., Crous P.W., Zhang N., Aoki T., Jung K., Park J., Lee Y.H., Kang S., Park B., Geiser D.M. Internet-accessible DNA sequence database for identifying fusaria from human and animal infections. J Clin Microbiol. 2010;48(10):3708-3718. https://doi.org/10.1128/JCM.00989-10.
- Liu Y.J., Whelen S., Hall B.D. Phylogenetic relationships among ascomycetes: evidence from an RNA polymerse II subunit. Mol Biol Evol. 1999;16(12):1799-808. https://doi.org/10.1093/oxfordjournals.molbev.a026092
- Leslie J.F., Summerell B.A. The Fusarium Laboratory Manual. Blackwell Publishing, Oxford, UK. 2006. https://doi.org/10.1002/9780470278376
- Anisimova O.K., Seredin T.M., Danilova O.A., Filyushin M. First Report of Fusarium proliferatum Causing Garlic clove Rot in Russian Federation. Plant Disease. 2021. (In press) https://doi.org/10.1094/PDIS-12-20-2743-PDN
- Mondani L., Chiusa G., Battilani P. Fungi Associated with Garlic During the Cropping Season, with Focus on Fusarium proliferatum and F. oxysporum. Plant Health Progress. 2021;22(1):37-46. https://doi.org/10.1094/PHP-06-20-0054-RS


