Идентификация возбудителей туберкулеза лабораторных животных с помощью спектрофотометрии
Автор: Околелов В.И., Золотова Н.С.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 4 (48), 2022 года.
Бесплатный доступ
Для успешного проведения профилактических и оздоровительных мероприятий против туберкулеза важное теоретическое и практическое значение имеет идентификация возбудителей туберкулеза, в том числе и атипичных микобактерий, которые могут быть причиной псевдо- и парааллергических реакций. Традиционные методы не всегда пригодны для точного и достоверного определения бактериального патогена. С помощью приборов нового поколения, в том числе спектрофотометров, которые просты в использовании, подразумевают автоматизацию процесса и компьютерное сопровождение исследований, вносится существенный вклад в решение данной проблемы. С применением спектрофотометрии механизмы фотохимических изменений в клетке возможно изучить на молекулярном уровне. В работе рассмотрены вопросы сравнительной эффективности спектрофотометрии и традиционных методов (культурально-морфологические, биохимические, биологические свойства изучаемых культур микобактерий) идентификации микобактерий. Определение спектров гемолизата проводили на морских свинках, давших отрицательные результаты на ППД туберкулин. В экспериментальных целях было сформировано пять групп животных: четыре, зараженные микобактериями различных видов, и одна - контрольная. Морских свинок первой группы инфицировали штаммом 8 Mycobacterium bovis, второй группы - штаммом 14 Mycobacterium bovis, третьей группы - штаммом 9 Mycobacterium avium, четвертой группы - Mycobacterium smegmatis. Параллельно со спектрофотометрией выводили лейкоцитарную формулу. Полученные данные свидетельствуют о том, что с помощью спектрофотометрии прижизненный диагноз устанавливается значительно быстрее (в течение нескольких часов), чем с применением общепринятых методов, проведение которых требует длительного периода (2-3 мес).
Микобактерии, спектры поглощения, гемолизат крови, гематология, атипичные микобактерии
Короткий адрес: https://sciup.org/142236101
IDR: 142236101 | УДК: 619:616-002.5/072 | DOI: 10.48136/2222-0364_2022_4_147
Текст научной статьи Идентификация возбудителей туберкулеза лабораторных животных с помощью спектрофотометрии
По отечественным и зарубежным литературным данным установлено, что при туберкулезе важную роль играет диагностика не только прижизненная, но и послеубой-ная [1–4]. Основой прижизненной диагностики является внутрикожная туберкулиновая проба. Иммунологические (иммуноферментный анализ, полимеразная цепная реакция, реакция агглютинации с латексом) и аллергические (глазные и внутривенные туберкулиновые пробы) реакции используют для дифференциации данного заболевания [5]. Важным отягощающим фактором при оценке истинной картины по туберкулезу является псевдо- и парааллергическая реактивность животных к туберкулину. Данная неспецифическая реакция организма наносит значительный экономический ущерб, слагающийся из затруднений в оценке эпизоотической ситуации, потери продукции и недополучения приплода, преждевременного убоя продуктивных животных, ограничения племенной работы, а также дополнительных затрат на выполнение уточняющих диагностических исследований [6; 7]. В связи с этим разработка быстрых, надежных и доступных методов для прижизненной диагностики и дифференциации туберкулеза является чрезвычайно важным [8; 9]. В последние десятилетия интенсивно изучаются этиология и распространение парааллергии у животных, а также совершенствуются методы дифференциации [10; 11]. Одно из новых направлений в микробиологии – использование современных методов, опирающихся на изучение нуклеиновых кислот, однако недостаток праймеров, специфических зондов, ферментов и реактивов значительно ограничивает их применение. Несмотря на то, что предложено множество методов, прижизненная диагностика туберкулеза остается открытым вопросом.
Учитывая то, что течение болезней бактериальной этиологии в острой и хронической форме влечет за собой изменения в составе крови, многие авторы, работающие в данном направлении, установили связь между изменениями в структуре гемоглобина и развитием патологического процесса. С применением спектрофотометрии механизмы фотохимических изменений в клетке возможно изучить на молекулярном уровне [11]. Использование спектрофотометрии может стать решением по вопросу изыскания новых методов прижизненной диагностики туберкулеза, что и предопределило цель наших исследований.
Материалы и методы
Объектом исследования являлись пробы крови, взятые от лабораторных животных. Пробы исследовали спектрофотометрическим методом с использованием прибора немецкого производства «SPECORD M-400».
Экспериментальные исследования по определению спектров гемолизата были проведены на морских свинках живой массой 350–400 г. Животных, которые не дали положительную реакцию на ППД туберкулин для млекопитающих, разделяли на группы в зависимости от вида заражаемой культуры. Морских свинок первой группы инфицировали Mycobacterium bovis штаммом 8, второй группы – Mycobacterium bovis штаммом 14, третьей группы – Mycobacterium avium штаммом 9, четвертой группы – Mycobacterium smegmatis, животные пятой группы являлись интактными (контрольная группа). В каждой группе было по 5 голов.
Vestnik of Omsk SAU, 2022, no. 4(48)
VETERINARY AND ZOOTECHNY
После заражения в определенные периоды (3, 5, 10, 15, 20 и 25 сутки) у животных из сердца брали по 1 мл крови, к которой добавляли антикоагулянт Трилон Б. Далее полученную кровь во флаконах смешивали с дистиллированной водой. Полученный гемолизат переливали в кюветы из кварца для фотометрии (диапазон – 190–610 нм, скорость интегрирования – 2,00 нм/с, спектральный шаг – 1,00 нм, время интегрирования – 0,5 с, ширина поглощения монохроматора – 2,0 нм). Подготовка пробы и непосредственно спектрофотометрия занимает в среднем 10 минут.
Наряду с вышеописанным методом проводили гематологические исследования, включающие подсчет форменных элементов в крови и выведение лейкоцитарной формулы. Исследования провели в трех последовательностях.
Основываясь на методических рекомендациях 1980 г. «Бактериологической и биохимической идентификации микобактерий», провели сравнение предложенного и традиционных методов диагностики туберкулеза. Традиционными методами микобактерий идентифицировали согласно наставлению по диагностике туберкулеза животных и ГОСТу 26072–84 «Животные и птица сельскохозяйственные».
С целью определения патогенности исследуемых культур микобактерий и их видовой принадлежности по общепринятым методикам заражали лабораторных животных. По снижению массы тела, гибели животных и степени поражения внутренних органов животных делали заключение о патогенности культуры.
Результаты спектрофотометрического, гематологического исследований подвергали биометрической обработке адаптированными программами персональных компьютеров.
Результаты и их обсуждение
При исследовании проб крови методом спектрофотометрии установлено, что у свинок, инфицированных штаммами 8 и 14 Mycobacterium bovis, спектры гемолизата в области 415 нм имеют характерный пик с коэффициентом поглощения 2966–3166 (5 сут после заражения), 2683–3033 (10 сут), 2600–2933 (15 сут), 2733–3066 (20 сут) и 2716–2833 (25 сут) соответственно (рисунок). На протяжении всего эксперимента гемолизат от животных интактной группы составил 2233 ± 33,3 (P < 0,05) (табл. 1).
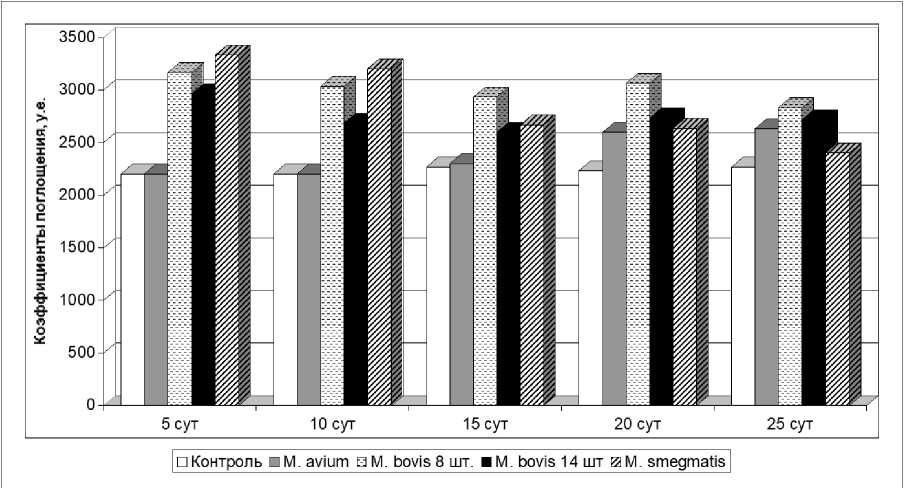
Спектры гемолизата морских свинок, зараженных микобактериями
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY
Таблица 1
Спектры поглощения гемолизата морских свинок, зараженных микобактериями разных видов
|
№ п/п |
Наименование штаммов |
Сроки исследования после заражения (дни) проб крови и полученные спектры поглощения |
||||
|
5 |
10 |
15 |
20 |
25 |
||
|
M ± m |
M ± m |
M ± m |
M ± m |
M ± m |
||
|
1. |
M. bovis шт.8 |
3166,67 ± 166 |
3033,33 ± 317 |
2933,33 ± 266 |
3066,67 ± 66 |
2833,33 ± 88 |
|
2. |
M.bovis шт. 14 |
2966,67 ± 366 |
2683,33 ± 130 |
2600 ± 208 |
2733,33 ± 33 |
2716,67 ± 16 |
|
3. |
M. smegmatis |
3333,33 ± 176 |
3200 ± 200 |
2666 ± 120 |
2633,33 ± 88 |
2400 ± 230 |
|
4. |
M. avium шт. 9 |
2200 ± 404 |
2200 ± 115 |
2300 ± 57 |
2600 ± 251 |
2633 ± 266 |
|
5. |
Контроль |
2200 ± 33 |
2200 ± 33 |
2266,67 ± 33 |
2233,33 ± 33 |
2266,67 ± 33 |
Примечание . Материалы обработаны с достоверностью не выше Р = 0,05
В области 415 нм характерный пик также имели гемолизаты от животных, зараженных Mycobacterium avium и Mycobacterium smegmatis.
Полученные данные о спектрах гемолизата и морфологических показателях крови зараженных атипичными и патогенными микобактериями морских свинок позволяют проследить закономерности, происходящие в организме лабораторных животных.
Так, наивысшее значение в спектрах гемолизата от морских свинок, зараженных штаммами 8 и 14 Mycobacterium bovis, установлено на 5-е сутки за счет существенного увеличения лимфоцитов в 1,3 раза по сравнению с контролем. Повышение уровня палочкоядерных нейтрофилов и снижение количества сегментоядерных нейтрофилов инициируют сдвиг нейтрофильного ядра влево.
Несмотря на то, что спектр поглощения на 10-е сутки снизился, относительно контроля показатель остался выше на 800 условных единиц (у.е.), количество лимфоцитов продолжало увеличиваться. Наибольший контраст виден в группе животных, подвергшихся заражению штаммом 8 Mycobacterium bovis, где количество лимфоцитов достигало отметки 9,8 х 10 9 /л, в то же время в контроле данный параметр имел значение 6,3 х 109/л. У морских свинок, инфицированных штаммом 14 Mycobacterium bovis, регистрировали увеличение количества сегментоядерных нейтрофилов на фоне снижения данного показателя в остальных опытных группах. Содержание палочкоядерных нейтрофилов и эозинофилов находилось в пределах физиологической нормы.
К 15-м суткам спектры поглощения продолжали снижаться на фоне сохранения тенденции к увеличению количества лимфоцитов. В сравнении с контролем уровень сегментоядерных нейтрофилов и эозинофилов в исследуемый период был понижен.
Нарастание воспалительного процесса с последующим некрозом и возникновение язв в местах введения культур микобактерий привело к тому, что на 20-е сутки спектры поглощения увеличились до показателей 10-х суток. Количество лимфоцитов продолжило увеличиваться, кроме этого, содержание сегментоядерных нейтрофилов заметно повысилось по сравнению с данными контроля. Относительно палочкоядерных нейтрофилов наблюдали аналогичную картину, несмотря на то, что их содержание находилось в пределах физиологической нормы. При подсчете эозинофилов в опытных группах было отмечено, что их количество снижено в 0,9 раза по сравнению с контролем.
На фоне сохранения высоких показателей спектрофотометрии у животных на 25-е сутки отмечался выраженный лимфоцитоз. У инфицированных штаммом 14 Mycobacterium bovis отмечено значительное увеличение содержания сегментоядерных нейтрофилов. Уровень палочкоядерных нейтрофилов во всех опытных группах продолжал расти. У зараженных штаммом 8 Mycobacterium bovis наблюдали эозинофилию,
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY в то время как в остальных группах этот показатель снижался. Содержание моноцитов во всех опытных группах не имело достоверных различий.
Наблюдение за спектрами гемолизата от свинок, зараженных Mycobacterium smegmatis, с 5 по 25 сутки показало, что на 5-е сутки после заражения был зарегистрирован наибольший пик, к 20–25 суткам отмечалось постепенное снижение. Относительно контроля разница спектров определялась в пределах 400–200 единиц соответственно.
При изучении лейкограммы инфицированных Mycobacterium smegmatis свинок было установлено, что содержание лимфоцитов в опытной группе в среднем 3,5 раза больше, чем в контрольной. Увеличение количества палочкоядерных нейтрофилов спровоцировало сдвиг нейтрофильного ядра влево. На 15-е сутки в группе зараженных животных наблюдалась эозинофилия с последующим восстановлением к 25 суткам.
Количество сегментоядерных нейтрофилов относительно контрольной группы сократилось в 1,7 раза на 20–25 сутки.
Отличие гемолизата морских свинок, инфицированных штаммом 9 Mycobacterium avium, от всех вышеперечисленных заключалось в повышении характерных пиков только на 15–25-е сутки. Разница опытных и контрольных спектров на 15-е сутки составила 1000 у.е., на 20–25-е – 3000 у.е.
При анализе лейкограммы лабораторных животных, зараженных Mycobacterium avium штаммом 9, отмечено незначительное увеличение лимфоцитов (в 0,1–0,2 раза) по сравнению с контролем на 5–10 сутки. С 15 по 25-е сутки отмечался резкий лимфоцитоз, в среднем разница с контролем составила 1,1 раза.
На фоне снижения количества сегментоядерных нейтрофилов, начиная с 5-х суток, отмечалось увеличение эозинофилов в 0,5 раза по сравнению с контролем. Содержание моноцитов во всех опытных группах не имело достоверных различий.
С целью сравнения эффективности предложенного метода спектрофотометрии и общепринятых методов идентификации микобактерий были проведены исследования по изучению культурально-морфологических, тинкториальных, биохимических и патогенных свойств культур, выделенных от опытных животных.
Изучая мазки, окрашенные методом Циля-Нильсона, определили, что изучаемые культуры – это палочки однородной структуры, кислотоустойчивые, которые в зависимости от видовой принадлежности отличаются между собой формой и размерами. Некислотоустойчивые палочки встречались в мазках из Mycobacterium smegmatis. Культуральные особенности исследуемых культур микобактерий определяли на питательной среде Левенштейна-Йенсена путем засева приготовления суспензий густотой 2–3 мг/мл. Посевы помещали в термостаты с постоянной температурой 22, 37, 45, 52 ° С. Результаты учитывали на 3-и, 5-е, 7-е, 14-е сутки и далее в течение 3 месяцев. Полученные результаты представлены в табл. 2.
Характер роста и пробу на фотохромогенез у субкультур определяли одновременно. Для этого из уже приготовленных ранее суспензий делали посевы на среду Леве-штейна-Йенсена в 3 пробирки. Рост всех штаммов Mycobacterium bovis (8, 14 и полевой изолят) наблюдали при температуре 37 ° С, при температуре 22, 45 и 52 ° С культуры данных штаммов не растут. Диапазон температуры роста штамма Mycobacterium avium (9), варьирует от 22 до 45 ° С. У Mycobacterium smegmatis рост наблюдали также при 22, 37 и 45 ° С.
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY
Таблица 2
Культуральные свойства микобактерий
|
Наименование |
Виды микобактерий |
||
|
M. bovis |
M. smegmatis |
M. avium |
|
|
Число штаммов |
3 |
1 |
1 |
|
Скорость роста |
М* |
Б* |
М |
|
Рост на среде при Т, °С |
|||
|
22 |
– |
+ |
+ |
|
37 |
+ |
+ |
+ |
|
45 |
– |
+ |
+ |
|
52 |
– |
– |
– |
|
Рост на среде с добавлением |
|||
|
салицилата натрия 0,05–0,1% |
± |
+ |
+ |
|
0,2% ПАСК |
± |
+ |
+ |
|
5% натрия хлорида |
– |
+ |
– |
|
Окраска колоний |
Н* |
Н |
Н |
|
Окраска по Цилю-Нильсену |
+ |
+ |
+ |
Условные обозначения: М* – медленнорастущие микобактерии; Н* – неокрашенные микобактерии; С – скотохромогенные микобактерии
При изучении морфологических свойств отмечено, что полевой изолят Mycobacterium bovis наряду с музейными штаммами образовывал на среде Левенштей-на-Йенсена гладкие колонии шаровидной формы цвета слоновой кости, однако у полевого изолята наблюдали более медленный рост и меньшие размеры колоний по сравнению с музейными штаммами.
Mycobacterium avium росли в виде мягких округлых колоний серо-белого цвета в более ранние сроки. Mycobacterium smegmatis относится к быстрорастущим микобактериям и на среде Левенштейна-Йенсена как в темноте, так и на свету образовывали мягкие и блестящие колонии цвета слоновой кости.
Предложено несколько методов дифференциации исследуемых культур микобактерий:
– чувствительность культур рода Mycobacterium к салицилату натрия в 0,05–0,1% концентрации;
-
– чувствительность культур рода Mycobacterium к 0,2% параамино-салицилату натрия;
-
– устойчивость культур рода Mycobacterium к хлориду натрия в 5%-ной концентрации.
За основу брали яичную среду Левенштейна-Йенсена, в которую добавляли вышеперечисленные препараты. Среда без препаратов служила контролем. Все среды готовили одновременно.
Микобактериальную суспензию готовили из каждой культуры (густота 2–3 мг/мл), далее делали посев на среду Левенштейна-Йенсена в объеме 0,2–0,3 мл на 12 пробирок (9 пробирок с препаратами и 3 – без них).
Опыт проводили в трехкратной повторности. На 3-й день пробирки с посевами парафинировали и инкубировали при постоянной температуре 37 ° С. Рост культур на средах с препаратами и контрольных средах учитывали ежедневно и сравнивали между собой.
В результате исследования установлено, что салицилат натрия и ПАСК не всегда подавляют рост Mycobacterium bovis, что значительно затрудняет оценку результатов теста. Остальные культуры растут на среде Левенштейна-Йенсена с добавлением вы-
Vestnik of Omsk SAU, 2022, no. 4(48)
VETERINARY AND ZOOTECHNY
шеуказанных реагентов. Однако незначительную задержку и снижение интенсиности роста наблюдали у культуры Mycobacterium avium.
Полностью ингибирует рост всех штаммов Mycobacterium bovis и всех медленнорастущих атипичных микобактерий 5%-ный хлорид натрия. Заметных отличий роста Mycobacterium smegmatis на среде с добавлением хлорида и в контроле не отмечалось.
Вышеуказанными методами проводят дифференциацию культур на микобактерии туберкулеза, а атипичные формы распределяют на различные группы согласно классификации Раньона, но все данные методы занимают продолжительное время.
Для характеристики биохимических свойств исследуемых культур определяли ниацин, гидролизат Твин-80, термостабильность каталазы (при 68 ° С) и дегидратацию ПАСК или NaCl.
Изучая биохимическую активность Mycobacterium bovis и полевого изолята, выявили, что исследуемые культуры являются ниацинотрицательными и имеют не выраженную каталазную активность, которая при нагревании исчезает (табл. 3).
Таблица 3
Биохимические свойства микобактерий
|
Вид микобактерий |
Проба с ниацином |
Гидролизат Твин-80 |
Термостабильность каталазы |
Разрушение |
|
M. bovis |
– |
– |
– |
– |
|
M. avium |
– |
– |
+ |
– |
|
M. smegmatis |
– |
+ |
+ |
– |
По тинкториальным, морфологическим и биохимическим свойствам все музейные штаммы соответствовали параметрам, характерным для данных видов.
Видовую принадлежность определяли путем постановки биопробы на лабораторных животных (курах, морских свинках, кроликах).
Заражение морских свинок Mycobacterium bovis проводили подкожно. После чего учитывали результат. Так, в месте введения на 5–6-й день у всех животных наблюдали воспалительный инфильтрат, перерастающий в абсцесс, который вскрывался на 17–19-й день, а язвы формировались на 22–23-й день. Также на 6–10-й день увеличивались регионарные лимфатические узлы до размеров с горошину. При заражении морских свинок полевым изолятом Mycobacterium bovis к 10–12-му дню вскрывались абсцессы с последующим появлением незаживающих, хорошо выраженных язв, содержащих казеозные массы. Язвы, образованные при заражении полевым изолятом, были значительно больше, чем язвы, развившиеся при заражении музейным штаммом. После заражения Mycobacterium bovis морские свинки в среднем жили 28–37 дней.
Кроликам культуры Mycobacterium bovis вводили внутривенно. Как при музейном штамме, так и при полевом изоляте микобактерии бычьего вида гибель животных наступала на 25–35-е сутки из-за развившегося инфекционного процесса и значительного поражения легких.
При введении морским свинкам микобактерий птичьего вида подкожно отмечали абсцессы, как проявление местной воспалительной реакции, а также увеличение регионарных лимфоузлов. После заражения гибели животных не наблюдали.
Высокую патогенность штамма 9 Mycobacterium avium наблюдали при внутривенном заражении кур и кроликов.
Введение культур Mycobacterium smegmatis кроликам, морским свинкам и курам не вызывало у животных развития патологического процесса.
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY
Заключение
Сравнивая традиционные и разработанный методы диагностики туберкулеза животных, мы пришли к выводу, что с помощью спектрофотометрии прижизненный диагноз устанавливается значительно быстрее (в течение нескольких часов), чем с применением общепринятых методов, проведение которых требует длительного периода (2–3 мес).
Результаты по применению спектрофотометрии не являются исчерпывающими. Выявленные методологические подходы можно использовать с целью определения других хронических болезней сельскохозяйственных животных.
Список литературы Идентификация возбудителей туберкулеза лабораторных животных с помощью спектрофотометрии
- Баратов М.О., Сакидибиров О.П. Туберкулез крупного рогатого скота в Республике Дагестан: проблемы и перспективы // Ветеринария. 2021. № 1. С. 24-28.
- Леви Д.Т., Александрова Н.В., Лебединская Е.В. Туберкулинодиагностика: история и перспективы // ИмМунология. 2018. № 39(5-6). С. 312-325.
- Найманов А.Х., Калмыков В.М. Туберкулез животных. Санкт-Петербург: Лань, 2018. 504 с.
- Vordermeier H.M., Jones G.J., Buddie B.M., Hewinson R.G., Villarreal-Ramos B. Bovine Tuberculosis in Cattle: Vaccines, DIVA Tests, and Host Bio-marker Discovery. Annu Rev Anim Biosci. 2016;4:87-109. DOI 10.1146/annurev-animal-021815-111311.
- Кудлай Д.А. Биомаркеры и иммунологические тесты. Экспериментально-клинические параллели латентной туберкулезной инфекции // Туберкулез и болезни легких. 2020. Т. 98, № 8. С. 63-74. URL: https://doi.org/10.21292/2075-1230-2020-98-8-63-74.
- Мясоедов Ю.М. Оценка эффективности доз туберкулина при лабораторной диагностике туберкулеза животных. Тр. Всерос. НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2018. Т. 80. № 2. С. 257-260.
- Найманов А.Х., Гулюкин А.М., Толстенко Н.Г., Вангели Е.П., Калмыков В.М. Проба с диа-скинтестом при диагностике туберкулеза животных // Туберкулез и болезни легких. 2020. 98(12). С. 5356. URL: https://doi.org/10.21292/2075-1230-2020-98-12-53-56
- Ларионова Е.Е., Андреевская С.Н., Смирнова Т.Г., Севастьянова Э.В., Черноусова Л.Н. Методы идентификации микобактерий // Вестник Центрального научно-исследовательского института туберкулеза. 2021. № 1. С. 87-98.
- Ly A., Liu J. Mycobacterial Virulence Factors: Surface-Exposed Lipids and Secreted Proteins. Int JMol Sci. 2020; 21(11):3985.
- Hunter R.L. The Pathogenesis of Tuberculosis - The Koch Phenomenon Reinstated. Pathogens. 2020;9:813.
- Околелов К.В. Спектрофотометрия для диагностики туберкулеза крупного рогатого скота в эксперименте: дис. ... канд. вет. наук. Омск, 2003.


