Идиопатический легочный фиброз в практике врача-терапевта
Автор: Муркамилов Илхом Торобекович, Айтбаев Кубаныч Авенович, Фомин Виктор Викторович, Кудайбергенова Индира Орозобаевна, Маанаев Токтобай Исраилович, Муркамилова Жамила Абдилалимовна, Юсупов Фуркат Абдулахатович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 6 т.7, 2021 года.
Бесплатный доступ
Идиопатический легочный фиброз (ИЛФ) - это специфическая форма хронической прогрессирующей фиброзирующей интерстициальной пневмонии неизвестной этиологии, которая поражает только легкие и связана с гистологическим и/или рентгенологическим паттерном обычной интерстициальной пневмонии. Клиническим субстратом ИЛФ являются прогрессирующая одышка и сухой кашель. Характерный аускультативный признак ИЛФ - инспираторная крепитация. Важным морфологическим компонентом ИЛФ служит фиброз. Ведущий КТ-признак ИЛФ - «сотовое» легкое (локальные воздушные кисты, расположенные субплеврально и имеющие сходные размеры от 2-3 до 10 мм с четко отчерченными стенками). В основном болеют лица старше 60 лет, часто курильщики, либо имеющие курение в анамнезе. У 60% пациентов течение ИЛФ прогрессирующее, летальный исход в течение 5 лет в 40% случаев. В 30-50% случаев ИЛФ требует исключения других форм интерстициальных заболеваний легких. К настоящему времени установлено, что базисными препаратами в лечении ИЛФ с доказанной эффективностью являются нинтеданиб и пирфенидон. В данной статье представлен клинический случай ИЛФ у больного 63 лет, который находился на стационарном лечении в отделении пульмонологии. Приведенный пример обосновывает необходимость повышенной настороженности у врачей-пульмонологов и врачей общей практики при толковании клинических проявлений болезни.
Идиопатический легочный фиброз, течение, прогноз, нинтеданиб, пирфенидон, выживаемость
Короткий адрес: https://sciup.org/14121063
IDR: 14121063 | УДК: 616-004:616-07 | DOI: 10.33619/2414-2948/67/26
Текст научной статьи Идиопатический легочный фиброз в практике врача-терапевта
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-004:616-07
Введение. В последние пять лет на страницах российских и зарубежных изданий активно обсуждаются проблемы идиопатического легочного фиброза (ИЛФ), который является одним из многих интерстициальных заболеваний легких [1-3]. В многочисленных сообщениях отмечено, что ИЛФ характеризуется неуклонным прогрессирующим течением и высокой смертностью [4-6].
В отличие от большинства идиопатических интерстициальных пневмоний, иммуносупрессивная и глюкокортикоидная терапия (при не выраженности воспалительных изменений) не оказывают влияния на скорость прогрессирования ИЛФ [5].
По современным данным, ИЛФ это хроническая прогрессирующая репарация и склероз интерстиция респираторных отделов легких с образованием миофибробластических фокусов с неустановленной этиологией [7, 8]. Ранее сообщалось, что средняя выживаемость лиц с ИЛФ составляет от 2 до 5 лет [9].
После установления диагноза ИЛФ продолжительность жизни каждого четвертого пациента практически не превышает 5 лет. Сходные данные по выживаемости лиц с ИЛФ приводят и другие исследователи [10]. По разным данным, распространенность ИЛФ варьирует от 14 до 42,7 на 100 тыс. населения [11, 12].
В США распространенность ИЛФ составляет 18,2 случая на 100 тыс. населения [13]. Частота встречаемости ИЛФ составляет 20-30% в структуре всех случаев идиопатической интерстициальной пневмонии, а заболеваемость — от 7 до 17 случаев на 100 тыс. населения [14]. Нужно помнить, что примерно у 5 % больных ИЛФ имеет наследственный характер [15] с аутосомно-доминантным наследованием гена фиброза легких. Как показывают литературные данные, ИЛФ болеют несколько чаще мужчины, чем женщины [16].
ИЛФ развивается в основном у людей среднего и пожилого возраста (возраст 65% пациентов на момент постановки диагноза составляет 60 лет и более) [17]. В качестве факторов риска ИЛФ рассматриваются табакокурение, пожилой и старческий возраст, генетические факторы, гастроэзофагеальная рефлюксная болезнь, контакт с аэрополютантами, а также латентные инфекции дыхательных путей. Стоит заметить, что некоторые исследователи рассматривают в качестве фактора риска ИЛФ и сахарный диабет. Так, в работе Figueroa, Ma Cecilia García-Sancho и соавторов, опубликованном в журнале “Respiratory medicine”, сахарный диабет 2-го типа среди лиц ИЛФ встретился в 11,3% случаев, тогда как в контрольной группе – только в 2,9 % (отношение шансов = 4,3; 95% доверительный интервал = 1,9–9,8; p<0,0001) [18].
В мета-анализе, проведенном исследователями Bai L, Zhang L, Pan T, Wang W, Wang D, Turner C и He H также показано, что сахарный диабет увеличивает риск ИФЛ (отношение шансов = 1,65; 95% доверительный интервал = 1,30–2,10; p<0,0001) [19].
Кроме того, активно обсуждаются и генетические факторы, присутствие которых увеличивают риск ИФЛ. Так, в качестве факторов риска рассматриваются мутации генов теломеразного комплекса, полиморфизм гена MUC5B (Mucin 5B, Oligomeric Mucus/Gel-Forming), изменение активности генов, кодирующих белки сурфактанта (Surfactant Protein A2) [20, 21].
В международных рекомендациях подчеркнуто, что укорочение теломер, возникающее при геномных мутациях, сопровождается апоптозом альвеолярного эпителия, являющегося одним из патогенетических механизмов ИЛФ [22]. Недавние исследования также обобщили роль мутации генов в возникновении ИЛФ [23, 24].
Исследователи S.K. Mathai и D.A. Schwartz (2020) сообщают, что MUC5B кодирует муцин-5B, основной компонент слизи на многих поверхностях слизистых оболочек (включая слюну, шейку матки и легкие), который имеет решающее значение для иммунной функции легких [24].
В настоящее время факторы, ассоциированные с развитием ИЛФ, изучаются активно [25, 26]. Респираторным симптомом ИЛФ является сухой кашель. В продвинутой стадии заболевания, а также при обострении возможен продуктивный кашель с гнойной мокротой. Одышка у больных с ИЛФ в начале заболевания появляется во время физических нагрузок. По мере развития заболевания наблюдается усиление одышки, что в значительной степени ограничивает физическую активность больных. Как указывают исследователи, пациенты с ИЛФ успевают адаптироваться к своей одышке, т.к. болезнь прогрессирует довольно медленно, активность постепенно снижается и они переходят к более пассивному образу жизни [22].
В отдаленном периоде ИЛФ могут присоединиться другие неспецифические проявления заболевания: мышечная слабость, утомляемость, изменение ногтевых фаланг в виде барабанных палочек, снижение массы тела. Весьма характерной аускультативной симптоматикой со стороны легких является крепитация (хрипы “Velcro”), сравниваемая с застежкой-молнией. На начальных стадиях ИЛФ инспираторная крепитация негромкая и высокая по частоте [22]. Со временем у больных ИЛФ инспираторная крепитация приобретает грубый оттенок. Стоит подчеркнуть, что крепитация у больных ИЛФ выслушивается на высоте вдоха (в конечно-инспираторный период). Как правило, при ИЛФ, по мере прогрессирования заболевания, присоединяются дыхательная недостаточность, центральный (диффузный) цианоз, легочная гипертензия, усиление II тона над легочной артерией, тахикардия, набухание шейных вен, периферические отеки и т.п.
Диагноз ИЛФ устанавливают на основании характерных данных компьютерной томографии высокого разрешения, а также результатов биопсии легкого. В упомянутом исследовании отмечено, что компьютерная томография высокого разрешения играет ключевую роль в диагностике ИЛФ и позволяет установить диагноз приблизительно в 2/3 случаев [5].
Трудности диагностики ИЛФ обусловлены скудностью начальных клинических проявлений, сложностью дифференциальной диагностики на развернутой стадии и отсутствием соответствующих диагностических маркеров [6]. Примечательным является тот факт, что наличие достоверных КТ-признаков обычной интерстициальной пневмонии в настоящее время считают достаточным для диагностики ИЛФ без биопсии легкого. Так как, КТ-картина типичной обычной интерстициальной пневмонии по данным компьютерной томографии высокого разрешения согласуется с наличием гистологической картины типичной обычной интерстициальной пневмонии по данным биопсии легкого в 90-100% случаев [5]. К тому же, в большинстве случаев типичные признаки ИЛФ на компьютерной томографии высокого разрешения в сочетании с клинической симптоматикой позволяют избежать выполнения открытой биопсии легкого. Что касается биопсии легкого, то она рекомендуется при «возможном ИЛФ». В последние годы растет число больных ИЛФ. Распространенность и некоторые аспекты ИЛФ были приведены в ранее опубликованных нами серии обзорных статей [27,28,29]. Для терапевтов и семейных врачей ИЛФ представляет несомненный интерес как в теоретическом, так и в практическом плане. В этой связи, ниже мы представляем клинический случай ИЛФ из нашей практики.
Описание случая
Пациентка У., 63 лет, поступила в отделение пульмонологии Национального госпиталя МЗ и СР КР (г. Бишкек) в апреле 2021 г с жалобами на одышку в покое, усиливающуюся при незначительной нагрузке или при ходьбе и сопровождающуюся сухим кашлем.
Анамнез. В течение 10 лет отмечает сухой кашель, по поводу чего неоднократно лечилась по месту жительства, принимала муколитические и антибактериальные препараты с временным положительным эффектом. Со слов пациентки, кашель носил прогрессирующий характер. Стоит подчеркнуть, что при изменении места проживания пациентка отмечает значительное уменьшение кашлевого синдрома. Ранее бронхолитики не принимала. Последние 2 года пациентка стала замечать одышку при физической нагрузке, что побудило специалистов рекомендовать обзорную рентгенографию легких (Рисунок 1) и КТ органов грудной клетки, где выявлялись изменения, характерные для фиброза легких (Рисунок 2).
В частности, на обзорной рентгенограмме видны изменения ткани легких в виде мелкосетчатой деформации пульмонального рисунка за счет интерстициального компонента. Причем, эти изменения более выражены в кортикальных отделах легких и носят двусторонний характер, прежде всего над диафрагмой. Кроме того, можно заметить уменьшение объема легких, высокое расположение купола диафрагмы и более горизонтальное расположение сердечной тени. Корни легких расширены за счет расширения крупных легочных артерий и небольшого увеличения бронхопульмональных лимфатических узлов (Рисунок 1). Ради справедливости стоит отметить, что при рентгенографии в 10% случаев у лиц с ИЛФ изменения в легочной ткани могут не выявляться.
На КТ легких (Рисунок 2) у нашей пациентки просматриваются ретикулярные изменения на фоне неизмененной по типу матового стекла легочной ткани (Рисунок 2. А, Б, Рисунок 3. В, Г).
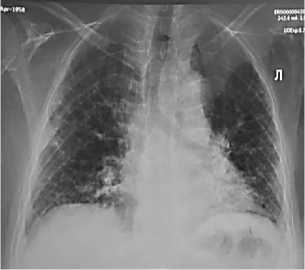
Рисунок 1. Обзорная рентгенография легких
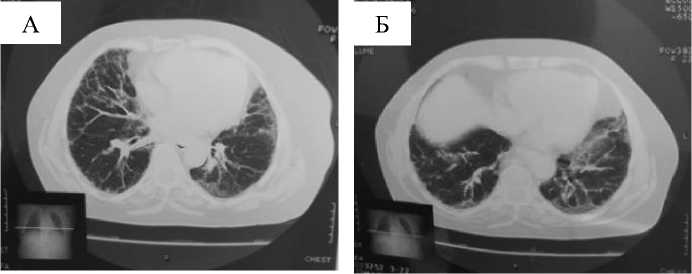
Рисунок 2. Типичная картина обычной интерстициальной пневмонии: A - Б «сотовое» легкое на фронтальных плоскостях
Ретикулярные изменения отчетливо видны в кортикальных отделах, вследствие утолщения внутридольковых перегородок. Вместе с тем, можно заметить умеренно выраженное сотовое легкое (Рисунок 3. В, Г).
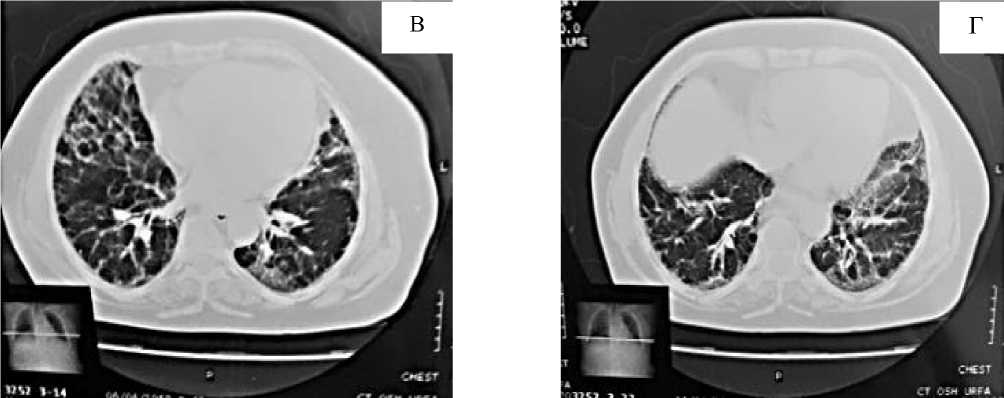
Рисунок 3. Компьютерная томография — В, Г. Аксиальный срез / фронтальная реформация. Хорошо видны диффузные двусторонние ретикулярные изменения в легких «медовых сот»
В связи с сохранением непродуктивного кашля и присоединением одышки, пациентке вновь назначена КТ легких (Рисунок 4) и рекомендовано обследование у пульмонолога-терапевта (Таблица 1).
Как уже было сказано, клиническое течение ИЛФ обычно является хроническим и медленно прогрессирующим. Однако, у некоторых больных наблюдается быстрое прогрессирование заболевания. Нередко при ИЛФ развиваются острые ухудшения клинического состояния больных на фоне пневмонии, пневмоторакса, сердечной недостаточности и тромбоэмболии легочной артерии. Если этиология острого ухудшения не установлена, используется термин «обострение ИЛФ». Традиционно критериями обострения ИЛФ считают беспричинное нарастание одышки в течение одного месяца, наличие документированной гипоксемии (ухудшение или тяжелое нарушение газообмена) и свежих альвеолярных инфильтратов, выявленных при рентгенографии легких. Необходимо помнить, что обострение ИЛФ может возникнуть в любой момент заболевания и иногда становится первым симптомом проявления ИЛФ, сопровождается усилением кашля, увеличением объема мокроты и лихорадкой. Для определения наличия обострения ИЛФ у нашей пациентки У., 63 лет, нами был проведен спектр лабораторных исследований (Таблица 1), направленных на выяснение причин ухудшения клинического статуса.
Д
Е
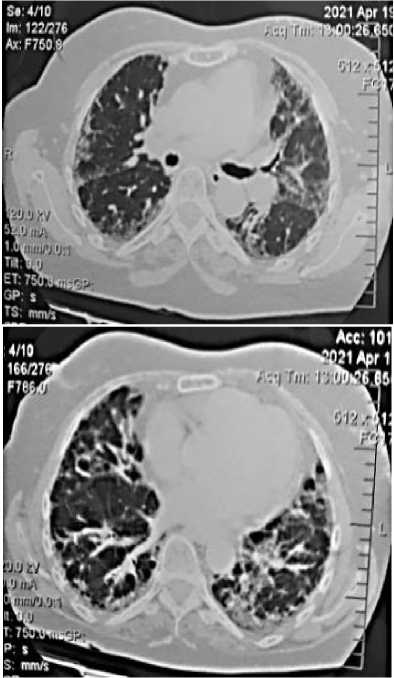
Е
Ж
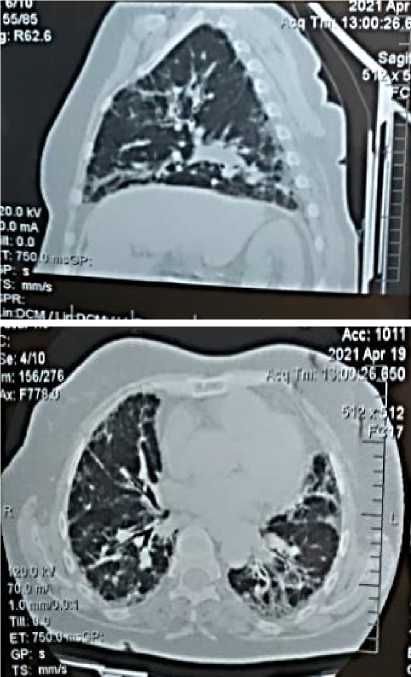
Рисунок 4. Компьютерная томография - Д, Е, Е, Ж. Аксиальный срез/фронтальная реформация. Хорошо видны диффузные двухсторонние ретикулярные изменения в легких
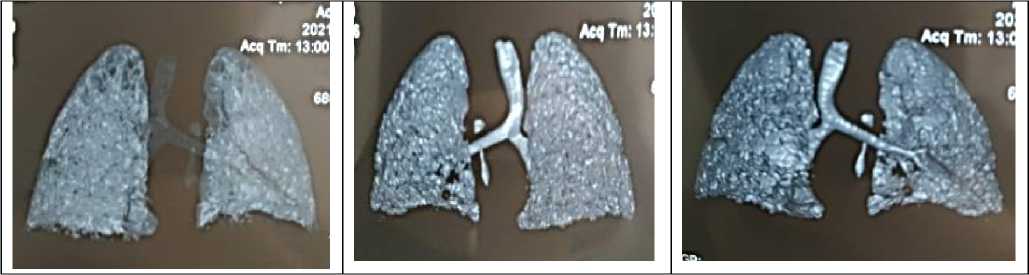
Рисунок 5. Компьютерная томография легких – срезы. 3Д реконструкция
Таблица 1.
|
Показатель |
22.02.2021 |
Единицы измерения |
Референсные значения |
|
Гемоглобин (Hb) |
138 |
г/л |
115,00-141,00 |
|
Гематокрит |
44,8 |
% |
34,04-42,48 |
|
Эритроциты |
4,47 |
1012/л |
3,61-5,00 |
|
Средний объем эритроцита |
100,20 |
фл |
88,05-104,07 |
|
Среднее содержание Hb в эритроците |
30,90 |
пг |
27,75-34,52 |
|
Cредняя концентрация Hb в эритроците |
308 |
г/л |
305,9-337,6 |
|
Гетерогенность эритроцитов по объему |
12,50 |
% |
11,43-13,90 |
|
Гетерогенность эритроцитов по объему |
46,40 |
фл |
38,56-50,28 |
|
Макроциты |
5,90 |
% |
3,20-6,77 |
|
Микроциты |
0,30 |
% |
0,20-1,87 |
|
Тромбоцитарные параметры |
|||
|
Тромбоциты |
227 |
109/л |
138,8-344,2 |
|
Тромбокрит |
0,23 |
% |
0,16-0,33 |
|
Средний объем тромбоцитов |
10,00 |
фл |
9,10-12,60 |
|
Гетерогенность тромбоцитов по объему |
11,2 |
фл |
9,3-16,7 |
|
Коэффициент числа крупных тромбоцитов |
24,80 |
% |
17,21-46,29 |
|
Лейкоцитарные параметры |
|||
|
Лейкоциты |
7,12 |
109/л |
3,89-9,23 |
|
Нейтрофилы |
3,06 |
109/л |
1,78-6,04 |
|
Эозинофилы |
0,23 |
109/л |
0,01-0,59 |
|
Базофилы |
0,05 |
109/л |
0,01-0,59 |
|
Моноциты |
0,45 |
109/л |
0,24-0,72 |
|
Лимфоциты |
3,33 |
109/л |
1,01-2,75 |
|
Незрелые гранулоциты |
0,02 |
109/л |
0,00-0,04 |
|
Реактивные лимфоциты |
0,18 |
109/л |
0,00-0,60 |
|
Плазматические клетки |
0,00 |
109/л |
0,00-0,00 |
|
Нейтрофилы |
43,00 |
% |
40,80-70,39 |
|
Эозинофилы |
3,20 |
% |
0,24-10,24 |
|
Базофилы |
0,70 |
% |
0,20-1,50 |
|
Моноциты |
6,30 |
% |
4,41-10,60 |
|
Лимфоциты |
46,80 |
% |
20,11-46,79 |
|
Незрелые гранулоциты |
0,30 |
% |
0,00-0,50 |
|
Реактивные лимфоциты |
2,50 |
% |
0,00-5,00 |
|
Интенсивность реактивности нейтрофилов |
51,7 |
SI |
36,0-62,4 |
|
Показатель регулярности нейтрофилов |
152,3 |
SI |
134,0-163,2 |
|
Скорость оседания эритроцитов |
37 |
мм/час |
2-30 |
|
Серологические исследования |
на инфекционные агенты |
||
|
Антитела к кандиде IgG |
4,01 |
УЕ |
<0,85 |
|
Антитела к капсидному антигену вируса Эпштейна-Барр IgG |
17,35 |
УЕ |
<0,8 |
|
Антитела к цитомегаловирусу IgG |
21,1 |
УЕ |
<0,9 |
|
Антитела к микоплазме пневмонии IgG |
0,15 |
УЕ |
<0,9 |
|
Антитела к хламидии пневмонии IgG |
0,10 |
УЕ |
<0,9 |
ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (пациентка У., 63 лет) Исследования выполнены на аппарате Aliifax Roller 20: Sysmex XN 1000 (Япония)
Бюллетень науки и практики / Bulletin of Science and Practice Т. 7. №6. 2021
|
Показатель |
22.02.2021 |
Единицы измерения |
Референсные значения |
|
Антитела к микобактерии туберкулеза |
Не обнаружено |
Не обнаружено |
|
|
Антитела к возбудителю коклюша IgG |
Обнаружено |
Не обнаружено |
|
|
Высокочувствительный С-реактивный белок |
1,77 |
мг/л |
0,00-5,00 |
|
D-димер |
1,35 |
мг/л |
0,00-0,55 |
|
Как видно из данных Таблицы 1, у пациентки отмечалось ускоренное СОЭ и повышение уровня D-димера крови. При повторном обследовании концентрация D-димера крови снизилась до референсных значений (Таблица 2). Таблица 2. ДАННЫЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (пациентка У., 63 г) |
|||
|
Показатель |
20.04.2021 |
Референсные значения |
|
|
Глюкоза, ммоль/л |
7,2 |
3,8-5,82 |
|
|
Мочевая кислота, мг/дл |
0,22 |
до 0,36 |
|
|
С-реактивный белок количественный, мг/л |
1,2 |
до 5 |
|
|
Лактатдегидрогеназа, МЕ/л |
191 |
125-220 |
|
|
Фолиевая кислота, нг/мл |
5,6 |
3,1-20,5 |
|
|
Креатинкиназа, Ед/л |
44 |
29-168 |
|
|
Аланинаминотрансфераза, Ед/л |
12 |
0-20 |
|
|
Аспартатаминотрансфераза, Ед/л |
21 |
0-20 |
|
|
Общий холестерин (ХС), ммоль/л |
- |
до 5,17 |
|
|
ХС липопротеинов высокой плотности, ммоль/л |
1,60 |
от 1,2 |
|
|
ХС липопротеинов низкой плотности, ммоль/л |
2,69 |
2,6-3,34 |
|
|
Триглицериды, ммоль/л |
до 1,7 |
||
|
Фибриноген, г/л |
3,96 |
1,8-3,5 |
|
|
D-димер, мг FEU/л |
0,83 |
0-0,55 |
|
|
Протромбиновый индекс, % |
100,0 |
97-100 |
|
|
Интерлейкин-10, пг/мл |
13,856 |
до 30 |
|
|
Интерлейкин-6, пг/мл |
0,487 |
до 10 |
|
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
1,607 |
до 6 |
|
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
172,08 |
10-700 |
|
|
Ревматоидный фактор, МЕ/мл |
<20 |
до 30 |
|
|
CYFRA-21-1, нг/л |
1,52 |
до 2,08 |
|
|
Общий билирубин, мкмоль/л |
4,4 |
0,5-20,5 |
|
|
Непрямой билирубин, мкмоль/л |
4,4 |
до 16,5 |
|
|
Прямой билирубин, мкмоль/л |
0 |
0-5,1 |
|
|
Тимоловая проба, единиц |
2,38 |
0-4 |
|
|
Бета-2 микроглобулин (кровь), мг/л |
1,785 |
0,97-2,64 |
|
|
Бета-2 микроглобулин (моча), мг/л |
<0,252 |
0,098-0,32 |
|
|
Гомоцистеин, мкмоль/л |
15,46 |
5,46-16,2 |
|
|
Креатинин, мкмоль/л |
64 |
62-115 |
|
|
Остаточный азот, ммоль/л |
15,0 |
7,06-14,1 |
|
|
Мочевина, ммоль/л |
3,8 |
3,3-6,6 |
|
|
Расчетная СКФ мл/мин/1,73м2, по креатинину |
89 |
90-130 |
|
|
Примечание: СКФ – скорость клубочковой фильтрации. |
|||
Известно, что в результате одновременной активации коагуляции и спонтанного фибринолиза уровень D-димера в крови повышается. Как отмечено в международных рекомендациях «негативный результат» высокочувствительного определения D-димера надежно исключает тромбоэмболию легочной артерии у больных с низкой и средней вероятностью тромбообразования. Между тем, при наличии клинической картины тромбоэмболии нормальный результат не исключает тромбоэмболию легочной артерии с достаточной надежностью, несмотря на применение высокочувствительных анализов. Можно заметить, что у нашей пациентки существенных отклонений в цитокиновом статусе отмечено не было (Таблица 2).
Вместе с тем, содержание С-реактивного белка в крови было в пределах нормы. Этот факт полностью подтверждает мнение о том, что для ИЛФ свойственно невыраженное воспаление. Фактор роста эндотелия сосудов является важнейшим положительным регулятором ангиогенеза и имеет множество эффектов, направленных на развитие и сохранность сосудистой сети в ткани. Роль ангиогенеза в прогрессировании ИЛФ, механизмы образования кровеносных сосудов, методы оценки локального легочного ангиогенеза, а также особенности применения иммуногистохимических маркеров эндотелия сосудов для выявления формирующихся сосудов с целью оценки агрессивности прогноза фиброза все еще исследуются. Общепризнано, что фактор роста эндотелия сосудов (VEGF) — это универсальный активатор неоангиогенеза в тканях, в том числе и легких. У нашей пациентки уровень VEGF равнялся 172,08 пг/мл (норма до 700). По данным литературы, VEGF является наиболее важным цитокином, влияет на дифференцировку клеток эндотелия, их миграцию, пролиферацию и образование сосудов. Повышенные уровни VEGF усиливают проницаемость сосудов и способствует проникновению белков плазмы крови в тканевое внеклеточное пространство.
Следовательно, VEGF запускает миграцию эндотелиальных клеток, активный протеолиз внеклеточного матрикса, а также участвует в регуляции клеточной адгезии и модуляции иммунных свойств. Учитывая возраст, наличие артериальной гипертензии и дыхательной недостаточности нами были исследованы параметры функционального статуса почек (табл.2). Примечательно, что биологические маркеры поражения почек у нашей пациентки обнаружены не были. Показатель CYFRA-21-1 также был в пределах референсных значений. CYFRA-21-1 является маркером немелкоклеточной карциномы легкого. При ИЛФ возможен его незначительный подъем. В отдельных работах, посвященных ИЛФ, продемонстрировано небольшое повышение уровня CYFRA-21-1 [30].
При рассмотрении параметров эхокардиографии был зафиксирован подъем легочного артериального давления (42 мм рт. ст.). Расширение полостей сердца и изменение сократительной функции желудочков выявлены не были. Как сказано выше, учитывая факторы риска ИЛФ, нашему пациенту были рекомендованы эзофагогастроскопия и фибробронхоскопия, результаты которых приведены ниже.
Фибробронхоскопия. Голосовая щель смыкается при фонации, трахея проходима, хрящевой рельеф сохранен. Бифуркация по средней линии. Справа. Долевые, сегментарные бронхи проходимы, устья сегментарных бронхов округлые, шпоры острые, слизистая гиперемирована, секрет верхней слизистой в умеренном количестве. Слева. Долевые, сегментарные бронхи проходимы, устья сегментарных бронхов округлые, шпоры острые, слизистая гиперемирована, секрет верхней слизистой в умеренном количестве. Заключение. Двусторонний катаральный эндобронхит II степени. При ультразвуковом исследовании внутренних органов каких-либо отклонений обнаружено не было.
Таблица 3.
ДАННЫЕ ЭХОКГ ИССЛЕДОВАНИЙ (пациентка У., 63 г) Исследования выполнены на аппарате GE Vivid Q (США)
|
Показатель |
06.04.2021 |
Референсные значения |
|
Аорта в восходящем отделе, см |
3,1 |
2,0-4,0 |
|
Конечный диастолический размер левого желудочка, см |
4,1 |
4,0-5,5 |
|
Конечный систолический размер левого желудочка, см |
2,8 |
2,5-3,8 |
|
Конечный диастолический объем левого желудочка, мл |
84 |
59-157 |
|
Конечный систолический объем левого желудочка, мл |
30 |
18-68 |
|
Ударный объем левого желудочка, мл |
54 |
44-100 |
|
Толщина задней стенки левого желудочка, см |
0,9 |
0,6-1,0 |
|
Толщина межжелудочковой перегородки, см |
0,9 |
0,6-1,0 |
|
Фракция выброса левого желудочка, % (Simpson) |
65 |
>52 |
|
Продольный размер правого желудочка, см |
2,8 |
<3,0 |
|
Толщина передней стенки правого желудочка, см |
0,5 |
<0,5 |
|
Размер левого предсердие, см |
3,6 |
1,9-4,0 |
|
Систолическое легочное АД, мм рт.ст. |
42 |
<35 |
|
Диаметр легочной артерии, см |
3,2 |
<2,8 |
|
Систолическая экскурсия плоскости трикуспидального кольца в M режиме, см |
2,7 |
>1,7 |
Клинический диагноз. Идиопатический легочный фиброз, медленно прогрессирующее течение, обострение. Двусторонний катаральный эндобронхит II степени. Хроническая дыхательная недостаточность I степени. Легочная гипертензия. Артериальная гипертензия. Смешанный гастрит. Проведена терапия: глюкокортикоиды, N-ацетилцистеин, нинтеданиб, антиагреганты и антикоагулянты, антагонисты кальция. На сегодняшний день пациентка вернулась в родное село, на фоне проводимой терапии отмечает улучшение самочувствия, уменьшение одышки, кашля, снижение утомляемости.
В заключение надо отметить следующее: идиопатический легочный фиброз –это хроническое прогрессирующее заболевание, с точно неустановленной этиологией. В реальной клинической практике не всегда удается верифицировать ИЛФ ввиду отсутствия специфических биомаркеров. Диагноз ИЛФ опирается на тщательный сбор жалоб, анамнеза и анализ факторов риска ИЛФ. Необходимо помнить, что ИЛФ — это единственная интерстициальная пневмония, которая при наличии типичного КТ-паттерна и клинической картины позволяет с вероятностью 95% поставить правильный диагноз.
Список литературы Идиопатический легочный фиброз в практике врача-терапевта
- Авдеев С. Н., Гайнитдинова В. В., Мержоева З. М., Неклюдова Г. В., Царева Н. А., Нуралиева Г. С. Обострение идиопатического легочного фиброза // Терапевтический архив. 2020. Т. 92. №. 3. С. 73-77. https://doi.org/10.26442/00403660.2020.03.000402
- Авдеев С. Н. Идиопатический легочный фиброз // Consilium Medicum. 2017. Т. 19. №3. C. 17-23.
- Verleden S. E., Tanabe N., McDonough J. E., Vasilescu D. M., Xu F., Wuyts W. A., Hogg J. C. Small airways pathology in idiopathic pulmonary fibrosis: a retrospective cohort study // The Lancet Respiratory Medicine. 2020. V. 8. №6. P. 573-584. https://doi.org/10.1016/S2213-2600(19)30356-X
- Фомин В. В., Попова Е. Н., Лебедева М. В. Идиопатический легочный фиброз: близки ли мы к общепринятым стандартам диагностики и лечения // Фарматека. 2012. Т. 5. С. 10-14.
- Бровко М. Ю., Акулкина Л. А., Шоломова В. И., Лебедева М. В. Идиопатический легочный фиброз (ИЛФ): современный подход к классификации и диагностике // Клиническая фармакология и терапия. 2018. Т. 27. №2. С. 43-49.
- Бекетов В. Д., Мухин Н. А. Клиническое значение определения серологических сурфактантных протеинов A и D и других биологических маркеров в диагностике саркоидоза и идиопатического легочного фиброза // Клиническая фармакология и терапия. 2017. Т. 26. №4. С. 73-78.
- Shenderov, K., Collins, S. L., Powell, J. D., & Horton, M. R. Immune dysregulation as a driver of idiopathic pulmonary fibrosis // Journal of Clinical Investigation. 2021. V. 131. №2. P. e143226. https://doi.org/10.1172/JCI143226
- Leavy O. C., Ma S. F., Molyneaux P. L., Maher T. M., Oldham J. M., Flores C., Allen R. J. Proportion of Idiopathic pulmonary fibrosis risk explained by known common genetic loci in european populations // American journal of respiratory and critical care medicine. 2021. V. 203. №6. P. 775-778. https://doi.org/10.1164/rccm.202008-3211LE
- King Jr, T. E., Tooze, J. A., Schwarz, M. I., Brown, K. R., & Cherniack, R. M. Predicting survival in idiopathic pulmonary fibrosis: scoring system and survival model // American journal of respiratory and critical care medicine. 2001. V. 164. №7. P. 1171-1181. https://doi.org/10.1164/ajrccm.164.7.2003140
- Strongman H., Kausar I., Maher T. M. Incidence, prevalence, and survival of patients with idiopathic pulmonary fibrosis in the UK //Advances in therapy. - 2018. - Т. 35. - №. 5. - С. 724736. https://doi.org/10.1007/s12325-018-0693-1
- Аверьянов А.В., Лесняк В.Н. От идиопатического фиброзирующего альвеолита к идиопатическому легочному фиброзу (часть II) // Клиническая практика. 2016. №4(28). https://doi.org/10.17816/clinpract7458-65
- Raghu G., Weycker D., Edelsberg J., Bradford W. Z., Oster G. Incidence and prevalence of idiopathic pulmonary fibrosis // American journal of respiratory and critical care medicine. 2006. V. 174. №7. P. 810-816. https://doi.org/10.1164/rccm.200602-1630C
- Raghu G., Chen S. Y., Hou Q., Yeh W. S., Collard H. R. Incidence and prevalence of idiopathic pulmonary fibrosis in US adults 18-64 years old // European Respiratory Journal. 2016. V. 48. №1. P. 179-186. https://doi.org/10.1183/13993003.01653-2015
- Pérez E. R. F., Daniels C. E., Sauver J. S., Hartman T. E., Bartholmai B. J., Eunhee S. Y., Schroeder D. R.Incidence, prevalence, and clinical course of idiopathic pulmonary fibrosis: a population-based study // Chest. 2010. V. 137. №1. P. 129-137. https://doi.org/10.1378/chest.09-1002
- Raghu G., Collard H. R., Egan J. J., Martinez F. J., Behr J., Brown K. K., Schunemann H. J. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management // American journal of respiratory and critical care medicine. 2011. V. 183. №6. P. 788-824. https://doi.org/10.1164/rccm.2009-040GL
- Spencer L. G., Loughenbury M., Chaudhuri N., Spiteri M., Parfrey H. Idiopathic pulmonary fibrosis in the UK: analysis of the British Thoracic Society electronic registry between 2013 and 2019 // ERJ open research. 2021. V. 7. №1. https://doi.org/10.1183/23120541.00187-2020
- She Y. X., Yu Q. Y., Tang X. X. Role of interleukins in the pathogenesis of pulmonary fibrosis // Cell Death Discovery. 2021. V. 7. №1. P. 1-10. https://doi.org/10.1038/s41420-021-00437-9
- Figueroa M. C. G. S., Carrillo G., Pérez-Padilla R., Fernández-Plata M. R., Buendía-Roldán I., Vargas M. H., Selman M. Risk factors for idiopathic pulmonary fibrosis in a Mexican population. A case-control study // Respiratory medicine. 2010. V. 104. №2. P. 305-309. https://doi.org/10.1016/j.rmed.2009.08.013
- Bai L., Zhang L., Pan T., Wang W., Wang D., Turner C., He H. Idiopathic pulmonary fibrosis and diabetes mellitus: a meta-analysis and systematic review //Respiratory Research. 2021. V. 22. №1. P. 1-10. https://doi.org/10.1186/s12931-021-01760-6
- Talbert J. L., Schwartz D. A., Steele M. P. Familial interstitial pneumonia (FIP) // Clinical pulmonary medicine. 2014. V. 21. №3. P. 120. https://www.ncbi.nlm.nih.gov/pubmed/25506193
- Seibold M. A., Wise A. L., Speer M. C., Steele M. P., Brown K. K., Loyd J. E., Schwartz D. A. A common MUC5B promoter polymorphism and pulmonary fibrosis // New England Journal of Medicine. 2011. V. 364. №16. P. 1503-1512. https://doi.org/10.1056/NEJMoa1013660
- Чучалин А. Г., Авдеев С. Н., Айсанов З. Р., Белевский А. С., Демура С. А., Илькович М. М., Коган Е. А., Самсонова М. В., Сперанская А. А., Тюрин И. Е., Черняев А. Л., Черняк Б. А., Черняк А. В., Шмелев Е. И. Диагностика и лечение идиопатического легочного фиброза Федеральные клинические рекомендации // Пульмонология. 2016. V. 26. №4. P. 399419. https://doi.org/10.18093/0869-0189-2016-26-4-399-419
- Barros A., Oldham J., Noth I. Genetics of idiopathic pulmonary fibrosis // The American journal of the medical sciences. 2019. V. 357. №5. P. 379-383. https://doi.org/10.1016/j.amjms.2019.02.009
- Mathai S. K., Schwartz D. A. Genetics of Idiopathic Pulmonary Fibrosis // Precision in Pulmonary, Critical Care, and Sleep Medicine. Humana, Cham, 2020. P. 71-85. https://doi.org/10.1007/978-3-030-31507-8_6
- Pardo A., Selman M. The interplay of the genetic architecture, aging, and environmental factors in the pathogenesis of idiopathic pulmonary fibrosis // American Journal of Respiratory Cell and Molecular Biology. 2021. V. 64. №2. P. 163-172. https://doi.org/10.1165/rcmb.2020-0373PS
- Luppi F., Kalluri M., Faverio P., Kreuter M., Ferrara G. Idiopathic pulmonary fibrosis beyond the lung: understanding disease mechanisms to improve diagnosis and management // Respiratory Research. 2021. V. 22. №1. P. 1-16. https://doi.org/10.1186/s12931-021-01711-1
- Муркамилов И. Т., Сабиров И. С., Фомин В. В., Айтбаев К. А., Юсупов Ф. А. Идиопатический легочный фиброз: распространенность и факторы риска (обзор литературы) // The Scientific Heritage. 2020. №49-2. С. 41-48.
- Муркамилов И.Т., Сабиров И.С., Фомин В.В., Айтбаев К.А., Юсупов Ф.А. Идиопатический легочный фиброз: современный взгляд на проблему лечения (обзор литературы) // The Scientific Heritage. 2020. №50-2. C. 21-28.
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Муркамилова Ж. А., Юсупов Ф. А., Айдаров З. А., Байжигитова А. А. Клиническая эффективность применения ривароксабана у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка // Бюллетень науки и практики. 2021. Т. 7. №1. С. 132-157. https://doi.org/10.33619/2414-2948/62/15
- Лукашенко М. В. Идиопатический фиброз легких: разбор клинического случая // // Вестник Биомедицина и социология. 2018. Т. 3. №4. С. 86-88.


