IFN-индуцированные дендритные клетки у больных множественной миеломой
Автор: Леплина О.Ю., Насонова Г.В., Тихонова М.А., Крючкова И.В., Лисуков И.А., Останин А.А., Черных Е.Р.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (36), 2009 года.
Бесплатный доступ
Проведено сравнительное исследование фенотипических и функциональных свойств дендритных клеток (ДК), генери- рованных in vitro в присутствии GM-CSF и IFN-α, у здоровых доноров (n=34) и больных множественной миеломой (n=12). Показано, что по своему составу (количеству зрелых/незрелых ДК и клеток промежуточной степени зрелости) популяция ДК больных в целом была сопоставима с ДК здоровых доноров. ДК больных множественной миеломой (ММ) не отличались от ДК доноров по уровню продукции IFN-γ и TNF-α. В то же время ДК больных характеризовались более низким содержанием активированных CD25+клеток в сочетании с повышенной продукцией IL-10, что, по-видимому, обусловливало ослабление их стимуляторной активности в СКЛ. Тем не менее ДК больных ММ сохраняли свою способность к запуску Th1-ответа, что проявлялось 5-кратным увеличением количества CD3+IFN-γ+ Т-клеток. Полученные данные аргументируют возмож- ность клинического применения ДК у больных ММ в качестве клеточных вакцин (особенно в сочетании с адъювантной цитокинотерапией) с целью повышения эффективности противоопухолевого иммунного ответа.
Множественная миелома, дендритные клетки, th1/th2 цитокины, скл
Короткий адрес: https://sciup.org/14055197
IDR: 14055197 | УДК: 616-006.448:612.017.1
Текст научной статьи IFN-индуцированные дендритные клетки у больных множественной миеломой
Множественная миелома (ММ) является В-клеточным лимфопролиферативным заболеванием, которое характеризуется клональной пролиферацией в костном мозге (реже – в экстрамедуллярных очагах) атипичных плазматических клеток, продуцирующих моноклональный иммуноглобулин и/или свободные моноклональные легкие цепи иммуноглобулинов (к или λ). В структуре гемобластозов доля ММ составляет 10%, при этом в России ежегодно погибает более 10 000 больных с данной патологией. Современные подходы в лечении ММ предполагают использование высокодозной полихимиотерапии (ПХТ) мелфаланом с последующей аутотрансплантацией периферических стволовых кроветворных клеток (СКК). Другой подход заключается в проведении повторных курсов ПХТ с трансплантацией аутологичных СКК после каждого курса химиотерапии («тандемная» трансплантация). Но даже такая комплексная терапия не предотвращает развитие рецидивов.
С целью контроля минимальной остаточной болезни и для поддержания ремиссии после ВДХ назначается интерферон- α (IFN- α ). Несмотря на то, что поддерживающая терапия позволяет в ряде случаев увеличивать продолжительность ремиссии, достичь увеличения продолжительности жизни при этом не удается. Общий прогноз при множественной миеломе неблагоприятный.
Это делает актуальным поиск новых подходов к лечению данного заболевания.
Известно, что ключевую роль в распознавании опухолевого антигена и презентации его специфическим цитотоксическим Т-клеткам играют дендритные клетки (ДК), способные инициировать иммунный ответ [5, 13]. Соответственно, создание лечебных вакцин на основе ДК рассматривается в качестве одного из новых подходов в комплексной терапии опухолевых заболеваний [3, 4, 9, 20].
Как правило, ДК получают in vitro из прилипающей фракции мононуклеарных клеток (МНК) периферической крови. Классическим считается протокол генерации ДК путем культивирования моноцитов крови в присутствии GM-CSF и IL-4 в течение 5–7 дней (незрелые ДК) с последующей стимуляцией их созревания в течение 24–48 ч с различными факторами (зрелые ДК) [18]. В последние годы в литературе появились данные о возможности быстрой генерации частично зрелых ДК с помощью GM-CSF и IFN- α [16]. Отличительными особенностями данного типа ДК (IFN-ДК) являются высокая способность к захвату антигена; высокая миграционная активность за счет экспрессии хемокинового рецептора ССR7; функциональная стабильность в отсутствие ростовых факторов; способность индуцировать как Th1-, так и Th2-ответ; а также секретировать IFN- α , обладающий противовирусной и противоопухолевой активностью [11]. Тем не менее исследование возможности генерации и характеристика IFN-ДК при ММ ранее не проводилось. Исходя из этого, целью работы явилось изучение фенотипических и функциональных свойств IFN α -индуцированных ДК у больных множественной миеломой.
Материал и методы
МНК выделяли из гепаринизированной венозной крови центрифугированием в градиенте плотности фиколла-верографина. Моноциты выделяли на чашках Петри (Nuclon, Дания) путем прилипания к пластику МНК (2–5×106 клеток/мл) в присутствии 10 % сыворотки крови АВ (IV) группы. Для генерации ДК моноциты культивировали во флаконах (BD Biosciences Falcon, Великобритания) в течение 3 сут в среде RPMI-1640 (Sigma-Aldrich, США), дополненной 0,3 мг/мл L-глутамина, 5мМ HEPES-буфера, 100 мкг/мл гентамицина и 5 % сыворотки плодов коровы («БиоЛот», СПб.), в присутствии GM-CSF (40 нг/мл, Sigma-Aldrich, США) и INF-α (1000 Ед/мл, Роферон-А, Roche, Швейцария) с последующим дозреванием с липополисахаридом (10 мкг/мл, LPS E. coli 0114:В4, Sigma-Aldrich, США) в течение 24 ч.
Фенотипический анализ ДК проводили методом одноцветной или двуцветной проточной цитофлюориметрии (FACSCalibur, Becton Dickinson, США) с использованием FITS- или PE-меченных моноклональных антител (CD83, CD1a, CD11c, CD14, CD25, CD123; PharMingen, США). Аллостимуляторную активность ДК оценивали в смешанной культуре лимфоцитов (СКЛ). В качестве отвечающих клеток использовались МНК доноров (0,1×106/лунку), которые культивировали в 96-луночных круглодонных планшетах для иммунологических исследований в среде RPMI-1640 (как описано выше) с 10 % инактивированной сыворотки крови АВ (IV) группы при 37°С в СО2-инкубаторе. Стимуляторами служили аллогенные IFN-ДК здоровых доноров или больных ММ в соотношении МНК:ДК = 10:1. Пролиферативный ответ в СКЛ оценивали на 5 сут радиометрически по включению 3H-тимидина (1 мкКю/лунку), вносимого за 18 ч до окончания культивирования.
В культуральных супернатантах, генерированных IFN-ДК, определяли концентрацию IFN-γ, IL-4, IL-10 и TNF-α с помощью соответствующих тест-систем для иммуноферментного
Клиническая и гематологическая характеристика больных ММ
Таблица 1
|
№ пациента |
Пол |
Возраст |
Изотип парапротеина |
Плазматические клетки в костном мозге, % |
Стадия |
Состояние здоровья |
Терапия |
|
1 |
Ж |
67 |
65 |
III |
Ремиссия |
Cy/Dexa+Велкейд |
|
|
2 |
Ж |
61 |
30 |
IIIБ |
Ремиссия |
Велкейд |
|
|
3 |
М |
49 |
IgG |
11,5 |
IIIА |
Ремиссия |
PAD |
|
4 |
Ж |
50 |
IgG |
31 |
II |
Ремиссия |
Нет |
|
5 |
Ж |
69 |
76 |
III |
Прогрессия |
Зомета |
|
|
6 |
М |
49 |
IgG |
10 |
III |
Ремиссия |
Велкейд |
|
7 |
Ж |
50 |
2 |
III |
Частичная ремиссия |
Нет |
|
|
8 |
М |
63 |
IgA |
48 |
III |
Частичная ремиссия |
Нет |
|
9 |
М |
46 |
IgA |
27 |
III |
Частичная ремиссия |
Нет |
|
10 |
М |
56 |
IgA |
6 |
III |
Частичная ремиссия |
Нет |
|
11 |
Ж |
67 |
IgG |
29,5 |
IIIБ |
Прогрессия |
VMmP |
|
12 |
Ж |
48 |
IgG |
8 |
III |
Прогрессия |
Нет |
анализа в соответствии с инструкцией фирмы-производителя («Вектор-Бест», Новосибирск).
Оценку экспрессии внутриклеточных цитокинов в популяции CD3+Т-лимфоцитов, стимулированных ДК, проводили методом трехцветной проточной цитометрии (FACSCalibur, «Becton Dickinson», США). Для этого МНК, истощенные от моноцитов, культивировали в 96-луночных планшетах в полной культуральной среде с 10 % сыворотки плодов коровы в отсутствие (контроль) и в присутствии (опыт) ДК в соотношении 10:1 в течение 72 ч. За 18 ч до конца инкубации в культуру добавляли брефел-дин (10 мкг/мл, «IСN», США), затем клетки отмывали и инкубировали 15 мин при комнатной температуре с APC-меченными моноклональными анти-CD3-антителами (Becton Dickinson, США). Далее проводили пермеабилизацию клеток с помощью 0,2 % раствора Твин-20 и инкубировали их с моноклональными FITC-конъюгированными анти-INF-γ антителами и PE-меченными анти-IL-4 (Becton Dickinson, США). В культурах МНК, истощенных от моноцитов (МНК0) и активированных ДК (МНК + ДК) здоровых доноров и больных ММ, определяли относительное содержание CD3+Т-клеток с внутриклеточной экспрессией IFN-γ и IL-4, при этом рассчитывали соответствующие индексы влияния ДК (ИВДК) на количество Т-клеток, экспрессирующих IFN-γ и IL-4, по формуле ИВДК = опыт/контроль.
Математическую обработку полученных результатов проводили с помощью пакета программ Statistica 6.0.
Результаты и обсуждение
Популяция прилипающих к пластику клеток у больных ММ, так же как и у здоровых доноров, была представлена преимущественно CD14+ моноцитами (77,6 ± 1,9 и 81,3 ± 2,3 % соответственно). В результате культивирования моноцитов с GM-CSF и IFN-α в течение 3–4 сут клетки теряли способность прилипать к пластику и приобретали типичные морфологические черты дендритных клеток. Сравнительный фенотипический анализ показал (табл. 2), что в группе больных ММ среди генерируемых IFN-ДК отмечается повышенное содержание CD14+моноцитов. Тем не менее общее количество миелоидных CD11с+ДК у больных было достоверно выше, чем у доноров, при этом относительное число зрелых CD83+ДК сохранялось на уровне нормы. Однако в популяции генерируемых IFN-ДК больных отмечалось
|
статистически значимое снижение содержания активированных ДК, экспрессирующих CD25 (рецептор к α-цепи IL-2). Таблица 2 Фенотипическая характеристика IFN-ДК здоровых доноров и больных ММ |
||
|
Маркеры |
Доноры (n=18), % |
Больные ММ (n=12), % |
|
CD14 |
8,7 ± 1,4 |
17,7 ± 2,1* |
|
CD1a |
10,4 ± 2,0 |
7,1 ± 1,35 |
|
CD11c |
28,7 ± 2,2 |
48,0 ± 6,5* |
|
CD123 |
24,9 ± 2,6 |
23,8 ± 4,9 |
|
СD83 |
22,4 ± 2,4 |
22,5 ± 5,9 |
|
CD25 |
25,1 ± 3,5 |
7,7 ± 2,1* |
|
CD83 +CD1a- |
17,9 ± 2,5 |
18,3 ± 5,8 |
|
CD83 +CD1a+ |
4,6 ± 0,8 |
4,2 ± 0,8 |
|
CD83 -CD1a+ |
5,3 ± 1,7 |
3,0 ± 1,5 |
|
CD11с+CD123- |
19,8 ± 4,3 |
34,3 ± 5,3* |
|
CD11с+CD123+ |
7,3 ± 1,3 |
13,8 ± 3,2* |
|
CD11с-CD123+ |
14,3 ± 2,3 |
8,6 ± 1,6 |
Примечание: * – различия статистически значимые по сравнению с донорами (pU<0,05, U критерий Вилкоксона–Манна–Уитни).
Поскольку маркеры CD83 и CD1a характеризуют различные стадии созревания миелоидных ДК, дополнительно была проанализирована коэкспрессия CD83 и CD1а молекул на IFN-ДК. Популяция генерируемых ДК больных ММ была сопоставима с ДК здоровых доноров по количеству терминально дифференцированных ДК с фенотипом CD83+CD1а-, а также по числу незрелых CD83-CD1а+ДК и CD83+CD1а+клеток промежуточной степени зрелости.
Одной из особенностей IFN-ДК является наличие на них рецептора к IL-3 (CD123). Данный маркер высоко экспрессируется на плазмаци-тоидных ДК и практически отсутствует на ДК, генерируемых в присутствии GM-CSF и IL-4 [17]. ДК больных ММ не отличались от ДК доноров по относительному количеству СD123+ клеток (табл. 2). Результаты двуцветной цитофлюорометрии показали, что у доноров большая часть CD123+ клеток сосредоточена в популяции CD11c-негативных клеток, что позволяет отнести их к классу плазмацитоидноподобных ДК. В то же время у больных ММ CD123 маркер чаще обнаруживался среди миелоидных CD11c+ДК. Соответственно, у больных относительное количество CD11+CD123+-клеток практически в 2 раза превышало аналогичный показатель здоровых доноров (13,8 ± 3,2 % и 7,3 ± 1,3 %; pU<0,05).
Как известно, популяция IFN-ДК является гетерогенной в отношении степени зрелости клеток , из которых только 25–30 % экспрессируют маркеры зрелых и активированных ДК (CD83 и CD25 соответственно) [11], что соответствует полученным нами данным в группе здоровых доноров. По группе обследованных нами больных ММ можно заключить, что при данной патологии в культуре in vitro генерируется популяция ДК, в целом сопоставимая с аналогичной популяцией здоровых доноров. Несмотря на то, что среди ДК больных оставалось повышенным относительное количество CD14+моноцитов, а доля активированных CD25+ДК была достоверно ниже, тем не менее у больных генерировалось большее количество миелоидных CD11c+ДК (48,0 ± 6,5 % против 28,7 ± 2,2% у доноров, pU<0,05), при этом среди них сохранялись нормальные пропорции зрелых CD83+ДК, включая терминально дифференцированные CD83+CD1а-клетки, и незрелых CD83-CD1а+ДК, а также CD83+CD1а+ клеток промежуточной степени зрелости.
Особенностью ДК, генерируемых у больных ММ, является увеличение относительного количества миелоидных CD11c+клеток ко-экспрессирующих CD123 (рецептор к IL-3). Поскольку известно, что IFN-α способен блокировать снижение экспрессии CD123 на моноцитах по мере их дифференцировки в ДК, то увеличение CD11c+CD123+ клеток может быть связано с функциональными особенностями моноцитов больных ММ. Кроме того, нельзя исключить наличие среди прилипающих к пластику клеток предшественников плазмацитоидных ДК. Однако в отличие от здоровых доноров у больных ММ CD123+ клетки преимущественно локализованы среди CD11c+ДК, что в сочетании с более низким числом плазмацитоидноподоб-ных CD11с-CD123+ДК снижает вероятность высказанного предположения.
Учитывая потенциальную возможность использования IFN-ДК в качестве клеточной основы при создании терапевтических вакцин для лечения гемобластозов, представлялось важным оценить функциональную активность
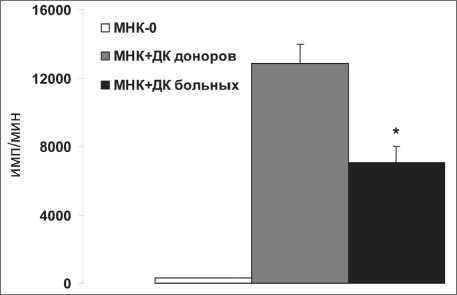
Рис. 1. Аллостимуляторная активность ДК здоровых доноров и больных ММ.
МНК доноров (0,1×106/лунку) культивировали в течение
5 сут в отсутствие (МНК-0) или в присутствии аллогенных ДК здоровых доноров (n=34) или больных ММ (n=12) в соотношении 10:1.
Примечание: интенсивность пролиферации (имп/мин) в СКЛ представлена в виде M ± S.E. * – различия статистически значимы по сравнению с ДК доноров (рU <0,05)
ДК, генерируемых у больных ММ. С этой целью был проведен сравнительный анализ аллости-муляторной активности ДК здоровых доноров и больных ММ в СКЛ (рис. 1). Было выявлено умеренное, но статистически значимое снижение уровня пролиферативного ответа в СКЛ в присутствии ДК больных (7093 ± 913 против 12880 ± 1100 имп/мин у доноров, pU<0,05). Полученные результаты свидетельствуют о нарушении антигенпрезентирующей функции IFN-ДК, полученных от больных ММ.
Поскольку способность ДК активировать
Т-клетки во многом связана со спектром и уровнем продуцируемых ими цитокинов, дополнительно была исследована продукция Th1/ про- (IFN-γ/TNF-α) и Th2/противовоспалитель-ных (IL-4/IL-10) цитокинов в культуральных супернатантах IFN-ДК (рис. 2). Оказалось, что ДК больных ММ активно секретировали IFN-γ и TNF-α на достаточно высоком уровне, сопоставимом со средними значениями здоровых доноров. Продукция IL-4 была минимальной и в обеих анализируемых группах находилась на нижней границе чувствительности иммунофер-ментных тест-систем (<5 пг/мл). В то же время ДК больных ММ характеризовались повышенной способностью секретировать IL-10 (110 ± 36 против 82 ± 13 пг/мл у доноров, pU<0,05). При этом у 50 % обследованных больных ММ (6/12) индивидуальные значения продукции IL-10 выходили за верхнюю границу квартильного диапазона нормы (>93 пг/мл). Можно полагать, что выявленное ранее снижение аллостимуляторной активности ДК больных в СКЛ обусловлено не столько дефектом их антигенпрезентирующей функции, сколько повышенной супрессорной активностью, которая опосредуется через синтез IL-10.
Следует отметить, что пролиферативный ответ МНК в присутствии ДК больных ММ был снижен в среднем на 45 % по сравнению с уровнем ответа в присутствии ДК здоровых доноров. Иными словами, примерно половина Т-клеток все-таки пролиферировала в ответ на аллоантигены, представленные дендритными клетками больных. Чтобы выяснить, какой тип
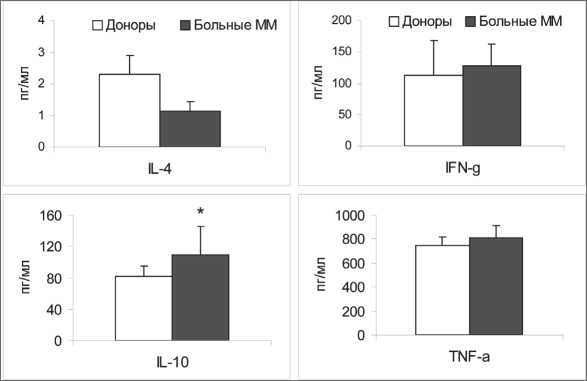
Рис. 2. Концентрация цитокинов в культуральных супернатантах ДК здоровых доноров и больных ММ. Содержание IFN-γ, IL-4, IL-10 и TNF-α (пг/мл, M ± S.E.) измеряли в супернатантах генерируемых культур IFN-ДК здоровых доноров (n=17) и больных ММ (n=12). Примечание: * – различия статистически значимы по сравнению с ДК доноров (рU<0,05)
Влияние ДК здоровых доноров и больных ММ на внутриклеточную экспрессию Т-клетками IFN-γ и IL-4
Таблица 3
|
Источник ДК |
CD3+ IFN-γ+ Т-клетки, % |
CD3+ IL-4+ Т-клетки, % |
||||
|
МНК0 |
МНК + ДК |
ИВДК |
МНК0 |
МНК + ДК |
ИВДК |
|
|
Доноры (n=18) |
1,83 ± 0,3 |
6,35 ± 0,61 |
5,4 ± 1,1 |
1,3 ± 0,2 |
1,6 ± 0,3 |
1,6 ± 0,3 |
|
Больные (n=12) |
1,36 ± 0,1 |
6,11 ± 0,58 |
5,5 ± 1,4 |
1,9 ± 0,1 |
2,3 ± 1,1 |
2,0 ± 0,2 |
Примечание: ИВДК – индекс влияния ДК на количество Т-клеток, экспрессирующих IFN-γ и IL-4.
Т-лимфоцитов преимущественно активируется в присутствии IFN-ДК, была исследована внутриклеточная экспрессия Т-клетками IFN-γ и IL-4 в СКЛ (табл. 3). Видно, что стимуляция МНК дендритными клетками здоровых доноров приводила к четкому усилению внутриклеточной продукции IFN-γ в популяции Т-лимфоцитов, что проявлялось 5-кратным увеличением количества CD3+IFN-γ+ Т-клеток. В то же время активация внутриклеточной продукции IL-4 в популяции CD3+Т-клеток была слабовыражен-ной (ИВ=1,6 ± 0,3). ДК больных ММ обладали сходной с донорами стимулирующей активностью в отношении внутриклеточной продукции IFN-γ (ИВДК 5,5 ± 1,4 против 5,4±1,1 расч.ед. у доноров) и такой же низкой Th2-поляризующей активностью (ИВДК в отношении CD3+IL-4+Т-клеток составил 2,0 ± 0,2 расч.ед.). Таким образом, IFN-ДК больных, так же как и ДК доноров, активируют преимущественно Th1 ответ.
В литературе имеются противоречивые данные о количестве и функциональной активности ДК у больных ММ. Так, в отдельных работах показано, что пациенты с ММ характеризуются пониженным содержанием и/или функциональной дефектностью дендритных клеток [10, 15]. В то же время ряд других исследователей отмечают только функциональные (но не количественные) нарушения ДК [7, 8], тогда как, по данным N. Raje et al., ДК, генерированные из МНК костного мозга или периферической крови больных ММ, вообще являются фенотипически и функционально нормальными [14]. Не менее противоречивыми являются данные относительно экспрессии маркеров зрелости и аллостимуляторной активности ДК при множественной миеломе [7, 8, 10, 14, 15].
Следует отметить, что в большинстве на- учных работ, в том числе посвященных ММ, исследуются ДК, генерированные in vitro по «классическому» протоколу с использованием GM-CSF и IL-4 [18]. Однако является ли данный путь генерации ДК физиологичным, остается спорным вопросом, поскольку продукция большого количества IL-4 в естественных условиях представляется маловероятной. Кроме того, имеются данные, что ДК, полученные с помощью GM-CSF/IL-4, характеризуются in vivo слабой миграционной активностью и низкой стабильностью в отсутствие цитокинов [19]. С этой точки зрения большой интерес представляют ДК, генерируемые в присутствии GM-CSF и IFN-α. Как известно, помимо антивирусной активности, IFN-α обладает выраженным стимулирующим эффектом на клеточный и гуморальный иммунитет и индуцирует быструю дифференцировку моноцитов в ДК с высокой миграционной активностью. Кроме того, IFN-α продуцируется в больших количествах в ответ на стимуляцию инфекционными антигенами и провоспалительными цитокинами, и, следовательно, активация системы интерферонов, возможно, отражает ранний и более физиологичный путь генерации ДК in vivo в ответ на инфекцию и опухолевую прогрессию [6, 17].
Задержка созревания и нарушение функций ДК являются характерным проявлением опухолевой иммуносупрессии при многих онкологических заболеваниях [12]. Дисфункции ДК являются, очевидно, одним из критических механизмов ускользания опухоли от иммунного ответа. Нарушение созревания ДК при опухолевом росте обычно связывают с изменением цитокинового микроокружения, в частности снижением уровня цитокинов, стимулирующих дифференцировку ДК, и увеличением кон- центрации факторов, ингибирующих данный процесс. Кроме того, дефект ДК у больных гемобластозами может быть обусловлен также изменением функциональных свойств моноцитов, которые являются источником генерации ДК. Так, согласно полученным нами ранее данным, проведение ПХТ у больных лимфомами индуцирует супрессорную активность моноцитов, в том числе за счет увеличения продукции ИЛ-10 [1, 2]. В то же время хорошо известно, что дифференцировка ДК в присутствии IL-10 существенно ингибируется, а генерируемые ДК характеризуются толерогенными свойствами.
В целом проведенные нами исследования продемонстрировали возможность генерации у больных миеломной болезнью IFN-ДК, которые обладают определенными фенотипическими и функциональными особенностями. По своему составу (количеству зрелых/незрелых ДК и клеток промежуточной степени зрелости) популяция ДК больных в целом была сопоставима с ДК здоровых доноров. Отличия заключались в более низком содержании активированных CD25+клеток в сочетании с повышенной продукцией IL-10, что, по-видимому, и приводит к ослаблению их стимуляторной активности в СКЛ. Тем не менее ДК больных ММ сохраняют свою способность к запуску Th1-ответа, что демонстрирует принципиальную возможность их клинического применения в качестве лечебных, клеточных вакцин с целью индукции противоопухолевого иммунного ответа. Можно полагать, что действие дендритноклеточных вакцин у больных ММ может быть более эффективным в комбинации с адъювантной цитокинотерапией (например, с использованием препаратов рекомбинантного IL-2 и/или интерферона-α), которая позволит нивелировать иммуносупрессорные эффекты IL-10 и активировать in vivo дополнительное количество ДК и цитотоксических Т-лимфоцитов, участвующих в запуске и развитии противоопухолевого иммунного ответа.


