Иммобилизация лакказы на глинистых минералах как перспективный способ связывания углерода в почвах
Автор: Заварзина А.Г., Демин В.В., Лисов А.В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 124, 2025 года.
Бесплатный доступ
Понимание механизмов, обеспечивающих накопление и стабилизацию углерода в почвах, необходимо для сохранения и повышения их секвестрационного потенциала, а также внедрения практик устойчивого землепользования при переводе почв в сельскохозяйственное использование. Целью работы было выявить роль фермента лакказы в связывании ароматического углерода минеральными фазами почв при концентрациях фенольных субстратов, близких к природным условиям. Лакказу гриба белой гнили древесины Cerrena unicolor (ВКМ F-3196) сорбировали на иллите и каолините, модифицированном гидроксидом алюминия – каолинит-Al(OH)x. В качестве абиогенного катализатора сравнения был взят один из распространенных природных оксидов марганца (IV) – пиролюзит b- MnO2. Окислительная активность минеральных фаз с 1 мМ АБТС (диаммониевая соль 2,2'-азино-бис-(3-этилбензтиозолин-6- сульфокислоты) при рН 4.5 составляла для пиролюзита 124 Ед/г, иллита – 0.25 Ед/г и отсутствовала у модифицированного каолинита. Активность лакказы, иммобилизованной на модифицированном каолините и иллите, составляла 1.17 и 0.82 Ед/г соответственно. Эквимолярную смесь галловой, протокатеховой, п-гидроксибензойной, сиреневой, ванилиновой, феруловой кислот (0.01 мМ каждой в 0.01 М KNO3, pH 4.7) инкубировали с минеральными фазами в течение 1, 24 и 72 часов. Убыль кислот определяли методом обращенно-фазовой высокоэффективной жидкостной хроматографии, а растворенного углерода – на ТОС-L анализаторе. Наибольшая реакционная способность при взаимодействии со всеми минералами установлена для галловой кислоты (40–100% убыль за сутки) и в меньшей степени – протокатеховой (19–100% убыль за сутки). п-Гидроксибензойная кислота реагировала только с иллитом, а ванилиновая – только с пиролюзитом (50% убыль за сутки). Значимая трансформация сиреневой и феруловой кислот (80–100% за сутки) выявлена только в присутствии пиролюзита и комплекса “модифицированный каолинит-лакказа”. При меньшей (на 2 порядка) окислительной активности и меньшей (в 3 раза) площади поверхности (18 м2/г vs 54 м2/г у b-MnO2), комплекс каолинит-Al(OH)x- лакказа связывал за сутки количество углерода, сопоставимое с пиролюзитом (6.5 г/кг), а за трое суток – в 1.1 раза большее (7.3 г/кг). При близкой к комплексу модифицированный каолинит-лакказа активности и высокой площади поверхности (100 м2/г), количество углерода, связанного с иллитом в присутствии лакказы было в 3 раза меньше (1.7 г/кг). Лакказа усиливала связывание углерода с модифицированным каолинитом и иллитом в 2–3 раза. Результаты работы показывают важную роль лакказы и гидроксидов металлов в стабилизации Сорг. Сохранение и повышение природного уровня активности лакказ в почвах за счет регулирования рН и влажности, а также внесение препаратов лакказы в иммобилизованной форме в почвы может быть перспективным подходом для повышения секвестрационного потенциала почв агроландшафтов и обусловливает необходимость дальнейших исследований в данной области.
Органическое вещество почв, лакказа, оксид марганца, органо-минеральные взаимодействия
Короткий адрес: https://sciup.org/143184853
IDR: 143184853 | УДК: 631.4 | DOI: 10.19047/0136-1694-2025-124-272-308
Текст научной статьи Иммобилизация лакказы на глинистых минералах как перспективный способ связывания углерода в почвах
1 Leninskie Gori, Moscow 119234, Russian Federation, *, e-mail:
Почвы являются главным резервуаром органического углерода в наземных экосистемах. Запасы углерода в метровом слое почв составляют 1 500 Гт и втрое превышают таковые в биомассе (550 Гт) (Batjes, 2014). Процесс связывания атмосферной CO2 в почвенное органическое вещество (ПОВ) во многом сформировал и определяет современный климат. Изменения климата и смена вида землепользования влияют на биологические и физикохимические факторы устойчивости ПОВ, что может привести к декарбонизации и дегумификации. Понимание механизмов, обеспечивающих накопление и стабилизацию углерода в почвах, необходимо для сохранения и повышения секвестрационного потенциала почв и внедрения практик устойчивого землепользования (Иванов и др., 2021).
Традиционные взгляды о биохимической устойчивости ПОВ за счет образования в процессе гумификации сложных для биодеструкции специфических соединений – гуминовых веществ (Орлов, 1990; Stevenson, 1994; Hayes and Swift, 2018), дополнены концепцией функциональной сложности ПОВ (Lehmann et al., 2020) и представлениями о ведущей роли органоминеральных взаимодействий в накоплении углерода в почвах (Семенов и др., 2013; Иванов и др., 2017; Lutzow et al., 2006; Lehmann, Kleber, 2015; Singh et al., 2018; Li et al., 2023). Часть поступающего в почву органического вещества подвергается минерализации и выделяется в окружающую среду в виде CO 2 , в то время как остальная часть стабилизируется и сохраняется в течение длительного времени в виде соединений с минеральной компонентой (Li et al., 2023). Известно, что среди почвенных минералов важную роль в стабилизации ПОВ играют оксиды/гидроксиды Fe и Al и глины (Sarkar et al., 2018; Li et al., 2023). Среди глинистых минералов в почве наиболее распространены минералы каолинит и иллит (Sarkar et al., 2018), представляющие собой двух- и трехслойные алюмосиликаты илистой фракции соответственно (Cоколова и др., 2005). По сравнению с иллитом, каолинит обладает относительно малой площадью поверхности, которую, однако, можно увеличить путем его модификации гидроксидом алюминия (Заварзина и др., 2018). Это придает минералу положительный заряд в почвенных условиях, так как точка нулевого заряда гиббсита составляет около 9.0 ± 0.61 (Kosmulski, 2009). В результате повышается сорбционная способность модифицированного каолинита по отношению к отрицательно заряженным органическим соединениям (Заварзина и др., 2020, 2022).
Несмотря на то, что процессы сорбции ПОВ минералами хорошо изучены (Колчанова и др., 2024), построение моделей стабилизации углерода в почве невозможно без учета протекающих в почвах реакций окислительной полимеризации (Li et al., 2023) или окислительного связывания (oxidative coupling, Sjaoblad, Bollag, 1981). Эти реакции лежат в основе конденсационной теории гумификации (Кононова, 1963; Stevenson, 1994). Их также называют реакциями вторичного синтеза (Stevenson, 1994) или гумификации (Bui et al., 2023). В этих реакциях фенольные соединения окисляются до феноксильных радикалов и хинонов, которые затем подвергаются спонтанной конденсации друг с другом, азотсодержащими соединениями и сахарами с образованием гетерогенных продуктов. Стадия окисления катализируется внеклеточными фе-нолоксидазами и пероксидазами микроорганизмов (de Nobili et al., 2020), а также абиогенными катализаторами, в первую очередь, ионами Fe (III) и Mn (IV) в составе почвенных минералов (Huang, Hardie, 2009; Bui et al., 2023). В гетерофазных системах (каталитически активный минерал-почвенный раствор) олигомерные продукты реакции могут сорбироваться минеральными фазами (Zhao et al., 2019), что приводит к стабилизации углерода. Поиск эффективных биогенных и абиогенных катализаторов окислительных реакций и минеральных фаз с высокой сорбционной емкостью по отношению к органическим соединениям (с возможностью внесения их в почвы в виде препаратов), является актуальной задачей, которая может способствовать решению проблемы декарбонизации почв, особенно при переводе земель в сельскохозяйственное использование.
Среди биогенных катализаторов окислительных реакций наиболее распространенным ферментом в почвах является лакказа (Sinsabaugh, 2010). Лакказа (КФ 1.10.3.2, бензендиол : кислород оксидоредуктаза) – медьсодержащая фенолоксидаза, которая продуцируется внеклеточно аскомицетами, базидиомицетами и дей-теромицетами (Baldrian, 2006; Yang et al., 2017), а также широко распространена в бактериях (Janusz et al., 2020). Фермент катализирует окисление широкого ряда фенольных субстратов и ароматических аминов молекулярным кислородом, который восстанавливается до воды. Феноксильные радикалы и хиноны, образующи- еся при каталитическом окислении субстратов, подвергаются реакциям спонтанной конденсации с образованием олигомеров и полимеров (de Nobili et al., 2020). Редокс-потенциал фермента различных продуцентов составляет от 0.42 В у бактерий до 0.80 В у грибов белой гнили древесины и базидиомицетов подстилок (Janusz et al., 2020). Лакказа эффективно сорбируется почвенными минералами (Ahn et al., 2006; Zavarzina, 2010), что повышает ее устойчивость в почвенной среде (Sinsabaugh 2010).
Наиболее мощные природные абиогенные катализаторы представлены оксидами марганца (IV). Они способны окислять широкий спектр соединений за счет высокого редокс-потенциала, варьирующего от 0.99 В при рН 4.0 до 0.76 В при рН 8 (Remucal and Ginder-Vogel, 2014). Самым изученным, с точки зрения катализа окислительной полимеризации в почве, является бернессит σ -MnO 2 (Chang et al., 2016; Zou et al., 2020; Wang et al., 2022), в то время как роль другого распространенного в почве оксида марганца (IV) – пиролюзита β -MnO 2 – остается мало изученной. Основными структурными единицами пиролюзита являются октаэдры MnO 6 , объединенные в туннельные структуры 1 × 1 (Remucal, Ginder-Vogel, 2014). Наличием туннелей объясняются уникальные сорбционные свойства оксидов Mn (IV) по отношению к различным органическим и неорганическим соединениям (Husnain et al., 2020).
Одним из факторов, ограничивающих скорость ферментативных окислительных реакций, является низкая концентрация субстратов в почвенных растворах, не превышающая долей-десятков мкМ (Olofsson et al., 2010). Фактором, ограничивающим связывание исходных веществ и продуктов полимеризации, может быть низкая сорбционная способность минеральных фаз, что обусловливает необходимость изучения гетерофазных каталитических реакций в присутствии различных минеральных сорбентов.
Целью работы было выявить роль реакций окислительного связывания, катализируемых лакказой, в усилении сорбции и стабилизации органического углерода на минеральной матрице. Лакказу гриба белой гнили древесины Cerrena unicolor ВКМ F-3196 иммобилизовали на иллите и каолините, модифицированном гидроксидом алюминия. Модельными субстратами служили феноль- ные кислоты – типичные продукты деструкции лигнина; концентрации субстратов выбирали в соответствии с их концентрациями в почвенных растворах (Whitehead et al., 1982; Olofsson et al., 2014). Для оценки влияния лакказы на сорбцию фенольных кислот параллельно проводили эксперименты с глинистыми минералами без лакказы. Абиогенным катализатором сравнения служил пиролюзит.
ОБЪЕКТЫ И МЕТОДЫ
Минералы . В работе использовали коммерческий пиролюзит β -MnO 2 (Merck, Германия, кат. номер 8.05958), Ca-иллит и модифицированный каолинит (каолинит-Al(OH)x). Модифицированный каолинит был синтезирован осаждением гидроксида алюминия (2.5 ммоль Al/г) на поверхности K-каолинита. Для этого к 4 г минерала добавляли 10 мл 1 М раствора AlCl 3 × 6H 2 O и доводили рН до 8 титрованием 0.5 M NaOH. Далее смесь перемешивали 2 ч., диализовали против воды до отрицательной реакции на хлорид-ионы и высушивали на воздухе. Все минералы просеивали через сито 0.25 мм и использовали фракцию < 0.25 мм.
Площадь поверхности минералов определяли статическим объемным методом низкотемпературной сорбции азота на анализаторе абсорбции газов и паров 3P Vapor 100 (3P Instruments, Германия). Расчет полной удельной поверхности по азоту осуществлялся по методу Брунауэра-Эммета-Теллера (БЭТ) автоматическим программным обеспечением анализатора.
Каталитическая активность минералов. Окислительную каталитическую активность минералов определяли с субстратом АБТС (диаммониевая соль 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфокислоты; Sigma, США). Реакционная смесь содержала 1 мл 1 мМ АБТС в 20 мМ Na-ацетатном буфере (pH 4.5) и навеску минерала. В случае пиролюзита, обладающего очень высокой каталитической активностью, реакцию проводили непосредственно в спектрофотометрической кювете, добавляя субстрат к 1 мг минерала и регистрируя приращение оптической плотности при 420 нм в единицу времени на спектрофотометре Shimadzu UV1800 (Shimadzu, Япония). Активность двух других минералов определяли в пробирках типа эппендорф. Добавляли 1 мл субстрата к 20 мг минерала, смесь встряхивали 4 мин., центрифугировали 1 мин. при 10 000 об./мин. на центрифуге MC-10K (R-LAB, Китай) и измеряли оптическую плотность надосадочного раствора при 420 нм. Общее время реакции в этом случае составляло 5 мин.
Активность выражали в молекулярных единицах (Ед) как количество минерала, катализирующего окисление одного микромоля АБТС при 420 нм за 1 мин. Активность в расчете на 1 г минерала рассчитывали по формуле:
усл Ед-V-lOOO
Активность (Ед/г) =---------,
£420-1 •m , где усл Ед – условные единицы активности, т. е. приращение оптической плотности при 420 нм в 1 мин., V – объем реакционной смеси (1 мл), 1 000 – пересчет в микромоли, ε420 – коэффициент экстинкции АБТС при 420 нм (36 000 M–1 см–1 (Heinfling et al., 1998)), l – длина оптического пути (1 см), m – навеска минерала, г.
Лакказа . Препарат лакказы гриба Cerrena unicolor ВКМ F-3196 был получен как описано в работе (Lisova et al., 2010). Концентрация белка составляла 0.25 мг/мл. Активность лакказы определяли по скорости окисления 1 мМ АБТС в 20 мМ Na-ацетатном буфере (рН 4.5). Реакционная смесь содержала 1 мл субстрата и 5 мкл препарата фермента. Активность рассчитывали в молекулярных единицах (Ед), которые определяли как количество лакказы, окисляющее один микромоль АБТС в одну минуту. Активность в расчете на 1 мл препарата лакказы рассчитывали по формуле:
услЕд•V•1000
Активность (Ед/мл) =---------,
£420-1 -V , где усл Ед – условные единицы активности, т. е. приращение оптической плотности при 420 нм в 1 мин., V – объем реакционной смеси (1 мл), 1 000 – пересчет в микромоли, ε420 – коэффициент экстинкции АБТС при 420 нм (36 000 M–1 см–1 (Heinfling et al., 1998)), l – длина оптического пути (1 см), v – объем препарата лакказы, мл.
Активность препарата лакказы C. unicolor составляла 3.3
Ед/мл или 13.3 Ед/мг.
Иммобилизация лакказы на иллите и модифицированном каолините. Иммобилизацию лакказы проводили в растворе 0.01 М KNO 3 (рН 4.7) для создания постоянной ионной силы. Раствор готовили с использованием ультрачистой воды с удельной электропроводностью 0.18 мкСм/см. К навеске минерала (20 мг) добавляли 6 мкл (1.5 мкг) препарата лакказы в 1 мл 0.01 М KNO 3 . Смесь встряхивали на термошейкере (1 000 об./мин., 25 °С, 1 ч.; TS-100C Thermo-shaker, Biosan, Латвия), затем центрифугировали 2 мин. при 10 000 об./мин. (центрифуга MC-10K, R-LAB, Китай ) и измеряли активность лакказы в надосадочном растворе. Для удаления слабо связанного фермента к минералу добавляли 1 мл 0.01 M KNO 3 , смесь встряхивали 1 мин., центрифугировали и снова измеряли активность в надосадочном растворе. Эффективность иммобилизации определяли по разности между исходной добавленной активностью и суммой активностей в надосадочных растворах. Активность иммобилизованной лакказы измеряли как описано выше для минералов.
Приготовление комплексов лакказы с иллитом и модифицированным каолинитом. Для экспериментов по взаимодействию фенольных кислот с минералами в присутствии лакказы фермент к минералам добавляли с таким расчетом, чтобы активность иммобилизованного фермента в реакционной смеси составляла 0.02 Ед. Это соответствует активности лакказы в органогенных и минеральных горизонтах почв, определенной по АБТС (Zavarzina et al., 2025). С учетом потери активности лакказы при иммобилизации, к иллиту добавляли 7.5 мкл (1.9 мкг) лакказы, а к модифицированному каолиниту – 15 мкл (3.8 мкг) лакказы на 20 мг минерала. Иммобилизацию проводили в 0.01 M KNO 3 (рН 4.7), как описано выше. Полученные комплексы лакказы с модифицированным каолинитом и иллитом обозначали как каолинит-Al(OH)x-лакказа и иллит-лакказа соответственно.
Фенольные кислоты. В работе использовали фенольные кислоты: галловую (GAL), протокатеховую (PCAT), гидроксибен-зойную (HDB), феруловую (FER), сиреневую (SYR) и ванилино- вую (VAN) (Sigma, США).
Взаимодействие фенольных кислот с минералами и их комплексами с лакказой. Готовили эквимолярную смесь фенольных кислот (10 мкМ каждой) в водном растворе 0.01 М KNO 3 с использованием ультрачистой воды с удельной электропроводностью 0.18 мкСм/см. Выбранная концентрация фенольных кислот лежала в диапазоне концентраций, указываемых для почвенных систем (Whitehead et al., 1982; Olofsson et al., 2010). К 20 мг минералов, содержащих или нет 0.02 Ед лакказы, добавляли 50 мл раствора кислот. Реакцию проводили в центрифужных пробирках типа фалькон при постоянном перемешивании (200 об./мин., 25 ° С). Для мониторинга убыли фенольных кислот через 1, 24 и 72 ч. после начала взаимодействия смеси центрифугировали (10 мин., 10 000 об./мин.) и из надосадочной жидкости отбирали аликвоты 1 мл для определения концентрации кислот методом обращенно-фазовой жидкостной хроматографии (ОФ ВЭЖХ). После 24 и 72 ч. взаимодействия дополнительно отбирали аликвоты 20 мл для определения концентрации растворенного углерода С орг . Для каждого времени взаимодействия готовили отдельную серию растворов. Повторность (n) трехкратная.
Определение концентрации растворенного углерода и количества связанного углерода. Концентрацию С орг в растворах определяли на ТОС-L анализаторе (Shimadzu, Япония). Количество углерода, связанного с минералами, определяли по разности между исходной концентрацией и после взаимодействия с минералами и выражали в мг C орг /г минерала или мг С орг /м2 поверхности.
Определение концентрации фенольных кислот методом ОФ ВЭЖХ. Анализ проводили на хроматографе Agilent-1100 с диодно-матричным детектором. Для разделения фенольных кислот использовали колонку с фазой C18 с полярным эндкеппингом SynergiHydro-RP (150 × 4.6 мм, 4 мкм, Phenomenex, США). Стартовый элюент (раствор А): смесь вода : ацетонитрил : трифторуксусная кислота (90 : 5 : 5, об.). Градиент создавали раствором B: ацетонитрил : трифторуксусная кислота (95 : 5, об.). Градиентный режим: 0–20 мин. – 5–15% B; 20–30 мин. – 15–40% B; 30–40 мин.
– 40% В. Скорость элюирования составляла 0.5 мл/мин., объем пробы 20 мкл. Температура колонки 30 °С. Концентрацию кислот определяли по площадям соответствующих хроматографических пиков.
Снижение концентрации каждой кислоты в растворе (убыль кислот) рассчитывали по разности концентраций до и после взаимодействия с минералами и выражали в мкМ, а также в процентах от исходного количества. Убыль фенольных кислот в пересчете на С орг рассчитывали по формуле:
Убыль кислот (мг СОпг/л) = Х(С1 С2)МЮ, орг 1000 , где С1 – исходная концентрация фенольной кислоты (10 мкМ), С2 – концентрация фенольной кислоты после взаимодействия с минералом (мкМ), М – молекулярная масса фенольной кислоты (мг/ммоль), ω – массовая доля углерода в фенольной кислоте, 1 000 – пересчет на мг/л. Массовая доля углерода для исследованных кислот составляла: 0.49 (GAL), 0.55 (PCAT), 0.61 (HDB), 0.57 (VAN), 0.54 (SYR), 0.62 (FER).
Убыль кислот, определяемая с помощью ОФ ВЭЖХ, обусловлена как сорбцией на минералах, так и окислительной трансформацией кислот в растворе (если минерал обладал каталитической активностью). Данные по снижению С орг , определяемые на TOC-L анализаторе, в свою очередь, отвечали только сорбции фенольных кислот и продуктов их трансформации. Сопоставление этих данных позволяет оценить вклад сорбции в убыль кислот, определяемую с помощью ВЭЖХ:
Свэжх-Стос
Свэжх ,
Сорбция (ОФ-ВЭЖХ, %) = 100
где Свэжх – снижение концентрации кислот в пересчете на С орг , определяемое методом ОФ-ВЭЖХ (мг Сорг/л), Стос – снижение концентрации углерода, определяемое на ТОС-анализаторе (мг Сорг/л).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Свойства минералов и их комплексов с лакказой. Мине- ралы существенно различались по площади поверхности и каталитической активности (табл. 1). Площадь поверхности пиролюзита (58.54 м2/г) была примерно в 3 раза выше, чем модифицированного каолинита, но в 1.7 раз ниже, чем иллита. Пиролюзит отличался очень высокой окислительной активностью (124.4 Ед/г). У иллита обнаружена слабая активность (0.25 Ед/г), у модифицированного каолинита активность отсутствовала (табл. 1).
Эффективность иммобилизации лакказы гриба С. unicolor на иллите и модифицированном каолините составляла 100% при внесении до 0.2 мг белка/г минерала. При иммобилизации на модифицированном каолините лакказа теряла около 50% от исходной активности, а при иммобилизации на иллите – 30%. В результате подбора условий иммобилизации, активности комплексов модифицированного каолинита и иллита с лакказой были сопоставимы, причем у иллита 23% от общей активности приходилось на абиогенную и 77% на биогенную составляющие. Каталитическая активность этих минеральных фаз была на 2 порядка ниже, чем активность β -MnO 2 (табл. 1).
Таблица 1. Некоторые свойства минеральных фаз
Таблица 1. Some properties of the minerals under the study
|
Минерал |
Площадь поверхности, м2/г |
Каталитическая активность, Ед/г |
||
|
Минерал |
Иммобилизованная лакказа |
Минерал-лакказа |
||
|
Пиролюзит |
58.54 |
124.4 ± 6.5 |
— |
— |
|
Каолинит-Al(OH)x |
18.45 |
0 |
1.17 ± 0.07 |
1.17 ± 0.07 |
|
Иллит |
100.2 |
0.25 ± 0.05 |
0.82 ± 0.05 |
1.07 ± 0.01 |
Примечание. ± – стандартное отклонение (n = 3).
Note. ± – standard deviation (n = 3).
Взаимодействие фенольных кислот с минералами и их комплексами с лакказой. Реакционная способность кислот, определяемая как исчезновение фенольных кислот из раствора в присутствии изученных минеральных фаз, существенно различалась (рис. 1).
Убыль кислот была наиболее выраженной в присутствии β -MnO 2 (рис. 1А). Убыль (в % от исходного содержания) галловой, протокатехо-вой, сиреневой и феруловой кислот за первый час инкубации составила 80–100%, а ванилиновой – 20%, убыль которой через 24 и 72 ч. возросла до 50 и 65% соответственно. п-Гидроксибензойная кислота практически не реагировала с пиролюзитом (рис. 1А, табл. 2).
Реакционная способность кислот в присутствии каолинита-Al(OH)x и иллита была существенно ниже, чем в присутствии пиролюзита: общая убыль составила 8 и 3% за час инкубации, а за сутки – около 20 и 10% соответственно (рис. 1B, D, табл. 2). С модифицированным каолинитом эффективно взаимодействовали только галловая и протокатеховая кислоты, потеря остальных кислот не превышала 3% (табл. 2). С иллитом в течение 24 ч. инкубации реагировала в основном галловая кислота (убыль до 40%), однако через 72 ч. отмечено почти полное исчезновение протокатеховой (83%) и гидроксибензойной (99%) кислот.
Иммобилизация лакказы на модифицированном каолините и иллите существенно повлияла на исчезновение фенольных кислот из растворов. В присутствии комплекса каолинит-Al(OH)x-лакказа (72 часа взаимодействия) убыль галловой кислоты, по сравнению с каолинитом-Al(OH)x возросла с 82% до 100%, а протокатеховой – с 83% до 100% (табл. 2). Для феруловой и сиреневой кислот, практически не взаимодействующих с модифицированным каолинитом без лакказы, убыль в присутствии лакказы достигала, в зависимости от времени инкубации, 5– 99% и 37–100% (табл. 2). Несмотря на меньшую на 2 порядка каталитическую активность (табл. 1), по эффективности трансформации изученных веществ (как качественно, так и количественно) комплекс каолинит-Al(OH)x-лакказа был сопоставим с пиролюзитом (табл. 2, рис. 1А, С). С комплексом каолинит-Al(OH)x-лакказа не реагировала ванилиновая кислота, и в течение первого часа инкубации существенно медленнее реаги-ровалиЕФ протокатеховая, сиреневая и феруловая кислоты (рис. 1С, табл. 2). Иммобилизация лакказы на иллите усилила убыль только галловой и протокатеховой кислот – примерно в 2 и 5 раз соответственно за 24 ч. реакции, и не влияла на реакционную способность остальных кислот (рис. 1Е). Общая убыль кислот, по сравнению с чистым иллитом, значительно не увеличилась (табл. 2).
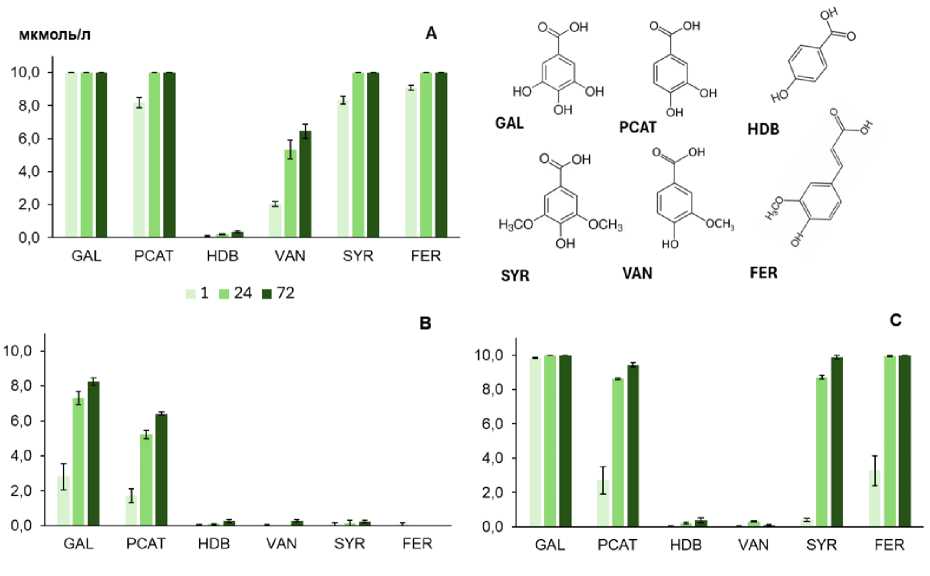
Рис. 1. Убыль фенольных кислот (мкМ) в реакционной смеси, содержащей чистые минералы ( A , B , D ) и комплексы минерал-лакказа ( C , E ): А – пиролюзит, B – каолинит-Al(OH)x, C – каолинит-Al(OH)x-лакказа, D – иллит, E – иллит-лакказа. Каталитическая активность минеральных фаз (Ед/г, 1 мМ АБТС, рН 4.5): A – 124.4; B – 0; C – 1.17; D – 0.25; E – 1.07. Фенольные кислоты: GAL – галловая, PCAT – протокатеховая, HDB – п -гидроксибензойная, VAN – ванилиновая, SYR – сиреневая, FER – феруловая (0.01 мМ каждой в 0.01 М KNO 3 , pH 4.7). Время инкубации – 1, 24 и 72 ч. Исходная концентрация каждой кислоты 10 мкМ. Планки погрешности соответствуют стандартному отклонению (n = 3).
Fig. 1. Loss of phenolic acids ( µ mol/l) in the reaction mixture containing pure minerals ( A , B , D ) and mineral-laccase complexes ( C , E ): A – MnO 2 , B – kaolinite-Al(OH)x, С – kaolinite-Al(OH)x with laccase, D – illite, E – illite with laccase. The catalytic activities of the minerals (U/g; oxidation of 1 mM ABTS, pH 4.5) were: A – 124.4; B – 0; C – 1.17; D – 0.25; E – 1.07. Phenolic acids: GAL – gallic, PCAT – protocatechuic, HDB – p-hydroxybenzoic, VAN – vanillic, SYR – syringic, FER – ferulic (equimolar mixture, 0.01 mM each in 0.01 M KNO 3 , pH 4.7). Reaction times were 1, 24, 72 hours. Initial amount of each phenolic acid – 10 µ mol/l.
Таблица 2. Убыль фенольных кислот, % от исходного количества в присутствии минералов и их комплексов с лакказой. Исходная концентрация каждой кислоты 10 мкМ, общая концентрация кислот 60 мкМ
Table 2. Loss of individual phenolic acids (% of initial amount) in the presence of minerals and mineral-laccase. Initial amount of each acid – 10 µmol/l, total amount – 60 µmol/l
|
Минерал |
Кислоты |
Минерал |
Минерал-лакказа |
||||
|
Время взаимодействия, ч |
Время взаимодействия, ч |
||||||
|
1 |
24 |
72 |
1 |
24 |
72 |
||
|
Пиролюзит |
GAL |
100 ± 0 |
100 ± 0 |
100 ± 0 |
- |
- |
- |
|
PCAT |
82 ± 3 |
100 ± 0 |
100 ± 0 |
- |
- |
- |
|
|
HDB |
1 ± 0 |
2 ± 0 |
4 ± 1 |
- |
- |
- |
|
|
VAN |
21 ± 1 |
53 ± 6 |
65 ± 4 |
- |
- |
- |
|
|
SYR |
83 ± 2 |
100 ± 0 |
100 ± 0 |
- |
- |
- |
|
|
FER |
91 ± 1 |
100 ± 0 |
100 ± 0 |
- |
- |
- |
|
|
Всего |
63 |
76 |
78 |
- |
- |
- |
|
|
Каолинит-Al(OH)x |
GAL |
28 ± 7 |
73 ± 4 |
82 ± 2 |
98 ± 0 |
100 ± 0 |
100 ± 0 |
|
PCAT |
17 ± 4 |
52 ± 2 |
64 ± 1 |
27 ± 8 |
86 ± 1 |
94 ± 1 |
|
|
HDB |
0 ± 0 |
1 ± 0 |
3 ± 1 |
0 ± 0 |
2 ± 0 |
4 ± 1 |
|
|
VAN |
0 ± 0 |
0 ± 0 |
3 ± 1 |
1 ± 0 |
0 ± 0 |
0 ± 0 |
|
|
SYR |
0 ± 0 |
0 ± 0 |
2 ± 1 |
5 ± 0 |
87 ± 1 |
99 ±1 |
|
|
FER |
0 ± 0 |
0 ± 0 |
0 ± 0 |
37 ± 5 |
100 ± 0 |
100 ± 0 |
|
|
Всего |
8 |
22 |
25 |
27 |
63 |
67 |
|
Продолжение таблицы 2
Table 2 continued
|
Минерал |
Кислоты |
Минерал |
Минерал-лакказа |
||||
|
Время взаимодействия, ч |
Время взаимодействия, ч |
||||||
|
1 |
24 |
72 |
1 |
24 |
72 |
||
|
Иллит |
GAL |
17 ± 2 |
44 ± 2 |
60 ± 4 |
48 ± 2 |
85 ± 5 |
99 ± 1 |
|
PCAT |
2 ± 2 |
4 ± 2 |
83 ± 9 |
1 ± 1 |
19 ± 6 |
100 ± 0 |
|
|
HDB |
1 ± 1 |
5 ± 1 |
99 ± 2 |
0 ± 0 |
6 ± 3 |
100 ± 0 |
|
|
VAN |
1 ± 1 |
2 ± 1 |
2 ± 1 |
0 ± 0 |
2 ± 1 |
3 ± 0 |
|
|
SYR |
0 ± 0 |
0 ± 0 |
3 ± 1 |
0 ± 0 |
3 ± 1 |
6 ± 1 |
|
|
FER |
0 ± 0 |
0 ± 0 |
0 ± 0 |
0 ± 0 |
0 ± 0 |
0 ± 0 |
|
|
Всего |
3 |
9 |
42 |
8 |
19 |
52 |
|
Примечание. ± – стандартное отклонение (n = 3).
Note. ± – standard deviation (n = 3).
Вклад сорбции в убыль кислот при взаимодействии с минералами и их комплексами с лакказой. При отсутствии каталитической активности минерала (модифицированный каолинит) убыль кислот в растворе была связана только с их сорбцией. При наличии окислительной активности (остальные изученные минеральные фазы) убыль кислот складывалась из их окислительной трансформации в растворе, сорбции исходных веществ и продуктов реакции. Для того, чтобы оценить вклад сорбции в общую убыль кислот, данные ОФ ВЭЖХ были пересчитаны на С орг и сопоставлены с данными ТОС (табл. 3). Для каолинита-Al(OH)x полученные величины совпадали (табл. 3), что согласуется с отсутствием каталитической активности (табл. 1) и свидетельствует о применимости такого подхода.
Общая убыль исходных веществ была наибольшей в смеси с пиролюзитом, при этом сорбция составила около 60% от убыли кислот. Соответственно, около 40% приходилось на окислительную трансформацию кислот в растворе без дальнейшего связывания с минералом. Сорбционное равновесие устанавливалось за 24 ч. (табл. 3, рис. 2). Несколько меньшей убылью исходных веществ, но очень близкими величинами связывания С орг характеризовался комплекс каолинит-Al(OH)x-лакказа, вклад сорбции в общую убыль кислот составил около 70% (табл. 3). В присутствии лакказы сорбция С орг увеличилась в 2.5 раза по сравнению с минералом без лакказы (табл. 3, рис. 2). За сутки каолинитом и его комплексом с лакказой было связано 75 и 90% С орг от количества, сорбированного за 72 ч. (табл. 3).
Для иллита установлена наиболее медленная скорость окислительной трансформации кислот и сорбции: за 24 ч. общая убыль исходных веществ в растворе составила около 20% от убыли за 72 ч., а количество связанного С орг – 10% (табл. 3, рис. 2). При этом половина продуктов окислительной трансформации оставалась в жидкой фазе. Иммобилизация лакказы на иллите увеличила потерю исходных веществ в растворе в 2 раза, а связывание С орг – в 3.5 раза. Соответственно, в присутствии лакказы существенно возрос вклад сорбции в общую убыль кислот (табл. 3).
Таблица 3. Вклад сорбции в общую убыль кислот в растворе в присутствии минералов и их комплексов с лакказой
Table 3. The contribution of sorption to the loss of phenolic acids from solution in the presence of minerals and minerallaccase complexes
|
Минерал |
Снижение концентрации кислот (С орг , мг/л) |
Сорбция, % от общей убыли |
||||
|
По данным ОФ ВЭЖХ |
По данным ТОС-L анализатора |
|||||
|
24 ч |
72 ч |
24 ч |
72 ч |
24 ч |
72 ч |
|
|
Пиролюзит |
4.49 ± 0.06 |
4.61 ± 0.04 |
2.58 ± 0.06 |
2.58 ± 0.08 |
57 ± 1 |
56 ± 1 |
|
Каолинит-Al(OH)x |
1.08 ± 0.06 |
1.31 ± 0.03 |
1.04 ± 0.11 |
1.36 ± 0.16 |
97 ± 10 |
104 ± 12 |
|
Каолинит-Al(OH)x-лакказа |
3.75 ± 0.02 |
3.94 ± 0.03 |
2.59 ± 0.03 |
2.93 ± 0.10 |
69 ± 1 |
74 ± 2 |
|
Иллит |
0.47 ± 0.03 |
2.08 ± 0.13 |
0.21 ± 0.04 |
2.26 ± 0.07 |
45 ± 8 |
108 ± 3 |
|
Иллит-лакказа |
0.98 ± 0.12 |
2.61 ± 0.02 |
0.74 ± 0.18 |
2.62 ± 0.07 |
76 ± 19 |
100 ± 3 |
Примечание. ± – стандартное отклонение (n = 3).
Note. ± – standard deviation (n = 3).
В отличие от пиролюзита и комплекса каолинит-Al(OH)x-лакказа, продукты окислительной трансформации медленно, но полностью связывались с иллитом. Через 72 ч. инкубации вклад сорбции в общую убыль кислот составлял 100% (табл. 3).
Влияние лакказы на связывание С орг . При внесении фенольных кислот в количестве 13 мг С орг /г минерала, пиролюзит и комплекс каолинит-Al(OH)x-лакказа обеспечивали связывание около 50% от исходного количества С орг за сутки, каолинит-Al(OH)x – 20%, а иллит – около 4% (рис. 2). На иллите и его комплексе с лакказой сорбция С орг достигала 45–50% от внесенного количества через 72 часа взаимодействия кислот с минералом.
Количество углерода, связанное за сутки минералами, было наибольшим и идентичным (6.5 г/кг) на пиролюзите и комплексе модифицированного каолинита с лакказой и в 3.8 раз меньшим на комплексе иллита с лакказой (табл. 4). Лакказа увеличивала сорбцию С орг на модифицированном каолините в 2.5 раза, а на иллите – в 3 раза. Через трое суток количество углерода, сорбированное комплексом каолинита с лакказой, превышало таковое на пиролюзите, а количество С орг , связанное с иллитом и его комплексом с лакказой, становилось сопоставимым с пиролюзитом (табл. 4). При этом вклад реакций окислительного связывания, катализируемых лакказой, в сорбцию С орг модифицированным каолинитом составлял около 60% и практически не менялся в течение трех суток инкубации. Вклад реакций, катализируемых лакказой, в сорбцию кислот иллитом был значительным только в течение суток инкубации (69%) и снижался до 14% к третьим суткам. Последнее свидетельствует о преимущественной сорбции иллитом исходных фенольных кислот или продуктов их абиогенного окисления.
В расчете на единицу площади поверхности пиролюзит за сутки связывал в 2–3 раза больше углерода, чем комплексы иллита и модифицированного каолинита с лакказой соответственно (табл. 4). Иммобилизованная лакказа, в свою очередь, существенно (в 4 и 2.5 раза) увеличивала связывание Сорг на единицу поверхности иллитом и модифицированным каолинитом. Количество Сорг, связанное иллитом за трое суток, возрастало на порядок по сравнению с сорбцией за сутки. Через 72 ч. инкубации иллит отличался наибольшей плотностью заполнения активных центров по сравнению с другими изученными минералами.
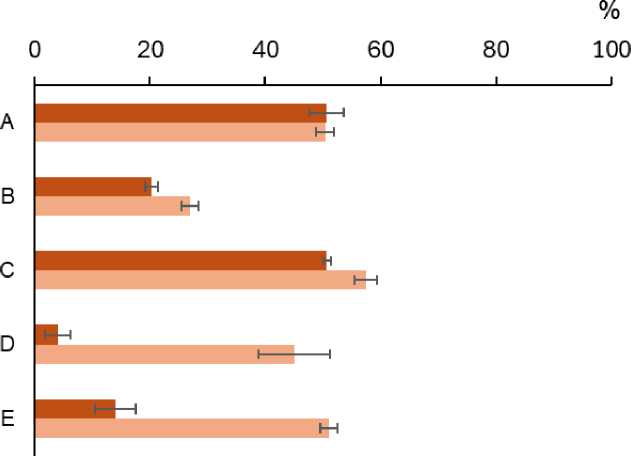
■ 24 часа ■ 72 часа
Рис. 2 Связывание углерода минеральными фазами (% от исходного количества) минералами и их комплексами с лакказой: A – пиролюзит, B – каолинит-Al(OH)x, C – каолинит-Al(OH)x-лакказа, D – иллит, Е – иллит-лакказа. Исходная концентрация С орг 5.11 мг/л (соответствует 13 мг/г минерала). Планки погрешности соответствуют стандартному отклонению (n = 3).
Fig. 2. Binding of C org by mineral phases (% of initial amount) in the presence and absence of immobilized laccase: A – MnO 2 , B – kaolinite-Al(OH)x, C – kaolinite-Al(OH)x with laccase, D – illite, E – illite with laccase. Initial amount of C org was 5.11 mg/l or 13 mg per gram of a mineral, incubation time 24 and 72 hours.
Таблица 4. Связывание органического углерода минералами и их комплексами с лакказой
Table 4. Binding of organic carbon by pure minerals and their complexes with laccase
|
Минерал |
Количество сорбированного С орг |
|||
|
24 ч |
72 ч |
|||
|
г/кг |
г/м2 |
г/кг |
г/м2 |
|
|
Пиролюзит |
6.46 ± 0.14 |
0.38 ± 0.01 |
6.44 ± 0.19 |
0.38 ± 0.01 |
|
Каолинит-Al(OH)x-лакказа |
6.48 ± 0.09 (60)1 |
0.12 ± 0.00 |
7.33 ± 0.24 (54) |
0.14 ± 0.00 |
|
Каолинит-Al(OH)x |
2.60 ± 0.28 |
0.05 ± 0.01 |
3.40 ± 0.40 |
0.06 ± 0.01 |
|
Иллит-лакказа |
1.69 ± 0.51 (69) |
0.19 ± 0.05 |
6.55 ± 0.35 (14) |
0.66 ± 0.03 |
|
Иллит |
0.53 ± 0.09 |
0.05 ± 0.01 |
5.64 ± 0.16 |
0.57 ± 0.02 |
Примечание. 1 вклад реакций, катализируемых лакказой, в сорбцию С орг , %;
-
± – стандартное отклонение (n = 3).
Note. 1 contribution of reactions, catalyzed by laccase, to the sorption of Corg, %;
-
± – standard deviation (n = 3).
Влияние свойств фенольных кислот на взаимодействие с минералами. Реакционная способность фенольных кислот в их эквимолярной смеси существенно различалась (рис. 1). Это в большой степени определяло качественный состав равновесных растворов и органоминеральных комплексов. Наибольшая реакционная способность при взаимодействии со всеми минералами установлена для галловой кислоты, причем лакказа существенно усиливала ее трансформацию (рис. 1, табл. 2). Протокатеховая кислота отличалась более низкой скоростью трансформации, но также взаимодействовала со всеми изученными минералами (табл. 2). Гидроксибензойная кислота в значимых количествах реагировала только в присутствии иллита (рис. 1D, E), а ванилиновая – только в присутствии пиролюзита (рис. 1А). Значимая убыль сиреневой и феруловой кислот происходила в присутствии пиролюзита и комплекса каолинит-Al(OH)x-лакказа (рис. 1А, B).
Наблюдаемые закономерности связаны с тем, что гетерофазное окисление органических соединений – это процесс, который контролируется доступностью поверхности минерала органической молекуле (Huang, Hardie, 2009; Remucal, Ginder-Vogel, 2014). Окисление фенольных соединений в присутствии минералов включает несколько стадий (на примере оксида марганца): 1) диффузию молекулы в пограничный слой, 2) образование поверхностного комплекса между адсорбатом и оксидом, 3) окисление за счет одноэлектронного переноса в поверхностном комплексе с образованием феноксильного радикала (ArO•). Фенольные соединения в недиссоциированном состоянии (ArOH) гораздо менее реакционноспособны, чем фенолят-анионы (ArO–), поэтому реакция зависит от рН. Далее возможно образование двух типов продуктов. Во-первых, феноксильный радикал может диффундировать от поверхности и взаимодействовать со вторым феноксиль-ным радикалом с образованием полимерных продуктов (окислительная полимеризация), которые могут оставаться в растворе и/или сорбироваться минералом. Во-вторых, в поверхностном комплексе может происходить второй одноэлектронный перенос с образованием Mn (II) и иона феноксения (ArO+), которые могут диффундировать с поверхности с последующим гидролизом ArO+ с образованием бензохинона (Remucal, Ginder-Vogel, 2014). В по- следнем случае происходит частичное растворение минерала. Аналогичным образом происходит взаимодействие с иллитом, где роль окислителя играют ионы Fe (III) (Huang, Hardie, 2009). В случае иммобилизованной на минералах лакказы для окисления фенольных соединений необходимо образование фермент-субстратного комплекса, что является необходимой стадией ферментативного катализа.
Образование поверхностных комплексов (реакция 2) и перенос электронов (реакция 3) являются наиболее важными факторами, определяющими скорость реакции (Remucal, Ginder-Vogel, 2014). Скорость образования поверхностных комплексов зависит от молекулярных свойств органического соединения (например, заряда или гидрофобности) и свойств поверхности минерала (заряда, наличия центров связывания). Скорость переноса электронов зависит от разности окислительно-восстановительных потенциалов окислителя и субстрата. Поэтому лимитирующая стадия может быть специфичной для конкретного соединения. Например, слабая адсорбция лимитирует формирование поверхностных комплексов, а высокий редокс-потенциал субстрата ограничивает перенос электронов. Скорость окисления уменьшается по мере протекания реакции из-за накопления продуктов реакции на поверхности минерала и увеличения доли менее реакционноспособных участков (Remucal, Ginder-Vogel, 2014).
Высокая реакционная способность галловой кислоты и более низкая – остальных кислот в эквимолярной смеси в условиях проведенных экспериментов (рН 4.7; ионная сила I 0.01) объясняется рядом факторов. Во-первых, отрицательным зарядом галловой кислоты в выбранных условиях за счет диссоциации СООН группы (pKa 3.92), что обусловливает электростатическое притяжение к положительно заряженной поверхности минералов. Точка нулевого заряда рНZPC каолинита-Al(OH)x составляет около 9.0 (Kosmulski, 2009), а иллита – лежит в диапазоне 8.2–9.5 (Kriaa et al., 2009; Hao et al., 2018). Во-вторых, наиболее низким редокс-потенциалом галловой кислоты среди изученных кислот, равным 0.26 В (Chiorcea-Paquim et al., 2020). Редокс-потенциал феруловой кислоты составляет, по данным разных авторов, от 0.33 В (Teixeira et al., 2013) до 0.53 В (Chiorcea-Paquim et al., 2020); для протока- теховой, сиреневой и ванилиновой кислот эти величины равны 0.41 В, 0.49 В и 0.73 В соответственно (Simic et al., 2007). В результате в смеси кислот галловая кислота окисляется в первую очередь, что было показано нами ранее на примере гомогенной системы (без минерала) и лакказы гриба Coprinus comatus (Заварзина и др., 2022). В-третьих, тип связи с поверхностью минерала определяет ее устойчивость в условиях конкурентной сорбции. Сорбция фенольных кислот и продуктов их полимеризации возможна за счет водородных связей, электростатических взаимодействий и лигандного обмена с участием ОН-групп, в результате образуются внешнесферные и внутрисферные комплексы различной силы (Kleber et al., 2015). В случае дифенолов (галловой, протока-теховой кислот) возможно образование хелатных комплексов за счет лигандного обмена между фенольными группами в ортоположении и группировками Al(OH)xn минералов (рис. 3). Аналогичные комплексы орто-дифенолов образуются с гидроксидом железа (Li et al., 2023). Этот тип взаимодействия приводит к образованию устойчивых связей, заполнению активных центров и препятствует связыванию остальных кислот, которые сорбируются за счет СООН-группы. Ранее нами было показано, что сиреневая, феруловая, ванилиновая и гидроксибензойная кислоты слабо связываются с модифицированным каолинитом в присутствии галловой и протокатеховой кислот (Заварзина и др., 2020).
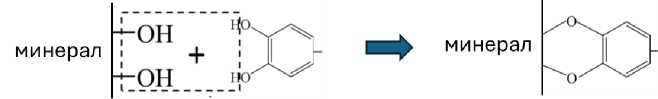
Рис. 3. Взаимодействие орто-дифенолов с поверхностью минералов за счет лигандного обмена.
Fig. 3. Interaction of o-diphenols with minerals by ligand exchange mechanism.
Убыль протокатеховой, феруловой и сиреневой кислот существенно возрастала как в присутствии лакказы, так и пиролюзита (рис. 1), что связано с их окислением, образованием олигомер- ных продуктов и сорбцией последних. Аналогичный эффект описан для лакказы Trametes versicolor, существенно усиливающей связывание этих кислот с гидроксидом железа (Zhao et al., 2020). Пара-гидроксибензойная кислота (p-HDB) не окислялась лакказой, что согласуется с данными, полученными для лакказы Coprinus comatus (Заварзина и др., 2022) и Trametes versicolor (Zhao et al., 2020), и объясняется высоким редокс-потенциалом p-HDB (0.92 В), превышающим таковой лакказ грибов белой гнили (0.75 В). Ванилиновая кислота не окислялась лакказой, но окислялась в присутствии пиролюзита, что связано с его более высоким редокс-потенциалом (0.99 В).
Роль биогенных и абиогенных окислительных реакций в связывании органического углерода. Полученные результаты показали, что фенольные кислоты в концентрациях, соответствующих концентрациям в почвах, эффективно окислялись как пиролюзитом, так и лакказой в составе комплексов с глинистыми минералами 1 : 1 и 1 : 2. Продукты окисления связывались с минеральными фазами, о чем свидетельствовала убыль Сорг в растворе. Количество сорбированного за сутки углерода (табл. 4) не имело прямой взаимосвязи с площадью поверхности минералов или их каталитической активностью (табл. 1). При меньшей (на 2 порядка) каталитической активности и меньшей (в 3 раза) площади поверхности (табл. 1) комплекс модифицированного каолинита с лакказой связывал количество углерода, идентичное пиролюзиту, а через трое суток – в 1.1 раз большее (табл. 4). Вклад реакций окислительного связывания, катализируемых лакказой, в сорбцию Сорг модифицированным каолинитом практически не менялся в течение трех суток инкубации, что свидетельствует о пролонгированном действии фермента как гетерогенного катализатора. Комплекс иллит-лакказа, обладающий близкой каталитической активностью и в 5 раз большей площадью поверхности, связывал за сутки меньшее (в 3.8 раза) количество углерода, чем комплекс ка-олинит-Al(OH)x-лакказа (табл. 4). Вклад реакций, катализируемых лакказой, в сорбцию кислот иллитом снижался к третьим суткам. Это можно объяснить тем, что существенный вклад в сорбцию на третьи сутки начинали вносить гидроксибензойная и протокатехо- вая кислоты (рис. 1D, E). Гидроксибензойная кислота не окисляется лакказой (рис. 1) и сорбируется в своем исходном состоянии. Окисление протокатеховой кислоты осуществлялось не только лакказой, но и абиогенно за счет каталитической активности иллита (табл. 2).
ЗАКЛЮЧЕНИЕ
Результаты работы свидетельствуют о важной роли лакказы и оксидов марганца как катализаторов окислительных реакций, а гидроксидов металлов (алюминия) – как матрицы для стабилизации С орг . Усиление процесса гумификации в присутствии лакказы и оксидов марганца ранее было показано при компостировании органических остатков (Niu et al., 2021; Long et al., 2024). Усиление стабилизации органического углерода в присутствии свеже-осажденных (оксо)гидроксидов железа, эффективно связывающих фенольные димеры, образующиеся под действием лакказ, продемонстрировано в работе (Zhao et al., 2020). Активность лакказы в наших экспериментах (0.8–1.1 Ед/г) была в пределах ее активности в почвах, составляющей (по АБТС) от 0.02 до 3.84 Ед/г (Feng et al., 2015; Zavarzina et al., 2025). Это свидетельствует о возможности экстраполяции данных на природные условия. Для широкого ряда почв (дерново-подзолистые – серые – черноземы) установлена корреляция лакказной активности с влажностью почв (Zavarzina et al., 2025). Сохранение и повышение природного уровня активности лакказ в почвах за счет регулирования рН и влажности, а также внесение препаратов лакказы в иммобилизованной на гидроксидах металлов форме в почвы может являться перспективным подходом для повышения секвестрационного потенциала почв и обусловливает необходимость дальнейших исследований в данной области.


