Иммобилизация о-дифенолоксидазы льна
Автор: Лихуша Павел Сергеевич, Лапина Галина Петровна
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 3, 2014 года.
Бесплатный доступ
В данной работе рассматриваются иммобилизация о-ДФО на твёрдом носителе в оптимальных условиях, разработанных на предыдущих этапах (Лихуша, Лапина, 2009; Лапина, Лихуша, 2010) исследования, а также ферментативные параметры иммобилизованной о-ДФО льна. В качестве носителя для иммобилизации энзима использованы фильтровальная бумага и пластинки «Sorbfil».
О-дифенолоксидаза (о-дфо) биотканей льна, бензидин, константа михаэлиса (k m), константа каталитическая (k kat), максимальная скорость (v max), иммобилизация
Короткий адрес: https://sciup.org/146116520
IDR: 146116520 | УДК: 541.647.577.1
Текст научной статьи Иммобилизация о-дифенолоксидазы льна
Введение. Иммобилизация - это процесс прикрепления ферментов к поверхности природных или синтетических материалов, включение их в полимерные материалы, полые волокна и мембранные капсулы, поперечная химическая сшивка. При иммобилизации ферментов происходит стабилизация каталитической активности, т.к. этот процесс препятствует денатурации белков (Кестнер, 1974; Тривен, 1983; Волова, 1999). Сравнительное исследование фермента о-ДФО биотканей льна в растворе и иммобилизованном состоянии важно, поскольку позволит не только получить новые сведения о его биокаталитических свойствах, но и расширить теоретические представления о взаимосвязи структуры и функций ферментов, осуществляющих биокатализ в объме водной фазы и на поверхности раздела (в иммобилизованном состоянии). Помимо этого, иммобилизованную форму фермента можно использовать для создания тест-систем для определения перекисных соединений в продуктах питания, в частности, в льняном масле.
Методика. На две полоски фильтровальной бумаги наносили 10 капель САЧ (сывороточный альбумин человека - коммерческий препарат: концентрация 2,2-10"5 М, сухое вещество содержит не более 6% воды по массе), 20 капель экстракта о-ДФО (5,13-10"5 М) и дополнительно 10 капель раствора бензидина (1,08-10"3 М). Капли наносили поочередно с последующим высушиванием. Диаметр пятен от капель составил 4-6 мм во всех вариантах нанесения компонентов. Аналогичная методика была применена и для пластин «Sorbfil». Растворы пероксида водорода готовили разбавлением исходного (2,283-10"2 М). Концентрация разбавленного раствора составляла
1,083 • 10"2 М, т.е. на три порядка больше концентрации фермента.
Вслед за этим проводили погружение иммобилизованных форм о-ДФО в растворы Н2О2. При окислении бензидина образовывалось восстановленное соединение синего цвета, количество которого определяли фотометрически при Х=540 нм. Затем проводили просушивание и сканирование, с последующим сравнением интенсивности окрашенных зон. Чем больше концентрация пероксида водорода (в интервале (1,083 - 2,283)-10"2 М), тем интенсивнее была окраска пятен. Интенсивность окраски демонстрировала успешность иммобилизации; реакция с участием фермента о-ДФО шла как в объёме водного раствора, так и на твердом носителе, на котором был иммобилизован фермент. При большей концентрации перекиси водорода ферментативная реакция протекала интенсивнее с увеличенным выходом продуктов. Наиболее оптимальным твёрдым носителем были выбраны пластинки «Sorbfil».

Рис. 1 . Внешний вид тестовых систем иммобилизованной о-дифенолоксидазы льна на пластинках «Sorbfil» (а) и фильтровальной бумаге (б)
По разработанной схеме в условиях стационарной кинетики и насыщения фермента субстратом были получены кинетические кривые D-т при ионных силах 0,1 -^0,4 М и проведены расчёты ферментативных параметров kkat и Км. Затем были построены зависимости kkat и Км от ионной силы раствора (I) для сравнения ферментативного поведения иммобилизованного биокатализатора и свободной формы фермента.
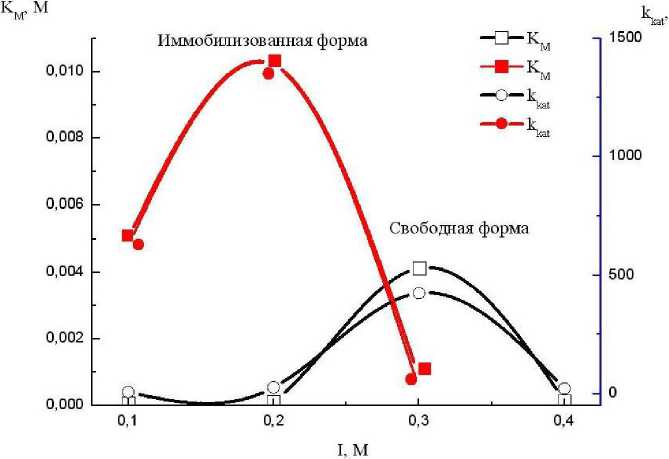
Рис. 2. Зависимость Км и kKat от ионной силы (I) раствора
Результаты и обсуждение. Из рис. 2 видно, что при повышении ионной силы до 0,2 М, одновременно возрастают и Км, и ккат (для иммобилизованной формы). При дальнейшем повышении ионной (М) силы от 0,2 до 0,3 наблюдается снижение указанных значений. Из графика видно, что (1) для иммобилизованной о-ДФО льна оптимальное для проявления каталитических свойств значение ионной силы составляет 0,2 М; (2) графики изменений значений и Км, и kKat для иммобилизованной формы о-ДФО льна расположены выше графиков изменений значений Км и kKat для водорастворимой формы биокатализатора. Это свидетельствует о худшем взамимодействии фермента с субстратом для иммобилизованной формы в сравнении с водорастворимой формой. В то же время биокатализ (kKat) идёт значительно (~ в 3 раза) интенсивнее в случае иммобилизованной о-ДФО льна.
Заключение. Иммобилизация трёхкратно усиливает каталитическую активность о-ДФО льна в сравнении с растворимой формой.
Лихуша П.С. Иммобилизация о-дифенооксидазы льна / П.С. Лихуша, Г.П. Лапина // Вести. ТвГУ. Сер. Биология и экология. 2014. № 3. С. 27-30.
Список литературы Иммобилизация о-дифенолоксидазы льна
- Волова Т.Г. 1999. Биотехнология. Новосибирск: Изд-во Сибирского отделения РАН. 252 с.
- Кёстнер А.И. 1974. Иммобилизованные ферменты//Успехи химии. Т. 43. Вып. 8. С. 1480-1499.
- Лапина Г.П., Лихуша П.С. 2010. Закономерности хода ферментативной реакции, катализируемой о-дифенолоксидазой льна при варьировании ионной силы раствора//Вестн. ТвГУ. Сер. Биология и экология. Вып. 20. № 32. С. 23-26.
- Лихуша П.С., Лапина Г.П. 2009. Зависимость ферментативных параметров о-дифенолоксидазы льна-долгунца от ионной силы раствора//Вестн. ТвГУ. Сер. Биология и экология. Вып. 15. № 34. С. 29-41.
- Тривен М. 1983. Иммобилизованные ферменты. М.: Мир. 213 с.


