Иммунный гомеостаз: новая роль микро- и макроэлементов, здоровой микробиоты
Автор: Булгакова Светлана Викторовна, Романчук Наталья Петровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 10 т.6, 2020 года.
Бесплатный доступ
Наличие инновационных технологий, таких как секвенирование следующего поколения и коррелированные инструменты биоинформатики, позволяют глубже исследовать перекрестные нейросетевые взаимосвязи между микробиотой и иммунными реакциями человека. Иммунный гомеостаз - это баланс между иммунологической толерантностью и воспалительными иммунными реакциями - является ключевой особенностью в исходе здоровья или болезни. Здоровая микробиота - это качественное и количественное соотношение разнообразных микробов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека. В исследованиях П. И. Романчук установлено, что микробиота представляет собой ключевой элемент, потенциально способный влиять на функции антигена вызывать защитный иммунный ответ и на способность иммунной системы адекватно реагировать на антигенную стимуляцию (эффективность вакцины), действуя в качестве иммунологического модулятора, а также природного адъюванта вакцины. Механизмы, лежащие в основе перекрестных помех между микробиотой кишечника и иммунной системой, играют решающее значение, особенно в раннем возрасте (ранняя микробиота кишечника формирует иммунологические функции). Новые взаимодействия, наряду с другими генетическими и экологическими факторами, приводят к определенному составу и богатству микробиоты, которые могут разнообразить индивидуальный ответ на прививки. Вариации в микробных сообществах могут объяснить географическую эффективность вакцинации. Современные технологии количественного измерения специфических и функциональных характеристик микробиоты желудочно-кишечного тракта, наряду с фундаментальными и новыми концепциями в области иммунологии, выявили многочисленные пути, по которым взаимодействие хозяина и микробиоты протекает благоприятно, нейтрально или неблагоприятно. Микробиота кишечника оказывает сильное влияние на форму и качество иммунной системы, соответственно, иммунная система определяет состав и локализацию микробиоты. Таким образом, здоровая микробиота непосредственно модулирует кишечный и системный иммунный гомеостаз. Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» - это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное - повышению защитных механизмов иммунитета.
Диета, иммунный гомеостаз, иммуномодуляция, здоровая микробиота, межиндивидуальные и внутрииндивидуальные факторы, микро- и макроэлементы, образ жизни, функциональное питание
Короткий адрес: https://sciup.org/14117625
IDR: 14117625 | УДК: 612.017.11 | DOI: 10.33619/2414-2948/59/22
Текст обзорной статьи Иммунный гомеостаз: новая роль микро- и макроэлементов, здоровой микробиоты
Бюллетень науки и практики / Bulletin of Science and Practice
Новые взаимодействия, наряду с другими генетическими и экологическими факторами, приводят к определенному составу и богатству микробиоты, которые могут разнообразить индивидуальный ответ на прививки. Вариации в микробных сообществах могут объяснить географическую эффективность вакцинации [1].
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии. Функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности. Факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов, некоторые из них оказывают защитное действие, а другие — вредное. Генетические и эпигенетические факторы обеспечивающие долголетие и сверхдолголетие, требуют от человека разумного нового взаимодействия с природой и обществом, и ответственности за будущие здоровые поколения. В исследованиях П. И. Романчук (2020) показано, что увеличение средней продолжительности жизни человека и нейроэндокринные изменения при физиологическом и патологическом старении, с одной стороны, эпигенетические факторы и электромагнитная информационная нагрузка/перегрузка, с другой стороны, внесли существенный вклад в циркадианную природу нейросетевого взаимодействия головного мозга человека с искусственным интеллектом [1].
Новая эпигенетика Homo sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно-функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений [2].
Продолжительность жизни человека в значительной степени определяется эпигенетически. Эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении, и связанных с возрастом заболеваниях [2].
Разработки П. И. Романчук (2020) позволяют управлять острым и хроническим стрессом, снижают аллостатическую перегрузку, повышают нейропластичность мозга, включают гибридные и комбинированные инструменты и методики нейрореабилитации и психонейроиммунореабилитации [3]. В исследовании [3] установлены основные современные инструменты и методики эпигенетической защиты здорового старения и долголетия человека разумного.
Хронотерапевтические и психохронобиологические стратегии защиты от воздействия циркадианного стресса на различные группы и категории населения, позволяют заблокировать переход когнитивных нарушений в когнитивные расстройства. Современные технологии искусственного интеллекта способны на многое, в том числе прогнозировать когнитивные нарушения и когнитивные расстройства, с помощью комбинированной и гибридной нейровизуализации, секвенирования нового поколения и др., с целью начала своевременной и эффективной реабилитации мозга H. sapiens [3].
В многочисленных работах А. Н. Волобуева и П. И. Романчук исследованы механизмы и модели сложной взаимосвязи, существующей между церебральной сосудистой системой и нейрогенезом, через развитие и в патологических состояниях, таких как артериальная гипертония, сахарный диабет и болезнь Альцгеймера [2, 4].
Многофункциональный сон — эпигенетический дар человеку с большим интеллектом, новыми квантовыми идеями (каждый материальный объект имеет квантовые состояния и параллельные миры) и будущими изобретениями (открытиями). Циркадианная система
-
H. sapiens и структурно-функциональные часы организма человека, синхронизированы генетически и эпигенетически. Жизнедеятельность H. sapiens — это волнообразные циклические колебания различной интенсивной процессов циркадианного стресса. Многоосцилляторная система, включает в себя эволюционные структурно-функциональные центральные и периферические водители ритма, первичные и вторичные пейсмекеры. Три самый мощных современных водителей ритма для человека, первый — свет. Второй по мощности водитель ритма – питание. Третий, эпигенетический, в т. ч. социальные факторы, прежде всего, социальный статус и самоактуализация личности [4].
Циркадианный стресс вызывает дисрегуляцию «программного обеспечения» мозга H. sapiens , с последующим нарушением работы «когнитивного» и «висцерального» мозга. Циркадные ритмы организма запрограммированы системой циркадных генов. Циркадианные часы и циркадная система — являются биофизическим и биохимическим регулятор иммунной защиты. Циркадная система синхронизации представляет собой эволюционный программный продукт «биокомпьютера» для выживания и подготовки организма к ожидаемым циклическим вызовам, различной эпигенетической направленности. Понимание временной связи между стрессорами и стрессовыми реакциями имеет решающее значение для понимания молекулярных основ физиологии и патогенеза заболевания. Хронический стресс и циркадианное рассогласование запускают каскад сбоев в функционировании нейрофизиологических, нейроэндокринных и психонейроиммунных механизмов. Эпигенетическая нагрузка и аллостатическая перегрузка снижает как общую работоспособность организма, так и его физическую, профессиональную и когнитивную составляющие. Циркадианный стресс оказывает патологическое влияние на человека, во все его возрастные периоды жизнедеятельности [5].
Концентрация мелатонина в желудочно–кишечных тканях превосходит его уровень в крови в 10–100 раз, а в желудочно–кишечном тракте, по крайней мере, в 400 раз больше мелатонина, чем в шишковидной железе. Организм человека представляет собой симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, вирусов и архебактерий. Общее число соматических и зародышевых клеток достигает 1 трлн, а микробных клеток — свыше 100 трлн. В системно-интегративной деятельности головного мозга человека насчитывается огромное количество — примерно 10 млрд. связанных между собой и постоянно взаимодействующих клеток.
Результаты исследования [6] позволяют восстановить функционирование циркадианной системы человека, нормализовать уровень и концентрацию мелатонина в организме, осуществлять регуляцию процессов сна и бодрствования, управлять нейропластичностью, проводить профилактику когнитивных нарушений, активировать собственные циркадианные ритмы и их синхронизацию с окружающей средой, через использование мультимодальной схемы повышения циркадного уровня гормона мелатонина в крови человека: циркадианные очки, функциональное питание и физическая активность.
Функциональные продукты питания различные по составу, оказывают системное воздействие как на гуморальные и гормональные циркадианные колебания, так и на персонифицированное состояние здоровья, и его полиморбидность [7]. Включение в комбинированную схему лечения и профилактики заболеваний — функционального продукта питания обусловлено его сбалансированностью по содержанию микро- и макроэлементов, витаминов и минералов, клетчатки и др., необходимых мужскому и женскому организму человека как для профилактики гормональных нарушений в репродуктивной системе, так и для диетического, профилактического и функционального питания при диссомнии, десинхронозе [8].
В связи с возникающей пандемией COVID-19, вызванной вирусом SARS-CoV-2, поиск потенциальных защитных и терапевтических противовирусных стратегий представляет особый и неотложный интерес [9]. Цинк, как известно, модулирует противовирусный и антибактериальный иммунитет и регулирует воспалительную реакцию. Несмотря на отсутствие клинических данных, некоторые признаки указывают на то, что модуляция цинкового статуса может быть полезной при COVID-19 [9].
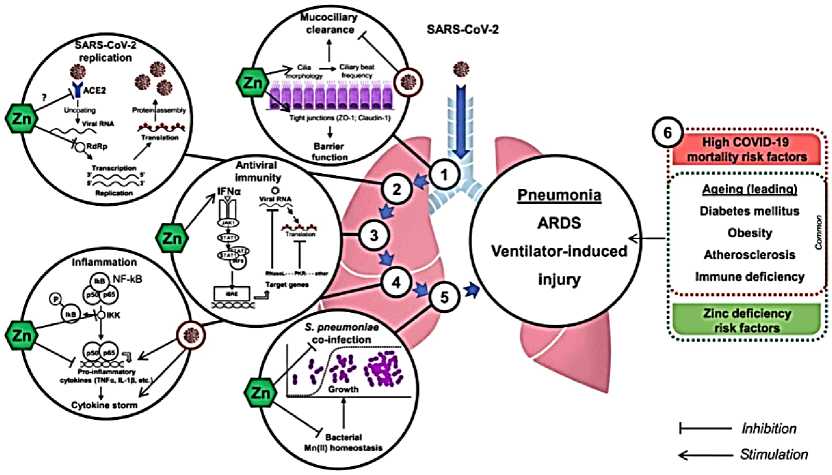
Рисунок 1. Предлагаемые защитные механизмы цинк в КОВИД-19 [9].
-
1. Цинк значительно улучшает морфологию ресничек [10] и увеличивает цилиарный ритм частоты [11] таким образом, улучшается мукоцилиарный клиренс и удаление бактерий и вирусов, содержащих частицы. Путем регулирования вверх плотного соединения белков ZO-1 и Клодин-1 [12] и увеличение антиоксидантной активности респираторного эпителия [13] цинк повышает барьерную функцию. В свою очередь, было показано, что коронавирусная инфекция ухудшает мукоцилиарный клиренс [14] предрасполагая легкие к дальнейшей вирусной и бактериальной агрессии.
-
2. Цинк может также обладать противовирусной активностью за счет ингибирования RdRp и блокирование дальнейшей репликации вирусной РНК, как показано на (Рисунке 1) для SARS-CoV [15]. Косвенные данные также указывают на то, что Zn2+ может снижать активность ACE2 [16], как известно, является рецептор для SARS-CoV-2 [17].
-
3. Модуляция противовирусного иммунитета цинком также может ограничить ОРВИ-ков-2 инфекции, по крайней мере, через up-регуляцию продукции IFNa [18] и увеличение его противовирусной активности [19]. Последнее может быть опосредовано через IFNa-индуцированную сигнализацию JAK1/STAT1 и up-регуляцию противовирусных белков (РНК и ПКР), которые разрушают вирусную РНК и ингибируют ее трансляцию [20].
-
4. Чрезмерная воспалительная реакция приводит к перепроизводству провоспалительных цитокинов и известно, что цитокиновый шторм играет значительную роль в COVID-19 патогенезе [21]. Цинк обладает противовоспалительной активностью за счет ингибирования ИКК активности и последующая сигнализация NF-kB, приводящая к пониженной регуляции продукции провоспалительных цитокинов [22–23]. Модуляция
-
5. Учитывая высокий риск бактериальной инфекции коинфекция при вирусной пневмонии [28], ZN-индуцированное ингибирование S-рост пневмоний через модуляцию бактериального Mn (II) гомеостаза [29] является полезной.
-
6. Цинковый статус — снижает высокую смертность при COVID-19. В частности, старение, иммунодефицит, а также метаболические заболевания, такие как ожирение, диабет и другие — атеросклероз, как известно, является суммирующими факторами риска развития высокой заболеваемости и смертности [30–31] при дефиците цинка [32]. В свою очередь, добавление Zn может оказывают благотворное влияние на модуляцию по крайней мере некоторых из этих рисков факторов: АЦЕ2, ангиотензинпревращающий фермент 2; ИФН, интерферон; IKK, IkB киназа; NF-kB, ядерный фактор-kB; ОРЗ, острые респираторные заболевания дистресс-синдром.
регуляторных Т-клеток функции цинком могут также ограничивать чрезмерную воспалительную реакцию [24–25], а также понижающее регулирование продукции провоспалительных цитокинов [26–27].
Эксперименты in vitro показывают, что Zn2+ обладает противовирусной активностью за счет ингибирования РНК — полимеразы SARS-CoV. Этот эффект может лежать в основе терапевтической эффективности хлорохина, известного как ионофор цинка. Косвенные данные также указывают на то, что Zn2+ может снижать активность ангиотензинпревращающего фермента 2 (ACE2), который, как известно, является рецептором для SARS-CoV-2. Улучшение противовирусного иммунитета цинком может также происходить за счет усиления регуляции продукции интерферона α и повышения его противовирусной активности. Цинк обладает противовоспалительной активностью, ингибируя сигнализацию NF-kB и модуляцию регуляторных функций Т-клеток, которые могут ограничивать цитокиновый шторм при COVID-19. Улучшение состояния Zn может также снизить риск бактериальной коинфекции за счет улучшения мукоцилиарного клиренса и барьерной функции респираторного эпителия, а также прямого антибактериального действия против S. pneumoniae . Цинковый статус также тесно связан с факторами риска развития тяжелого COVID-19, включая старение, иммунодефицит, ожирение, диабет и атеросклероз, поскольку они являются известными группами риска при дефиците цинка. Таким образом, Zn обладает защитным эффектом в качестве профилактической и адъювантной терапии COVID-19 за счет уменьшения воспаления, улучшения мукоцилиарного клиренса, предотвращения ИВЛ-индуцированного повреждения легких, модуляции противовирусного и антибактериального иммунитета [9].
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии.
Функциональные продукты питания, здоровая биомикробиота, здоровый образ жизни и управляемое защитное воздействия окружающей среды, искусственный интеллект и электромагнитная информационная нагрузка/перегрузка — ответственны за работу иммунной системы и ее способности своевременного иммунного ответа на пандемические атаки.
Внедрение изобретения [8] позволило получить пищевой продукт для подавления свободно-радикальной активности, инвазивной детоксикации организма человека, оптимизации нейрогенной регуляции сосудистого тонуса и восстановления репродуктивных функций у лиц мужского и женского пола.
Настоящее изобретение направлено на повышении диетического, функционального и профилактического воздействия функциональных продуктов питания на циркадианную нейроось «микробиота–кишечник–мозг», на работу висцерального и когнитивного мозга. Функциональное и сбалансированное питание обеспечивают циркадианное функционирование нейрооси «мозг–кишечник» с одновременным питанием «мозга» и «микробиоты». Новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке и клинической гериатрии.
Оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека, посредством работы трех составляющих:
–употребления функционального и сбалансированного питание, содержащее в большом количестве растительные белки [8].
–воздействия света определенной длины светового спектра [7],
–активации проприоцептивной сенсорной системы при физической нагрузке [7].
Длительный, более 15 минут, яркий свет стимулирует нейроны СХЯ гипоталамуса и тормозит выработку мелатонина эпифизом. В исследованиях Н. П. Романчук [6–8], разработана методика воздействие на циркадианные биологические ритмы человека, устройства (очков) состоящего из источника питания, светодиодных излучателей, регуляторов режимов подачи светового потока, выполненного в виде очков, излучателей светового потока, генерирующих пиковую длину волны в области от 480±5 нм до 490±10 нм и смонтированных в виде концентрических кругов, эллипсов или линий на светопрозрачной основе, а в электрическую цепь блока излучателей включено реле-прерыватель светового потока с постоянным временем 400 мс, автоматически управляемое от блока регуляции яркости светового потока. Используемые светодиоды смонтированы в виде горизонтальных, вертикальных или круговых линий, между которыми имеется светопрозрачные промежутки, необходимые для осуществления зрительной функции. Светодиоды имеют диапазон длин волн в синей части видимого спектра величиной от 480±5 нм до 490±10 нм. Источник питания светодиодов смонтирован в оправе очков. После включения питания кнопками управления задаются режим светового потока по показателям яркости частоты пауз светового потока по субъективному предпочтению человека [7].
Указанный технический результат достигается тем, что в продукте функционального, диетического и профилактического питания для больных с хронической ишемией головного мозга, представляющем собой заливаемую при употреблении жидкостью смесь, изготовленную из экологического цельнозернового натурального сырья, произведенного в РФ и не содержащего генно-модифицированных организмов, содержащего высушенное зерно твердой пшеницы, термообработанное методом взрыва, арбузные семена, семена льна, расторопшу, дополнительно введены высушенные зерна ржи, термообработанные методом взрыва, растолченные частицы чечевицы, грецких и кедровых орехов, соя (в виде окары), пчелиная перга, порошок топинамбура, спирулины, ламинарии, женьшеня и каменного масла.
Компоненты находятся в следующем соотношении, г/100 г готового сухого продукта:
-
1) зерно твердой пшеницы 19,5–20,5,
-
2) зерно ржи 19,5–20,5,
-
3) соя 19,5–20,5,
-
4) чечевица 10,5–11,0,
-
5) семена льна 5,0–5,5,
-
6) расторопша 5,0–5,5,
-
7) порошок топинамбура 2,50–2,75,
-
8) арбузные семена 2,50–2,75,
-
9) грецкие орехи 2,50–2,75,
-
10) кедровые орехи 2,50–2,75,
-
11) перга пчелиная 2,50–2,75,
-
12) порошок спирулины 2,50–2,75,
-
13) порошок ламинарии 2,50–2,75,
-
14) порошок женьшеня 0,50–0,75,
-
15) порошок каменного масла 0,50–0,75.
Указанный продукт сбалансирован по содержанию микро- и макроэлементов, витаминов и минералов, клетчатки и др., необходимых организму человека для сохранения интеллектуальных, творческих, производственных способностей и повышения качества жизни, а также для профилактики хронической ишемии головного мозга, с помощью систематического употребления диетического, профилактического и функционального питания заявленного состава.
Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Установлено с позиции доказательной медицины, во-первых, что более 33% граждан, страдающих психическими расстройствами личности (депрессия, тревога, немотивированные страхи), испытывают дефицит витаминов «В» в рационе повседневного питания. Во-вторых, быстрая производственная и творческая утомляемость, а также снижение интеллектуальных способностей, свидетельство дефицита железа и недостаточное содержание витаминов В3, В6, В9 (фолиевая кислота) в организме. Фолиевая кислота способствует сохранению и частичному восстановлению краткосрочной и долгосрочной памяти, устойчивости запоминания.
В-третьих, аминокислоты (в т. ч. и незаменимые) и витамины (В3, В6, В9, В12, С и др.), а также ведущие микро- и макроэлементы (магний, цинк, селен и др.) для головного мозга в организме человека не синтезируются, а поступают только с пищей и являются профилактическим базисом по поддержанию функционирования нейрометаболических и интегративных процессов высшей нервной деятельности человека посредством гармонизации биофизических, биохимических и гормональных взаимодействий в циклической системе «хронобиология–хрономедицина».
В настоящем изобретении используются способ получения функционального продукта питания с использованием инновационных технологий (патент РФ RU 2423873 С1 «Способ производства зернового компонента для пищевого продукта быстрого приготовления и способ производства функционального пищевого продукта быстрого приготовления», приоритет от 05.04.2010) [8].
В рамках настоящего изобретения рассматривается новый следующий состав функционального продукта питания для профилактического и диетического питания, содержащий:
–во-первых, рожь 19,5–20,5% в 100 г готового сухого продукта — как базовый ФПП, необходимый для восполнения недостающих полезных веществ, так и цельнозерновой продукт — «платформа» для биосинтеза витаминов и биохимических реакций в организме женщины (эндокринной и др. систем);
–во-вторых, чечевица 10,5–11,0% в 100 г готового сухого продукта - важный источник железа и фолиевой кислоты. Она способна обеспечить до 90% суточной нормы этих веществ, необходимых человеку. Чечевица содержит большое количество сложных углеводов и аминокислот, необходимых для быстрого протекания биохимических нейрометаболических процессов в клетках мозга;
–в-третьих, впервые введена цельнозерновая экологическая без ГМО соя 19,5–20,5% в 100 г готового сухого продукта со среднего Поволжья с функциональными характеристиками, решающими поставленную техническую задачу;
–в-четвертых, введен порошок топинамбура, который содержит до 20% сухих веществ, среди которых до 80% содержится полимерного гомолога фруктозы — инулина. Топинамбур аккумулирует кремний из почвы и относится к «кремнефильным» растениям, содержание этого элемента составляет до 8% в расчете на сухое вещество. Кроме того, содержит 8 аминокислот, которые синтезируются только растениями и не синтезируются в организме человека: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, триптофан, фенилаланин;
–в-пятых, добавлен порошок спирулины, имеющий в своем составе полноценный белок, углеводы, жиры, микро- и макроэлементы, витамины, фикоцианин, бета-каротин, линолевую кислоту и другие биологически активные компоненты. Как мощный антиоксидант спирулина предотвращает преждевременное старение в результате окислительных процессов в организме;
–в-шестых, введена ламинария, которая обладает противоопухолевой активностью, антимикробным, антибактериальным и противовирусным действием. Антимутагенным и радиопротекторным действием, а также противовоспалительной и иммуномодулирующей активностью. В ламинарии концентрация магния превышает таковую в морской воде в 9–10 раз, серы — в 17 раз, брома — в 13 раз. В 1 кг ламинарии содержится столько йода, сколько его растворено в 100 000 л морской воды. Содержание полисахаридов фукоидана и ламинарина способствует профилактике и лечению сердечно-сосудистых и цереброваскулярных заболеваний. Эти заболевания во многом зависят от баланса липидов, нарушение которого приводит к повышенной склонности к образованию атеросклеротических бляшек в сосудах. Ламинарин также оказывает гипотензивный эффект и проявляет антикоагулянтную активность, которая составляет 30% от активности гепарина;
–в-седьмых, натуральное экологическое специально переработанное (для лучшей усвояемости) каменное масло, необходимое для организма человека, вместе с другими компонентами, входящими в данный состав, для достижения профилактического базиса по поддержанию функционирования нейрометаболических и интегративных процессов высшей нервной деятельности человека, посредством гармонизации биофизических, биохимических и гормональных взаимодействий в циклической системе «хронобиология–хрономедицина».
Клинические испытания проводились в Федеральном государственном учреждении «Российский научный центр Восстановительной медицины и курортологии (ФГУ «РНЦ ВМ и К») Минздравсоцразвития РФ в период с 20.10.2009 г. по 19.03.2010 г. по договору №1389/09 от 20.10.2009.
Установлены следующие клинические эффекты при употреблении функциональных продуктов питания в рекомендуемых дозах и режимах:
-
1) геропротекторный,
-
2) дезинтоксикационный,
-
3) пребиотический,
-
4) гепатопротекторный,
-
5) пробиотический,
-
6) антиоксидантное действие
-
7) постоянный синтез ферментов и гормонов.
Влияние дефицита витаминов на иммунную систему многогранно. Так, при дефиците витамина А нарушается секреция ИФН-γ, что способствует активации Th2 и проявлению атопии, ингибируется пролиферация Т-клеток в ответ на воздействие антигенов, снижается эффективность нейтрофильного фагоцитоза, в клетках накапливаются продукты перекисного окисления. Дефицит цинка сопровождается атрофией тимуса и лимфоцитопенией, уменьшением количества В-клеток, снижением антителогенеза. Снижение активности Th1-лимфоцитов сопровождается дефицитом IL-2 и ИФН-γ, что стимулирует Th2-тип иммунного ответа (атопия). При дефиците селена наблюдается снижение бактерицидной активности нейтрофилов, снижение активности селен-содержащих ферментов, участвующих в метаболизме гормонов щитовидной железы, которые нарушают развитие и функцию иммуно-компетентных клеток тимуса, снижение активности факторов врожденного иммунитета. При дефиците железа снижается бактерицидная активность макрофагов, падает число Th1-лимфоцитов, что сопровождается уменьшением продукции IL-2. Железо является эссенциальным фактором, влияющим на клеточную дифференцировку.
Важнейшими компонентами адаптационных систем организма являются антиоксиданты — соединения разной химической природы, способные блокировать образование свободных радикалов, тем самым защищая от повреждения перекисью клеточные мембраны иммунокомпетентных клеток. К антиоксидантам относят витамины С, А, каротиноиды, Е, Д, В 6 , фолиевую кислоту, марганец, медь, цинк и селен. Фнкциональные продукты питания применяются, как комплексные препараты для иммунной системы, с достаточным эффектом синергизма.
Количество видов бактерий пищеварительного тракта человека достигает от 10 тысяч штаммов — до 50 тысяч. Количественное содержание этих бактерий находится в пределах сотен триллионов, а с вирусами — превышает квадриллион. Количество генов в хромосомах человека достигает 25000; микрогеном включает до 5–10 миллионов генов. Восстановление (замена) всех эукариотических клеток у человека требует не менее 20–25 лет, за это время все симбиотические микроорганизмы меняются не менее пяти–шести раз, что свидетельствует о высокой адаптационной способности человеческого надорганизма. Более 80% энергии человека синтезируется в митохондриях, 20% энергетического обеспечения человека приходится на микроорганизмы кишечника.
С возрастом эффективность работы системы активные радикалы / антиоксидантная защита снижается, что приводит к нарушению работы дыхательной цепи переноса электронов и уменьшению образования АТФ. Увеличение образования активных радикалов кислорода и липидов в митохондриях сопровождается повреждением функций последних и приводит к преждевременной гибели клеточных структур и клеток. Долголетию способствует повышенная активность ряда белков, связанных с антиоксидантной защитой (Mn-SOD; Cu/Zn, SOD; митохондриальная каталаза). Активные радикалы усиливают пролиферативные процессы и выживаемость клеток в ответ на физиологические стрессы и сигналы, активируя компенсаторные гомеостатические ответы.
В результате пищеварительной деятельности кишечной микробиоты образуется огромное количество разнообразных низкомолекулярных соединений, в том числе и обладающих нейрогормональной активностью.
Понимание механизмов функционирования генома, эпигенома, их взаимоотношений с факторами среды повышает точность диагностики заболеваний, позволяет разрабатывать персонифицированные диеты и выявлять среди известных или вновь созданных лекарственных средств те, которые имеют эпигеномную направленность.
Основное внимание для реализации этого подхода уделяется созданию персонифицированных пищевых рационов для родителей (прежде всего женщин в детородном возрасте) и детей во все периоды их жизни после рождения, а также сохранению и восстановлению кишечной микробной экологии будущих матерей, беременных и кормящих женщин. Большое значение имеет поддержание на нужном уровне всех этапов становления и сукцессии микробиоты кишечника будущего человека. Более широкое применение для оптимизации пищевых рационов населения находят функциональные продукты питания, позволяющие целенаправленно конструировать пищевые рационы с учетом этнической принадлежности потребителей, их возраста, профессии, экологических и географических особенностей регионов их проживания.
Такие продукты, предназначены для систематического (регулярного) употребления в составе обычных пищевых рационов всеми группами здорового населения, сохраняющие и улучшающие состояние их здоровья и снижающие риск алиментарных заболеваний, благодаря наличию в составе подобных продуктов функциональных нутриентов, способных оказывать благоприятный эффект на физиологические функции, метаболические и/или поведенческие реакции организма человека. В категорию функциональных продуктов относят продукты, естественно содержащие требуемые количества функционального ингредиента или группы их; натуральные продукты, дополнительно обогащенные каким-либо функциональным ингредиентом или группой их; натуральные продукты, из которых удален компонент, препятствующий проявлению физиологической активности присутствующих в них функциональных ингредиентов; натуральные продукты, в которых исходные потенциальные функциональные ингредиенты модифицированы таким образом, что они начинают проявлять свою биологически активную физиологическую активность или эта активность усиливается; натуральные пищевые продукты, в которых в результате тех или иных модификаций биоусвояемость входящих в них функциональных ингредиентов увеличивается; натуральные или искусственные продукты, которые в результате применения комбинации вышеуказанных технологических приемов, приобретают способность сохранять и улучшать физическое и психическое здоровье человека и/или снижать риск возникновения заболеваний.
Иммунный гомеостаз — это баланс между иммунологической толерантностью и воспалительными иммунными реакциями — является ключевой особенностью в исходе здоровья или болезни. События, происходящие в слизистой, тесно связаны не только с понятием пероральной иммунологической толерантности, но трактуются гораздо шире, поскольку включают взаимоотношения с комменсалами, воспалительные изменения слизистых оболочек, вызванные инфекцией, а также процессы, развивающиеся при аутоиммунных, аллергических заболеваниях.
Слизистые оболочки (бронхолегочного, кишечного, урогенитального трактов) у человека имеют общую площадь более 400 м2 , через них в организм поступают экзогенные потенциально агрессивные субстанции. Мукозная иммунная система составляет приблизительно 80% всех иммунных клеток.
Многочисленными исследованиями установлено, что здоровая микробиота — это качественное и количественное соотношение разнообразных микробов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека. У человека 1013 своих клеток и 1014–1015 клеток различных микроорганизмов, или более 100 трлн. Следовательно, на одну клетку приходится 10 микробов (более 1000 видов). Большинство из них попадают в четыре филы (крупнейшие таксономические единицы бактерий и архей) — Bacteroidetes, Firmicutes, Actinobacteria и Proteobacteria.
Кишечная микробиота играет жизненно важную роль в различных аспектах здоровья человека. Многочисленные исследования связали изменения в микробиоте кишечника с развитием различных заболеваний. Среди огромного бактериального сообщества кишечника бифидобактерии — это род, который доминирует в кишечнике здоровых грудных детей, тогда как в зрелом возрасте уровни ниже, но относительно стабильны. Наличие различных видов бифидобактерий изменяется с возрастом, от детства до глубокой старости (Рисунок 2). Bifidobacterium longum , B. breve и B. bifidum как правило, доминируют у новорожденных, тогда как B. catenulatum, B. adolescentis и, а также B. longum они более распространены у взрослых [33].
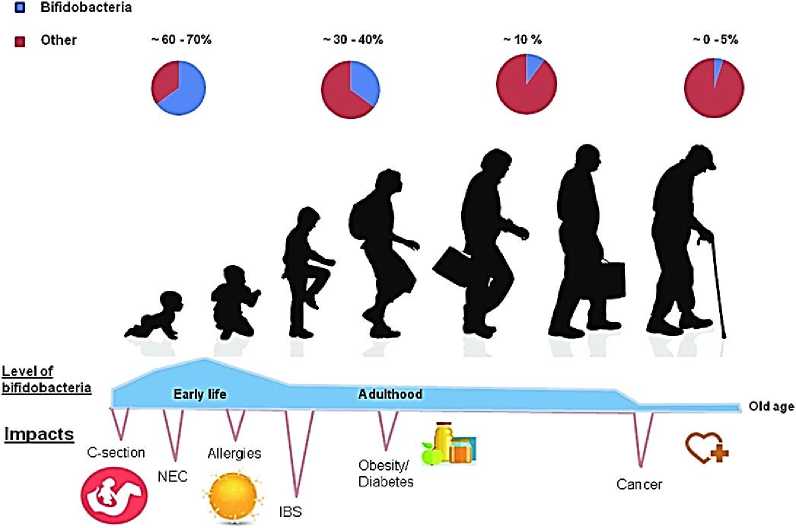
Рисунок 2. При рождении уровень бифидобактерий находится на самом высоком уровне. В случаях естественного деторождения это число наиболее велико при рождении [33].
Убедительные доказательства указывают на наличие окна возможностей в ранней жизни, во время которого изменения в кишечной микробной колонизации могут привести к иммунной дисрегуляции, которая предрасполагает восприимчивых хозяев к заболеванию. Хотя экологические закономерности микробной сукцессии в первый год жизни были частично определены в конкретных человеческих группах, таксономические и функциональные особенности, а также пороги разнообразия, характеризующие эти микробные изменения, по большей части неизвестны. Установлены, наиболее важные связи между временной мозаикой микробной колонизации кишечника и зависящими от возраста иммунными функциями, которые зависят от них. Взаимодействие между сложной экосистемой и иммунной системой хозяина ведет к пониманию важности темпорально структурированных структур разнообразия, ключевых групп и межцарственных микробных взаимодействий для экосистемных функций имеет большой потенциал для разработки биологически обоснованных мероприятий, направленных на поддержание и/или улучшение развития иммунной системы и предупреждение заболеваний.
В конечном счете, выявление критических событий и факторов, влияющих на устойчивость и функционирование микробиома, позволит разработать эффективные мероприятия, направленные на поддержание и/или улучшение развития иммунной системы и профилактику заболеваний. Выполнен огромный объем работы, чтобы понять зависимость иммунной системы от микробиома кишечника ребенка, многое еще предстоит выяснить о конкретных механизмах, ответственных за эту подготовку (Рисунок 3). Улучшение нашего понимания будет происходить в результате продолжения междисциплинарных совместных усилий иммунологов, микробиологов, клиницистов, биоинформатиков и экологов [34].
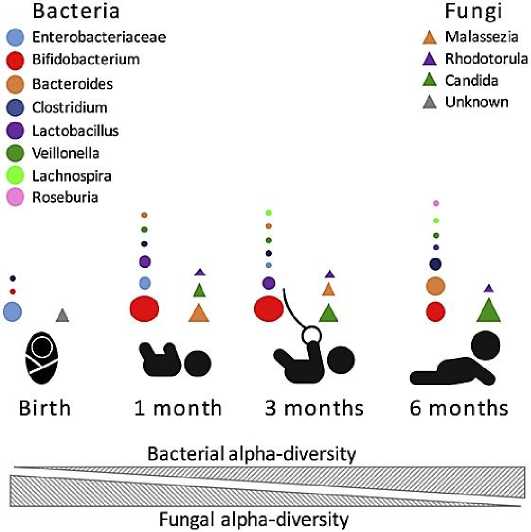
Рисунок 3. Наиболее распространены бактериальные (круги) и грибковые (треугольники) таксоны в течение первых 6 месяцев жизни человека. Размер круга пропорционален относительному обилию бактериальных таксонов [34].
Суммарный геном нормальной микробиоты содержит в 100 раз больше генов, чем геном человека. Масса нормальной микробиоты составляет от 2 до 8 кг. 99,9% составляет микробиота толстого кишечника. Филогенетически древние отношения в биотопах человеческого организма жизненно важны как для организма, так и для самой микробиоты.
В микробиоценозе представлены постоянно обитающие виды бактерий (главная, автохтонная, индигенная, резидентная микрофлора), составляющие 90% от всех микроорганизмов, а также добавочные (сопутствующие, факультативные), на которые приходится 10%, и транзиторные (случайные виды, аллохтонная, остаточная микрофлора) — 0,01%.
Облигатная (нормальная, дружественная — friendly) микробиота представлена анаэробными бактериями родов Bacterioides, Bifidobacterium , непатогенными штаммами клостридий ( Bifidobacterium, Lactobacillus , нормальная E. coli, Peptostreptococcus spp., Streptococcus faecium и др.).
Факультативная микрофлора кишечника представлена пептококками, стафилококками, стрептококками, бациллами, дрожжевыми и дрожжеподобными грибами.
В микробных сообществах, относящихся к нормальной микрофлоре человека, эволюционно сформировались межклеточные сети, представляющие систему трофических и энергетических взаимосвязей внутри кишечного микробиоценоза. Практически ни один доступный биосубстрат не используется только в интересах одной видовой популяции микроорганизмов. 95–99% всех микроорганизмов в естественной среде существует в виде биопленки.
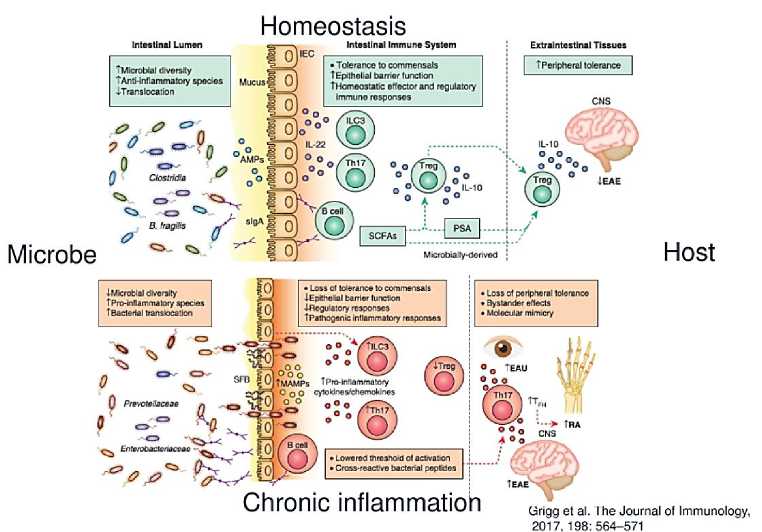
Рисунок 4. Иммунный гомеостаз [35].
Взаимодействия хозяин-микробиота лежат в основе гомеостаза и воспаления в кишечнике и внетестинальных тканях. При гомеостазе кишечные бактерии компартментализированы в просвете посредством исключения слизью, нейтрализации антимикробными пептидами, продуцируемыми IEC, и высвобождения секреторного IgA (sIgA) из кишечно-резидентных В-клеток. В ответ на различные сигналы ILC3s и Th17 клетки в кишечнике вырабатывают IL-22, который действует на IEC, чтобы способствовать компартментализации микробиоты. Tregs продуцируют IL-10 и индуцируются микробно полученными SCFA и PSA или бактериальными видами B. fragilis и Clostridium. Кишечная активация Tregs может защитить от нейровоспаления в ЦНС во время EAE. Во время хронического воспаления кишечника потеря функция кишечного барьера приводит к бактериальной транслокации через эпителий, высвобождению соразмерно полученных MAMPs, провоспалительного цитокина и активация хемокинов и ответы Th17 и В-клеток. Специфические бактерии усугубляют воспаление кишечника, включая Prevotellaceae, Imageobacteriaceae и Th17-inducing SFB. Потеря толерантности к self-Ags может произойти из-за пониженных порогов для автоактивации (эффект Байандера), которые могут опосредовать аутоиммунитет в внетестинальные ткани. Побочные эффекты инициируют и усугубляют воспаление Th17-mediated на мышиных моделях EAE и RA. При РА, Th17 и фолликулярном помощнике Т-клеточные ответы способствуют выработке аутоантитела во вторичных лимфатических узлах. Лицензирование кросс-реактивных ответов Т-клеток, которые распознают микробно полученные пептиды и реакция на самопептиды может также инициировать аутоиммунитет во внетестинальных тканях, как показано на мышиной модели экспериментального аутоиммунного увеита (EAU) [35].
Нормальная микробиота представляет собой большое количество чужеродных молекул (антигенов и паттернов), которые способна распознавать иммунная система. Однако иммунная система слизистых не осуществляет привычные защитные функции в отношении нормальной микробиоты и не элиминирует ее. Современные исследования о взаимоотношениях нормальной микробиоты кишечника и иммунной системы, демонстрируют обеспечение возможности проживания большого количества видов симбионтных бактерий на слизистых рассматривается как отдельная и независимая функция иммунной системы — акцептивная. Акцептивный иммунитет — это взаимодействие иммунной системы с нормальной микробиотой в отличие от «протективного иммунитета», направленного на уничтожение патогенов. Защитная (протективная) реакция обеспечивает агрессию против патогенов, их повреждение, уничтожение, формирует противоинфекционный иммунитет, аллергию, аутоиммунные реакции. В то время как акцептивная обеспечивает мирное сосуществование, сохранение, химеризм, симбиоз с нормальной микробиотой, толерантность к пищевым антигенам, нормальное течение беременности, противоопухолевый иммунитет.
Взаимодействия между симбиотическими микробами и их хозяином изменяют реакцию иммунной системы хозяина на другие микроорганизмы, включая патогенные, и необходимые для поддержания надлежащего иммунного гомеостаза.
Новые достижения в понимании того, как функционально взаимодействуют иммунная система млекопитающих и кишечная микробиота, дали новые представления о здоровье и болезнях человека. Современные технологии количественного измерения специфических и функциональных характеристик микробиоты желудочно-кишечного тракта, наряду с фундаментальными и новыми концепциями в области иммунологии, выявили многочисленные пути, по которым взаимодействие хозяина и микробиоты протекает благоприятно, нейтрально или неблагоприятно для хозяев млекопитающих. Очевидно, что микробиота кишечника оказывает сильное влияние на форму и качество иммунной системы; соответственно, иммунная система определяет состав и локализацию микробиоты. Эти взаимодействия охватывают гомеостаз и воспаление в кишечнике и, в некоторых случаях, внекишечных тканях. Трансляционные методы лечения, основанные на исследованиях взаимодействия хозяина и микробиоты, могут быть использованы для лечения хронических воспалительных заболеваний [35].
Влияние пищевых привычек на микробиоту кишечника. Поскольку наши пищевые привычки являются результатом специфической смеси микро — и макроэлементов, непрерывно и бесконечно поступающих в нашу кишечную экосистему, огромное влияние инновационных и современных пищевых привычек на микробиоту кишечника, связанную с барьерными и иммунными функциями слизистой оболочки хозяина.
Функциональное питание, актуализированное по содержанию макро- и микроэлементов, клетчатки — является одним из ключевых модуляторов состава микробиоты кишечника, которая непосредственно влияет на гомеостаз хозяина и
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №10. 2020 биологические процессы, а также через метаболиты, полученные из микробной ферментации питательных веществ.
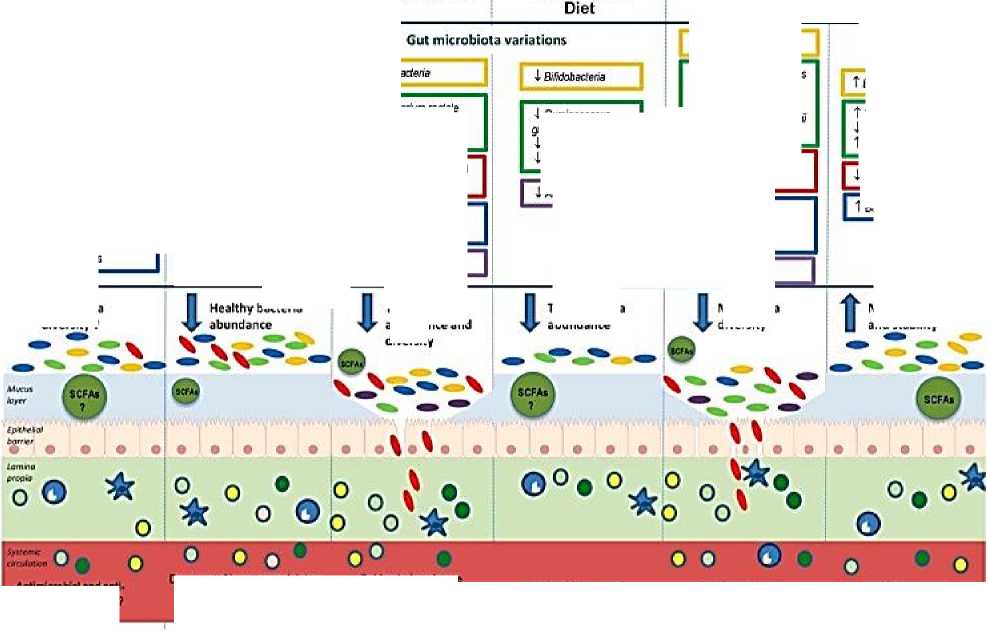
Влияние различных видов диеты на комменсальные бактериальные виды, слизистый слой, в которой находятся иммунные клетки (Рисунок 5) [36].
Low Fodmap
Gluten-free Diet
Ketogenic Diet
Western Diet
• Bfifcbviwia v BiMabaciena елмж1еп> t Baclorotdelos
T Enierafiaerena’ [foal)
Г AAAewflrttil bacteria
1 BilMabacleftaf
1 Corobacferiaoeae t Bactera'dcsPrraofeVa t fl PiefaoJaomitw) T BactemcfelES
* Enterobacteria
T AAsipes
1 Р/еШ4
* flarte/oWes
Microbiota diversity ?
MlcroWota diversity t CAMfindum obstifMOtorme T F^ausniUV
4 CtorfAAtim cluster XIV t KtebsicA'a pneumoniae
I fiMophito
* Puwiihococcw lorries
4 Roestone
4 Eub^rcwm reclame
4 RiATibococcus trami
4 LactoOaoiUs
Microbiota diversity and stability
Vegan/Vegetarian diet
Mediterranean Diet
* E^nbadina (E cot^
* DesaftWtno sop
РагвйаЛгояЛй * Bacteroidetes v EubactenUiw rectal v Duster
4 Fr me ules
4 uetoeovaceae
4 Pumhococcvs biwvi
J Pcoeburit t WcfivaV^eao TCfestridface»
4 EacbtacilUs"
4 Cbslnritiim
Museburense
4 F praMnJtzv
I Елютмма
T LacfoftaoiVus
4 Cfcslnttum
T Lachros^raceae
® Treg cell
Macrophage
Pro* Inflammatory IL-17, INFtx, IFNy
Antimicrobial and antiInflammatory «fleets ?
• Fecal varatonenurctxta ol r«ify alite KAmvq GFO over ere moon
Antiinflammatory IL-1Q, IL-22
Actinobactaria « - Flmilcutea ^» Proteobacteria ^^ BacteroidetBS ^ Vwrumicrobla ь ^^'^Х и Ar^bhla^l.
Irtlammatoiy^?
and glutamate levels '


ДМеялжв!»
Total bacteria abundance and diversity

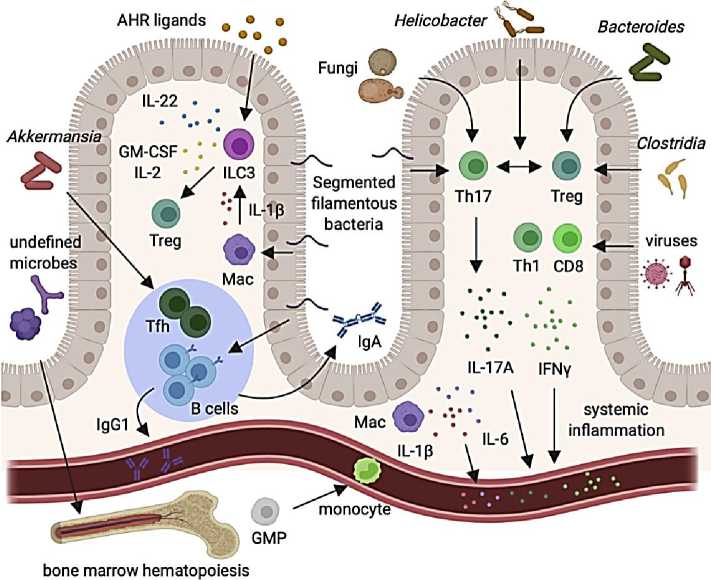
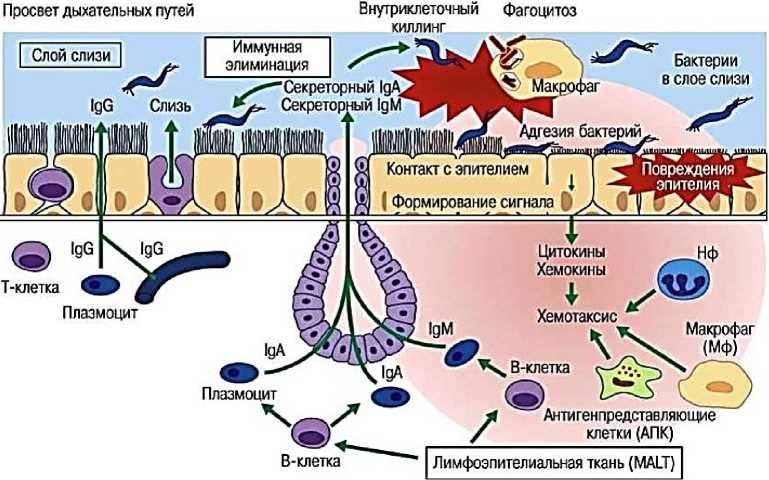
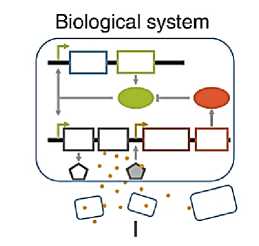
Der I flawococcas l С.ОЗШШ! IF pawiitf 1 AWMHftan Total bacteria abundance O’1’” One o™ Рисунок 5. Влияние иммунные клетки [36]. различных видов диеты на микробиоту кишечника, слизистый слой и Вариации видов бактерий обозначены прямоугольными рамками. Стрелки, указывающие вверх или вниз, соответственно, указывают на увеличение или уменьшение численности бактерий. Каждый цвет прямоугольных рамок представляет один тип: желтый для актинобактерий, зеленый для Firmicutes, красный для Proteobacteria, синий для Bacteroides и фиолетовый для Verrumicrobia. На рисунке кишечного эпителия овальные формы представляют микробиоту. Каждый цвет представляет собой один тип. Сокращения: ферментируемые олиго-, ди-, моносахариды и полиолы; GFD: безглютеновая диета; SCFAs: короткоцепочечные жирные кислоты [36]. Желудочно-кишечный тракт колонизирован триллионами местных микроорганизмов, которые формируют иммунную функцию местного и внекишечного хозяина. Дисрегулируемые иммунные ответы все чаще оцениваются как движущие силы не только нейровоспалительных, но также психоневрологических и нейродегенеративных заболеваний. Новые результаты исследований на животных и человеке указывают на то, что кишечная микробиота является значительным фактором нарушения регуляции иммунитета при различных расстройствах ЦНС. Кишечные микробы непосредственно модулируют кишечный и системный иммунный гомеостаз, чтобы повлиять на нейровоспаление, и могут способствовать системному воспалению низкой степени при психоневрологических расстройствах. Патологическая иммунная активация в отношении кишечных микробов, особенность хронического воспаления кишечника, также является значительным фактором риска нейродегенерации. Кроме того, кишечная микробиота регулирует функцию иммунных клеток, резидентных в ЦНС, с потенциальными последствиями для нервного развития и нейровоспалительных состояний. Следовательно, нацеливание на ось микробиота–иммунитет является многообещающим терапевтическим подходом для лечения ЦНС и связанных с ними расстройств (Рисунок 6) [37]. Специфические сообщества кишечной микробиоты оказывают неперекрывающееся влияние на иммунную систему хозяина. Виды бактерий регулируют дифференцировку миелоидных клеток линии в костном мозге и функция циркулирующих зрелых гранулоцитов. Макрофаги обнаруживают колонизацию микробов с помощью рецепторов распознавания образов и высвобождают цитокины для регуляции врожденных лимфоидных клеток группы 3 (ILC3) и регуляторных реакций Т-клеток (Treg). Аккермансия и сегментированные нитевидные бактерии (SFB) промотировать выработку иммуноглобулина G (IgG1) и IgA В-клетками через Т-фолликулярный хелпер (Tfh)-зависимый и независимый механизмы соответственно. SFB, Helicobacter, Bacteroides, Clostridia и местные грибы совместно формируют баланс провоспалительного Т-хелпера 17 (Th17) и противовоспалительного Treg re губки, которые имеют патологические последствия и служат тканезащитным функциям. Во время хронического воспаления кишечника, потери целостности кишечного барьера в кишечнике микробы могут активировать врожденные и адаптивные иммунные клетки для высвобождения провоспалительных цитокинов IL-1β, IL-6, TNFα в кровеносную систему, что приводит к системному воспалению. AHR, арильный углеводородный рецептор; GM-CSF, гранулоцитарно-макрофаговый колониестимулирующий фактор; Мак, макрофаг; GMP, предшественник гранулоцитов-моноцитов (Рисунок 6) [37]. Рисунок 6. Кишечная микробиота является мощным регулятором иммунных реакций хозяина Огромное количество литературы выявило несколько путей, опосредующих двунаправленную связь между кишечником и ЦНС, совместно называемых осью кишечник-мозг. В частности, микробы, естественно колонизирующие желудочно-кишечный тракт млекопитающих, называемые кишечной микробиотой, не только коррелируют, но также играют причинную роль в регуляции функции ЦНС, развития и поведения хозяина. Сообщества кишечной микробиоты были установлены в качестве мощных модуляторов функции кишечных, системных и ЦНС — резидентных иммунных клеток, что позволяет предположить, что взаимодействия кишечника и мозга могут включать иммунную систему хозяина. Множественные нарушения ЦНС с ассоциированы с микробиотой кишечника, включая нейровоспалительные, психоневрологические и нейродегенеративные расстройства, которые имеют значительные воспалительные проявления (Рисунок 7). Роль микробиоты — иммунных взаимодействий как критического регулятора оси кишечника — мозга в контекст ЦНС и связанных с ним расстройств. Кишечные воспалительные расстройства связаны с нейрофизиологическими и поведенческими симптомами. С другой стороны, многие нарушения центральной нервной системы (ЦНС) сопровождаются кишечными осложнениями. Эти наблюдения показывают, что физиология кишечника и нервной системы функционально связана. Первая линия защиты Рисунок 7. Механизмы воспалительного процесса на слизистой. Микробиота кишечника, представляющая собой совокупность видов различных микроорганизмов, обладает огромным метаболическим потенциалом и способна осуществлять множество биохимических процессов подобно огромной биохимической лаборатории. Фактически в настоящий момент формируется представление о микробиоте кишечника как об отдельном органе человеческого организма, что не противоречит исторически сложившемуся определению органа, как части организма, представляющей собой эволюционно сложившийся комплекс тканей, объединенный общей функцией, структурной организацией и развитием. При этом человека можно рассматривать как «сверхорганизм», чей обмен веществ обеспечивается четко организованной работой ферментов, кодируемых не только геномом собственно H. sapiens, но и геномами всех симбиотических микроорганизмов. В исследованиях Н. П. Романчук [6–8, 38] показано, что оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека. Установлено, что системно–локальное и индивидуальное сочетанное (медикаментозное и немедикаментозное) вмешательство в циркадианную ось «микробиота–кишечник–мозг» с помощью ежедневного употребления функциональных продуктов питания, положительно влияет на когнитивное и психическое здоровье человека. Висцеральный и когнитивный мозг регулируя уровни мелатонина изменяют флору кишечника и улучшают антимикробные действия. Функциональное и сбалансированное питание обеспечивают циркадианное функционирование нейрооси «мозг–кишечник» с одновременным питанием «мозга» и «микробиоты». Новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке и клинической гериатрии [38–39]. Внедрение результатов исследования, позволяет восстановить функционирование циркадианной системы человека, нормализовать уровень и концентрацию мелатонина в организме, осуществлять регуляцию процессов сна и бодрствования, управлять нейропластичностью, проводить профилактику когнитивных нарушений, активировать собственные циркадианные ритмы и их синхронизацию с окружающей средой, через использование мультимодальной схемы повышения циркадианного уровня гормона мелатонина в крови человека: циркадианные очки, функциональное питание и физическая активность [6–7]. Исследования позволяют подойти к осознанному управлению сном и запрограммированным качественно повторяющимся сновидениям, с использованием квантового ресурса. Разум — это персонализация мозга. Нейрофизиология и нейробиология – мультидисциплинарно синхронизированы с медициной, генетикой, молекулярная биологией, различными физическими, оптическими, математическими методами и инструментами, с нейроинтерфейсами и искусственным интеллектом [39]. Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности [39]. «Нейроинтерфейсный камень» самооценки H. sapiens для самоактуализации и самореализации личности — это, самооткрытие, саморазвитие, самообладание, самореализация. Депрессия — это разрушительный синдром, с аллостатической перегрузкой и транзиторной дисрегуляцией функций неврологического, метаболического и иммунологического статуса, а также перепрограммированием в гипоталамо-гипофизарно-надпочечниковой оси. Депрессия вызывает патологические изменения в секреции и моторике пищеварительной системы, а сбой в работе двунаправленных кишечно-мозговых связей модифицируют микробиоту кишечника. Хроническая депрессия дестабилизирует работу «когнитивного и висцерального мозга» [39]. Продолжающимися перспективными современными фундаментальными и прикладными исследованиями, являются математическое, биологическое, биофизическое, нейрофизиологическое, генетическое и эпигенетическое моделирование функционирования «когнитивного» и «висцерального» мозга, его мультидисциплинарное и мультимодальное взаимодействие в триаде «мозг–глаза–сосуды», а так же использование нейроинтерфейсов и искусственного интеллекта для открытия механизмов сна и сновидений, и их клинического применения в нейрореабилитации и профилактике старения мозга и сохранения когнитивных функций, в различные возрастные периоды жизнедеятельности [40]. Сохранение когнитивных способностей мозга возможно только при его непрерывной тренировке творческо-мыслительной работой. Активное и когнитивное долголетие человека может быть достигнуто путем исследования биофизики генома, нутригеномики, нутригенетики, ревитализации, циркадианного функционирования нейрооси «мозг — кишечник» с одновременным питанием «мозга» и «микробиоты» с помощью ежедневного полифункционального диетического комплекса функциональных продуктов питания. Современная нутригенетика и нутригеномика персонифицировали генетический контроль в нутрицитологии. Разработаны комбинированные и/или дополнительные методы, которые активируют процессы нейрогенеза в головном мозге и его нейропластичность [41]. Всего в головном мозге примерно 1011 (сто миллиардов) нейронов. В коре больших полушарий 0,14×1011 нейронов. ЦНЦ состоит из 2–3 нейронов. Поэтому в головном мозге может быть до 5×109 ЦНЦ. Образованный человек может оперировать (помнить) примерно 105 понятий (слов). Для каждого понятия, по-видимому, необходимо до 10 ЦНЦ: само понятие, его запись, принципы связи с другими понятиями и т.д. Поэтому, для работы с понятиями нужно примерно 106 ЦНЦ. Если человек знает два языка, то необходимо еще 106– 107 ЦНЦ. Нужно не только помнить слова другого языка, но и отождествить слова в двух языках [41]. Оставшиеся ЦНЦ, фактически те же 5×109 служат для запоминания других фактов, необходимых для жизнедеятельности: партнеров, окружающей среды, стандартных наборов поведения, рабочих навыков и т. д. Мозг имеет практически неограниченные ресурсы памяти. Эти ресурсы памяти используются далеко не полностью. Синаптическая нейропластичность и современная эпигенетическая защита, гарантируют долговременное запоминание и включение в новообразованную сеть участков с совершенно не использованными, новообразованными контактами между клетками. Чем больше новых синаптических контактов участвует в сети первичной (кратковременной) памяти, тем больше у этой сети шансов сохраниться надолго [41]. Кишечные эпителиальные клетки, выстилающие желудочно-кишечный тракт, создают барьер между внешней средой и внутренней средой. Неповрежденный кишечный барьер поддерживает здоровье кишечника и общее хорошее здоровье организма, предотвращая повреждение тканей, инфекцию патогенов и развитие заболеваний. Когда нарушается барьерная функция кишечника, может произойти бактериальная транслокация. Наша кишечная микробиота также играет фундаментально важную роль в здоровье, например, поддерживая целостность кишечного барьера, метаболизм и модулируя иммунную систему и т. д. [42]. Любое нарушение состава микробиоты кишечника может привести к различным патологическим состояниям. Кишечный барьер и кишечная микробиота — это два важнейших фактора, влияющих на здоровье кишечника. Желудочно-кишечный тракт — это сложная среда, подверженная воздействию многих пищевых компонентов и комменсальных бактерий. Диетические компоненты играют различные полезные роли помимо основного питания, что приводит к разработке концепций функционального питания [42]. Новые математические и вычислительные методы имеют решающее значение для проведения исследований во многих областях медицины, биофизики и биологии, таких как геномика, молекулярная биология, клеточная биология, биология развития, нейробиология, экология и эволюция. Современное цифровое здравоохранение, ядерная медицина, биофизика, биология, медицинская иммунология создают новые проблемы, которые стимулируют развитие нового биофизического контура и математических моделей геномноклеточного — организменного ядерного синтеза. При этом эффективно используются: детерминированные, стохастические, гибридные, многомасштабные методы моделирования, а также аналитические и вычислительные методы. Ключом к использованию метода глубокого обучения является установление такого отображения посредством обучения в обход генерации временных курсов, что приводит к массовому ускорению прогнозируемых результатов (Рисунок 8). Используется небольшая часть данных, генерируемых моделью на основе механизма, для обучения нейронной сети. Данные, генерируемые механистической моделью, должны быть достаточно большими, чтобы обеспечить надежное обучение, но достаточно малыми, чтобы генерация данных была вычислительно осуществима [43]. Biological system Mechanism-based model ^ = к№+^ kjVxyxj+f^x^... xn) Small-scale predictions slow but manageable Large-scale predictions slow or impossible Neural network t *^ Dynamics Predictions fast Рисунок 8. Использование искусственной нейронной сети для сложной биологической модели, основанной на механизмах многомасштабных методов моделирования [43]. Показана гипотетическая биологическая сеть и соответствующая механистическая модель. Механистическая модель используется для генерации обучающего набора данных, который используется для обучения нейронной сети. В зависимости от конкретной механистической модели обученная нейронная сеть может работать на порядки быстрее, позволяя исследовать гораздо большее параметрическое пространство системы (Рисунок 8). Таким образом, нейродегенеративные и возраст-ассоциированные хронические заболевания, при которых имеют место такие патофизиологические проявления как нестабильность генома и эпигенома, окислительный стресс, хроническое воспаление, укорочение теломер, утрата протеостазиса, митохондриальные дисфункции, клеточное старение, истощение стволовых клеток и нарушение межклеточной коммуникации преимущественно инициируются несбалансированным питанием и дисбалансом симбиотической кишечной микробиоты. Суммарный геном нормальной микробиоты содержит в 100 раз больше генов, чем геном человека. В микробных сообществах, относящихся к нормальной микрофлоре человека, эволюционно сформировались межклеточные сети, представляющие систему трофических и энергетических взаимосвязей внутри кишечного микробиоценоза. Учитывая, что 90% энергии для клеток пищеварительного тракта производится кишечными бактериями и именно микроорганизмы являются ключевым звеном, стартерами возникновения, а затем эволюции и эпигенетики биологической жизни, включая человека, на нашей планете — необходимо соответствующее управление биоэнергией. Молекулярными, клеточными и средовыми основами здоровья и долголетия являются метагеном и эпигеном человека, а полноценность их реализации в конкретных условиях жизнедеятельности H. sapiens — являются многомасштабные методы моделирования и прогнозирования.
Список литературы Иммунный гомеостаз: новая роль микро- и макроэлементов, здоровой микробиоты
- Романчук П. И. Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет // Бюллетень науки и практики. 2020. Т. 6. №9. С. 127-166. DOI: 10.33619/2414-2948/58/14
- Романчук П. И., Волобуев А. Н. Современные инструменты и методики эпигенетической защиты здорового старения и долголетия Homo sapiens // Бюллетень науки и практики. 2020. Т. 6. №1. С. 43-70. DOI: 10.33619/2414-2948/50/06
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110. DOI: 10.33619/2414-2948/51/07
- Волобуев А. Н., Романчук П. И. Генетика и эпигенетика сна и сновидений // Бюллетень науки и практики. 2020. Т. 6. №7. С. 176-217. DOI: 10.33619/2414-2948/56/21
- Пятин В. Ф., Романчук Н. П., Булгакова С. В., Романов Д. В., Сиротко И. И., Давыдкин И. Л., Волобуев А. Н. Циркадианный стресс Homo sapiens: новые нейрофизиологические, нейроэндокринные и психонейроиммунные механизмы // Бюллетень науки и практики. 2020. Т. 6. №6. С. 115-135. DOI: 10.33619/2414-2948/55/16
- Романчук Н. П., Пятин В. Ф. Мелатонин: нейрофизиологические и нейроэндокринные аспекты. Бюллетень науки и практики. 2019. Т. 5. № 7. С. 71-85.
- DOI: 10.33619/2414-2948/44/08
- Пятин В. Ф., Романчук Н. П., Романчук П. И., и др. Способ нормализации циркадианных ритмов человека. Патент РФ на изобретение №2533965.
- Романчук Н. П. Способ производства зернового компонента для пищевого продукта быстрого приготовления и способ производства функционального пищевого продукта быстрого приготовления. Патент РФ на изобретение №2423873.
- Skalny A. V., Rink L., Ajsuvakova O. P., Aschner M., Gritsenko V. A., Alekseenko S. I.,.., Tsatsakis A. Zinc and respiratory tract infections: Perspectives for COVID-19 // International Journal of Molecular Medicine. 2020. V. 46. №1. P. 17-26.
- DOI: 10.3892/ijmm.2020.4575
- Pittet L. A., Hall-Stoodley L., Rutkowski M. R., Harmsen A. G. Influenza virus infection decreases tracheal mucociliary velocity and clearance of Streptococcus pneumoniae // American journal of respiratory cell and molecular biology. 2010. V. 42. №4. P. 450-460.
- DOI: 10.1165/rcmb.2007-0417OC
- Darma A., Ranuh R. G., Merbawani W., Setyoningrum R. A., Hidajat B., Hidayati S. N.,.. Sudarmo S. M. Zinc supplementation effect on the bronchial cilia length, the number of cilia, and the number of intact bronchial cell in zinc deficiency rats // The Indonesian Biomedical Journal. 2020. V. 12. №1. P. 78-84.
- DOI: 10.18585/inabj.v12i1.998
- Truong-Tran A. Q., Carter J., Ruffin R., Zalewski P. D. New insights into the role of zinc in the respiratory epithelium // Immunology and cell biology. 2001. V. 79. №2. P. 170-177.
- DOI: 10.1046/j.1440-1711.2001.00986.x
- Woodworth B. A. et al. Zinc increases ciliary beat frequency in a calcium-dependent manner // American journal of rhinology & allergy. 2010. V. 24. №1. P. 6-10.
- DOI: 10.2500/ajra.2010.24.3379
- Speth R., Carrera E., Jean-Baptiste M., Joachim A., Linares A. Concentration-dependent effects of zinc on angiotensin-converting enzyme-2 activity (1067.4) // The FASEB journal. 2014. V. 28. P. 1067.4.
- DOI: 10.1096/fasebj.28.1_supplement.1067.4
- Sandstead H. H., Prasad A. S. Zinc intake and resistance to H1N1 influenza // American journal of public health. 2010. V. 100. №6. P. 970.
- Zhang H., Penninger J. M., Li Y., Zhong N., Slutsky A. S. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target // Intensive care medicine. 2020. V. 46. №4. P. 586-590.
- DOI: 10.1007/s00134-020-05985-9
- Xu L., Tong J., Wu Y., Zhao S., Lin B. L. Targeted oxidation strategy (TOS) for potential inhibition of coronaviruses by disulfiram-a 70-year old anti-alcoholism drug. 2020.
- Korant B. D., Kauer J. C., Butterworth B. E. Zinc ions inhibit replication of rhinoviruses // Nature. 1974. V. 248. №5449. P. 588-590.
- DOI: 10.1038/248588a0
- Cakman I, Kirchner H and Rink L. Zinc supplementation reconstitutes the production of interferon-α by leukocytes from elderly persons // Journal of interferon & cytokine research. 1997. V. 17. №8. P. 469-472.
- DOI: 10.1089/jir.1997.17.469
- Berg K., Bolt G., Andersen H., Owen T. C.Zinc potentiates the antiviral action of human IFN-α tenfold // Journal of Interferon & Cytokine Research. 2001. V. 21. №7. P. 471-474.
- DOI: 10.1089/10799900152434330
- Khera D., Singh S., Purohit P., Sharma P., Singh K. Prevalence of Zinc Deficiency and Effect of Zinc Supplementation on Prevention of Acute Respiratory Infections: A Non Randomized Open Label Study. 2018.
- DOI: 10.2139/ssrn.3273670
- Lang C. J., Hansen M., Roscioli E., Jones J., Murgia C., Ackland M. L.,.. Ruffin R. Dietary zinc mediates inflammation and protects against wasting and metabolic derangement caused by sustained cigarette smoke exposure in mice // Biometals. 2011. V. 24. №1. P. 23-39.
- DOI: 10.1007/s10534-010-9370-9
- Wessels I., Haase H., Engelhardt G., Rink L., Uciechowski P. Zinc deficiency induces production of the proinflammatory cytokines IL-1β and TNFα in promyeloid cells via epigenetic and redox-dependent mechanisms // The Journal of nutritional biochemistry. 2013. V. 24. №1. P. 289-297.
- DOI: 10.1016/j.jnutbio.2012.06.007
- Prasad A. S., Bao B., Beck F. W., & Sarkar F. H. Zinc-suppressed inflammatory cytokines by induction of A20-mediated inhibition of nuclear factor-kB // Nutrition. 2011. V. 27. №7-8. P. 816-823.
- DOI: 10.1016/j.nut.2010.08.010
- Wellinghausen N., Martin M., Rink L. Zinc inhibits interleukin-1-dependent T cell stimulation // European journal of immunology. 1997. V. 27. №10. P. 2529-2535.
- DOI: 10.1002/eji.1830271010
- Rosenkranz E., Metz C. H., Maywald M., Hilgers R. D., Weßels I., Senff T.,.., Plümäkers B. Zinc supplementation induces regulatory T cells by inhibition of Sirt-1 deacetylase in mixed lymphocyte cultures // Molecular nutrition & food research. 2016. V. 60. №3. P. 661-671.
- DOI: 10.1002/mnfr.201500524
- Von Bülow V., Dubben S., Engelhardt G., Hebel S., Plümäkers B., Heine H.,.., Haase H. Zinc-dependent suppression of TNF-α production is mediated by protein kinase A-induced inhibition of Raf-1, IκB Kinase β, and NF-κB // The Journal of Immunology. 2007. V. 179. №6. P. 4180-4186.
- DOI: 10.4049/jimmunol.179.6.4180
- Kahmann L., Uciechowski P., Warmuth S., Plümäkers B., Gressner A. M., Malavolta M.,.., Rink L. Zinc supplementation in the elderly reduces spontaneous inflammatory cytokine release and restores T cell functions // Rejuvenation research. 2008. V. 11. №1. P. 227-237.
- DOI: 10.1089/rej.2007.0613
- Osendarp S. J., Prabhakar H., Fuchs G. J., van Raaij J. M., Mahmud H., Tofail F.,.. Black R. E. Immunization with the heptavalent pneumococcal conjugate Vaccine in Bangladeshi infants and effects of zinc supplementation // Vaccine. 2007. V. 25. №17. С. 3347-3354.
- DOI: 10.1016/j.vaccine.2007.01.001
- Tsatsakis A., Tyshko N. V., Docea A. O., Shestakova S. I., Sidorova Y. S., Petrov N. A.,.. Tutelyan V. A. The effect of chronic vitamin deficiency and long term very low dose exposure to 6 pesticides mixture on neurological outcomes - A real-life risk simulation approach // Toxicology letters. 2019. V. 315. P. 96-106.
- DOI: 10.1016/j.toxlet.2019.07.026
- Wu C., Chen X., Cai Y., Zhou X., Xu S., Huang H.,.., Song J. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China // JAMA Intern Med. 2020. V. 180. №7. P. 934-943.
- DOI: 10.1001/jamainternmed.2020.0994
- Скальная М. Г., Скальный А. В. Эссенциальный след элементы здоровья человека: взгляд врача. Томск, 2018.
- Arboleya, S., Watkins, C., Stanton, C., & Ross, R. P. Gut bifidobacteria populations in human health and aging // Frontiers in microbiology. 2016. V. 7. P. 1204.
- DOI: 10.3389/fmicb.2016.01204
- Laforest-Lapointe I., Arrieta M. C. Patterns of early-life gut microbial colonization during human immune development: an ecological perspective // Frontiers in immunology. 2017. V. 8. P. 788.
- DOI: 10.3389/fimmu.2017.00788
- Grigg J. B., Sonnenberg G. F. Host-microbiota interactions shape local and systemic inflammatory diseases // The Journal of Immunology. 2017. V. 198. №2. P. 564-571.
- DOI: 10.4049/jimmunol.1601621
- Rinninella E., Cintoni M., Raoul P., Lopetuso L. R., Scaldaferri F., Pulcini G.,.., Mele M. C. Food components and dietary habits: Keys for a healthy gut microbiota composition // Nutrients. 2019. V. 11. №10. P. 2393.
- DOI: 10.3390/nu11102393
- Fung T. C. The microbiota-immune axis as a central mediator of gut-brain communication // Neurobiology of Disease. 2020. V. 136. P. 104714.
- DOI: 10.1016/j.nbd.2019.104714
- Романчук Н. П., Романчук П. И., Малышев В. К. Продукт диетического, профилактического и функционального питания при хронической ишемии головного мозга // Патент РФ на изобретение №2489038.
- Романчук Н. П., Пятин В. Ф, Волобуев А. Н., Булгакова С. В., Тренева Е. В., Романов Д. В. Мозг, депрессия, эпигенетика: новые данные // Бюллетень науки и практики. 2020. Т. 6. №5. 163-183.
- DOI: 10.33619/2414-2948/54/21
- Пятин В. Ф., Романчук Н. П., Романчук П. И., Волобуев А. Н, Мозг, глаза, свет: биоэлектромагнитизм света и нейрореабилитация когнитивных нарушений // Бюллетень науки и практики. 2019. Т. 5. №12. С. 129-155.
- DOI: 10.33619/2414-2948/49/14
- Волобуев А. Н., Романчук П. И., Романчук Н. П., Давыдкин И. Л., Булгакова С. В. Нарушение памяти при болезни Альцгеймера // Врач. 2019. T. 30. №6. С. 10-13.
- DOI: 10.29296/25877305-2019-06-02
- Wan M. L., Ling K. H., El-Nezami H., Wang M. F. Influence of functional food components on gut health // Critical reviews in food science and nutrition. 2019. V. 59. №12. P. 1927-1936.
- DOI: 10.1080/10408398.2018.1433629
- Wang S., Fan K., Luo N., Cao Y., Wu F., Zhang C.,.., You L. Massive computational acceleration by using neural networks to emulate mechanism-based biological models // Nature communications. 2019. V. 10. №1. P. 1-9.
- DOI: 10.1038/s41467-019-12342-y


