Иммунобиологическая активность инденопирролов и инденопиридазинов
Автор: Гейн О.Н., Гейн С.В., Чижова Е.Г., Носова Н.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Наличие высокоэффективных лекарственных препаратов с минимальными побочными эффектами является необходимым в медицинской практике. В связи с этим активно ведется поиск фармакологически активных веществ растительного и химического происхождения. Перспективными в плане поиска биологически активных соединений являются производные пиррола и пиридазина - инденопирролы и инденопиридазины. Оценка влияния данных соединений на функциональную активность иммунной системы актуальна, поскольку иммунная система играет одну из ключевых ролей в поддержании гомеостаза в организме. В качестве объектов исследования нами были взяты инденопирролы (1а-г) и инденопиридазины (2а-г), отличающиеся наличием различных заместителей в структуре молекулы. Для оценки влияния исследуемых соединений на фагоцитарную активность лейкоцитов периферической крови крыс в системе in vivo исследуемые вещества вводили животным внутрибрюшинно в 2%-ной крахмальной слизи в дозе 100 мг/кг. Из хвостовой вены забирали образцы крови. Определение фагоцитарной активности лейкоцитов проводили стандартным методом в модификации. Результаты учитывали микроскопически. Подсчитывали клеточность селезенки, количество антителообразующих клеток в селезенке оценивали методом локального гемолиза в геле агарозы по Jerne. Влияние исследуемых соединений на клеточный иммунитет оценивали с помощью реакции гиперчувствительности замедленного типа. Нами выявлено преимущественно стимулирующее влияние, прежде всего инденопирролов на фагоцитарную активность нейтрофилов и общий лейкоцитарный фагоцитоз. Инденопирролы снижали клеточность селезенки и уменьшали количество антителообразующих клеток. Инденопиридазины оказывали разнонаправленное влияние на антителогенез. Исследуемые соединения не изменяли выраженность реакции гиперчувствительности замедленного типа.
Фагоцитоз, антителообразование, гиперчувствительность замедленного типа, инденопирролы, инденопиридазины
Короткий адрес: https://sciup.org/147241310
IDR: 147241310 | УДК: 571.27 | DOI: 10.17072/1994-9952-2023-3-274-279
Текст научной статьи Иммунобиологическая активность инденопирролов и инденопиридазинов
Наличие высокоэффективных лекарственных препаратов с минимальными побочными эффектами является необходимым в медицинской практике. В связи с этим, многие исследователи ведут поиск фармакологически активных веществ, обладающих низкой токсичностью. Среди соединений химического синтеза достаточно много веществ, проявляющих различные виды биологической активности. Не являются исключением пирролы [Li Petri et al., 2020] и их производные пиридазины [Saeed et al., 2012; Zhang-Xu He et al., 2021]. Среди веществ растительного и химического происхождения встречаются соединения, содержащие в своей структуре пиррольное кольцо. Эти соединения обладают различными видами фармакологической активности: антиканцерогенной, антибактериальной, противовирусной, а также могут проявлять антигистаминное и иммуносупрессивное действие [Li Petri et al., 2020; Seipp et al., 2021]. Ряд известных в медицине и широко применяемых лекарственных препаратов содержат в своей структуре пиррольное кольцо. К пирролосодержащим лекарственным препаратам относится нестероидное противовоспалительное средство кеторолак, гиполипидемический препарат аторвастатин, антисеротонинер-гическое средство ондансетрон и ряд других [Li Petri et al., 2020]. Соединения, в структуре которых присутствует пиридазин, также оказывают фармакологическое действие и проявляют противовоспалительное, противоопухолевое действие [Saeed et al., 2012; Abbas et al., 2016; Zhang-Xu He et al., 2021].
Инденопирролы и инденопиридазины являются соответственно производными пиррола и пиридази-на, следовательно, могут обладать биологическими эффектами. Однако их биологическая активность изучена недостаточно. Оценка влияния данных соединений на функциональную активность иммунной системы является актуальной, поскольку иммунная система играет одну из ключевых ролей в поддержании гомеостаза в организме.
Цель работы – исследование влияния инденопирролов и инденопиридазинов на фагоцитарную активность лейкоцитов периферической крови, антителообразование и выраженность реакции гиперчувствительности замедленного типа.
Материалы и методы исследований
В качестве объектов исследования были взяты восемь соединений: инденопирролы (1а-г) и индено-пиридазины (2а-г), отличающиеся наличием различных заместителей в структуре молекулы (рисунок).
Эксперименты в системе in vivo проведены на белых нелинейных половозрелых крысах массой 180– 230 г, а также на белых нелинейных мышах массой 21–26 г.
Все исследовательские работы с лабораторными животными выполняли в соответствии с общепринятыми этическими нормами обращения с животными, принятыми Европейской конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей [Европейская конвенция …, 1986].
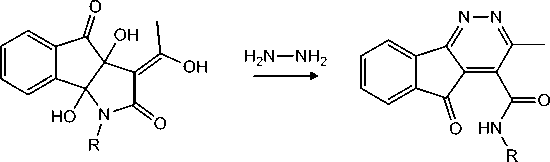
1а–г
2а–г
Структурные формулы изучаемых соединений
R=C 6 H 5 ( 1а , 2а ), R=2-СlC 6 H 4 ( 1б , 2б ), R=2-СН 3 C 6 H 4 ( 1в , 2в ), R=H ( 1г , 2г )
[Structural formulas of the studied compounds
R=C 6 H 5 ( 1а , 2а ), R=2-СlC 6 H 4 ( 1б , 2б ), R=2-СН 3 C 6 H 4 ( 1в , 2в ), R=H ( 1г , 2г )]
Для оценки влияния исследуемых соединений на фагоцитарную активность лейкоцитов периферической крови крыс в системе in vivo исследуемые вещества вводили животным внутрибрюшинно в 2%-ной крахмальной слизи в дозе 100 мг/кг. Из хвостовой вены забирали образцы крови до введения исследуемых веществ (контроль), а также спустя 1 ч после их введения. Определение фагоцитарной активности лейкоцитов периферической крови проводили стандартным методом в модификации [Шилов, Владыкина, Атнагузина, 1998]. Результаты учитывали микроскопически. Рассчитывали показатели фагоцитарной активности лейкоцитов: процент фагоцитоза и фагоцитарный индекс дифференцированно для нейтрофильного, моноцитарного и общего лейкоцитарного фагоцитоза.
Для изучения влияния исследуемых веществ на антителообразование вещества суспендировали в 2%-ной крахмальной слизи и вводили мышам внутрибрюшинно в дозе 50 мг/кг. Контрольной группе животных вводили 2%-ную крахмальную слизь. Через 1 ч животных иммунизировали эритроцитами барана в концентрации 108 внутрибрюшинно. На 5-е сутки животных выводили из эксперимента путем декапитации под эфирным наркозом и оценивали клеточность и количество антителообразующих клеток (АОК) в селезенке методом локального гемолиза в геле агарозы по Jerne [Jerne, Nordin, 1963].
Для оценки влияния исследуемых соединений на выраженность реакции гиперчувствительности замедленного типа (ГЗТ), вещества суспендировали в 2%-ной крахмальной слизи и вводили мышам внутрибрюшинно в дозе 50 мг/кг. В качестве контроля вводили 2%-ную крахмальную слизь. Через 1 ч животных иммунизировали эритроцитами барана внутрибрюшинно в концентрации 108 клеток. Разрешающую дозу эритроцитов барана (108 клеток в 20 мкл физиологического раствора) вводили на 4-е сутки (опытная стопа). Параллельно с введением антигена в левую стопу (контроль) вводили физиологический раствор в объеме 20 мкл. Выраженность иммунного воспаления при ГЗТ оценивали через 24 ч после введения разрешающей дозы антигена путем изменения массы опытной и контрольной стопы. Результаты представляли в виде разности массы опытной и контрольной стопы и в виде индекса реакции, который рассчитывали по формуле
(Ро – Рк)/Рк*100%, где Ро – показатели массы опытной конечности, Рк – показатели массы контрольной конечности.
Статистическую обработку данных проводили методами вариационной статистики с помощью t -критерия Стьюдента. Эффект считали статистически значимым при p<0.05 по сравнению с контролем. Результаты представляли в виде средней и ее стандартной ошибки (М±m).
Результаты и их обсуждение
При изучении влияния инденопирролов и инденопиридазинов на фагоцитарную активность лейкоцитов периферической крови выявлено изменение поглотительной активности лейкоцитов, прежде всего нейтрофилов (табл. 1). Так, инденопирролы 1а, 1б, 1г увеличивали количество активных нейтрофилов и стимулировали их поглотительную активность. Соединение 1г, помимо влияния на нейтрофильный фагоцитоз, увеличивало также количество фагоцитирующих моноцитов, но без изменения их поглотительной активности. Стимулирующее влияние на общий лейкоцитарный фагоцитоз оказывали все индено-пирролы (1а–г). Среди инденопиридазинов стимулирующее влияние на поглотительную активность нейтрофилов оказывало лишь соединение 2г. При введении соединения 2а выявлено уменьшение количества активных моноцитов, захватывающих объекты фагоцитоза. Исследуемые вещества 2б и 2в не оказывали влияния на фагоцитарную активность нейтрофилов, моноцитов и общий лейкоцитарный фагоци- тоз. Таким образом, нами было выявлено большее влияние инденопирролов на фагоцитарную активность лейкоцитов периферической крови по сравнению с их производными – инденопиридазинами.
Таблица 1
Влияние соединений инденопирролов (1а–г) и инденопиридазинов (2а–г) на фагоцитарную активность лейкоцитов
[The effect of indenopyrroles (1a–г) and indenopyridazines (2a–г) compounds on the phagocytic activity of leukocytes]
|
Группа |
Нейтрофилы |
Моноциты |
Лейкоциты |
|||
|
фагоцитарный индекс |
процент фагоцитоза |
фагоцитарный индекс |
процент фагоцитоза |
фагоцитарный индекс |
процент фагоцитоза |
|
|
К ( n =9) |
1.31±0.09 |
29,20±4.01 |
1.11±0.06 |
31.30±3.79 |
1.29±0.09 |
29.24±3.67 |
|
1а ( n =9) |
1.59±0.07* |
45.77±3.69* |
1.18±0.09 |
31.67±6.92 |
1.57±0.07* |
44.02±3.68* |
|
К ( n =6) |
1.45±0.02 |
32.87±1.39 |
1.09±0.04 |
22.53±3.22 |
1.45±0.02 |
31.42±1.52 |
|
1б ( n =6) |
1.68±0.06* |
44.91±4.06* |
1.59±0.25 |
25.09±1.46 |
1.65±0.05* |
42.48±4.19* |
|
К ( n =6) |
1.26±0.05 |
24.15±3.64 |
1.07±0.07 |
21.49±1.19 |
1.17±0.05 |
19.45±3.05 |
|
1в ( n =6) |
1.33±0.03 |
32.39±2.80 |
1.19±0.12 |
20.22±3.62 |
1.32±0.04* |
31.08±2.55* |
|
К ( n =7) |
1.25±0.04 |
17.87±0.72 |
1.07±0.07 |
18.52±3.03 |
1.23±0.04 |
18.09±0.69 |
|
1г ( n =7) |
1.51±1.43* |
36.28±3.11* |
1.34±0.09 |
39.77±4.65* |
1.49±0.08* |
36.52±2.79* |
|
К ( n =8) |
1.50±0.06 |
25.49±1.89 |
1.32±0.08 |
34.97±3.38 |
1.40±0.06 |
25.84±1.54 |
|
2а ( n =8) |
1.56±0.08 |
24.31±1.78 |
1.34±0.13 |
24.53±2.66* |
1.54±0.07 |
24.16±1.69 |
|
К ( n =6) |
1.59±0.12 |
29.36±3.79 |
1.31±0.17 |
27.89±2.49 |
1.53±0.09 |
26.93±2.99 |
|
2б ( n =6) |
1.66±0.09 |
28.23±4.31 |
1.32±0.22 |
26.65±4.29 |
1.64±0.09 |
27.17±3.89 |
|
К ( n =6) |
1.53±0.05 |
37.53±2.82 |
1.35±0.12 |
27.63±6.51 |
1.54±0.10 |
38.95±5.02 |
|
2в ( n =6) |
1.69±0.11 |
46.12±3.77 |
1.44±0.24 |
20.48±5.65 |
1.67±0.11 |
43.94±3.27 |
|
К ( n =6) |
1.39±0.06 |
42.02±3.35 |
1.14±0.06 |
32.43±5.15 |
1.48±0.07 |
45.38±3.39 |
|
2г ( n =6) |
1.75±0.12* |
48.37±3.23 |
1.47±0.21 |
18.55±3.99 |
1.74±0.11 |
46.52±3.03 |
Примечание. Результаты представлены в виде средней и ее стандартной ошибки (М ± m); К – контроль; n – количество животных в группе; * - р <0.05 по сравнению с контролем.
При оценке влияния изучаемых соединений 1а–г и 2а–г на гуморальный иммунный ответ, выявлено снижение количества ядросодержащих клеток (ЯСК) селезенки на фоне введения инденопирролов, а именно, соединений 1б и 1в (табл. 2). При введении соединения 1б клеточность селезенки снижалась более чем на 40%. Соединения 1а и 2а–г не вызывали статистически значимого изменения клеточности селезенки. Количество антителообразующих клеток селезенки изменялось при введении соединений 1в, 2а и 2в. Указанные соединения оказывали несколько разнонаправленное влияние на количество антителообразующих клеток: вещества 1в и 2в уменьшали количество антителообразующих клеток в селезенке, в то время как соединение 2а приводило к их увеличению.
Следовательно, на антителообразование оказывали влияние, прежде всего инденопирролы, и это влияние носило угнетающую направленность.
Таблица 2
Влияние инденопирролов (1а-г) и инденопиридазинов (2а-г) на антителогенез [Effect of indenopyrroles (1a-г) and indenopyridazines (2a-г) on antibody genesis]
|
Соединение |
ЯСК селезенки (x 106) |
lg АОК на cелезенку |
lg АОК на 106 ЯСК |
|
Контроль (n= 10) |
385.44 ± 50.19 |
4.62 ± 0.08 |
2.07 ± 0.08 |
|
1а ( n = 6) |
350.40 ± 41.45 |
4.75 ± 0.09 |
2.23 ± 0.08 |
|
1б ( n = 6) |
185.92 ± 22.58* |
4.43 ± 0.13 |
2.17 ± 0.13 |
|
1в ( n = 6) |
216.32 ± 31.53* |
4.22 ± 0.09* |
1.90 ± 0.09 |
|
1г ( n = 6) |
504.0 ± 39.87 |
4.84 ± 0.12 |
2.14 ± 0.12 |
|
2а ( n = 6) |
616.0 ± 101.87 |
4.96 ± 0.08* |
2.19 ± 0.09 |
|
2б ( n = 6) |
438.40 ± 102.68 |
4.78 ± 0.27 |
2.17 ± 0.19 |
|
2в ( n = 6) |
226.80 ± 46.72 |
4.15 ± 0.09* |
1.83 ± 0.14 |
|
2г ( n = 6) |
225.28 ± 42.21 |
4.54 ± 0.05 |
2.23 ± 0.04 |
Примечание. Результаты представлены в виде средней и ее стандартной ошибки (М ± m); n – количество животных в группе; * - р <0.05 по сравнению с контролем.
Влияние исследуемых соединений на клеточный иммунитет оценивали с помощью реакции гиперчувствительности замедленного типа. Как видно из данных табл. 3, исследуемые соединения не изменяли выраженность клеточного иммунитета в реакции ГЗТ.
Таблица 3
Влияние инденопирролов (1а–г) и инденопиридазинов (2а–г) на выраженность реакции ГЗТ [The effect of indenopyrroles (1a–г) and indenopyridazines (2a–г) on the severity of the HRT reaction]
|
Соединение |
Масса стопы |
|
|
разность, г |
индекс реакции, % |
|
|
Контроль ( n = 10) |
26.10 ± 2.88 |
18.72 ± 2.04 |
|
1а ( n = 6) |
24.20 ± 2.52 |
15.86 ± 1.92 |
|
1б ( n = 6) |
17.40 ± 3.40 |
14.34 ± 2.79 |
|
1в ( n = 6) |
19.60 ±5.45 |
14.52 ± 4.19 |
|
1г ( n = 6) |
20.25 ± 3.09 |
13.69 ± 2.69 |
|
2а ( n = 6) |
18.00 ± 2.77 |
12.23 ± 2.45 |
|
2б ( n = 6) |
24.60 ± 4.34 |
17.42 ± 3.04 |
|
2в ( n = 6) |
23.40 ± 8.34 |
18.31 ± 6.20 |
|
2г ( n = 6) |
20.60 ± 5.10 |
15.55 ± 3.69 |
Примечание. Результаты представлены в виде средней и ее стандартной ошибки (М ± m); n – количество животных в группе.
Полученные результаты, с одной стороны, говорят об отсутствии влияния исследуемых соединений на иммунное воспаление в реакции ГЗТ. Но с другой стороны, отсутствует и стимуляция, что имеет положительное значение при использовании у данных соединений иных биологических эффектов, поскольку вероятность развития аллергической реакции по типу ГЗТ будет минимальна.
Заключение
В нашем исследовании выявлено преимущественно стимулирующее влияние исследуемых соединений, прежде всего инденопирролов на фагоцитарную активность нейтрофилов и общий лейкоцитарный фагоцитоз. Инденопирролы снижали клеточность селезенки, уменьшали количество антителообразующих клеток в селезенке. Инденопиридазины оказывали разнонаправленное влияние на антителогенез. Как инденопирролы, так и инденопиридазины, не изменяли выраженность реакции гиперчувствительности замедленного типа. Предполагая возможные механизмы наблюдаемых эффектов, нельзя исключить, что стимулирующее влияние исследуемых соединений на поглотительную активность лейкоцитов реализуется через их взаимодействие с паттернраспознающими рецепторами, участвующими в фагоцитозе [Черешнев и др., 2011], или влиянием на каналы TRPM2 (транзиторный рецепторный потенциальный катионный канал, подсемейство М, тип 2) и/или кальциевые каналы, которые широко представлены на фагоцитирующих клетках. Изменение их активности приводит к изменению поглотительной активности лейкоцитов [Hallett, 2023]. Влияние исследуемых соединений на антителообразование в селезенке, скорее всего, носит опосредованный характер и осуществляется при участии макрофагов, способных доставлять в селезенку циркулирующие в организме вещества.
В заключение необходимо отметить перспективность дальнейшего изучения биологических эффектов и механизмов их развития соединений ряда инденопирролов и их производных инденопиридазинов.
Список литературы Иммунобиологическая активность инденопирролов и инденопиридазинов
- Европейская конвенция по защите позвоночных животных, используемых в экспериментальных и других научных целях. Страсбург, 1986.
- Черешнев В.А. и др. Экспериментальные модели в патологии. Пермь, 2011. 267 с. EDN: QMBKWN
- Шилов Ю.И., Владыкина В.П., Атнагузина А.Т. Некоторые методические подходы к оценке показателей общего и дифференцированного фагоцитоза лейкоцитов периферической крови. Характеристика различий у здоровых людей // Пермский медицинский журнал. 1998. Т. 15, № 2. С. 3-9.
- Abbas S.H. et al. Synthesis, cytotoxic activity, and tubulin polymerization inhibitory activity of new pyrrol-2(3H)-ones and pyridazin-3(2H)-ones // Bioorganic Chemistry. 2016. Vol. 66. P. 46-62.
- Hallett M.B. Localisation of Intracellular Signals and Responses during Phagocytosis // Int. J. Mol. Sci. 2023. Vol. 24. 2825.
- Jerne N.K., Nordin A.A. Plaque formation in agar by single antibody-producing cells // Science. 1963. Vol. 140, № 3365. P. 405-415.
- Li Petri G. et al. Bioactive pyrrole-based compounds with target selectivity // European Journal of Medicinal Chemistry. 2020. Vol. 208. 11278.
- Saeed, M.M. et al. Synthesis and anti-inflammatory activity of novel pyridazine and pyridazinone derivatives as non-ulcerogenic agents // Archives of Pharmacal Research. 2012. Vol. 35, № 12. P. 2077-2092. EDN: RIBYPA
- Seipp K., Geske L., Opatz T. Marine Pyrrole Alkaloids // Mar. Drugs. 2021. Vol. 19. 514. EDN: FMSHBF
- Zhang-Xu He et al. Pyridazine as a privileged structure: An updated review on anticancer activity of pyridazine containing bioactive molecules // Eur. J. Med. Chem. 2021. Vol. 209. 112946.


