Иммунофенотипические и цитогенетические особенности острого лейкоза у детей Архангельской области: ретроспективное исследование
Автор: Уланова Анна Сергеевна, Кудрявцев Александр Валерьевич, Турабова Анна Леонидовна, Григорьева Наталья Александровна, Турабов Иван Александрович, Рыков Максим Юрьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Эпидемиологические исследования
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Актуальность. Для диагностики и прогнозирования острого лейкоза (ОЛ) применяется комплекс клинических и лабораторных методов. Важную роль среди них играет хромосомный анализ. В клинической практике постоянно используются цитогенетические маркеры лейкозного клона. Современная классификационная система ВОЗ опухолей кроветворных и лимфоидных тканей создана на основе объединенного анализа клинических, цитоморфологических, иммунофенотипических и цитогенетических данных. Иммунофенотипирование бластных клеток с использованием моноклональных антител позволило значительно улучшить диагностику лейкозов за счет выявления степени дифференцировки опухолевых клеток. Цель исследования - описать структуру ОЛ на основании результатов иммунофенотипического и цитогенетического исследований и изучить влияние цитогенетических нарушений на прогноз при ОЛ в детской популяции Архангельской области. Материал и методы. Архивные данные были использованы для анализа результатов цитогенетического и иммунофенотипического обследований всех детей в возрасте от 0 до 17 лет в Архангельской области, у которых в период с 01.01.2004 по 31.12.2018 был диагностирован ОЛ. Результаты. В результате иммунофенотипического исследования бластных клеток костного мозга больных ОЛ выявлено, что преобладал В-линейный лимфобластный лейкоз (74,8 %). Среди количественных аномалий были выявлены гиперплоидии, наблюдались дополнительные хромосомы 4,10,17. Среди структурных хромосомных аномалий больше всего случаев пришлось на t(12;21). Филадельфийская хромосома (Ph) (9;22) встретилась в 6,5 % случаев. Риск смертельного исхода у пациентов с ОЛ был наиболее высоким при остром миелобластном лейкозе (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Острый лимфобластный лейкоз у детей, иммунофенотипирование, цитогенетическое исследование, транслокации
Короткий адрес: https://sciup.org/140254423
IDR: 140254423 | УДК: 616.155.392-053(470.11) | DOI: 10.21294/1814-4861-2021-20-2-13-21
Текст научной статьи Иммунофенотипические и цитогенетические особенности острого лейкоза у детей Архангельской области: ретроспективное исследование
Background. For the proper diagnosis and optimal prognosis of acute leukemia (AL), a complex of clinical and laboratory methods is used. Among them, chromosomal analysis plays an important role. Cytogenetic markers of leukemic cells are widely used in clinical settings. WHO classification of Tumors of Haematopoietic and Lymphoid Tissues is based on a combined analysis of clinical, cytomorphological, immunophenotypic and cytogenetic findings. Immunophenotyping of blast cells using monoclonal antibodies has significantly improved the diagnosis of leukemia by detecting the grade of tumor differentiation. Aim: based on the results of immunophenotypic and cytogenetic examinations, to describe the structure of AL and to study the effect of cytogenetic abnormalities on the prognosis of acute leukemia in the child population of the Arkhangelsk region. Material and Methods. Archived data were used to analyze the results of cytogenetic and immunophenotypic examinations of all children aged 0–17 years in the Arkhangelsk region, who were diagnosed with AL in the period from January, 2004 to December, 2018. Results. Immunophenotypic examination of bone marrow blast cells in patients with AL revealed that B-linear lymphoblastic leukemia was the most common (74.8 %). Among the quantitative anomalies, hyperploidy was the most common (additional chromosomes 4, 10 and 17 were observed). The t(12; 21) was the most frequent structural chromosomal abnormality. The Philadelphia chromosome (Ph) (9;22) was found in 6.5 % of cases. The highest risk of death was observed in AL patients with the acute myeloid leukemia phenotype (p<0.001). The overall survival in AL patients significantly improved over the study period (p<0.001). Conclusion. No specific differences in the structure of chromosomal abnormalities were detected. All chromosomal abnormalities which usually have negative effects on the prognosis of the disease also showed negative impacts on the prognosis. Survival of AL patients significantly increased over the study period. The lowest survival was in patients with the acute myeloid leukemia phenotype.
Актуальность
Среди проблем современной педиатрии злокачественные новообразования занимают одно из ведущих мест. Ежегодно в России они выявляются более чем у 3 500 детей, 30 % среди которых составляют больные острым лейкозом (ОЛ) [1]. Заболеваемость этой патологией в Архангельской области (АО) в последние годы достигает 5 на 100 тыс. чел., значительно превысив этот показатель в ранее исследованном периоде (1982–1997 гг.) [2–4]. В первую очередь это объясняется ростом заболеваемости острым лимфобластным лейкозом с 2,3 до 3,6 на 100 тыс. детского населения, что явилось следствием более точной верификации диагноза благодаря использованию современных методов диагностики (иммунологических, цитогенетических, молекулярно-генетических и др.) [4].
Острый лимфобластный лейкоз (ОЛЛ) – неопластическое заболевание, которое характеризуется преимущественной клональной экспансией лейкозных клеток в костном мозге, лимфатических узлах, тимусе и селезенке. В основе развития ОЛЛ лежат разнообразные соматические дефекты генов, в результате которых опухолевые клетки демонстрируют усиленную пролиферацию, удлинение срока жизни и сбой программы дифференцировки предшественников лимфопоэза [5].
Современная классификационная система ВОЗ опухолей кроветворных и лимфоидных тканей создана на основе объединенного анализа клинических, цитоморфологических, иммунофе-нотипических и цитогенетических данных [6]. Иммунофенотипирование бластных клеток с использованием моноклональных антител позволило значительно улучшить диагностику лейкозов за счет выявления степени дифференцировки опухолевых клеток. Различные иммунологические варианты ОЛЛ отличаются клиническим течением и чувствительностью к противоопухолевой терапии [7]. Для диагностики и прогнозирования ОЛЛ применяется комплекс клинических и лабораторных методов. Важную роль среди них играет хромосомный анализ. В клинической практике постоянно используются цитогенетические маркеры лейкозного клона [8]. При назначении лечения при ОЛЛ у детей ориентируются на прогностические факторы, и одно из самых важных значений среди них имеет цитогенетический тип лейкоза [9].
Цель исследования – изучить структуру острого лейкоза на основании данных иммунофе-нотипического и цитогенетического исследований и оценить связи результатов этих исследований с прогнозом заболевания.
Материал и методы
В ретроспективном режиме историко-архивным методом были проанализированы результаты обследования (цитогенетика, иммунофенотипирова-ние) детей в возрасте от 0 до 17 лет с диагнозом острый лейкоз в Архангельской области за период с 2004 по 2018 г. Проведен анализ результатов иммунофенотипического и цитогенетического исследований костного мозга детей в возрасте от 0 до 17 лет с диагнозом ОЛЛ в АО с 2004 по 2018 г. В качестве источников информации использовали истории болезни и выписки из них детей, находившихся на лечении в онкологическом отделении химиотерапии опухолей АОДКБ (ф. 003, ф. 027-1/У); данные канцер-регистра Архангельского областного онкологического диспансера.
При установлении диагноза острый лейкоз всем пациентам проводилось иммунофенотипирование бластных клеток костного мозга методом проточной цитофлоуметрии (ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева); цитогенетическое исследование бластных клеток костного мозга методом кари-отипирования клеток и молекулярно-генетическое исследование методом ПЦР (2004–2015 гг.) (ГБУЗ АО АОДКБ); молекулярно-генетические исследования методом ПЦР и молекулярной цитогенетики (FISH) (ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева) (с 2006 г.).
Данные представлены как абсолютные частоты и процентные доли. При описании динамики численности случаев ОЛ в исследуемый период год постановки диагноза рассматривался как по- рядковая переменная с тремя категориями, соответствующими трем пятилетним периодам. Для сравнения групп по категориальным признакам использовался критерий χ2 Пирсона. Для оценки динамики в распределении случаев по изучаемым характеристикам использовался тест Кохрана – Армитажа для линейного тренда. Анализ связей изучаемых параметров с риском смерти проводился с помощью регрессионного анализа пропорциональных рисков Кокса. Одномерный регрессионный анализ проводился для пола, возраста, варианта ОЛ, наличия хромосомный изменений, года постановки диагноза. Ввиду малого количества наблюдений в многомерный анализ включались только признаки, которые имели связи с риском смерти на уровне p≤0,2 по результатам одномерного анализа. Статистический анализ проводился с использованием Stata 12.
Этические аспекты
Исследование было одобрено 28.11.2018 комитетом по этике ФГБОУ ВО «Северный государственный медицинский университет» (г. Архангельск) Минздрава России.
Результаты
За период 2004–18 гг. в Архангельской области было зарегистрировано 160 случаев острого лейкоза у детей в возрасте 0–17 лет, из них 92 (57,5 %) ребенка мужского пола. По результатам иммуно-фенотипического исследования бластных клеток костного мозга большая часть случаев пришлась на ОЛЛ – 123 (76,9 %) случая. Острый миелобластный лейкоз (ОМЛ) был представлен 34 (21,2 %) случаями. Бифенотипический лейкоз был диагностирован у 3 (2 %) больных, они исключены из дальнейшего исследования ввиду малого количества. В течение изучаемого периода наблюдалась тенденция к воз-
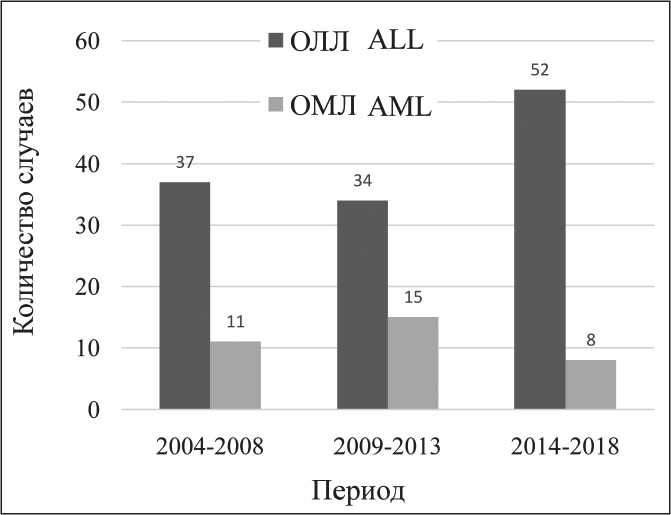
Рис. 1. Абсолютные числа случаев ОЛЛ и ОМЛ среди детей 0–17 лет в Архангельской области, 2004–2018 гг.
Fig. 1. The absolute numbers of ALL and AML cases among children aged 0–17 years in the Arkhangelsk region, 2004–2018
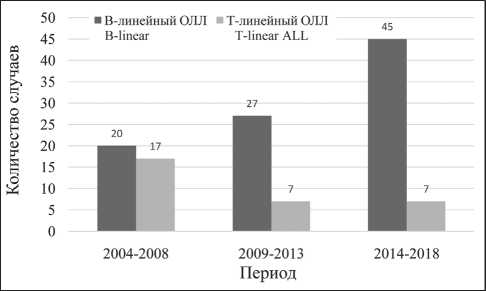
Рис. 2. Абсолютные числа случаев В-линейного и Т-линейного ОЛЛ среди детей 0–17 лет в Архангельской области, 2004–2018 гг.
Fig. 2. The absolute number of cases of B-linear and T-linear ALL among children aged 0–17 years in the Arkhangelsk region, 2004–2018
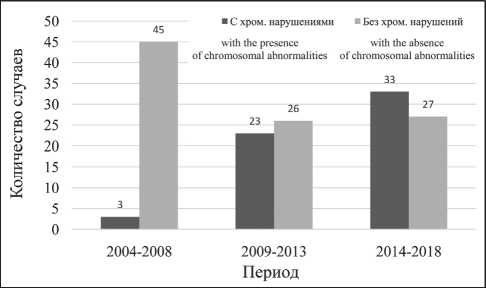
Рис. 3. Абсолютные числа случаев ОЛ с наличием и отсутствием хромосомных нарушений среди детей 0–17 лет в Архангельской области, 2004–2018 гг.
Fig. 3. The absolute number of cases of AR with the presence and absence of chromosomal abnormalities among children aged 0–17 years in the Arkhangelsk region, 2004–2018
растанию доли случаев ОЛЛ в общем количестве ОЛ (рис. 1) (pтренд=0,190).
В структуре ОЛЛ В-линейный лейкоз диагностирован в 92 (74,8 %), Т-линейный – в 31 (25,2 %) случае. Во всех случаях В-линейного лейкоза бластные клетки экспрессировали молекулы CD19 и/или CD79a, и/или цитоплазматическую CD22. Для Т-линейного ОЛЛ была характерна экспрессия антигенов CD7, CD3. В течение изучаемого периода наблюдалось значимое возрастание доли случаев B-линейного лейкоза в общем количестве больных с ОЛЛ (pтренд<0,001) (рис. 2).
По результатам цитогенетического исследования бластных клеток костного мозга хромосомные нарушения были выявлены в 59 (38,2 %) случаях. Доля пациентов с выявленными хромосомными нарушениями значительно увеличивалась (pтренд<0,001) (рис. 3). При этом доли пациентов с хромосомными нарушениями были существенно выше (p=0,006) при наличии ОМЛ и B-линейного ОЛЛ в сравнении с Т-линейным ОЛЛ (табл. 1).
Из группы количественных аномалий была выявлена гиперплоидия (наблюдались дополнительные хромосомы 4,10,17) в 4 (9,3 %) случаях. У этих пациентов во всех случаях отмечен ранний ответ на терапию, сохранная ремиссия по настоящее время, рецидивов не зафиксировано.
В группу случайных перестроек (5 случаев) были определены изменения, не имеющие диагностической значимости и не оказывающие никакого влияния на определение тактики лечения и прогноз.
Из группы качественных аномалий распределение выявленных транслокаций среди пациентов было неоднородным (табл. 2).
В нашем исследовании t(12;21) определена у 17 пациентов. Данная транслокация является благоприятным прогностическим фактором. У всех пациентов данной группы в процессе лечения была зафиксирована ремиссия, один пациент умер на этапе консолидации, так как имел отягощенный генетический фон – синдром Дауна; остальные пациенты живы по настоящее время, рецидивы не зафиксированы.
Филадельфийская хромосома (Ph) (9;22) выявлена у 4 пациентов. В ходе нашего исследования 1 пациент умер в процессе противорецидивной терапии, также у него была выявлена del (17), которая сама по себе имеет отрицательное влияние на достижение и сохранение ремиссии. У второго пациента развился поздний костномозговой рецидив, в настоящее время получает противорецидивное лечение. У остальных пациентов достигнуты ремиссии, все они сохранны по настоящее время.
У детей с диагнозом ОЛ нередко обнаруживают транслокации, вовлекающие локус 11q23. В нашей работе на данную группу хромосомных аномалий пришлось 3 случая. К настоящему времени накопились факты, не позволяющие включать все изменения района 11q23 в группу прогностически неблагоприятных аномалий кариотипа. У всех пациентов данной группы была достигнута ремиссия, все они живы.
На долю транслокации t(1;19)(q23;p13.3) в нашем исследовании пришлось 3 случая. При ОЛЛ у детей этот цитогенетический маркер служит независимым фактором высокого риска рецидивов с поражением ЦНС. У пациентов данной группы была достигнута ремиссия, она сохранна по настоящее время. Один пациент умер в процессе консолидирующей терапии в результате возникших инфекционных осложнений.
Хромосомный дефект del (17p), отмечен в 2 случаях. Один пациент умер от рецидивирова-ния заболевания, после проведения аллогенной родственной трансплантации; второй пациент закончил лечение, затем развился поздний вне-костномозговой рецидив, по настоящее время находится на терапии.
Таблица 1/Table 1
Выявленные транслокации в зависимости от варианта ОЛ
Revealed translocations depending on the AL type
|
Вариант ОЛ/ AL type |
Всего больных/ Total number of patients |
Хромосомные нарушения/ Chromosomal abnormalities |
p |
|
ОЛЛ B-линейный/B-linear lymphoblastic leukemia |
92 |
39 (42,4 %) |
|
|
ОЛЛ Т-линейный/T-linear lymphoblastic leukemia |
31 |
4 (12,9 %) |
|
|
ОМЛ/AML |
34 |
16 (47,1 %) |
0,006 |
|
Всего/Total |
157 |
59 (37,6 %) |
Таблица 2/Table 2
Группы выявленных транслокаций в зависимости от варианта ОЛЛ и исхода заболевания Groups of identified translocations depending on the ALL type and disease outcome
|
Транслокации/ Translocations |
ОЛЛ/ALL |
Исходы/ Outcomes |
|
|
В-линейный/ B-linear |
Т-линейный/ T-linear |
||
|
t(12;21)(p13;q22)/ETV6-RUNX1 (TEL-AML1) |
17 (39,5 %) |
– |
16 – в ремиссии/remission 1 – умер/died |
|
t(9;22)(q34;q11.2)/BCR-ABL11 |
4 (9,3 %) |
– |
1 – умер/died 1 – рецидив/recurrence 2 – в ремиссии/remission |
|
t(9;11)(p22;q23)/ MLL-MLLT3 ( AF9 ), |
2 (4,6 %) |
– |
2 – в ремиссии/remission |
|
t(10;11)(p13–15;q14–21)/ MLL-MLLT10 ( AF10 ) |
– |
1 (2,3 %) |
1 – в ремиссии/remission |
|
t(1;19)(q23;p13.3)/ TCF3-PBX1 |
3 (6,9 |
- |
1 – умер/died 2 – в ремиссии/remission |
|
t(5;14)(q35;q32) |
– |
1 (2,3 %) |
1 – в ремиссии |
|
t(8;14)(q24;q32) |
– |
1 (2,3 %) |
1 – в ремиссии/remission |
|
Del(17) |
1 (2,3 %) |
1 (2,3 %) |
1 – умер/died 2 – рецидив/remission |
|
Del(9) |
3 (6,9 %) |
– |
1 – умер/died 2 – в ремиссии/remission |
|
Случайные/Accidental |
5 (11,6 %) |
– |
5 – в ремиссии/remission |
|
Гиперплоидия/ Hyperploidy |
4 (9,3 %) |
– |
4 – в ремиссии/remission |
|
Всего/Total |
39 (90,4 %) |
4 (9,2 %) |
43 |
К настоящему времени умерли 49 (31,2 %) больных из общего числа пациентов с ОЛ, включая ОЛЛ и ОМЛ. Согласно результатам одномерного регрессионного анализа (табл. 3), относительные риски (hazard ratios) смерти пациентов были значимо выше у пациентов по сравнению с больными Т-линейным ОЛЛ (p=0,007) и с ОМЛ (p<0,001) относительно пациентов с В-линейным ОЛЛ. Пациенты с наличием выявленных хромосомных нарушений имели более низкие риски смерти в сравнении с теми, у кого такие нарушения не были определены, однако эта тенденция не подтверждалась статистической значимостью (p=0,132). При этом риск смерти пациентов с ОЛ значимо снижался (p<0,001) со временем постановки диагноза, измеренной календарными годами (2004–2018 гг.). По результатам многомерного регрессионного анализа в качестве независимо связанных с риском смерти среди пациентов были определены ОМЛ (ОР=5,7; 95 % ДИ 2,9–11,2; p<0,001) и год постановки диагноза (ОР=0,9; 95 % ДИ 0,8–1,0; p=0,005).
Обсуждение
Прогнозирование течения острого лейкоза путем выявления экспрессии иммунофенотипических маркеров на лейкозных клетках методом проточной цитофлоуметрии имеет решающее значение для обеспечения индивидуализированного лечения и улучшения исходов в педиатрической практике [10, 11]. Среди острых лейкозов у детей чаще встречается ОЛЛ, доля которого составляет 75–85 % [2, 3, 12]. В нашем исследовании по результатам имму-нофенотипического исследования бластных клеток костного мозга среди всех случаев ОЛ преобладал ОЛЛ (76,8 %), в структуре которого большая доля пришлась на В-линейный лейкоз (74,8 %), что не отличается от общероссийской статистики.
Современная диагностика ОЛЛ должна включать цитогенетическое и молекулярно-генетическое исследование, а также определение ДНК-индекса – цитометрического показателя, отражающего количественные хромосомные аномалии в опухолевых клетках. На практике наиболее оправданной пред-
Таблица 3/Table 3
Относительные риски смерти среди случаев ОЛЛ среди детей 0–17 лет в зависимости от иммунофенотипических и цитогенетических характеристик, возраста, пола и года постановки диагноза; Архангельская область, 2004–2018 гг.
Relative risks of death among ALL cases among children aged 0–17 years, depending on immunopheno-typic and cytogenetic characteristics, age, sex and year of diagnosis; Arkhangelsk region, 2004–2018
|
Показатель/Parameter |
Кол-во больных (n=157)/ Number of patients (n=157) |
Умерло/ Died |
ОР1 (95% ДИ)/ RR (95% CI) |
p |
ОРкорр.2 (95% ДИ)/ RR (95% CI) |
p |
|
Возраст, лет 3 /Age, years |
||||||
|
0–4 |
68 |
24 (35,3 %) |
1,0 |
|||
|
5–9 |
38 |
9 (23,7 %) |
0,7 (0,3–1,4) |
0,301 |
||
|
10–14 |
33 |
8 (24,2 %) |
0,7 (0,3–1,5) |
0,345 |
||
|
15–17 |
18 |
8 (44,4 %) |
1.5 (0,7–3,2) |
0,360 |
||
|
Пол/Sex |
||||||
|
Женский/Female |
66 |
21 (31,8 %) |
1,0 |
|||
|
Мужской/Male |
91 |
28 (30,8 %) |
0,9 (0,5–1,6) |
0,800 |
||
|
Вариант ОЛ/AL type |
||||||
|
ОЛЛ B-линейный/ B-linearALL |
92 |
15 (16,3 %) |
1,0 |
1,0 |
||
|
ОЛЛ Т-линейный/ T-linear ALL |
31 |
12 (38,7 %) |
2,8 (1,3-6,1) |
0,007 |
1,8 (0,8–4,1) |
0,132 |
|
ОМЛ/AML |
34 |
22 (64,7 %) |
6,0 (3,1-11,7) |
<0,001 |
5,7 (2,9-11,2) |
<0,001 |
|
Хромосомные нарушения/Chromosomal abnormalities |
||||||
|
Нет/No |
98 |
35 (35,7 %) |
1,0 |
1,0 |
||
|
Есть/Yes |
59 |
14 (23,7 %) |
0,6 (0,3–1,2) |
0,130 |
0,8 (0,4–1,7) |
0,635 |
|
Год постановки диагноза 4/ The year a person was diagnosed 4 |
157 |
49 (31,2 %) |
0,9 (0,8-0,9) |
<0,001 |
0,9 (0,8-1,0) |
0,005 |
Примечание: 1 – относительный риск (ОР) по результатам одномерного регрессионного анализа; 2 – ОР по результатам многомерного регрессионного анализа с включением всех характеристик, имеющих связи с риском смерти на уровне p≤0,2 по результатам одномерного анализа; 3 – возраст больного на момент постановки диагноза ОЛ; 4– календарный год как количественная переменная.
Note: 1– relative risk (RR) based on the results of univariate regression analysis; 2– OR based on the results of multivariate regression analysis with the inclusion of all characteristics that have links with the risk of death at the level of p≤0.2 according to the results of univariate analysis; 3– at the age of the patient at the time of diagnosis of AL; 4 – calendar year as a quantitative variable.
ставляется целенаправленная идентификация клинически значимых генетических аберраций [13]. Количественные аномалии в нашем исследовании были представлены только гиперплоидией. Среди структурных хромосомных аномалий больше всего случаев пришлось на t(12;21).
Одним из благоприятных прогностических факторов считается транслокация t(12;21). Эта транслокация обнаруживается у 25 % детей с пре-B-ОЛЛ [14]. Результаты нашего исследования также не противоречат общим тенденциям и составили 30 % всех случаев. Один пациент из данной группы имел отягощающий генетический фон – синдром Дауна и умер на этапе консолидации. Важно отметить, что у детей с синдромом Дауна чаще развивается тяжелая системная токсичность, такая как миелосупрессия, мукозит и гепатоксичность после воздействия антифолатного агента, что приводит к тяжелым инфекционным осложнениям [15].
Структурные хромосомные аномалии обнаруживаются чаще при острых лейкозах, перестройки обычно представлены транслокациями.
Выявление филадельфийской хромосомы при диагностике ОЛЛ делает прогноз течения заболевания как у взрослых, так и у детей крайне неблагоприятным. Наблюдается четкая зависимость частоты встречаемости Ph+ ОЛЛ от возраста. Разные авторы сходятся во мнении, что данная нозологическая форма редко встречается у детей (2–5 %), в то время как у взрослых ее частота достигает 25 % и более, увеличиваясь на 10 % каждую декаду жизни [16]. В нашем исследовании на данную транслокацию пришлось 6,5 %, средний возраст дебюта ОЛЛ пациентов составил 14,5 лет. Независимо от возраста, обнаружение филадельфийской хромосомы при ОЛЛ является фактором неблагоприятного прогноза. Результаты лечения детей изменились: в 1960 г. сообщалось о 5-летней выживаемости только 3 % детей; в 2008 г. N. Seibel в своем обзоре указывал, что 5-летняя выживаемость среди больных до 15 лет составляет 88 % [16]. Эти результаты достигнуты благодаря появлению новых лекарственных препаратов и внедрению режимов интенсивной терапии. На- чало XXI века ознаменовалось внедрением в клиническую практику ингибиторов тирозинкиназ, применение которых радикально изменило результаты терапии. Первым из препаратов-ингибиторов ABL-тирозинкиназы был иматиниб (Гливек) [17]. К настоящему времени у 50 % наших пациентов этой группы, получавших терапию с иматинибом, достигнута сохранная ремиссия.
Перестройка 11q23 характерна для ОЛЛ у детей 1-го года жизни, в этом возрасте она встречается в 65 % случаев. Самой частой является транслокация t(4;11), несколько реже выявляются транслокации t(11;19) и t(9;11) [17]. В нашем исследовании на долю данной группы транслокаций пришлось 13 %. С возрастом частота их снижается, вероятность их обнаружения у подростков и взрослых составляет 1–2 и 4–9 % соответственно. Средний возраст данной группы составил 2,6 года.
Не все транслокации обладают благоприятным прогностическим признаком. Все хромосомные изменения, которые имеют отрицательное влияние на течение заболевания, также проявляли свое негативное влияние на прогноз.
С увеличением диагностических возможностей, улучшением качества и совершенствованием методов цитогенетического исследования в последние годы отмечается увеличение и количества выявленных хромосомных нарушений. Этому способствует также усовершенствование и индивидуализация терапевтических протоколов лечения, что ведет к увеличению выживаемости пациентов с хромосомными нарушениями. По результатам нескорректированного анализа (без учета года постановки диагноза) мы получили картину положительного влияния хромосомных нарушений на выживаемость. Но сомнительно, что это соответствует действительности. Ранее мы оговаривали, что с каждым последующим периодом наблюдения увеличивается количество выявляемых хромосомных нарушений ввиду улучшения качества методов цитогенетического исследования, а также увеличивается выживаемость ввиду увеличения терапевтических возможностей, коррекции протоколов лечения.
Список литературы Иммунофенотипические и цитогенетические особенности острого лейкоза у детей Архангельской области: ретроспективное исследование
- Kaprin A.D., Starinskii V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii (zabolevaemost' i smertnost') v 2018 godu. M., 2019. 250 s.
- Turabov I.A. Onkologicheskaya zabolevaemost' detskogo naseleniya na evropeiskom severe Rossii. Detskaya onkologiya. 2003; 4: 29-36.
- Turabov I.A., Kudryavtsev V.A., Kustyshev I.G., Denshchikov B.V. Onkologicheskaya zabolevaemost' detei evropeiskogo Severa Rossii (rasprostranennost', struktura). Ekologiya cheloveka. 1999; 2: 61-64.
- Turabov I.A., Kudryavtsev A.V., Rykov M.Yu., Karpunov A.A., Ulanova A.S. Onkologicheskaya zabolevaemost' detei v Arkhangel'skoi oblasti i Nenetskom avtonomnom okruge: ekologicheskoe issledovanie. Onkopediatriya. 2019; 6(2): 70-77.
- Rukavitsyn O.A. Gematologiya: natsional'noe rukovodstvo. M., 2015. 776 s.
- Swerdlow S.H., Campo E., Harris N.L., Jaffe E.S., Pileri S.A., Stein H., Thiele J. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon, France: IARC Press, 2008. 439 p.
- Mentkevich G.L., Mayakovoi S.A. Leikozy u detei. M., 2009. 384 s.
- Mayakova S.A., Nemirovchenko V.S., Popa A.V. Klinicheskie rekomendatsii po diagnostike i lecheniyu detei, bol'nykh ostrymi leikozami. M., 2014. 9 s.
- Riley R.S., Massey D., Jackson-Cook C., Idowu M., Romagnoli G. Immunophenotypic analysis of acute lymphocytic leukemia. Hematol Oncol Clin North Am. 2002; 16(2): 245-99, v. https://doi.org/10.1016/s0889-8588(02)00004-7.
- Amritha Malini G., Rajeevan K., Ajith Kumar V.T., Sathi P.P., Aravindan K.P. Clinical Significance of CD34 & CD10 Expression in Pediatric Acute Lymphoblastic Leukemia. Indian J Pathol Oncol. 2017; 4(4): 564-569.
- Maschan M.A., Myakova N.V. Ostryi limfoblastnyi leikoz u detei. Onkogematologiya. 2006; 1-2: 50-63.
- Misyurin A.V. Tsitogeneticheskie i molekulyarno-geneticheskie faktory prognoza ostrykh limfoblastnykh leikozov. Klinicheskaya onkogematologiya. 2017; 10(3): 227-234.
- Rykov M.Yu., Baibarina E.N., Chumakova O.V., Polyakov V.G. Epidemiologiya zlokachestvennykh novoobrazovanii u detei v Rossiiskoi Federatsii. Analiz osnovnykh pokazatelei i puti preodoleniya defektov statisticheskikh dannykh. Onkopediatriya. 2017; 4(3): 159-177.
- Xavier A.C., Taub J.W. Acute leukemia in children with Down syndrome. Haematologica. 2010; 95(7): 1043-5. https://doi.org/10.3324/haematol.2010.024968.
- Zarubina K.I., Parovichnikova E.N., Gavrilina O.A., Sokolov A.N., Troitskaya V.V., Kuz'mina L.A., Mamonov V.E., Galstyan G.M., Savchenko V.G. Toksichnost' i effektivnost' tirozinkinaznykh ingibitorov v sochetanii s khimioterapiei pri rezistentnom techenii ostrogo Ph-pozitivnogo limfoblastnogo leikoza (obzor literatury i klinicheskii sluchai). Onkogematologiya. 2017; 3(12): 41-49.
- Seibel N.L. Treatment of acute lymphoblastic leukemia in children and adolescents: peaks and pitfalls. Hematology Am Soc Hematol Educ Program. 2008. 374-80. https://doi.org/10.1182/asheducation-2008.1.374.
- Volkova M.A. Ph-pozitivnyi ostryi limfoblastnyi leikoz. Onkogematologiya. 2009; 2(1): 103-111.


