Иммуногистохимическая оценка пролиферации и апоптоза кератиноцитов после однократного фракционного ионизирующего облучения
Автор: Шаповалова Е.Ю., Марукян А.Х., Вадюхин М.А., Демяшкин Г.А.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Лучевую терапию не-меланомных видов рака кожи онкодерматологи и радиобиологи используют при неэффективном хирургическом лечении и в качестве адъювантной или паллиативной терапии. Создание экспериментальных моделей для изучения пролиферативно-апоптотического баланса кератиноцитов дает возможность оценить степень и глубину постлучевого повреждения кожи после воздействия электронами для подбора оптимальных доз в клинике. Цель исследования: иммуногистохимическая оценка пролиферации и апоптоза кератиноцитов после локального облучения электронами кожи. В эксперименте использованы крысы-самцы породы Вистар (n=50), которые были поделены на группы: I - контрольная (n=20), которым вводили физиологический раствор и опытные - которым было произведено локальное облучение электронами кожи наружной поверхности бедра: II - 8 Гр (n=10; однократное), III - 40 Гр (n=10, однократно), IV - фракционное по 13 Гр в течение 6 суток суммарной очаговой дохой 78 Гр (n=10;). После завершения эксперимента осуществляли биопсию кожи наружной поверхности бедра и производили иммуногистохимическое исследование гистологических препаратов с антителами к антигенам Ki-67, каспазе-3 и p53. Анализ фрагментов кожи после облучения показал смещение пролиферативно-апоптотического баланса в сторону апоптоза кератиноцитов: уменьшение уровня экспрессии Ki-67 и увеличение количества p53-позитивных клеток. После однократного облучения электронами в дозах 8 Гр и 40 Гр обнаружили достоверное увеличение кератиноцитов, позитивно окрашенных с антителами к каспазе-3, - в 3,4 и в 6,6 раз соответственно, а при фракционном режиме облучения в суммарной дозе 78 Грей - в 11,6 раз по сравнению с контрольной группой. Таким образом, локальное облучение электронами в разовых дозах 8 Гр и 40 Гр приводит к смещению пролиферативно-апоптотического баланса кератиноцитов в сторону их апоптоза, активность которого прямо пропорциональна дозе ионизирующего излучения, а фракционный режим (суммарная очаговая доза 78 Гр) приводит к частичной десквамации эпителия и воспалительной инфильтрации.
Эпидермис, ионизирующее облучение, кератиноциты, апоптоз, пролиферация, иммуногистохимия
Короткий адрес: https://sciup.org/143181182
IDR: 143181182 | DOI: 10.20340/mv-mn.2023.31(3).775
Текст научной статьи Иммуногистохимическая оценка пролиферации и апоптоза кератиноцитов после однократного фракционного ионизирующего облучения
(3).775
Shapovalova EYu, Marukyan AKh, Vadyukhin MA, Demyashkin GA. Immunohistochemical assessment of proliferation and apoptosis of keratino-cytes after a single fractional ionizing irradiation. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(3):775. (3).775
Введение. Рак кожи является наиболее часто диагностируемым видом рака среди всех злокачественных новообразований [1]. Развитие и распространение онкологического процесса, прогноз и морфологические признаки позволяют делить не-меланомный рак кожи на базальноклеточный и плоскоклеточный [2]. Лучевую терапию не-меланомного рака кожи онкодерматологи и радиобиологи применяют при неэффективном хирургическом лечении, а также в качестве адъювантной или паллиативной терапии [3]. При этом используют брахитерапию, ги-пофракционированное и традиционно фракционированное контактное или поверхностное облучение фотонами или X-лучами, причем доза подбирается индивидуально и составляет в среднем у молодых людей фракции в дозах 2 - 2,5 Гр, а у пожилых - в дозах 3 - 5 Гр и более [4]. Не смотря на относительно щадящие дозы и режимы фракционирования у молодых людей, часто отмечают повреждение око-ло-опухолевых тканей в виде десквамации эпителия, некроза мягких тканей, хрящевой и костной ткани, пигментные изменения, телеангиоэктазии, фиброз и атрофия кожи [5-6].
Лучевая терапия основана на концепции, что активно пролиферирующие атипичные клетки более чувствительны к ионизирующему излучению и не могут восстанавливаться так же эффективно, как здоровые. В течение нескольких часов после облучения инициируется ряд сигнальных и воспалительных цитокиновых каскадов, образуются ионы, проходящие через ткани и вызывающие двуцепочечные разрывы ДНК (прямой эффект) [7]. Энергия ионизирующего излучения также воздействует на молекулы воды с образованием активных форм кислорода (АФК) - супероксида, перекиси водорода и гидроксильного радикала, которые косвенно вызывают дальнейшее повреждение ДНК и других клеточных компонентов (например, клеточных мембран, белков и липидов; косвенный эффект) [8-9]. Гибель клеток происходит путем апоптоза, некроза, включая высвобождение молекул, ассоциированных с повреждением: белков теплового шока, амфотерина, фрагментов гиа луронана и других [10-11]. Это активирует иммунную систему, обеспечивая дополнительные противоопухолевые реакции [12-13]. Наименьшие побочные эффекты описаны в единичных работах с применением фракционного локального облучения электронами в суммарных дозах 44 Гр и 54 Гр [14]. Тем не менее, механизмы постлучевых повреждений окончательно не раскрыты, а исследования жизненного цикла кератиноцитов немногочисленны, в связи с чем проблема по-прежнему остается актуальной. Жизненный цикл керати-ноцитов регулируются белками Ki-67, обеспечивающими пролиферацию, и каспазами, ответственными за апоптоз. Постоянно обновляющийся эпителий обладает высокой чувствительностью к радиоактивному излучению, что проявляется снижением митотического деления и гибелью кератиноцитов. Активация апоптоза происходит по внешнему и внутреннему путям, а за терминальную фазу ответственна каспаза-3. Другим регулятором клеточного цикла является проапоптоти-ческий белок р53 [15]. Создание экспериментальных моделей для изучения про-лиферативно-апоптотического баланса кератиноцитов может предоставить возможность оценить степень и глубину постлучевого повреждения кожи после воздействия электронами для подбора оптимальных доз.
Цель исследования: иммуногистохимическая оценка пролиферации и апоптоза кератиноцитов после локального облучения кожи электронами ионизирующего излучения.
Материалы и методы исследования. В эксперименте использованы крысы-самцы породы Вистар (n=50), которые были поделены на группы: I - контрольная (n=20), которым вводили физиологический раствор и опытные - которым было произведено локальное облучение электронами кожи наружной поверхности бедра: II - 8 Гр (n=10; однократное), III - 40 Гр (n=10, однократно), IV - фракционное по 13 Гр в течение 6 суток суммарной очаговой дохой 78 Гр (n=10). Животных подвергали локальному облучению кожи наружной поверхности бедра (мощность дозы 1 Гр/мин, энергия 10 МэВ и частота 9
Гц, размер поля – Ø 100 мм) с использованием линейного акселератора «NOVAC-11». Все манипуляции осуществляли в соответствии с Международными рекомендациями (ЕЭС, Страсбург, 1985), Европейской конвенцией о защите позвоночных животных (ЕЭС, Страсбург, 1986), Руководствами по проведению медикобиологических исследований по уходу и использованию лабораторных животных (ILAR, DELS), Правилами лабораторной практики и приказом Минздрава России № 199-н от 01.04.2016 «Об утверждении правил лабораторной практики». Фрагменты кожи после фиксации в забуфе-ренном растворе формалина готовили по стандартному протоколу, окрашивали гематоксилином и эозином. Полученные гистологические микропрепараты анализировали в 10 полях зрения светового микроскопа.
Для иммуногистохимического исследования фрагменты кожи после фиксации в растворе Буэна готовили по стандартному протоколу. В качестве первичных использовали моноклональные антитела к Ki-67 (ThermoFisher, Clone MM1), p53 (ThermoFisher, Clone DO-7) и Caspase 3 (ThermoFisher, Clone 74T2), а вторичные – универсальные антитела (HiDef Detection™ HRP Polymer system, «Cell Marque», США). Ядра клеток докрашивали гематоксилином Майера. Подсчет количества иммунопозитивных клеток проводили в 10 случайно отобранных полях зрения при увеличении ×400 в % к общему числу клеток в поле зрения. Микроскопический анализ выполнялся с помощью системы видео-микроскопии микроскопа (Leica DM2000, Германия; камера Leica ICC50 HD). Полученные в результате подсчёта данные обрабатывали с использованием компьютерной программы и данные были выражены как среднее значение ± стандартное отклонение. Сравнения проводились с использованием дисперсионного анализа. Значение p <0,05 считалось статистически значимым.
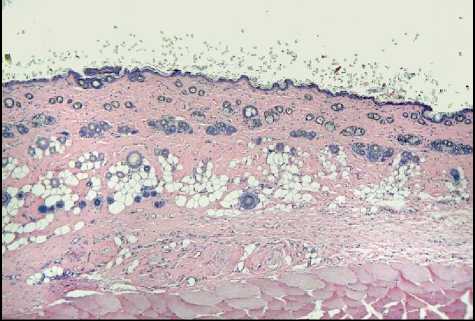
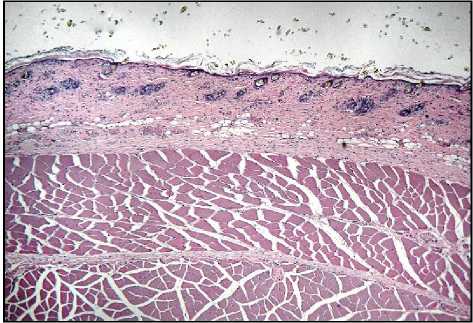
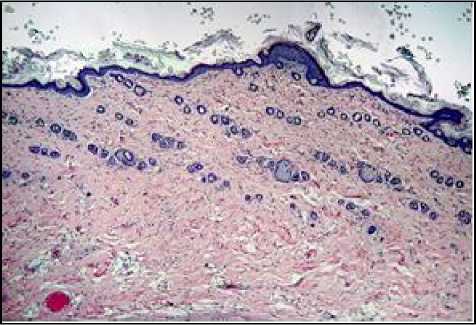
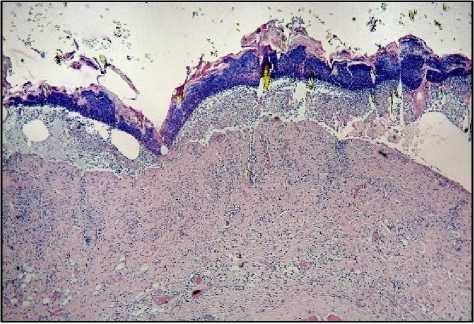
Результаты исследования и обсуждение. При микроскопическом исследовании у животных контрольной группы кожа состояла из эпидермиса, сосочкового и сетчатого слоев дермы и гиподермы, от- четливо визуализировались придатки кожи и обильные волосяные фолликулы (рис. 1-А). В опытных группах (II–IV) наблюдали повреждения кожи разной степени, коррелирующие с дозой облучения. Во II группе отмечали утолщение базального слоя эпидермиса в области волосяных луковиц с незначительным расслоением рогового слоя и интактными придатками. В сосочковом слое дермы наблюдалась очаговая лейкоцитарная инфильтрация, периваскулярный отек, расширенные кровеносные сосуды со сладжем эритроцитов в их просвете (рис. 1-Б). В III группе (доза облучения электронами 40 Гр) выявлены уплощение и частичное отсутствие базального слоя эпидермиса, сглаженный сосочковый слой дермы, расширенные кровеносные сосуды со слад-жем эритроцитов в их просвете, отсутствие сальных желез, сохранные волосяные фолликулы и подкожно-жировая клетчатка. Обнаружены микрополости эпидермально-дермального перехода, заполненные слущенными клетками эпидермиса и полиморфно-ядерными лейкоцитами (рис. 1-В). После фракционного облучения электронами (суммарная доза 78 Гр) в препаратах кожи эпителий частично отсутствует, видны сглаженный и интенсивно инфильтрированный полиморфно-ядерными лейкоцитами сосочковый слой дермы, отек сетчатого слоя дермы и гиподермы, коллагеновые волокна разрыхлены, расширенные кровеносные сосуды с отслойкой эндотелия, агрегацией и сладжем эритроцитов, сальные железы и волосяные фолликулы деструктурирова-ны (рис. 1-Г).
При иммуногистохимическом исследовании наблюдали окрашивание ядер антителами к Ki-67 в кератиноцитах базального слоя эпидермиса и интерфолликулярных эпителиоцитах, окрашивания меланоцитов и клеток Лангерганса не обнаружились. При анализе распределения окраски на Ki-67 отмечали уменьшение позитивно окрашенных кератиноцитов после однократного облучения дозой 8 Гр (II группа) в 1,2 раза, и дозой 40 Гр – в 2,6 раза, а также фракционно суммарной дозой 78 Гр – в 5,9 раз по сравнению с контрольной группой (табл. 1, рис. 2).
После однократного облучения электронами в дозах 8 Гр и 40 Гр обнаружили достоверное увеличение кератино-цитов позитивно окрашенных с антителами к каспазе-3, – в 3,4 и в 6,6 раз соответ- ственно, а при фракционном режиме облучения в суммарной дозе 78 Грей – в 11,6 раз по сравнению с контрольной группой (табл. 1, рис. 2).
Б
В
Г
Рис. 1. Микрофото гистологических препаратов кожи крыс I-III групп (на 10 сутки) и IV группы (на 15 сутки). Обозначения: A – контроль; Б – после однократного облучения электронами в дозе 8 Гр; В – после однократного облучения электронами в дозе 40 Гр; Г – после фракционного облучения электронами в суммарной дозе 78 Гр. Окр.: гематоксилином и эозином. Ув.: ×100
Количество р53+ клеток после однократного облучения электронами в дозах 8 Гр и 40 Гр увеличилось в 3,0 раза и в 5,3 раз, соответственно, а после фракционного облучения электронами в суммарной дозе 78 Гр – в 7,3 раза по сравнению с контрольной группой (табл. 1, рис. 2). На основании результатов иммуногистохимического исследования наблюдается увеличение интенсивности апоптоза кератиноцитов, коррелирующее с дозой облучения, фракционный режим является наиболее повреждающим для окружающих тканей.
Таблица 1 Доля позитивно окрашенных к антигенам кератиноци-тов во фрагментах кожи контрольной и опытных групп крыс в % (P±pm)
|
Группы |
Ki-67 |
Сas 3 |
p53 |
|
Контроль |
37,2±1.8 |
5,4±0.2 |
7,8±0.3 |
|
8 Гр |
31,8±1.6 a |
18,6±0.9 a |
23,5±1.1 a |
|
40 Гр |
14,5±0.7 b |
35,5±1.7 b |
41,2±2.0 b |
|
78 Гр |
6,3±0.3 c |
62,4±3.1 c |
57,2±2.8 c |
Примечание: a - p <0,05 (контроль и 8 Гр), b - p <0,05 (контроль и 40 Гр), c - p <0,05 (контроль и 78 Гр)
Иммуногистохимические маркеры
Группы
Ki-67+
Caspase 3+ p53+
Контроль
8 Гр
40 Гр
78 Гр
78 Gy
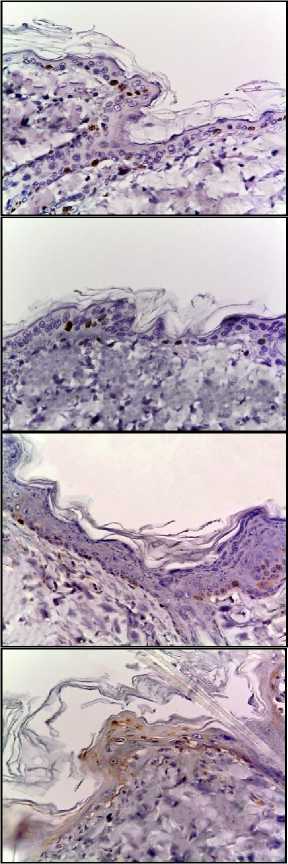
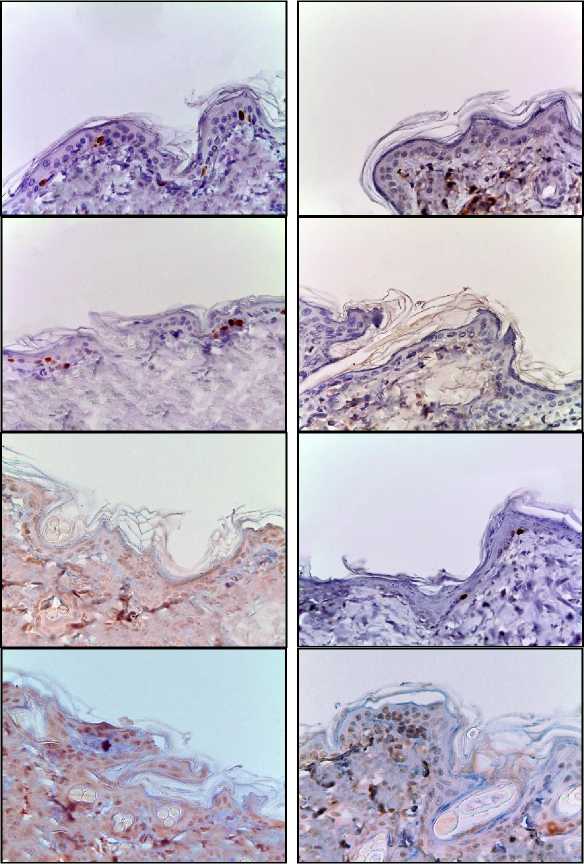
Рис. 2. Микрофото гистологических препаратов кожи крыс I-III групп на 10 сутки и IV группы на 15 сутки. Окр.: иммуногистохимическая (см. в тексте) с докраской ядер гематоксилином. Ув.: ×400
Настоящее исследование посвящено иммуногистохимической оценке нарушения пролиферации кератиноцитов, возникшего после однократного (8 Гр и 40 Гр) и фракционного (суммарная доза 78 Гр) локального облучения кожи наружной поверхности бедра у крыс электронами ионизирующего излучения. В современной онкологии радиологии наиболее часто применяют следующие виды ионизирующего излучения: фотоны, рентгеновское излучение, электроны. Данные об использовании этих видов терапии и их побочных эффектах при лечении преимущественно не-меланомного рака кожи не- многочисленны и противоречивы. При однократном облучении γ-лучами в невысоких дозах (3–5 Гр) ряд авторов отмечали гибель кератиноцитов базального слоя эпидермиса [16-17]. Однако, в проведенном нами исследовании, однократное облучение электронами в дозе 8 Гр привело к слабым патологическим изменениям эпидермиса. В другом исследовании, после воздействия рентгеновского излучения в дозе 25 Гр было обнаружено уменьшение плотности микрососудов в коже, приводящее к ишемии тканей и, тем самым, значительно снижающее скорость заживления ран. Кроме того, авторы отмечали увеличение экспрессии провоспалитель-ных факторов (TNF-α, IL-1 и IL-6) высвобождение молекул клеточной адгезии, что ускоряло миграцию, адгезию и экссудацию лейкоцитов и индуцировало миграцию макрофагов, нейтрофилов и моноцитов, как клеточного субстрата местной воспалительной реакции в ответ на лучевое поражение [18]. Вероятно, обнаруженная полиморфно-клеточная инфильтрация кожи при различных дозах облучения электронами может быть объяснена механизмом развития воспаления. Некоторые авторы отмечали поражение сальных и потовых желез, а также волосяных фолликулов после воздействия фотонов в дозе 45 Гр. Это приводило к некрозу, патогенетически связанному с ишемией вследствие разрушения стенки кровеносных сосудов [19-20]. Напротив, в нашем исследовании после однократного облучения электронами в дозе 40 Гр волосяные фолликулы сохранялись на всех уровнях среза, а сальные железы погибали из-за их большей радиочувствительности. Наиболее выраженное повреждение кожи наблюдали после фракционного облучения электронами с незначительным поражением сосудистой стенки, в то время как другие виды облучения (например, фотоны) приводят к ее полному разрушению [6].
Молекулярные механизмы радиационно-индуцированной гибели клеток до сих пор мало изучены. Дисбаланс между пролиферацией и апоптозом керати-ноцитов, в том числе вызванным облучением, сопровождается уменьшением клеточного пула за счет модуляции GSK3-, ERK- и Ras/Raf/MEK-1 сигнальных путей, который ведет к деактивации Bсl-2 и индукции p53-антигена [21-22]. После однократного облучения электронами в дозах 8 Гр и 40 Гр наблюдали снижение числа Ki-67-позитивных кератиноцитов, которое связано с прямым токсическим действием ионизирующего излучения на активно пролиферирующие клетки и в которых происходит разрушение клеточных мембран и структуры макромолекул (ДНК, РНК, белков, липидов и других), а также модуляция MAPK-, PI3K-и NFκB-сигнальных путей, белков семейства ErbB и нарушение клеточного дыхания на уровне цепи переноса электронов в митохондриях, что приводит к дисбалансу антиоксидантной и прооксидантной систем [23]. Кроме того, обнаруженное угнетение дифференцировки кератиноцитов связано с повреждением таких сигнальных путей как PI3-киназы/Akt и Ras/Raf/MEK-1, а также гликогенсинтазы, киназы-3 (GSK-3) и киназы, регулируемой внеклеточными сигналами (ERK) [21]. Модуляция активности вышеперечисленных каскадов приводит к конденсации хроматина и фрагментации ДНК, то есть к апоптозу, подтвержденному увеличением доли caspase-3- и p53-позитивных клеток. После однократного облучения электронами наблюдались снижение количества мито-тически делящихся генераций клеток. При физиологическом жизненном цикле кератиноцитов преимущественно уменьшается пул делящихся клеток вследствие их активной селекции [24-25] и происходит смещение пролиферативно-апоптоти-ческого баланса в сторону апоптоза [23]. Согласно результатам нашего исследования, смещение пролиферативно-апопто-тического баланса, обнаруженное во II и III группах в сторону апоптоза кератино-цитов после фракционного облучения электронами оказалось значительно выше, чем при однократном.
Заключение . Локальное облучение электронами в разовых дозах 8 Гр и 40 Гр приводит к смещению пролиферативно-апоптотического баланса кератиноцитов в сторону их апоптоза, активность которого прямо пропорциональна дозе ионизирующего излучения, а фракционный режим облучения в суммарной дозе 78 Гр приводит к частичной десквамации эпителия и воспалительной инфильтрации. Полученные в настоящем исследовании экспериментальные данные могут быть использованы в разработке различных видов лучевой терапии и определения оптимальных доз облучения в экспериментальной и ветеринарной медицине.
Список литературы Иммуногистохимическая оценка пролиферации и апоптоза кератиноцитов после однократного фракционного ионизирующего облучения
- Perez M, Abisaad JA, Rojas KD, et al. Skin cancer. Primary, secondary, and tertiary prevention. Part I. J Am Acad Dermatol. 2022;87(2):255-268. D0I:10.1016/j.jaad.2021.12.066
- Cives M, Mannavola F, Lospalluti L, et al. Non-Melanoma Skin Cancers. Biological and Clinical Features. Int J Mol Sci. 2020;21(15):5394. D0I.10.33 90/ijms211553 94
- Pashazadeh A, Boese A, Friebe M. Radiation therapy techniques in the treatment of skin cancer. an overview of the current status and outlook. J Dermatolog Treat. 2019;30(8):831-839. D0I:10.1080/09546634.2019.1573310
- Chua B, Jackson JE, Lin C, Veness MJ. Radiotherapy for early non-melanoma skin cancer. Oral Oncol. 2019;98:96-101. D0I:10.1016/j.oraloncology.2019.09.018
- Locke J, Karimpour S, Young G, et al. Radiotherapy for epithelial skin cancer. Int J Radiat Oncol Biol Phys. 2001;51(3):748-755. D0I:10.1016/s0360-3016(01)01656-x
- 0lschewski T, Bajor K, Lang B, et al. Radiotherapie des Basalzellkarzinoms im Gesichts-/Kopfbereich. Bedeutung einer niedrigen Einzeldosis für das Langzeitsergebnis [Radiotherapy of basal cell carcinoma of the face and head. Importance of low dose per fraction on long-term outcome]. J Dtsch Dermatol Ges. 2006;4(2):124-130. D0I:10.1111/j.1610-0387.2006.05880.x
- Jackson SP, Bartek J. The DNA-damage response in human biology and disease. Nature. 2009;461(7267):1071-1078. D0I:10.1038/nature08467
- Mehta SR, Suhag V, Semwal M, Sharma N. Radiotherapy: Basic Concepts and Recent Advances. Med J Armed Forces India. 2010;66(2):158-162. D0I:10.1016/S0377-1237(10)80132-7
- Yoshimura M, Itasaka S, Harada H, Hiraoka M. Microenvironment and radiation therapy. Biomed Res Int. 2013;2013:685308. D0I:10.1155/2013/685308
- Lumniczky K, Säfräny G. The impact of radiation therapy on the antitumor immunity. local effects and systemic consequences. Cancer Lett. 2015;356(1):114-125. D0I:10.1016/j.canlet.2013.08.024
- Brix N, Tiefenthaller A, Anders H, et al. Abscopal, immunological effects of radiotherapy: Narrowing the gap between clinical and preclinical experiences. Immunol Rev. 2017;280(1):249-279. D0I:10.1111/imr. 12573
- Jeong H, Bok S, Hong BJ, et al. Radiation-induced immune responses: mechanisms and therapeutic perspectives. Blood Res. 2016;51(3):157-163. D0I:10.5045/br.2016.51.3.157
- Formenti SC, Demaria S. Systemic effects of local radiotherapy. Lancet 0ncol. 2009;10(7):718-726. D0I:10.1016/S1470-2045(09)70082-8
- van Hezewijk M, Creutzberg CL, Putter H, et al. Efficacy of a hypofractionated schedule in electron beam radiotherapy for epithelial skin cancer: Analysis of434 cases. Radiother 0ncol. 2010;95(2):245-249. D0I:10.1016/j.radonc.2010.02.024
- GuoM, Hay BA. Cell proliferation and apoptosis. Curr 0pin Cell Biol. 1999;11(6):745-752. D0I:10.1016/s0955-0674(99)00046-0
- Ward WF, Molteni A, Ts'ao C, Hinz JM. The effect of Captopril on benign and malignant reactions in irradiated rat skin. Br J Radiol. 1990;63(749):349-354. D0I:10.1259/0007-1285-63-749-349
- Ran X, Cheng T, Shi C, Xu H, et al. The effects of total-body irradiation on the survival and skin wound healing of rats with combined radiation-wound injury. J Trauma. 2004;57(5):1087-1093. D0I:10.1097/01.ta.0000141885.72033.c7
- Li Z, Gan H, Liang A, Wang X, et al. Promoting repair of highly purified stromal vascular fraction gel combined with advanced platelet-rich fibrin extract for irradiated skin and soft tissue injury. Ann Transl Med. 2022;10(17):933. D0I:10.21037/atm-22-3956
- McPartlin AJ, Slevin NJ, Sykes AJ, Rembielak A. Radiotherapy treatment of non-melanoma skin cancer: a survey of current UK practice and commentary. Br J Radiol. 2014;87(1043):20140501. D0I:10.1259/bjr.20140501
- Wang XJ, Lin S, Kang HF, et al. The effect of RHIZ0MA C0PTIDIS and C0PTIS CHINENSIS aqueous extract on radiation-induced skin injury in a rat model. BMC Complement Altern Med. 2013;13:105. D0I:10.1186/1472-6882-13-105
- Wang Q, Zhou Y, Wang X, Evers BM. Glycogen synthase kinase-3 is a negative regulator of extracellular signal-regulated kinase. 0ncogene. 2006;25(1):43-50. D01:10.1038/sj.onc. 1209004
- Morel C, Carlson SM, White FM, Davis RJ. Mcl-1 integrates the opposing actions of signaling pathways that mediate survival and apoptosis. Mol Cell Biol. 2009;29(14):3845-3852. D0I:10.1128/MCB.00279-09
- Reisz JA, Bansal N, Qian J, et al. Effects of ionizing radiation on biological molecules--mechanisms of damage and emerging methods of detection. Antioxid Redox Signal. 2014;21(2):260-292. D0I:10.1089/ars.2013.5489
- Khavkin J, Ellis DA. Aging skin: histology, physiology, and pathology. Facial Plast Surg Clin North Am. 2011;19(2):229-234. D0I:10.1016/j.fsc.2011.04.003
- Martincorena I, Roshan A, Gerstung M, et al. Tumor evolution. High burden and pervasive positive selection of somatic mutations in normal human skin. Science. 2015;348(6237):880-886. D0I:10.1126/science.aaa6806


