Иммуногистохимическая оценка шаперон-индуцируемой аутофагии в различных отделах головного мозга человека при старении
Автор: Магнаева Алина Станиславовна, Баранич Татьяна Ивановна, Воронков Дмитрий Николаевич, Гофман Анна Андреевна, Гулевская Татьяна Сергеевна, Глинкина Валерия Владимировна, Сухоруков Владимир Сергеевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.31, 2023 года.
Бесплатный доступ
Поддержание функционального пула нейронов при возрастной инволюции головного мозга тесно связано с шаперон-опосредованной аутофагией, основной функцией которой является обеспечение клеточного протеостаза и утилизация нейротоксичных белков. Нарушение этого типа аутофагии лежит в основе патогенеза многих возраст-ассоциированных нейродегенеративных заболеваний. В этом аспекте актуальным представляется изучение взаимосвязи между ключевыми маркерами шаперон-опосредованной аутофагии и их относительным вкладом в старение и нейродегенерацию для определения фармацевтических мишеней. Целью исследования явилось определение уровней экспрессии маркеров шаперон-опосредованной аутофагии - белка теплового шока 70 (HSP70) и лизосом-ассоциированного мембранного белка типа 2А (LAMP2) в нейронах различных зон головного мозга человека при старении. Работа была выполнена на аутопсийном материале пациентов, причины смерти которых не были связаны с неврологическими заболеваниями. Исследовали препараты коры прецентральной извилины, стриатума и гиппокампа в группе случаев молодого возраста (35-45 лет, n=5) и старческого возраста (>75 лет, n=10). Иммуногистохимическое окрашивание выполнялось с использованием первичных антител к HSP70 и LAMP2. Оптическая плотность оценивалась в перикарионе 150 крупных нейронов V слоя коры прецентральной извилины, стриатума, пирамидного слоя гиппокампа. Результаты проведенного исследования продемонстрировали увеличение экспрессии как HSP70, так и LAMP2A в препаратах головного мозга случаев старческого возраста. Выявленные более высокие показатели оптической плотности HSP70 по сравнению с LAMP2A в препаратах головного мозга случаев старческого возраста, вероятно, обусловлены диссоциацией между стадией связывания субстрата и стадией его транслокации. Можно предположить, что связывание нефункционирующих белков с HSP70 и кошаперонами происходит быстрее, чем их перемещение в просвет лизосом посредством LAMP2A. Полученные результаты дают основание предполагать, что повышенные уровни маркеров шаперон-опосредованной аутофагии могут носить компенсаторно-приспособительный характер и обеспечивать выживаемость нейронов в условиях хронического стресса при физиологическом старении.
Аутофагия, головной мозг, старение, иммуногистохимия, шапероны
Короткий адрес: https://sciup.org/143180238
IDR: 143180238 | DOI: 10.20340/mv-mn.2023.31(1).724
Текст научной статьи Иммуногистохимическая оценка шаперон-индуцируемой аутофагии в различных отделах головного мозга человека при старении
Введение. За последние десятилетия было показано, что поддержание функционального пула нейронов при возрастной инволюции головного мозга тесно связано с протеостазом и обновлением цитоплазмы за счет утилизации нефункционирующих белков и органелл [13]. В свою очередь, накопление поврежденных ультраструктурных компонентов клетки и агрегированных форм белков, обладающих нейротоксичностью, может способствовать развитию ряда воз-раст-ассоциированных нейродегенера-тивных заболеваний [4]. Одним из механизмов, препятствующих накоплению дисфункциональных белков, является ша-перон-опосредованная аутофагия [5-7]. Последняя представляет собой вид селективной аутофагии, при которой белки, содержащие мотив KFERQ, распознаются и связываются с цитозольным белком теплового шока 70 (HSC70). Образовавшийся комплекс взаимодействует с лизосом-ассоциированным мембранным белком типа 2А (LAMP2А), который способствует транслокации субстрата в просвет лизосомы, где он подвергается ферментативному гидролизу [7-8]. Таким образом, нефункционирующие белки элиминируются из клетки посредством шаперон-опосредованной аутофагии, а нарушение активности последней может приводить к снижению пластичности энергозависимой нервной ткани. В этом аспекте актуальным представляется определение взаимосвязи между ключевыми маркерами ша-перон-опосредован-ной аутофагии и их относительным вкладом в старение и нейродегенерацию с конечной целью определить фармацевтические мишени.
Цель исследования - определение уровней экспрессии маркеров шаперон-опосредованной аутофагии HSP70 и LAMP2A в нейронах различных зон головного мозга человека при старении.
Материалы и методы исследования. Проведено исследование секционного материала, полученного от 10 пациентов в возрасте 75 лет и старше, непосред- ственной причиной смерти которых явилась тромбоэмболия легочной артерии при наличии постинфарктного или атеросклеротического кардиосклероза. В качестве условного контроля использовался аутопсийный материал от случаев молодого возраста (35-45 лет), умерших от внезапной сердечной смерти (n=5). В анамнезе всех умерших отсутствовали указания на когнитивные и двигательные нарушения. Головной мозг исследовался посредством серии фронтальных срезов толщиной 1,0 см через оба полушария, затем вырезались участки из коры прецентральной извилины, базальных ядер (стриатума), а также гиппокампа. Исследование было одобрено локальным этическим комитетом Научного центра неврологии.
Полученные образцы тканей мозга были фиксированы в 10% нейтральном (рН=7,4) забуференном формалине в течение 24 часов. Из полученных парафиновых блоков были изготовлены срезы толщиной 4-5 мкм, которые были нанесены на предметные стекла. Для обзорной световой микроскопии применяли окраску гематоксилином и эозином, а также метод Ниссля. Для иммуногистохимического исследования срезы были нанесены на предметные стекла с положительным зарядом поверхности Super Frost Plus (Thermo Scientific), а затем высушены в течение 24 часов при температуре 48°С. Иммуногистохимическое окрашивание выполнялось на иммуностейнере Ventana Bench-Mark XT (Roche Diagnostics) при помощи метода ручного титрования с использованием первичных антител к HSP70 (клон JG1, Thermo Fisher Scientific, концентрация 1:100) и LAMP2 (Sigma-Aldrich, концентрация 1:750), затем окрашенные срезы были проведены через батарею спиртов и ксилола с заключением под покровное стекло. Цифровые копии микропрепаратов в формате *.svs были получены с помощью цифрового сканера Aperio AT2 (Leica Biosystems). Оптическая плотность оценивалась в перикарионе 150 крупных нейронов V слоя коры прецен- тральной извилины, стриатума (скорлупы и бледного шара), пирамидного слоя гиппокампа и выражалась в условных единицах на 8-битном изображении при помощи программы для морфометрии Leica Qwin 2.7 (Leica Biosystems). Для статистической обработки данных использовали программу GraphPad Prism 9.3.1. Исследуемые показатели оптической плотности оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Для выявления различий между группами использовали критерий Краскела-Уоллиса, апостериорные сравнения выполнялись с помощью критерия Данна с поправкой Холма. Статистически значимым считали различия при значении р<0,05.
Результаты исследования и обсуждение. При микроскопическом исследовании образцов головного мозга лиц старческого возраста было обнаружено т.н. «выпадение» крупных нейронов, их хроматолиз, гиперхроматоз и сморщивание, в неокортексе в небольшом количестве определялись сенильные бляшки. Также были выявлены и изменения белого вещества, характерные для старения. К таким проявлениям сенильных изменений можно было отнести формирование спон-гиоформной структуры белого вещества, утрату олигодендрглиоцитов, расширение периваскулярных пространств. Более подробно эти результаты представлены в отдельной публикации авторов (Архив патологии, 2022, 4). Результаты проведенного иммуногистохимического исследования продемонстрировали увеличение экспрессии как белка теплового шока 70, так и лизосом-ассоциированного мембранного белка типа 2А в образцах головного мозга случаев старческого возраста по сравнению с аутопсийным материалом случаев молодого возраста.
При анализе экспрессии маркера HSP70 в двух возрастных группах были выявлены статистически значимые различия во всех исследуемых зонах головного мозга (рис.1, А-Ж). Оптическая плотность вышеуказанного белка в крупных нейронах коры прецентральной извилины у умерших старше 75 лет (Ме=133) была в 2,4 раза выше по сравнению с образцами умерших в молодом возрасте (Ме=54,5). Аналогичная тенденция наблюдалась в нейронах базальных ядер и пирамидного слоя гиппокампа. Так, в образцах, полученных в случаях старческого возраста, при сравнении с образцами случаев 35-45 лет уровень экспрессии HSP70 был в 2,2 и 2,1 раза выше, соответственно.
При изучении маркера LAMP2A нами также были обнаружены статистически значимые различия во всех исследуемых зонах головного мозга в зависимости от возраста (рис.2, А-Ж). При анализе показателей оптической плотности этого белка в крупных нейронах коры прецентральной извилины было выявлено, что величина последней у умерших старше 75 лет была в 1,7 раза больше по сравнению с умершими молодого возраста (Ме=84,8 и Ме=49,85, соответственно). Уровень экспрессии белка LAMP2A в нейронах базальных ядер и нейронах пирамидного слоя гиппокампа в образцах, полученных в случаях старческого возраста, был соответственно в 2 и 1,4 раза больше по сравнению со значениями, полученными в группе условного контроля. Кроме того, при сравнении исследуемых маркеров было обнаружено, что уровень оптической плотности HSP70 в образцах умерших старческого возраста повышался более интенсивно, чем уровень LAMP2A. Например, уровень оптической плотности HSP70 был выше относительного контроля на 59% (в коре), на 54,6% (в стриатуме) и на 52,9% (в гиппокампе), а уровень оптической плотности LAMP2A – на 40,7%, на 50% и на 41,8% в аналогичных зонах головного мозга. Необходимо отметить, что при анализе экспрессии как HSP70, так и LAMP2A внутри каждой возрастной группы статистически значимых различий в трех исследуемых зонах головного мозга обнаружено не было.
Данные литературы свидетельствуют о том, что при физиологическом старении может происходить увеличение конформационно дефектных нейротоксичных белков, как за счет их неправильного фолдинга, так и за счет нарушения утилизации [8-9]. Эти процессы лежат в основе большинства нейродегенератив-ных заболеваний, таких как болезнь Пар-
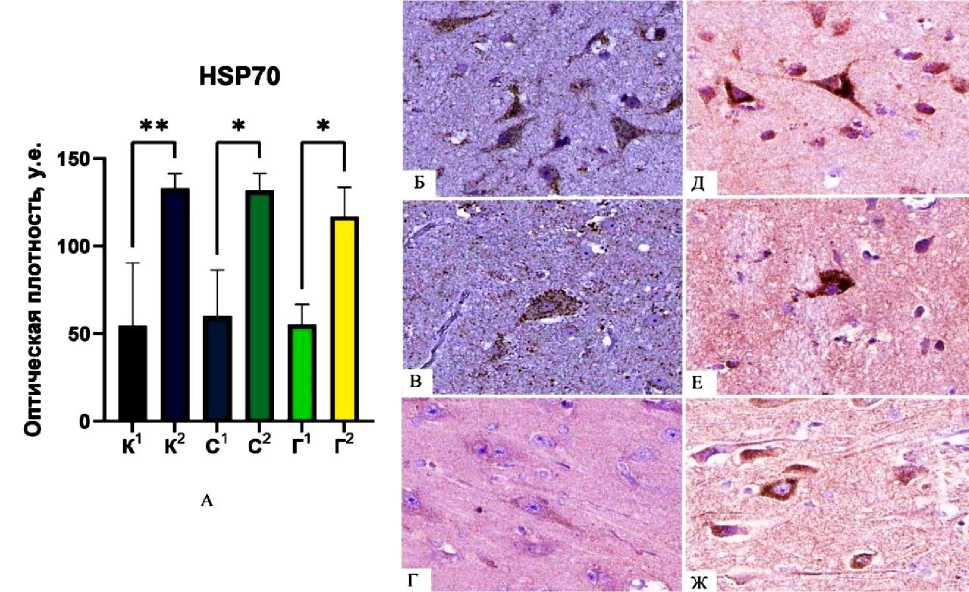
Рис. 1Б-1Ж. Экспрессия белка HSP70 в цитоплазме нейронов. Обозначения: кора (Б), стриатум (В) и гиппокамп (Г) в группе 35-45 лет; кора (Д), стриатум (Е) и гиппокамп (Ж) в группе >75 лет. Окр.: иммуногистохимическая. Ув.: х400
Рис. 1А. Сравнительные показатели оптической плотности белка HSP70. Обозначения: 1 -группа 35-45 лет, 2- группа >75 лет; К - кора прецентральной извилины, С - стриатум, Г - гиппокамп. Различия: * - р<0,05, ** - р<0,001
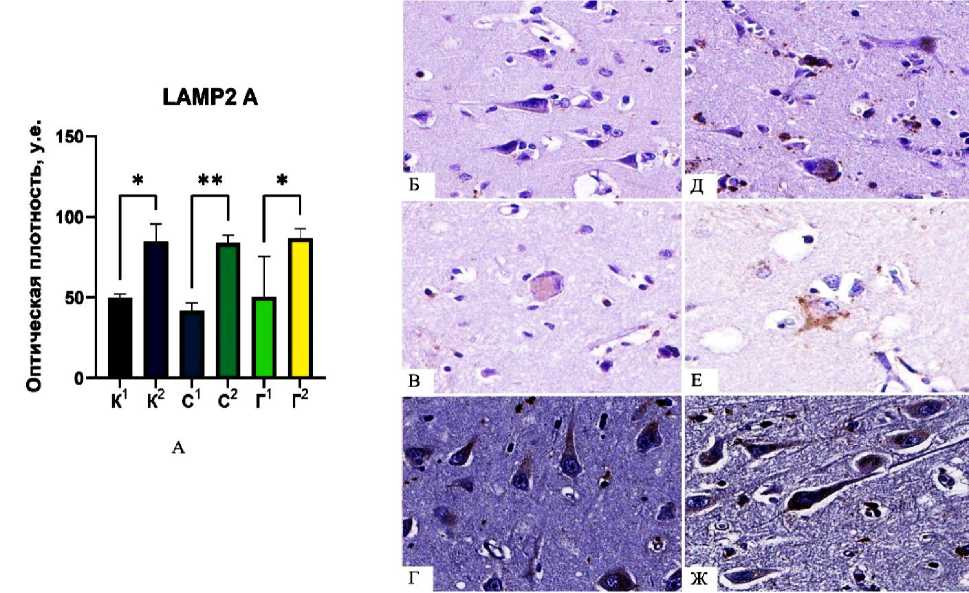
Рис. 2Б-2Ж. Экспрессия белка HSP70 в цитоплазме нейронов. Обозначения: кора (Б), стриатум (В) и гиппокамп (Г) в группе 35-45 лет; кора (Д), стриатум (Е) и гиппокамп (Ж) в группе >75 лет. Окр.: иммуногистохимическая. Ув.: х400
Рис. 2А. Сравнительные показатели оптической плотности белка LAMP2A . Обозначения: 1 - группа 35-45 лет, 2- группа >75 лет; К - кора прецентральной извилины, С - стриатум, Г -гиппокамп. Различия: *- р<0,05, **- р<0,001
кинсона, болезнь Альцгеймера, болезнь Гентингтона [4, 8-11]. Результаты проведенных исследований демонстрируют тот факт, что образованию и накоплению поврежденных агрегированных форм белков препятствует система шаперонов, образованная белками теплового шока, например, HSP70. Последний не только обеспечивает конформационный контроль белков, но и вместе с лизосомальным рецептором LAMP2A участвует в элиминации олигомеров с последовательностью аминокислот KFERQ путем шаперон-опосредован-ной аутофагии [8-10, 12-13]. Однако, несмотря на большое количество данных о функциях и механизмах этого селективного типа аутофагии, уровни экспрессии ее маркеров в нервной ткани головного мозга человека в современной литературе представлены неполно и во многом противоречивы. Так, ряд авторов выявили повышенные уровни различных белков теплового шока в головном мозге при возрастной инволюции [14-15], в то время как Gleixner и соавт. в своем исследовании продемонстрировали противоположные результаты [16].
Наше исследование, продемонстрировавшее повышенный уровень экспрессии маркеров шаперон-опосредован-ной аутофагии в нейронах при возрастной инволюции, частично согласуется с данными других авторов. За последнее десятилетие ряд работ продемонстрировал повышенный уровень экспрессии различных белков теплового шока как в ткани головного мозга, так и в миокарде, печени, скелетной мышечной ткани, однако, большая часть исследований была выполнена на моделях лабораторных беспозвоночных и позвоночных животных [13-23]. Малое количество исследований шаперон-опосредованной аутофагии, выполненных на биопсийном и аутопсийном материале, может быть связана со сложностью изучения изменений, обусловленных исключительно сенильными проявлениями из-за невозможности полного исключения ко-морбидных и возраст-ассоциированных заболеваний при старении. Обнаруженное при старении повышение уровней маркеров шаперон-опосредованной аутофагии может быть обусловлено тем, что этот тип селективной аутофагии является одним из регуляторов клеточного гомеостаза и уровень экспрессии его маркеров может быть стресс-индуцирован в ответ на повышенное количество конформацион-но дефектных белков и активных форм кислорода, накапливающихся с течением времени, например, в результате воспаления или гипоксии. Выявленные более высокие показатели оптической плотности HSP70 по сравнению с LAMP2A в образцах головного мозга умерших старческого возраста, вероятно, обусловлены диссоциацией между стадией связывания субстрата и стадией его транслокации. То есть можно предположить, что связывание нефункционирующих белков с HSP70 и ко-шаперонами происходит быстрее, чем их перемещение в просвет лизосомы посредством LAMP2A. Относительная недостаточность последнего, вероятно, лежит в основе вышеописанного механизма диссоциации, однако данная гипотеза требует дальнейшего изучения. Кроме того, белки теплового шока имеют более широкий спектр функциональной активности и участвуют не только в шаперон-опосредованной аутофагии, но и выполняют множественные функции в сигнальных путях для поддержания клеточного гомеостаза.
Заключение. Полученные результаты дают основание предполагать, что повышенные уровни маркеров шаперон-опосредованной аутофагии могут носить компенсаторно-приспособительный характер и обеспечивать выживаемость нейронов в условиях хронического стресса при физиологическом старении, а обнаруженная дискоординация HSP70 и LAMP2A в системе маркеров этого типа аутофагии может иметь важное значение для дальнейшего изучения механизмов старения.
Список литературы Иммуногистохимическая оценка шаперон-индуцируемой аутофагии в различных отделах головного мозга человека при старении
- López-Otín C, Blasco MA, Partridge L et al. The hallmarks of aging. Cell. 2013;153(6):1194-1217. https://doi.Org/10.1016/j.cell.2013.05.039
- Farr JN, Almeida M. The Spectrum of Fundamental Basic Science Discoveries Contributing to Organismal Aging. J Bone Miner Res. 2018;33(9):1568-1584. https://doi.org/10.1002/jbmr.3564
- Zhe Li, Zhenkun Zhang, Yikun Ren et al. Aging and age-related diseases: from mechanisms to therapeutic strategies. Biogerontology. 2021;22(2):165-187. https://doi.org/ 10.1007/s10522-021-09910-5
- Loeffler DA. Influence of Normal Aging on Brain Autophagy: A Complex Scenario. Front Aging Neurosci. 2019;11:49. https://doi.org/ 10.3389/fnagi.2019.00049
- Loos B, Klionsky DJ, Wong E. Augmenting brain metabolism to increase macro- and chaperone-mediated autophagy for decreasing neuronal pro-teotoxicity and aging. Prog Neurobiol. 2017;156:90-106. https://doi.org/ 10.1016/j.pneurobio.2017.05.001
- Kallergi E, Nikoletopoulou V. Macroautophagy and normal aging of the nervous system: Lessons from animal models. Cell Stress. 2021;5(10):146-166. https://doi.org/10.15698/cst2021.10.257
- Auzmendi-Iriarte J, Matheu A. Impact of Chaperone-Mediated Autophagy in Brain Aging: Neurodegenerative Diseases and Glioblastoma. Front Aging Neurosci. 2021;12:630743. https://doi.org/10.3389/fnagi.2020.630743
- Maksimovich NE, Bon' EI. Belki teplovogo shoka. Svoistva. Rol' v adaptatsii. Metodicheskie podkhody k opredeleniyu. Biomeditsina. 2020;16(2):60-67. In Russian. https://doi.org/10.33647/2074-5982- 16-2-60-67
- Pokrovskiy VM, Patrakhanov EA, Antsiferov OV i dr. Belok teplovogo shoka HSP70 - predposylki ispol'zovaniya v kachestve lekarstvennogo sredstva. Farmatsiya i farmakologiya. In Russian. 2021;9(5):346-355. https://doi.org/10.19163/2307-9266-2021-9-5-346-355
- Kanno H, Handa K, Murakami T et al. Chaperone-Mediated Autophagy in Neurodegenerative Diseases and Acute Neurological Insults in the Central Nervous System. Cells. 2022;11(7):1205. https://doi.org/10.3390/cells11071205
- Sukhorukov V, Voronkov D, Baranich T et al. Impaired Mitophagy in Neurons and Glial Cells during Aging and Age-Related Disorders. Int J Mol Sci. 2021;22(19):10251. https://doi.org/10.3390/ijms221910251
- Franklin TB, Krueger-Naug AM, Clarke DB et al. The role of heat shock proteins Hsp70 and Hsp27 in cellular protection of the central nervous system. Int J Hyperthermia. 2005;21(5):379-392. https://doi.org/10.1080/02656730500069955
- Bourdenx M, Martín-Segura A, Scrivo A et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell. 2021;184(10):2696-2714.e25. https://doi.org/10.1016/j.cell.2021.03.048
- Ye W, Xu K, Huang D et al. Age-related increases of macroautophagy and chaperone-mediated autophagy in rat nucleus pulposus. Connect Tissue Res. 2011;52(6):472-478. https://doi.org/10.3109/03008207.2011.564336
- Salway KD, Gallagher EJ, Page MM, Stuart JA. Higher levels of heat shock proteins in longer-lived mammals and birds. Mech Ageing Dev. 2011;132(6-7):287-297. https://doi.org/10.1016/j.mad.2011.06.002
- Gleixner AM, Pulugulla SH, Pant DB et al. Impact of aging on heat shock protein expression in the substantia nigra and striatum of the female rat. Cell Tissue Res. 2014;357:43-54. https://doi.org/10.1007/s00441-014-1852-6
- Joseph AM, Adhihetty PJ, Buford TW et al. The impact of aging on mitochondrial function and biogenesis pathways in skeletal muscle of sedentary high and low-functioning elderly individuals. Aging Cell. 2012;11(5):801-809. https://doi.org/10.1111/j.1474-9726.2012.00844.x
- Shilova V, Zatsepina O, Zakluta A et al. Age-dependent expression profiles of two adaptogenic systems and thermotolerance in Drosophila mela-nogaster. Cell Stress Chaperones. 2020;25(2):305-315. https://doi.org/10.1007/s12192-020-01074-4
- Cumming KT, Kvamme NH, Schaad L et al. Muscular HSP70 content is higher in elderly compared to young, but is normalized after 12 weeks of strength training. Eur J Appl Physiol. 2021;121(6):1689-1699. https://doi.org/10.1007/s00421-021-04633-4
- Calabrese V, Scapagnini G, Ravagna A, Colombrita C, Spadaro F, Butterfield DA, Giuffrida Stella AM. Increased expression of heat shock proteins in rat brain during aging: relationship with mitochondrial function and glutathione redox state. Mech Ageing Dev. 2004;125(4):325-335. https://doi. org/10.1016/j.mad. 2004.01.003
- Tower J. Hsps and aging. Trends in Endocrinology&Metabolism. 2009;20(5):216-222. https://doi.org/10.1016/j.tem.2008.12.005
- Kikis EA, Gidalevitz T, Morimoto RI. Protein homeostasis in models of aging and age-related conformational disease. Adv Exp Med Biol. 2010;694:138-159. https://doi.org/10.1007/978-1-4419-7002-2_11.
- Njemini R, Lambert M, Demanet C et al. Basal and infection-induced levels of heat shock proteins in human aging. Biogerontology. 2007;8(3):353-364. https://doi.org/ 10.1007/s10522-006-9078-y


