Иммуногистохимические показатели серозных карцином яичников и возможный механизм развития резистентности к препаратам платины
Автор: Жукова Г.В., Ульянова Е.П., Меньшенина А.П., Моисеенко Т.И., Златник Е.Ю., Непомнящая Е.М., Сагакянц А.Б., Вереникина Т.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Цель исследования - определение информативности иммуногистохимических показателей серозных карцином яичников и их статистических связей после неоадъювантного лечения для оценки развития резистентности опухолей к платиносодержащим режимам адъювантной полихимиотерапии (АПХТ). Материал и методы. Проводили иммуногистохимическое исследование опухолевой ткани у больных серозным раком яичников высокой степени злокачественности IIIC-IV стадии в возрасте 49-72 лет, чувствительных (n=59) и резистентных (n=22) к платиносодержащим режимам адъювантной полихимиотерапии, у которых был отмечен положительный эффект на неоадъювантную терапию. В ткани опухолей яичников, полученной на этапе хирургического вмешательства после неоадъювантной полихимиотерапии, изучали иммуногисто-химические показатели пролиферативной активности (Ki67), экспрессии белка эксцизионной репарации ДНК ERCC1 и белков семейства АВС-транспортеров - Pgp и BCRP, а также статистические связи между этими показателями (коэффициент ранговой корреляции Спирмена).
Серозная карцинома яичников высокой степени злокачественности, платиноре- зистентность, пролиферация, транспортные белки, статистическая связь, биологическая обратная связь
Короткий адрес: https://sciup.org/140307088
IDR: 140307088 | УДК: 618.11-006.66-08:615.28:57.053 | DOI: 10.21294/1814-4861-2024-23-4-45-53
Текст научной статьи Иммуногистохимические показатели серозных карцином яичников и возможный механизм развития резистентности к препаратам платины
В настоящее время развитие резистентности к препаратам платины, формирующейся у 75–90 % больных раком яичников (РЯ), является острой проблемой клинической онкологии, резко снижающей шансы пациенток с распространенным РЯ на получение эффективной помощи и определяющей высокую летальность [1, 2]. При этом обнадеживающие результаты первых курсов лекарственного лечения не гарантируют сохранение платиночув-ствительности опухолей на дальнейших этапах терапии. Решение данной проблемы связано с выявлением механизмов развития платинорезистент-ности и поиском эффективных прогностических маркеров. На современном этапе еще не удалось выявить ни одного молекулярно-генетического, иммуногистохимического (ИГХ) или биохимического показателя, позволяющего прогнозировать развитие устойчивости к платиносодержащим режимам химиотерапии [3–5], подобно тому, как это имеет место в отношении выживаемости пациентов с опухолями некоторых других локализаций [6–8].
Известно о связи мутаций в генах BRCA 1/2 c чувствительностью к препаратам платины при РЯ и раке молочной железы (РМЖ) [9]. Однако чувствительностью к указанным факторам могут обладать и пациентки, у которых такие мутации отсутствуют. Ранее в качестве маркеров динамики чувствительности РЯ к препаратам платины рассматривались показатели активности белка ERRCI [6, 7], однако дальнейшие исследования не подтвердили их прогностическую значимость [8, 9]. Распространенность случаев отсутствия сверхэкспрессии эффлюксных белков при платинорезистентном РЯ и выраженного лечебного эффекта при ингибировании их активности [10, 11] свидетельствует о малой изученности кон- кретных форм участия белков-транспортеров в развитии лекарственной резистентности. Остается открытым вопрос о соотношении эффлюкса противоопухолевых химиопрепаратов и транспорта эндогенных проопухолевых факторов, о динамике пролиферативных и транспортных процессов [12]. Не исследована роль не связанных с изменением генов регуляторных нарушений, развивающихся на различных структурно-функциональных уровнях организма, которые могут проявляться не только в виде резких сдвигов тех или иных показателей, но и в изменении динамики их соотношений и корреляционных связей на фоне терапии [13, 14]. Все вышесказанное обусловливает целесообразность проведения комплексного исследования, направленного на уточнение информативности ИГХ характеристик карцином яичников и их статистических связей для прогноза динамики чувствительности опухолей к лекарственной терапии с использованием препаратов платины.
Целью исследования явилось определение информативности иммуногистохимических показателей серозных карцином яичников и их статистических связей после неоадъювантного лечения для оценки развития резистентности опухолей к платиносодержащим режимам адъювантной полихимиотерапии (АПХТ).
Материал и методы
Ретроспективно изучены ИГХ показатели в ткани опухолей яичников у больных РЯ IIIC–IV стадии постменопаузального возраста (49–72 года), у которых был отмечен положительный эффект на неоадъювантную полихимиотерапию (НАПХТ), позволивший перейти к этапу хирургического лечения в объеме оптимальной циторедукции и последующей АПХТ. По данным гистологического исследования у всех пациенток наблюдалась серозная карцинома высокой степени злокачественности (high grade). Больным проводилось 3 курса НАПХТ карбоплатином и паклитакселом. Схема АПХТ также включала карбоплатин и паклитаксел, количество курсов варьировало от 4 до 6. Всем пациенткам проводились стандартные клиниколабораторные исследования в соответствии с клиническими рекомендациями [15], включая определение концентрации сывороточных маркеров СА-125 и Не-4. Всем больным исследован мутационный статус генов BRCA 1/2 с помощью метода HRM-PCR (High Resolution Melt Polymerase chain reaction) и секвенирования по Сэнгеру.
Больные были распределены на 2 группы в зависимости от сроков развития рецидива заболевания, по которому определялась чувствительность опухоли к платиносодержащим режимам АПХТ [15]. В группу больных с опухолями, сохранившими чувствительность к АПХТ (платиночувствительные опухоли), вошло 59 женщин, у которых рецидив РЯ развился в сроки, превышавшие 6 мес с момента окончания последнего курса АПХТ. Группу больных с опухолями, резистентными к платиносодержащим режимам АПХТ (платинорезистентные опухоли), составили 22 пациентки, у которых прогрессирование отмечено на фоне проведения АПХТ или в течение 6 мес после ее завершения. Четвертая стадия РЯ выявлена у 17 (29 %) больных с платиночувствительными опухолями и у 7 (32 %) пациенток с платинорезистентными карциномами. Больные исследованных групп не имели значимых различий по распространенности процесса, возрасту, характеру и выраженности сопутствующих заболеваний.
В последние годы для оценки ответа распространенного РЯ на химиотерапию часто используется система CRS (Chemotherapy Response Score), предусматривающая оценку изменений в ткани большого сальника на фоне НАПХТ. Имеются противоречивые данные об информативности показателей CRS в отношении прогноза платиноре-зистентности, а также отмечается недостаточная стандартизация методических подходов при их определении [16]. В силу этого мы сочли целесообразным использовать традиционные критерии лечебного патоморфоза и сосредоточиться на изменениях в опухолях яичников как при оценке лечебного патоморфоза НАПХТ, так и при выявлении связи резистентности с особенностями экспрессии ИГХ показателей. В результате при гистологическом исследовании опухолевой ткани в обеих группах после НАПХТ отмечены четко выраженное нарушение структуры опухоли и уменьшение ее площади на 30 % и более, а также другие признаки, указывающие на лечебный патоморфоз II или III степени по Г.А. Лавниковой [17].
В ткани серозных карцином яичников, полученных после проведения НАПХТ, с помощью ИГХ методов проводили сравнительное изучение пролиферативной активности (Ki67), а также экспрессии белка эксцизионной репарации ДНК ERCC1 и двух белков семейства АВС-транспортеров – Pgp и BCRP. Для этого использовали поликлональные кроличьи антитела к Pgp (или MDR1, 1:600) и ERCC1 (1:300) фирмы Affinity Biosciences, поликлональные кроличьи антитела к Ki67 (1:200, Diagnostic BioSystem), моноклональные мышиные антитела к BCRP (клон JF0994, 1:300, Hangzhou HuaAn Biotechnology Co.Ltd.). Срезы докрашивали гематоксилином Карацци, для заключения использовали витрогель. Оценка результатов ИГХ реакции проводилась с применением светового микроскопа «AxioLab.A1» (Германия) при ×10, ×20 и ×40.
Для определения экспрессии Ki67 подсчитывали процентное содержание окрашенных в результате ИГХ реакции опухолевых клеток, приходящихся на 100 опухолевых клеток. В соответствии с традиционным способом оценки значения 0–20 % расценивали как низкие, 21–50 % – как умеренные
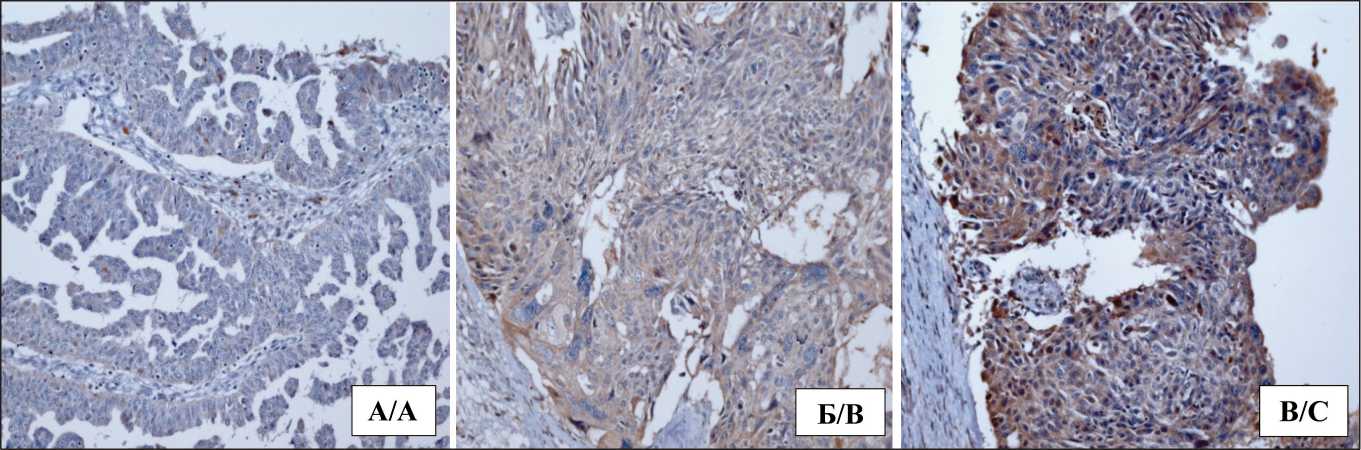
Рис. 1. Микрофото. Различная выраженность экспрессии белка ERRC-I в серозных карциномах яичников, ×200. А – отсутствие экспрессии; Б – низкая экспрессия, 1+; В – высокая экспрессия, 2+. Примечание: микрофото выполнены авторами
Fig. 1. Microphoto. Different expression of ERRC-I protein in serous ovarian carcinomas, ×200. A – lack of expression; B – low expression, 1+; C – high expression, 2+. Note: created by the authors
и 51–100 % – как высокие. Аналогичным образом, но с применением более подробной градации, оценивали экспрессию маркеров Pgp, BCRP и ERCC1: 1 (0–10 %), 2 (11–50 %), 3 (50–74 %), 4 (>75 %). При этом выраженность экспрессии ИГХ параметров в клетке определяли также полуколичественно по интенсивности окрашивания: 1+ – низкая, 2+ – умеренная, 3+ – высокая. Экспрессия считалась положительной при оценке не менее 2 по каждой из двух указанных шкал. На рис. 1 представлены микрофотографии ткани серозных карцином яичников у больных с различной выраженностью экспрессии ИГХ маркеров на примере белка эксцизионной репарации ДНК ERCC1.
Межгрупповые сравнения показателей проводили с помощью непараметрического критерия Манна–Уитни (U-критерий) и критерия согласия Пирсона χ2. В силу важности выявления критических величин, имеющих прогностическое значение, при анализе вариационных рядов обращали внимание на минимальные и максимальные значения рассматриваемых показателей (xmin – xmax) [18]. Статистические связи между исследованными показателями оценивали с помощью рангового коэффициента корреляции Спирмена (с оценкой его статистической значимости) и общепринятой градации выраженности («тесноты») связи на «слабую», «умеренную», «заметную» и «высокую», определяемой абсолютным значением коэффициента (шкала Чеддока). Использовали пакет программ «Statistica 13.3» (StatSoft Inc., США).
Исследования проведены с соблюдением «Этических принципов проведения научных медицинских исследований с участием человека» и в соответствии с «Правилами клинической практики в Российской Федерации».
Результаты и обсуждение
Медиана продолжительности безрецидивного периода у больных с платиночувствительными опухолями составила 19 мес, у больных с платинорезистентными опухолями – 5,2 мес (р=0,00001 Log-Ranktest). Также в исследуемых группах более чем в 2 раза различались показатели 3-летней общей выживаемости: у больных с чувствительностью к АПХТ – 51 %, у больных с резистентным течением – 23 % (p<0,05). Межгрупповые различия в выраженности токсических осложнений АПХТ не отмечены.
При молекулярно-генетическом исследовании у больных с платинорезистентным течением заболевания случаев мутаций в генах BRCA 1/2 не выявлено. У пациенток с опухолями, сохранившими чувствительность к АПХТ с карбоплатином, не наблюдались герминальные мутации в гене BRCА2 . В гене BRCA1 мутации выявлены у 8 из 59 таких больных (13 %). Эти мутации относились к 4 патогенным типам – 5382insC, 300T>G (C61G), 2080delA и c.1960A>T. При этом наиболее часто (n=4) встречалась минорная для российской популяции мутация 300T>G(C61G). В одном случае наблюдалась мутация Asp 1344del с неопределенным клиническим значением. Таким образом, в ходе исследования не отмечено связи между развитием платинорезистентности серозных карцином яичников на этапе АПХТ и наличием герминальных мутаций в генах BRCA 1/2 больных РЯ.
При изучении ИГХ показателей состояния ткани серозных карцином яичников после НАПХТ в целом выявлены признаки более высокого уровня пролиферации (Ki67), а также более высокой активности белков ERCC1, Pgp и BCRP у больных при развития резистентности к препаратам платины на этапе АПХТ (табл. 1, 2). В то же время у больных с платиночувствительными карциномами также отмечены случаи выраженной экспрессии исследуемых факторов, а у пациенток с платинорезистентными карциномами нередко встречались случаи сниженной экспрессии того или иного фактора. В наибольшей степени это
Таблица 1/Table 1
Характеристики пролиферативной активности после НАПХТ в серозных карциномах яичников, продемонстрировавших в дальнейшем различную чувствительность к платиносодержащим режимам АПХТ
Characteristics of proliferative activity in serous ovarian carcinomas after NAPCT, which further demonstrated different sensitivity to platinum-containing APCT regimens
|
Группа (опухоли)/ Groups (tumors) |
Частота встречаемости умеренных и высоких значений Кi67/ Frequency of moderate and high Кi67 values |
Значения Ki67 Ме [xmin–xmax]/ Кi67values Me [xmin–xmax] |
|
Платиночувствительные/ Platinum sensitive |
42 % |
17 [1–60] % |
|
Платинорезистентные/ |
77 %* |
38,5 [10–60] % |
|
Platinum resistiant |
р=0,006 |
p=0,305 |
Список литературы Иммуногистохимические показатели серозных карцином яичников и возможный механизм развития резистентности к препаратам платины
- Molekulyarno-geneticheskie podtipy raka yaichnikov: perspektivy dal'neishikh issledovanii. Voprosy onkologii. 2019; 65(1): 56-62.
- Motohara T., Yoshida G.J., Katabuchi H. The hallmarks of ovarian cancer stem cells and niches: Exploring their harmonious interplay in therapy resistance. Semin Cancer Biol. 2021; 77: 182-93. https://doi.org/10.1016/j.semcancer.2021.03.038.
- Kolesnikov E.N., Maksimov A.Yu., Kit O.I., Kutilin D.S. Zavisimost' obshchei i bezretsidivnoi vyzhivaemosti bol'nykh ot molekulyarno-geneticheskogo podtipa ploskokletochnogo raka pishchevoda. Voprosy onkologii. 2019; 65(5): 691-700. https://doi.org/10.37469/0507-3758-2019-65-5-691-700.
- Yu L., Jiang R., Chen W., Liu Ya., Wang, G., Xin Gong X., Wang Yo. Novel prognostic indicator combining inflammatory indicators and tumor markers for gastric cancer. World J Surg Onc. 2023; 21(1). https://doi.org/10.1186/s12957-023-02926-w.
- Golubeva V.A., Nepomuceno T.C., Monteiro A.N.A. Germline Missense Variants in BRCA1: New Trends and Challenges for Clinical Annotation. Cancers (Basel). 2019; 11(4): 522. https://doi.org/10.3390/cancers11040522.
- Steffensen K.D., Smoter M., Waldstrøm M., Grala B., Bodnar L., Stec R., Szczylik C., Jakobsen A. Resistance to first line platinum paclitaxel chemotherapy in serous epithelial ovarian cancer: The prediction value of ERCC1 and Tau expression. Int J Oncol. 2014; 44(5): 1736-44. https://doi.org/10.3892/ijo.2014.2311.
- Bogush T.A., Popova A.S., Dudko E.A., Bogush E.A., Tyulyandina A.S., Tyulyandin S.A., Davydov M.I. ERCC1 kak marker rezistentnosti raka yaichnikov k preparatam platiny. Antibiotiki i khimioterapiya. 2015; 60(3-4): 42-50.
- Bogush T.A., Stenina M.B., Bogush E.A., Zarkua V.T., Kalyuzhnyi S.A., Mamichev I.A., Tyulyandina A.S., Tyulyandin S.A. Kolichestvennye pokazateli ekspressii ERCC1 v tkani seroznogo raka yaichnikov i effektivnost' I linii khimioterapii s vklyucheniem preparatov platiny. Antibiotiki i khimioterapiya. 2018; 63(1-2): 24-31.
- Bao Y., Yang B., Zhao J., Shen S., Gao J. Role of common ERCC1 polymorphisms in cisplatin-resistant epithelial ovarian cancer patients: A study in Chinese cohort. Int J Immunogenet. 2020; 47(5): 443-53. https://doi.org/10.1111/iji.12484.
- Lu D., Shi H.C., Wang Z.X., Gu X.W., Zeng Y.J. Multidrug resistance-associated biomarkers PGP, GST-pi, Topo-II and LRP as prognostic factors in primary ovarian carcinoma. Br J Biomed Sci. 2011; 68(2): 69-74. https://doi.org/10.1080/09674845.2011.11730326.
- Xiao H., Zheng Yo., Ma L., Tian L., Sun Q. Clinically-Relevant ABC Transporter for Anti-Cancer Drug Resistance. Front Pharmacol. 2021; 12. https://doi.org/10.3389/fphar.2021.648407.
- Muriithi W., Macharia L.W., Heming C.P., Echevarria J.L., Nyachieo A., Filho P.N., Neto V.M. ABC transporters and the hallmarks of cancer: roles in cancer aggressiveness beyond multidrug resistance. Cancer Biol Med. 2020; 17(2): 253-69. https://doi.org/10.20892/j.issn.2095-3941.2019.0284.
- Glass L. Synchronization and rhythmic processes in physiology. Nature. 2001; 410(6825): 277-84 https://doi.org/10.1038/35065745.
- Mikhailov N.Yu., Garkavi L.Kh., Mashchenko N.M., Zhukova G.V. Issledovanie svyazi parametrov leikotsitarnoi formuly krovi s chastotnymi kharakteristikami signala pul'sovoi volny. Biofizika. 2012; 57(1): 99-104. https://doi.org/10.1134/S0006350912010150.
- Tyulyandina A.S., Kolomiets L.A., Morkhov K.Yu., Nechushkina V.M., Pokataev I.A., Rumyantsev A.A., Tyulyandin S.A., Urmancheeva A.F., Khokhlova S.V. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka yaichnikov, pervichnogo raka bryushiny i raka matochnykh trub. Zlokachestvennye opukholi. 2022; 12(3s2-1): 198-211. https://doi.org/10.18027/2224-5057-2022-12-3s2-198-211.
- Rodolakis I., Pergialiotis V., Liontos M., Haidopoulos D., Loutradis D., Rodolakis A., Bamias A., Thomakos N. Chemotherapy Response Score in Ovarian Cancer Patients: An Overview of Its Clinical Utility. J Clin Med. 2023; 12(6): 2155. https://doi.org/10.3390/jcm12062155.
- Lushnikov E.F., Abrosimov A.Yu., Dvinskikh N.Yu. Patomorfoz opukholei cheloveka. M., 2021. 224 s.
- Guo C., Lu M., Chen J. An evaluation of time series summary statistics as features for clinical prediction tasks. BMC Med Inform Decis Mak. 2020; 48. https://doi.org/10.1186/s12911-020-1063-x


