Иммуногистохимический анализ идиопатических эпиретинальных мембран
Автор: Алтынбаев У.Р., Лебедева А.И.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель: составить патоморфологическую характеристику идиопатических эпиретинальных мембран (иЭРМ), удаленных во время витреоретинальных операций, для более точного понимания их формирования, включая иммуногистохимическое выявление фиброгенных факторов и белков адгезии (TGFM, фибронектин, ламинин, GFAP). Материал и методы. Исследовали биопсийный материал - идиопатические эпиретинальные мембраны, изъятые у больных во время оперативных вмешательств. В работе использовали общегистологические (окраска гематоксилином и эозином), гистохимические (окраски по Маллори, по Вейгерту), иммуногистохимические (ИГХ) (TGFM, фибронектин, ламинин, GFAP), морфометрические методы исследования. Результаты. иЭРМ содержат в своем составе коллагеновые волокна. Толщина мембраны зависит от количества волокон коллагена. Приоритетными клетками в инициации их возникновения являются радиальные глиоциты. Они способствуют стимуляции фибробластических клеток и экспрессии клетками витреального интерфейса фиброгенных факторов: TGFbl, фибронектина, ламинина. Заключение. Накопление фибробластических клеток и коллагена может способствовать развитию и прогрессированию нейродегенеративного процесса, усилению контракции и снижению эластических свойств, что приводит к тракции, разрыву сетчатки и снижению зрения. Патоморфологическое исследование иЭРМ с использованием ИГХ методик позволяет применить адекватную тактику борьбы с витреальным фиброзом и принять конструктивное решение о срочности интравитреального пилинга.
Глиоз, идиопатическая эпиретинальная мембрана, иммуногистохимические исследования, фиброз
Короткий адрес: https://sciup.org/149135437
IDR: 149135437 | УДК: 612.842.5
Текст научной статьи Иммуногистохимический анализ идиопатических эпиретинальных мембран
ных с тракционным синдромом сетчатки, отслойкой сетчатки, формированием макулярных отверстий и т. д. Она характеризуется ростом фиброцеллю-лярной ткани на внутренней поверхности сетчатки. Большинство из мембран идиопатические, с распространенностью 1,02-28,90% [1]. В настоящее время появилась возможность поставить точный предоперационный диагноз иЭРМ и выполнить менее инвазивную операцию по ее удалению. Однако тенденция к более раннему хирургическому вмешательству поставила вопрос о том, насколько это оправдано и действительно ли выполнение операции у пациентов с иЭРМ необходимо. Некоторые специалисты выступают за более раннее хирургическое вмешательство для максимизации визуальных характеристик. Однако существует и противоположная точка зрения. Понимание этиопатогенетических механизмов развития и прогрессирования иЭРМ необходимо для прогнозирования течения заболевания и для принятия хирургической тактики [2].
Несмотря на успехи в области технологий визуализации, точный механизм формирования иЭРМ до сих пор неясен. Не определен пусковой механизм ее возникновения. Сложный клеточный состав ви-треального интерфейса, взаимодействие цитокинов объясняют причины и закономерности ее появления.
Цель: составить патоморфологическую характеристику идиопатических эпиретинальных мембран (иЭРМ), удаленных во время витреоретинальных операций, для более точного понимания их формирования, включая иммуногистохимическое выявление фиброгенных факторов и белков адгезии (TGFb1, фибронектин, ламинин, GFAP).
Материал и методы. У 15 больных во время витрэктомии были удалены первичные эпиретинальные мембраны, которые затем подвергнуты морфологическому исследованию. Мембраны для фиксации помещали в 10%-й раствор забуференного нейтрального формалина, после этого биопсийный материал обезвоживали в серии спиртов возрастающей концентрации и заливали в парафин по общепринятой методике. Срезы для гистологического исследования производили на микротоме LEICA RM 2145 (Германия), после чего их окрашивали гематоксилином и эозином, по Маллори. С целью выявления волокон эластина проводили окраску по Вейгерту резорцин-фуксином с последующей докраской литиевым кармином Орта.
Для иммуногистохимических (ИГХ) исследований парафиновые срезы нарезали толщиной не более 4 мкм и окрашивали при помощи иммуногистостейнера LeicaMicrosystemsBond™ (Германия). В качестве первичных антител использовали фибронектин в разведении 1:100 (sc — 8422), ламинин в разведении 1:100 (sc — 6018), GFAP в разведении 1:300 (sc — 33673), TGFb1 в разведении 1:300 (sc — 52893) (SantaCruzBiotechnology, США). В качестве вторичных антител использовали непрямую стрептавидин-био-тиновую систему детекции Leica BOND (Novocastra™, Германия). Для оценки специфичности реакции проводили окрашивание срезов без применения первичных антител. Морфологическое исследование и визуализацию препаратов проводили с применением светового микроскопа Leica DMD 108 (Германия), оснащенного специализированным программным обеспечением для управления настроек и захвата изображения (Германия). Морфометрию объектов проводили при увеличении х1000 с иммерсией.
Полученный цифровой материал обрабатывали с помощью программы Statistica 6,0. Проверка цифровых данных на нормальность с помощью критерия Колмогорова — Смирнова (D) и Шапиро–Уилка (W) показала, что распределение значений толщины мембраны отличалось от гауссова: D=0,18, p<0,01: W=0,67, p<0,0001. Внутривидовые числовые данные измерения толщины биопсийных мембран проводили с использованием медианы (Me) и квартилей.
Результаты. При морфометрическом исследовании толщины мембран выявлено резко асимметричное (коэффициент асимметрии As=4,00±0,13) и эксцессивное (коэффициент эксцесса Ex=28±0,26) распределение, в котором подавляющая масса значений (95%) варьировалась в интервале от 1,34 до 11,33 мкм. Но в единичных случаях толщина мембраны превышала эти значения на порядок и более (1,34–45,60 мкм). В связи с этим среднее значение, медиана и мода распределения резко различались между собой: 5,13±4,23 мкм, 4,14 мкм и 1,87 мкм, а коэффициент вариации (Cv, отношение Sd к среднему значению) составлял почти 100% (82%). Это свидетельствовало о существенной неоднородности исследуемой группы объектов.
Исследование распределения значений толщины мембраны для каждого объекта также показало неоднозначные результаты. Коэффициенты варьирования у всех объектов независимо от среднего уровня превышали 30%, варьируясь от 30 до 57%, что свидетельствовало о неоднородности выборки внутри каждого биопсийного образца. Однако проверка выборок на нормальность по критериям D и W показала, что в пяти случаях из пятнадцати отличия от нормальности оказались статистически незначимы. А в десяти случаях отличия от нормальности были статистически репрезентативны.
Исходя из этого, данные образцы были условно разделены на две группы. I группу составляли тонкие иЭРМ с толщиной от Ме 2,13 (1,58; 2,52) мкм до Ме 4,44 (3,46; 5,70) мкм, где распределение значений толщины мембраны оказалось статистически достоверно. II группу составляли образцы с более широким диапазоном значений: от Ме 6,03 (4,79; 6,88) мкм до Ме 16,50 (9,16; 21,50) мкм, где данные значений оказались неоднородны и статистически незначимы.
При морфологическом исследовании иЭРМ I группы имели вид относительно равномерной ленты волокнистой структуры. Мембраны образовывали многочисленные складки, направленные витреально в заднюю камеру. Клеток они не содержали. Длинные мембранные складки срастались между собой с образованием крупнопетлистой сети. Ретинальная сторона мембраны была инфильтрирована радиальными глиоцитами сетчатки, как в виде монослоя, так и в виде довольно массивных скоплений. В толще самой мембраны располагались ламиноциты. Данные клетки с удлиненным веретеновидным ядром были плотно припаяны к мембране и встречались в единичном количестве (рис. 1А).
Отмечено, что уровень складчатости иЭРМ находился в прямой зависимости с численностью радиальных глиоцитов. Коллагенпродуцирующие клетки выявлялись в небольшом, единичном количестве, что ставило их инициирующую роль под сомнение. Несмотря на это, иЭРМ имела характерную интенсивную окраску, специфичную для волокон коллагена (рис. 1 В). Эластин в мембранах I типа не выявлялся. Наличие плотных коллагеновых волокон и отсутствие эластина свидетельствовало о низкой степени растяжимости и высоких тракционных свойствах.
Белки адгезии фибронектин и ламинин также не определялись. GFAP экспрессировался только клетками нейроглии (рис. 2А). Помимо этого, TGFb1 довольно интенсивно выявлялся в мембране и локализовался в цитоплазме радиальных глиоцитов сетчатки (рис. 2В). Можно предположить, что клетки
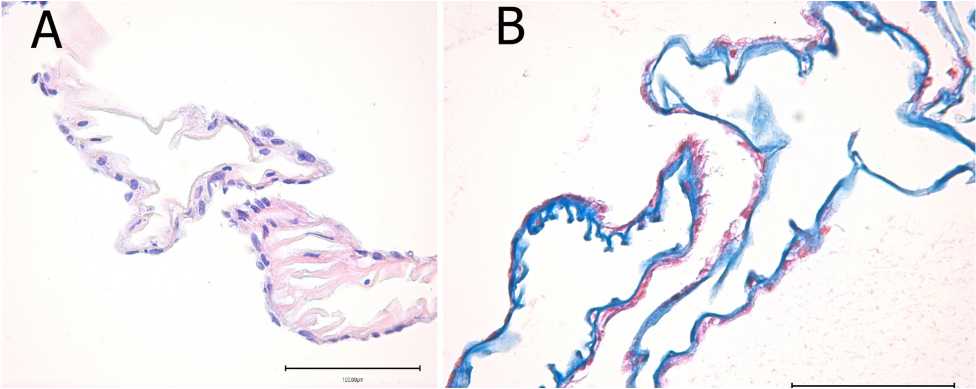
Рис. 1. Структура идиопатической эпиретинальной мембраны в I группе: А — окраска гематоксилином и эозином; В — окраска по Маллори
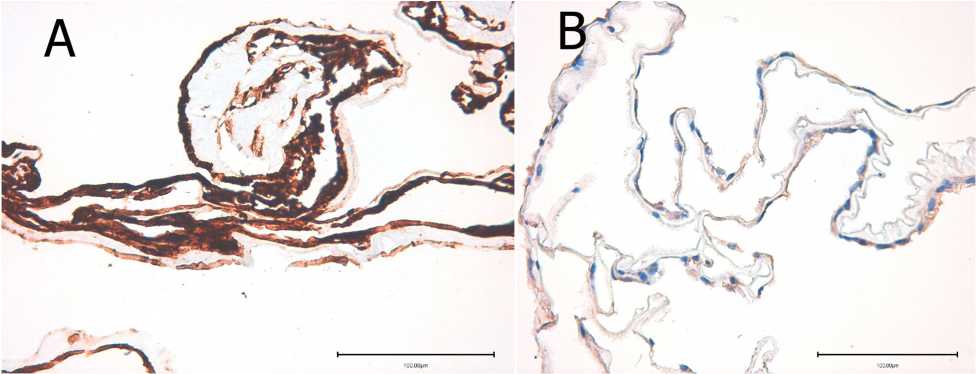
Рис. 2. Наличие фиброгенных факторов в сетчатке в идиопатической эпиретинальной мембране I группы:
А — интенсивная реакция на антигены к GFAP радиальными глиоцитами сетчатки, непрямой иммунопероксидазный метод выявления GFAP с докраской гематоксилином; В — антигены к TGFb1 на всем протяжении иЭРМ в цитоплазме радиальных глиоцитов сетчатки, непрямой иммунопероксидазный метод выявления TGFb1 с докраской гематоксилином
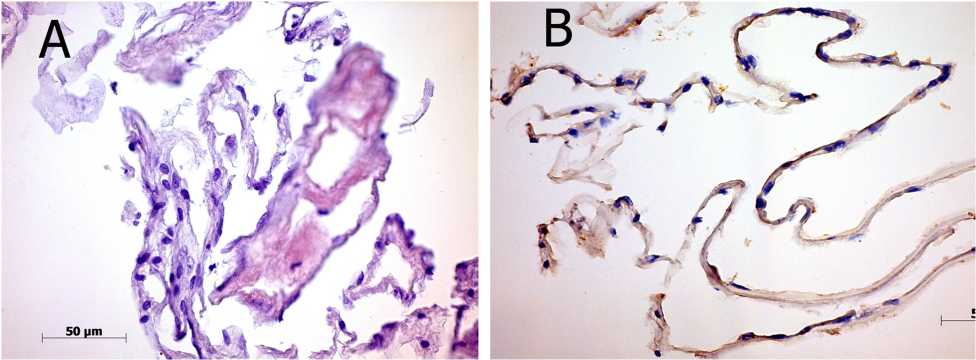
Рис. 3. Структура идиопатической эпиретинальной мембраны во II группе:
А — интенсивная фибробластическая инфильтрация и массивный фиброзный компонент в иЭРМ, окраска гематоксилином и эозином; В — положительная реакция к антигенам фибронектина иЭРм, непрямой иммунопероксидазный метод выявления фибронектина с докраской гематоксилином
нейроглии играют индуцирующую роль в возникновении мембраны при патологических условиях за счет экспрессии определенного спектра цитокинов.
При морфологическом исследовании иЭРМ II группы отмечено, что они представляли собой также непрерывные фибриллярные образования коллагеноволокнистой структуры, которые при окраске по Маллори окрашивались в интенсивный синий цвет. Мембрана имела в основном ламеллярное строение, в некоторых зонах обнаруживалась складчатость и отложения коллагена, как в виде волокнистых депозитов, так и в виде тонкофибриллярных скоплений, что обуславливало широкий диапазон цифровых данных толщины мембраны и ее неоднородность. Эластин также не выявлялся.
Они были инфильтрированы клетками различных дифферонов: от нервного — радиальными глиоцитами, до фибробластического — фибробластами, ламиноцитами, миофибробластами (рис. 3А). Кроме того, на поверхности мембраны встречались гиало-циты округлой формы. Клетки воспалительного ряда и форменные элементы крови отсутствовали.
Мембраны, условно классифицированные как иЭРМ II группы, имели положительное иммуно-фенотипирование к антигенам таких белков адгезии, как фибронектин, ламинин. Помимо этого, в них выявлялись антигены к фиброгенным антителам: TGFb1, GFAP, причем фибронектин и ламинин выявлялись со стороны витреальной полости наряду с выраженной фибробластической инфильтрацией и присутствием гиалоцитов (рис. 3В).
Таким образом, все иЭРМ имели в своем составе коллагеновые волокна, обнаруживаемые в том или ином количестве. Инициатором возникновения патологической витреальной мембраны являляются радиальные глиоциты. Накопление фибриллярного компонента, как в случае с мембранами II типа, может быть связано с вовлечением гиалоцитов со стороны витреального комплекса — стекловидного тела.
Обсуждение. Анализ полученных данных позволил условно разделить биопсийный материал на две группы. Сопоставляя массив цифровых значений с морфологией мембран, выявили прямую зависимость толщины коллагенового слоя с интенсификацией клеточной плотности. Следовательно, прогрессирование фиброзирования и усиление тракционных свойств может происходить в связи с накоплением клеток глии как за счет миграции, так и за счет пролиферации.
Фиброциты и гиалоциты присутствуют в витре-альной полости и являются резидентными клетками стекловидного тела в норме. Особая их роль проявляется при развитии патологических состояний стекловидного тела, поскольку они способны к размножению и синтезу межуточного вещества [3]. По данным C. Guidry (1996), радиальные глиоциты могут трансформироваться в миофибробласты. При изменении фенотипа нейроглиальных клеток на фибробластический экспрессия GFAP редуцируется, а а-актин гладкомышечных клеток в цитоплазме накапливается [4]. Анализируя клеточный состав иЭРМ, установили, что во II группе он значительно превосходит I группу по численности и видовому составу за счет накопления фибробластических клеток: фибробластов, миофибробластов, радиальных глиоцитов, ламиноцитов, которые могут быть источником профиброгенных факторов.
Фибронектин и ламинин, являясь гликопротеинами внеклеточного матрикса, стимулируют хемоаттракцию клеток, образуют каркас для их миграции и обладают высоким сродством к основным компонентам стекловидного тела, к коллагену II типа и гиалуроновой кислоте [5]. Фибронектин секретируется фибробластическими клетками, а также клетками пигментного эпителия, радиальными глиоцитами, гиалоцитами [6]. Несмотря на то что гиалоциты относятся к клеткам макрофагального ряда — облигатным фагоцитам, в определенных условиях, например при воспалении, они проявляют морфофункциональные свойства фибробластических и могут секретировать белки межклеточного матрикса. Ламинин продуцируется ламиноцитами, которые обнаружены в большом количестве в иЭРМ II группы [3].
TGFbl в сетчатке может располагаться в межфоторецепторном матриксе. Его гиперсекреция приводит к избыточному коллагеногенезу соединительнотканными клетками, его причисляют к фиброгенному фактору. TGFbl стимулирует продукцию фибронектина и коллагена фибробластами и повышает внедрение этих белков в экстраклеточный матрикс [7]. Известна роль TGFbl в трансдифференцировке глиальных клеток или гиалоцитов в миофибробласты, вызывая сокращение иЭРМ [8]. TGFb1 выявляется в витреальных гиалоцитах [9], а также между фоторецепторами и в цитоплазме радиальных глиоцитов, что согласуется с нашими исследованиями.
Известно, что GFAP является белком промежуточных филаментов, характерных для радиальных глиоцитов сетчатки, и выполняет роль маркера глиоза при его избыточном накоплении [10]. Нами обнаружено, что он интенсивно выявляется в иЭРМ как I типа, так и II типа и может активно участвовать в их формировании, оказывать влияние на клетки витреомакулярного интерфейса и стимулировать фиброз.
Заключение. Таким образом, во всех иЭРМ выявлены коллагеновые волокна. Они значительно различаются по толщине и клеточному составу инфильтрирующих их клеток. Приоритетными клетками в инициации их возникновения являются радиальные глиоциты. Обнаруженная положительная реакция утолщенных видов мембран к антигенам против фибронектина, ламинина, TGFb1 и GFAP, а также накопление фибробластических клеток могут способствовать развитию и прогрессированию нейродегенеративного процесса, усилению контракции и снижению эластических свойств, что приводит, как следствие, к развитию тангенциальных тракций и разрыву сетчатки.
Патоморфологическое исследование иЭРМ с использованием ИГХ методик позволяет применить адекватную тактику борьбы с витреальным фиброзом и принять конструктивное решение о срочности интравитреального пилинга.
Список литературы Иммуногистохимический анализ идиопатических эпиретинальных мембран
- Bu SC, Kuijer R, Li XR, et al. Idiopathic epiretinal membrane. retina 2014; 34: 2317-35.
- Rahman R, Stephenson J. Early Surgery for Epiretinal Membrane Preserves More Vision for Patients. Eye (Lond.) 2014; 28 (4): 410-4.
- Вит В.В. Строение зрительной системы человека: учеб. пособие. Одесса: Астропринт, 2010; 220 с.
- Guidry С. Isolation and characterization of porcine Muller cells: Myofibroblastic dedifferentiation in culture. Invest Ophthalmol Vis Sci 1996; 37 (5): 740-52.
- Weller M, Wiedemann P. The significance of fibronectin in vitreoretinal pathology: A critical evaluation. GraefesArch Clin Exp Ophthalmol 1988; 226 (3): 294-8.
- Grisanti S, Heimann K, Wiedemann P. Origin of fibronectin in epiretinal membranes of proliferative vitreoretinopathy and proliferative diabetic retinopathy. Br J Ophthalmol 1993; 77 (4): 238-42.
- Никитин H.A., Кузбеков Ш.P. Роль TGFb в офтальмологии. Цитокины и воспаление 2009; 8 (1): 3-9.
- lannetti L, Accorinti M, Malagola R. Role of the intravitreal growth factors in the pathogenesis of idiopathic epiretinal membrane. Invest. Ophthal Vis Sci 2011; 52 (8): 5786-9.
- Lutty G, Merges C, Threlkeld A, Crone S, et al. Heterogeneity in localization of isoforms of TGF-b in human retina, vitreous, and choroid. Invest Ophthalmol Vis Sci 1993; 34: 477-7.
- Turkmen N, Eren B, Fedakar R, et al. Glial fibrillary acidic protein (GFAP) and CD34 expression in the human optic nerve and brain in methanol toxicity. Adv Ther 2008; 25 (2): 123-32.


