Иммуногистохимический профиль дермы при введении поли-молочной кислоты
Автор: Могильная Галина Михайловна, Фомичева Евгения Васильевна, Блатт Юлия Евгеньевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.28, 2020 года.
Бесплатный доступ
Регенерации кожи в случае ее повреждения при введении филлеров обусловлена возникающей при этом воспалительной реакцией дермы. Среди обширной группы филлеров, используемых в эстетической медицине, достаточно хорошо себя зарекомендовала полимолочная кислота, которая рекомендуется в качестве фактора, формирующего «живой каркас», индуцирующий синтез коллагена фибробластами с последующей трансформацией клеток этого типа в миофибробласты. Цель исследования - анализ иммуногистохимического статуса дермы при введении имплантата из полимолочной кислоты. Исследование выполнено на 30 крысах с субдермальным введением препарата в объеме 0,05 мл. Оценку результатов проводили спустя две недели, 1, 2 и 4 месяца после инъекции. Морфологическая оценка проведена в срезах, окрашенных гематоксилином и эозином, по Ван-Гизон и реакций Маллори и Массона. Иммуногистохимическое выявление коллагенов I и III типов проведено с использованием поликлональных антител. Для оценки статуса фибробластов использовали виментин, а для оценки макрофагов маркер CD68. Эффект ремоделирования экстрацеллюлярного матрикса изучали с помощью α-SMA актина. Показано, что ответная реакция дермы на имплантат носит фазный характер, начинается субклинической воспалительной реакцией с последующей инкапсуляцией каждой индивидуальной микросферы и завершается дермальной фиброплазией. Это приводит к эффекту увеличения объема ткани и результат достигается не только свойствами вводимого продукта, но и реакцией организма на его введение. Выявленная активация синтеза коллагена фибробластами может быть использована в качестве регулятора объема экстрацеллюлярного матрикса дермы.
Дерма, полимолочная кислота, имплантат, филлер, неоколлагеногенез
Короткий адрес: https://sciup.org/143177426
IDR: 143177426 | DOI: 10.20340/mv-mn.2020.28(1)23-29
Текст научной статьи Иммуногистохимический профиль дермы при введении поли-молочной кислоты
Могильная Г.М., Фомичева Е.В., Блатт Ю.Е. Иммуногистохимический профиль дермы при введении полимолочной кислоты. Морфологические ведомости. 2020;28(1)23-29. (1):23-29
Mogilnaya GM, Fomicheva EV, Blatt YuE. Immunohistochemical profile of the dermis at the injection of polylactic acid. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(1):23-29. (1):23-29
Введение. Механизмы регенерации и воспаления кожи в случае ее повреждения в эстетической медицине при введении филлеров связаны между собой, поскольку в основе разыгрывающихся процессов лежит воспалительная реакция дермы. Считают, что ответная реакция инициируется характером повреждения, а при введении имплантата - его формой, композиционными свойствами, характером поверхности и размерами самого имплантата. Известны три стадии, пролонгированные во времени и сменяющие одна другую. Первая стадия это реакция на альтерацию с последующей адсорбцией. Вторая - клеточная адгезия с эффектом рекрутирования специализированных клеток, часть которых обеспечивает третий этап ответной реакции – ремоделирование внеклеточного матрикса. Среди обширной группы филлеров, используемых в эстетической медицине, достаточно хорошо себя зарекомендовала полимолочная кислота (далее - ПК), которая рекомендуется в качестве фактора, формирующего «живой каркас», индуцирующего синтез коллагена фибробластами с последующей трансформацией клеток этого типа в миофибробласты [1, 2].
Цель исследования : иммуногистохимическая характеристика этапов реакции дермы на введение полимолочной кислоты.
Материалы и методы исследования . В настоящем исследовании для изучения эффекта стимуляции фибробластов дермы использован препарат ПК фирмы Aesthe Fill (Южная Корея) который интерпретируется как биологически совместимый компонент не вызывающий отторжения и обладающий механическими свойствами которыми можно управлять. Этот продукт полностью резорбируется и элиминируется из организма естественным путем. Объектом исследования послужили беспородные крысы-самцы весом 200-250 г (30 особей, из Питомника лабораторных животных «Рапполово» Ленинградской области). Эксперимент проводился с разрешения локального этического комитета с соблюдением правил проведения работ с использованием экспериментальных животных. Всем животным подкожно вводили препарат полимолочной-α-кислоты в объеме 0,05 мл в заднюю часть шеи (холку). В группе контрольных животных использовали стерильный физиологический раствор в той же дозе. Оценку результатов проводили спустя две недели, 1, 2 и 4 месяца после инъекции. Для морфологического изучения использовали биоптаты кожи, которые подвергали стандартной гистологической обработке. Полученные срезы окрашивали гематоксилином и эозином, а также по Ван-Гизон и с помощью реакций Маллори и Массона [3]. Иммуногистохимическое выявление коллагена было проведено с использованием поликлональных антител Anti-Collagen-I, Anti-Collagen-III (Abcam, Англия) и системы визуализации (Nikon Eclipse 80i, Japan). С целью определения экспрессии маркеров макрофагов CD68, использовали первичные моноклональные антитела (LabVision), для оценки статуса фибробластов использовали виментин (Lab-Vision) и системы визуализации Ultra-Vision-LP (Lab-Vision). Выявление α-SMA проведено с помощью антител Anti-Actin-antibody (1:200, ab3280, Abcam, Англия). Исследование проводили на серийных парафиновых срезах толщиной 4 мкм с полилизиновым покрытием. Постановку иммуногистохимической реакции осуществляли согласно протоколам, прилагаемым к используемым антителам. Для завершения окрашивания осуществляли фоновое контрастирование срезов Hematoxylin-II (Roshe, Швейцария). С целью контроля окраски использовали эталоны позитивных и негативных образцов. Все цифровые данные подвергались статистической обработке. Достоверность различий параметрических данных оценивали по критерию Стьюдента. Различия между группами считались достоверными при p<0,05.
Результаты исследования и обсуждение. Согласно протоколу, первым сроком исследования была реакция дермы на имплантат, спустя 2 недели после его введения. Морфологические изменения в этот срок проявляются повреждением кровеносных сосудов и явлением стаза на отдельных участках дермы с нарушением целостности ее волокон. В зоне имплантата появляется большое количество клеток типа мононуклеаров. Они заполняют пространство между вакуолями, окруженными оксифильными уплощенными клетками с плоскими неструктурированными ядрами. При иммуногистохимической реакции на коллаген было видно, что стенка этих полостей образована тонкими фибриллами, обнаруживающими слабую реакцию на коллаген I типа. При избирательном выявлении коллагена III типа фибриллы также были тонкими, но уровень экспрессии коллагена был умеренным. На участке дермы над зоной имплантата при избирательном выявлении коллагена появляется достаточно большое количество клеток, вероятно, это фибробласты, содержащие гранулы проколлагена (рис. 1). Распределение красителя было диффузным, интенсивность окраски от умеренной до интенсивной. Вокруг имплантата формируется тонкая капсула из слабо окрашенных коллагеновых фибрилл I типа и достаточно интенсивно окрашенных фибрилл коллагена III типа.
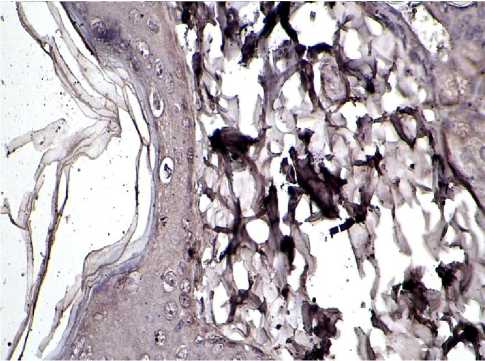
Рис. 1. Зона введения ПК через 2 месяца. Иммуногистохимическая реакция на коллаген I типа. Ув.: х400.
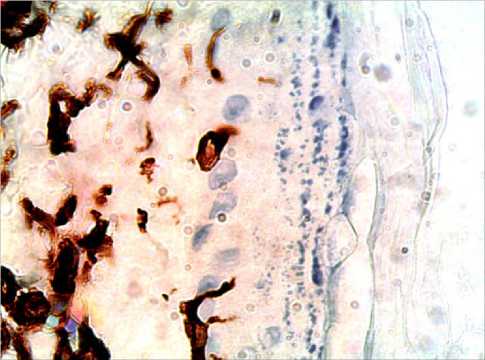
Рис. 2. Зона введения ПК через 1 месяц. Иммуногистохимическая реакция на виментин. Ув.: х400.
Спустя 1 месяц в зоне имплантата происходит снижение диаметров вакуолей и увеличение числа клеток между ними. В основном это клетки фибробластического ряда. В зоне формируемой вокруг имплантата капсулы уменьшается число кровеносных сосудов с эффектом стаза, но сама капсула остается тонкой. Через 2 месяца после инъекции размеры имплантата уменьшаются, вакуоли сужаются, некоторые из них становятся более плоскими, но стенки сохраняют монослой оксифильно окрашенных клеток и тонкие фибриллы. Иногда внутри имплантата появляются пучки гладкомышечных клеток, разделяющих его на отдельные фрагменты. По краю имплантата определяются многоядерные гигантские клетки инородных тел. Спустя 2 месяца площадь имплантата уменьшается и вокруг него формируется широкая соединительнотканная капсула с большим числом клеток. Внутри отдельных вакуолей сохраняется гомогенная масса, окрашивающаяся слабо базофильно, между ними встречается большое количество клеток фибробластического типа. Уровень содержания коллагена в этот срок наблюдения нарастает. Коллаген III типа выявляется не только в стенке сформированных микросфер, но и в цитоплазме отростчатых клеток, появившихся в зоне дермы над имплантатом. С увеличением срока пребывания ПК до 2-х и 4-х месяцев уровень содержания коллагена I типа увеличивается.
При иммуногистохимическом обнаружении виментина, спустя 2 недели после введения, зона имплантата определяется в виде большого количества различного размера и формы вакуолей или микросфер, содержащих ПК, стенка их окрашена в темно-коричневый цвет. Между ними находится большое количество клеток округлой или отростчатой формы с высокой степенью экспрессии виментина. В зоне имплантата клетки по форме вытянутые, а по периферии имплантата - отростчатые. Высокий уровень экспрессии виментина обнаруживают клетки, расположенные вне области имплантата. Так, в дерме над имплантатом выявляется большое количество отростчатых клеток типа фибробластов, цитоплазма их отличается высоким уровнем экспрессии виментина.
Спустя месяц на участке дермы, расположенной над имплантатом сохраняется большое количество диффузно и интенсивно окрашенных клеток, различных по форме. Между клетками появляются короткие, интенсивно окрашенные волокна. По сравнению с предыдущим сроком (2 недели) в зоне сосочкового и сетчатого слоев отмечается резкое увеличение числа клеток с высокой экспрессией виментина (рис. 2). Этот эффект прослеживается и в самом имплантате, в котором клетки и волокна от периферии перемещаются к центру имплантата.
Спустя 2 месяца в зоне дермы над имплантатом число клеток с высоким уровнем экспрессии виментина снижается, однако те клетки, которые остаются, сохраняют интенсивную реакцию. По краю имплантата появляются умеренно окрашенные многоядерные клетки инородных тел. В имплантате окраску сохраняют стенки микросфер и их содержимое, а также волокна, расположенные между микросферами, и гигантские клетки инородных тел. Спустя 4 месяца после введения ПК сам участок имплантата не определяется. Однако в дерме над зоной его введения отмечается появление многочисленных отростчатых клеток типа фибробластов, при этом они мигрируют в зону сосочкового слоя дермы. Единичные клетки можно увидеть и в зоне эпидермиса. Не исключено, что эти клетки являются эпидермальными макрофагами (клетками Лангерганса), а не фибробластами.
При выявлении структур, экспрессирующих CD68, оказалось, что спустя 2 недели после введения ПК в стенках отдельных микросфер выявляются уплощенные клетки, расположенные в один ряд (рис. 3А, 3Б). Цитоплазма их окрашена слабо. В других микросферах видна капсула, окружающая вакуоли, она обнаруживает реакцию умеренной интенсивности. Однако, в центральной части имплантата реакция отсутствует. По периферии имплантата встречаются макрофаги, цитоплазма которых имеет пенистый вид и характеризуется умеренной экспрессией CD68. Соединительнотканная капсула вокруг имплантата содержит единичные макрофаги. Участок дермы над имплантатом не обнаруживает их присутствия.
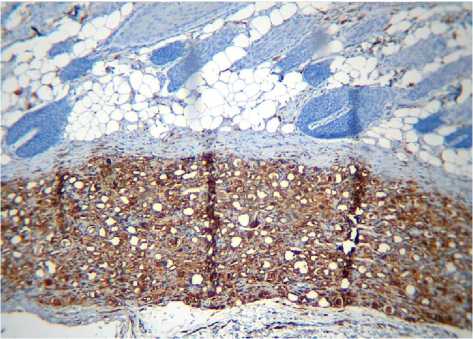
Рис. 3А. Зона введения ПК через 2 недели. Иммуногистохимическая реакция, CD68+ макрофаги. Ув.: х100.
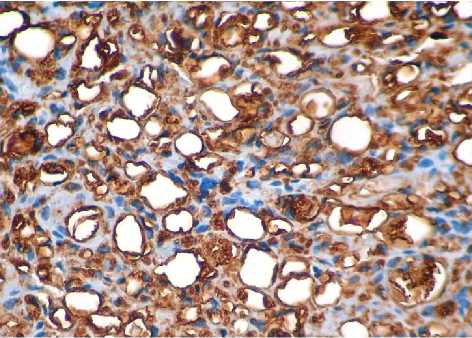
Рис. 3Б. Зона введения ПК через 2 недели. Иммуногистохимическая реакция, CD68+ макрофаги. Ув.: х400.
После пребывания имплантата в течение 1 месяца наблюдается эффект увеличения интенсивности окрашивания стенок микросфер и самих макрофагов, расположенных между ними. Стенки микросфер выстланы клетками с умеренным уровнем экспрессии CD68. В единичных вакуолях реакцию дает и их содержимое. Макрофаги между микросферами крупные, с умеренным уровнем экспрессии CD68, у некоторых из них цитоплазма вакуолизирована.
Спустя 2 месяца после пребывания имплантата в дерме появляется большое число макрофагов с высоким уровнем экспрессии CD68. Клетки этого типа локализуются как в сосочковом, так и сетчатом слоях. В них выявляется достаточно большое число многоядерных клеток, одни из них образуются при слиянии 10-15 макрофагов, тогда как другие насчитывают до 30 клеток.
К четырем месяцам пребывания имплантата происходит падение темпа экспрессии CD68 теми макрофагами, которые расположены в самом имплантате. Цитоплазма клеток этого типа сохраняет вакуолизированную структуру, но окрашивается слабо. Лишь местами по периферии имплантата, контактирующего с капсулой, сохраняются макрофаги с высокой степенью активности CD68.
При иммуногистохимическом выявлении а-актина спустя 2-недели после введения имплантата в поле зрения обнаруживается достаточно много содержащих его структур. Так, наибольшее число клеток с высоким уровнем экспрессии а-актина выявляется в поверхностном слое дермы в зоне над имплантатом. Эти участки содержат клетки овальной формы с диффузным распределением окраски, местами контуры клеток становятся вытянутыми, вероятно, это уже миофибробласты. В зоне глубокой дермы можно увидеть кровеносные сосуды различного калибра, в стенке которых обнаруживаются клетки с положительной реакцией на а-актин. В имплантате клетки, содержащие а-актин, встречаются в стенке кровеносных сосудов, а сам имплантат не обнаруживает присутствие клеток с экспрессией а-актина.
Спустя месяц в поверхностном слое дермы отмечается снижение числа клеток, содержащих а-актин. Глубокие слои дермы сохраняют миофибробласты в том же количестве. В имплантате в зоне между микросферами появляются единичные клетки с а-актином. Интересно отметить, что на фоне снижения числа миофибробластов в зоне дермы над имплантатом появляются структуры, имеющие вид фибрилл, толщиной в одну клетку – ассоциированная группа миофибробластов с высоким уровнем экспрессии а-актина.
Через 2 месяца после пребывания имплантата в зоне дермы число клеток, содержащих а-актин, снижается. В поверхностной зоне дермы миофибробласты отсутствуют, а-актин положительные клетки не выявляются и в стенке кровеносных сосудов. Вместе с тем, фибриллярных структур, как элементов слияния миофибробластов, становится больше, они смещаются на границу сосочкового и сетчатого слоев. В сосочковом слое дермы клетки, содержащие а-актин, отсутствуют.
Пребывание имплантата в течении 4-х месяцев приводит к увеличению содержания в дерме клеток с высоким уровнем экспрессии а-актина. Так в поверхностном сосочковом слое, выявляется большое число клеток отростчатой формы с узкой зоной цитоплазмы. Между ними выявляются интенсивно окрашенные фибриллы, ориентированные перпендикулярно к поверхности базальной мембраны. В глубокой зоне дермы клетки по форме овальные или округлые. Вероятно, это миофибробласты с высоким содержанием а-актина. В зоне самого имплантата, между сохранившимися микросферами, появляются миофибробласты с высоким содержанием а-актина. Таким образом, изучение иммуногистохимических маркеров клеточной структуры трех зон дермы, участвующих в реакции на введение ПК: имплантата, дермы над имплантатом и интактной зона, приближают нас к пониманию механизма ответной реакции дермы на имплантат на клеточном уровне.
В первый срок наблюдения после инъекции, соответствующий 2 неделям, реализуется эффект тканевой реакции на биоматериалы, то есть фаза белковой адсорбции [4]. Результатом взаимодействия белков плазмы крови с рецепторами адгезии воспалительных клеток является эффект формирования системы распознавания, а затем и защиты клеток. В зоне инъекции выявляются микросферы (вакуоли с ПК), окруженные моноклеточным слоем. Природа этих клеток в литературе дискутируется. Полагают, что вероятнее всего, это трансформированные в макрофаги моноциты. Однако, исходя из временной характеристики воспалительной реакции и смены ее фаз, вполне возможно предположить, что к концу второй недели пребывания имплантата в дерме капсула вокруг микросфер с ПК является результатом активации появившихся к концу 2-й недели фибробластов, которые приступили к изоляции инородных тел (микросфер) за счет формирования вокруг них капсулы. Капсула (стенка) вакуолей с ПК - это не только один ряд уплощенных клеток с гиперхромными ядрами (фиброциты), но и очень тонкие немногочисленные фибриллы, окружающие эти вакуоли и формирующие капсулу в составе которой выявляется коллаген III типа.
Иммуногистохимический профиль клеток дермы к указанному выше сроку наблюдения - это, прежде всего, экспрессирующие CD68 макрофаги, окружающие микросферы, а также многочисленные клетки, расположенные между ними. Макрофаги с высокой экспрессией CD68 в зоне имплантата присутствуют в достаточно большом количестве, они располагаются между микросферами и в составе стенки, окружающей эти микросферы. Выявляются они в поверхностном и глубоком слоях дермы в зоне над имплантатом. Интересно отметить также появление в этом сроке наблюдения единичных многоядерных клеток.
По данным литературы, клетки, содержащие CD68, выявляются вокруг микросфер проксимально, а фибробласты – дистально [5]. Многие авторы предлагают рассматривать макрофаги как ключевые клетки в реакции дермы на инородное тело, поскольку макрофаги индуцируют фибробласты к пролиферации и синтезу коллагена [6]. Макрофаги в условиях активации профибробластического фактора стимулируют локальные фибробласты к продукции экстрацеллюлярного матрикса, что в конечном итоге приводит к эффекту инкапсуляции имплантата. Закономерно возникает вопрос о количестве фибробластов и их функциональном статусе в эти сроки. Маркером этих клеток до этапа внеклеточного фибриллогенеза послужили в нашем исследовании проколлаген и виментин. Оказалось, что к сроку, соответствующему 2 неделям, в зоне вокруг имплантата формируется капсула из рыхлой соединительной ткани на поверхности, обращенной к дерме, и более плотной - на наружной стороне. Функционально активные по уровню экспрессии виментина клетки, располагаются по периферии имплантата, уровень содержания в них виментина высок. В одних клетках это фибриллы, а в других – плотные темно-коричневые гранулы, располагающиеся в зоне вокруг ядра и заполняющие многочисленные отростки клеток.
Выделяемые макрофагами факторы стимулируют также дифференцировку фибробластов в миофибробласты, последние характеризуются присутствием α-SMA. Одним из факторов увеличения объема экстрацеллюлярного матрикса является эффект, реализующийся в следующей последовательности: рекрутирование и стимуляция фибробластов к пролиферации и дифференцировке в миофибробласты. Миофибробласты инкапсулируют частицы ПК за счет образования коллагена III типа вокруг микросфер, с последующим отложением коллагена I типа в зоне капсулы. Некоторые также считают, что введение ПК приводит к образованию коллагена и развитию воспалительной реакции с изменением соотношения коллагенов I и III типов [7].
Заключение . Таким образом, полученные данные свидетельствуют, что ответная реакция дермы на имплантат полимолочной-α-кислоты носит фазный характер и начинается с воспалительной реакции с последующей инкапсуляцией введенного имплантата и фиброплазией, что и приводит к общему эффекту увеличения объема ткани. При этом конечный эффект достигается не только характером вводимого продукта, но и реакцией организма на его введение.
Авторы сообщают об отсутствии каких-либо конфликтов интересов при планировании, выполнении, финансировании и использовании результатов настоящего исследования.
Список литературы Иммуногистохимический профиль дермы при введении поли-молочной кислоты
- Stein P, Vitavska O, Kind P, Hoppe W, Wieczorek H, Schurer NY. The biological basis for poly-L-lactic acid-induced augmentation. Journal of Dermatological Science. 2015;(78):26-33. org/. DOI: 10.1016/j.jdermsci.2015.01.012
- Meleshina AV, Bystrova AS, Rogovaya OS, Vorotelyak EA, Vasiliev AV, Zagaynova EV. Tissue - Engineered Skin Constructs and application of Stem Cells for Creation of Skin equivalents. STM. 2017;9(1):198-2018. 10.17691/stm2017.9.1.24. org/10.17691/stm2017.9.1.24. DOI: 10.17691/stm2017.9.1.24.DOI
- Kiernan JA. Histological and Histochemical Methods: Theory and Practice. 5th edition, Scion Publishing; 2015.571 p. DOI: 10.5603/fhc.a2016.0007
- Junge K, Binnebosel M, Trotha K, Rosch R, Klinge U, Newmann U, Jansen P. Mesh biocompatibility: effects of cellular inflammation and tissue remodeling. Langenbecks Arch Surg. 2012;(397):255-270. DOI: 10.1007/s00423-011-0780-0
- Orazov МR, Sulaeva ОN, Satrkova ЕYu. Patogeneticheskie mechanism regeneracii dermi posle implantacii nitei na оsnove polydioxanona. Moskovskiy chirurgicheskyi zhurnal. 2017;4(56):13-28.
- Chang F. Shen Y. Ponnuswamy Mohanasundarametall. Vimentin coordinates fibroblast proliferation and keratinocyte differentiation in wound healing via TGF-β-Slug signaling. ProcNatlAcadSci USA. 2016;113(30):4320-4327. org/. DOI: 10.1073/pnas.1519197113
- Breithaupt A, Fitzgerald R. Collagen Stimulators Poly-L-Lactic Acid and Calcium Hydroxyl Apatite. Facial Plast Surg Clin North Am. 2015;23(4):459-69. DOI: 10.1016/j.fsc.2015.07.007


