Иммуногистохимическое исследование CD-3 лимфоцитов в соединительной ткани крупного рогатого скота при хроническом воспалении
Автор: Надеин К.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
Автором статьи проведено иммуногистохимическое исследование соединительной ткани крупного рогатого скота в норме и при хроническом воспалении. Выявлено повышение количества Т-лимфоцитов, которые локализуются в соединительной ткани.
Бурсит, иммуногистохимия, соединительная ткань, т-лимфоциты
Короткий адрес: https://sciup.org/14082221
IDR: 14082221 | УДК: 591.27
Текст научной статьи Иммуногистохимическое исследование CD-3 лимфоцитов в соединительной ткани крупного рогатого скота при хроническом воспалении
Иммуногистохимия – метод морфологической диагностики, в основе которого лежит визуализация и оценка с помощью микроскопа результатов реакции антиген-антитело в срезах биопсированной ткани. В качестве антигена выступают компоненты клеточных структур или межклеточного вещества ткани. Исследуемую ткань обычно обрабатывают антителами к антигену, который хотят в ней выявить. Затем обрабатывают антителами к диагностическим антителам. Эти антитела содержат либо краситель, либо энзим, которые затем могут быть легко выявлены.
Ценность иммуногистохимии заключается в том, что она базируется на строго специфических реакциях между диагностическими антителами и комплементарными им антигенами.
Способ окрашивания клеточных и тканевых компонентов с помощью специфических антител для микроскопического исследования был предложен в 1941 году. Антитела были мечены флюоресцирующей краской, что позволяло обнаружить комплекс тканевого антигена и диагностического антитела в гистологических срезах с помощью люминисцентного микроскопа. Следующий шаг в развитии иммуногистохимии был связан с разработкой антител, меченных не флюорохромами, а ферментами. Для обнаружения места связывания меченных ферментом антител применяют субстрат, в котором под воздействием ферментных меток образуются окрашенные продукты. Ферментные метки позволяют получить постоянные гистологические препараты, которые могут длительно храниться, и в которых результаты иммуногистохимической реакции точнее привязаны к структуре тканей [ 10, с. 47 ] .
Принципиальным отличием иммуногистохимии от других методов иммунологической диагностики, использующих реакцию антиген-антитело, является структурная специфичность исследования. Это означает, что в реакции оценивается не только наличие сигнала (есть окрашивание или нет) и его сила (интенсивность окрашивания), но и пространственное распределение сигнала в гистологическом препарате (окрашивание мембран клеток, цитоплазмы, ядра и других структурных элементов). По данным литературных источников, иммуногистохимические исследования в ветеринарии применяются для диагностики инфекционных болезней [ 7, с. 155; 9, с. 381 ] .
Наиболее часто в медицинской и ветеринарной практике встречаются диффузные болезни соединительной ткани (ДБСТ, или старое название – коллагенозы). Эта группа заболеваний, характеризующаяся системным поражением соединительной ткани, в том числе волокон, содержащих коллаген [1, с. 155]. У крупного рогатого скота преимущественно поражается голеностопный (тарсальный) сустав. Особенно часто данная патология наблюдается у животных с высокой молочной продуктивностью, что ведёт к значительному экономическому ущербу.
Преобладающим механизмом болезней СТ является дисрегуляция Т- и В-клеточных факторов иммунитета при наличии в крови избыточного содержания антигена, в том числе и аутоиммунного происхождения. Образующиеся комплексы антиген-антитело активируют свертывающую систему крови, откладываются на базальной мембране сосудов, кровоснабжающих органы и ткани (почки, синовиальные, серозные оболочки, мозг и т. п.); высвобождаемые при этом из фагоцитирующих клеток лизосомальные ферменты способствуют углублению поражения. Цитотоксическое действие оказывают фиксируемый иммунными комплексами комплемент, а также сенсибилизированные малые лимфоциты. В организме животных и человека Т-лимфоциты (CD3-лимфоциты) отвечают за реакции клеточного иммунитета и осуществляют иммунологический надзор за антигенным гомеостазом в организме. Они образуются в костном мозге и дифференцируются в вилочковой железе, где разделяются на эффекторные (Т-лимфоциты-киллеры, Т-лимфоциты гиперчувствительности замедленного типа) и регуляторные (Т-лимфоциты-хелперы, Т-лимфоциты-супрессоры) клетки. CD3-лимфоциты взаимодействуют с 24 кД белком Т-клеточного рецепторного комплекса. Они определяются как очаговое скопление в соединительной ткани в структуре воспалительного инфильтрата [2, с. 355] . Для понимания патогенеза и разработки тактики лечения ДБСТ крупного рогатого скота целесообразно изучение и сравнительный анализ происходящих морфологических изменений в суставной сумке тарсального сустава.
Цель исследований . Изучение местной реакции Т-лимфоцитов в соединительной ткани синовиальной сумки клинически здоровых и хронически больных животных.
Материалы и методы исследований. Материалом для исследований служила соединительная ткань суставных сумок, полученная после убоя здоровых и больных бурситом коров.
Контрольной группой служили клинически здоровые животные в количестве 30 голов (I группа), во второй (II) группе были животные, больные хроническим асептическим бурситом тарсального сустава (30 голов); длительность заболевания составляла свыше 1,5 месяцев. Животные находились в равноценных условиях кормления и содержания, больные животные лечились по одинаковой методике.
Иммуногистохимическое (ИГХ) исследование проводили в лаборатории морфологических исследований Всероссийского центра экстренной и радиационной медицины МЧС России (ВЦЭРМ МЧС России). Ткани синовиальной оболочки фиксировали в 10 % нейтральном формалине и заливали в парафин. Срезы толщиной 8–10 мкм обрабатывали набором антител фирмы «DAKO» к CD3 [3, с. 61] .
Протокол ИГХ исследований:
-
1. Прогревание парафиновых блоков в термостате при температуре 60°С в течение 30–60 мин.
-
2. Депарафинизация в ксилоле (3 мин х 2 раза), абсолютном спирте (3 мин х 2 раза), 96° этиловом спирте (3 мин х 2 раза).
-
3. Блокирование эндогенной пероксидазы в 3 % перекиси на воде.
-
4. Промывание в дистиллированной воде (3 мин).
-
5. Восстановление активности антигенов путём кипячения в цитратном буфере (рН 6,0) или в ЭДТА (рН 9,0) в водяной бане. Стёкла со срезами помещают в контейнер с буфером, прогревают до момента выравнивания температуры буфера и воды (95–99°С под контролем термометра) и выдерживают 30 мин, затем ещё 20 мин при комнатной температуре. Переносят в дистиллированную воду на 1–2 мин. Промывание в TBS (2 раза по 5 мин).
-
6. Инкубация с первичными антигенами (18 ч при температуре 6°С), разведёнными Antibody diluent (DAKO).
-
7. Инкубация с Envision mouse или Envision rabbit в зависимости от вида первичного антитела (30 мин при температуре 37°С. После этапов 8 и 9 – промывание в TBS (2 раза по 5 мин).
-
8. Реакция с DAB (3–5 мин под контролем микроскопа при комнатной температуре). Рабочий раствор DAB готовится путём добавления к 1 мл буфера 1 капли концентрированного хромогена согласно инструкции.
-
9. Смывание хромогена дистиллированной водой, промывание в дистиллированной воде в течение 3 мин.
-
10. Докрашивание ядер гематоксилином (2 мин). Подсинивание в проточной воде под контролем микроскопа.
-
11. Обезвоживание и заключение в бальзам с 96° спиртом (2 мин х 2 раза), карбол-ксилол (2 мин х 2 раза), ксилол (2 мин х 2 раза).
-
12. Заключение в бальзам.
Результаты исследований и их обсуждение. Полученные результаты представлены в таблице.
Содержание CD-3 лимфоцитов в соединительной ткани клинически здоровых животных (n = 30) и больных бурситом коров (n = 30)
|
Показатель |
Клинически здоровые животные (n = 30) |
Больные бурситом коровы (n = 30) |
|
CD-3 (%) |
18,8±1,14 |
37,5±0,64* |
* – р<0,001.
Как видно из табл., в соединительной ткани коров с хроническим воспалением выявлено достоверное увеличение содержания CD-3 лимфоцитов. При этом изменялась локализация клеток: в группе здоровых животных единичные CD3-позитивные клетки располагались преимущественно вокруг сосудов, в то время как у больных бурситом вся синовиальная оболочка была диффузно инфильтрирована CD3-позитивными лимфоцитами (рис. 1–2).
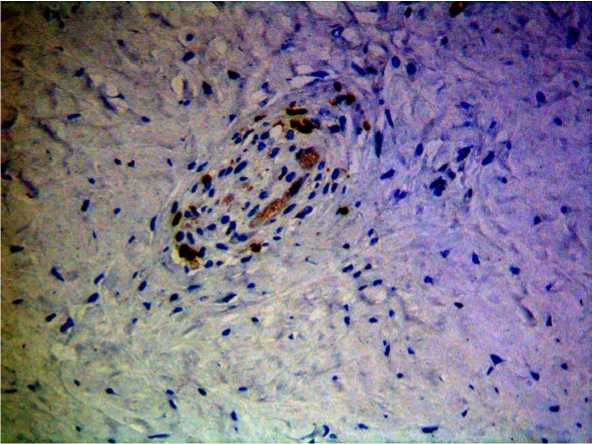
Рис. 1. СD3-позитивные Т-лимфоциты в синовиальной оболочке животных I группы. Увел. ×20
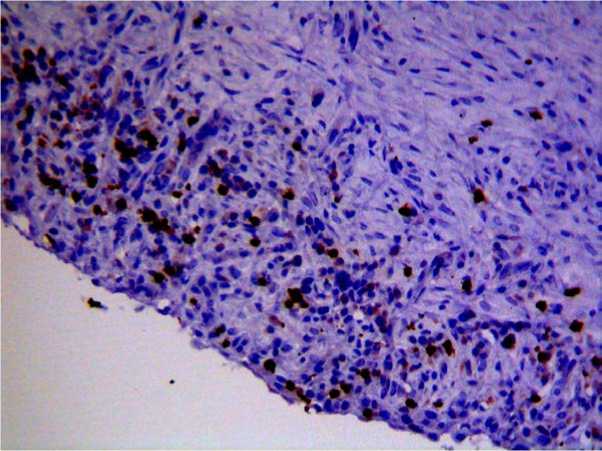
Рис. 2. СD-3-позитивные Т-лимфоциты в синовиальной оболочке животных II группы. Увел. ×20
Повышение количества СD-3 лимфоцитов указывает на гиперактивность иммунитета и наличие им-мунопролиферативных заболеваний в соединительной ткани.
Длительная активация Т-лимфоцитов может быть вызвана экзогенными антигенами и суперантигенами или изменёнными собственными белками (коллагеном, иммуноглобулинами) [5, с. 142]. Не исключено, что причиной воспаления служат перекрёстные реакции Т-лимфоцитов, сенсибилизированных к чужеродным антигенам различной природы с неизменёнными антигенами соединительной ткани синовиальной оболочки.
CD-3 обнаруживают отчётливую тенденцию к очаговому скоплению в воспалённой ткани. Ведущим фактором в подобной клеточной организации является массивный выброс хемокинов в очаге воспаления, в частности, бета-хемокинов, интенсивный диапедез клеток гематогенного происхождения, их активация и последующее распределение в очаге воспаления [4, с. 49; 6, с. 23] .
Таким образом, хроническое воспаление соединительной ткани крупного рогатого скота характеризуется повышением количества Т-лимфоцитов в патологически изменённой ткани.


