Иммуногистохимическое исследование MSH2, MSH6, PMS2, MLH1 в определении степени злокачественности аденокарциномы толстой кишки
Автор: Раскин Григорий Александрович, Петров Семен Венедиктович, Орлова Рашида Вахидовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
Микросателлитная нестабильность связана с нарушением функций генов MSH2, MLH1, PMS2 и MSH6, которые в норме осуществляют репарацию неспаренных нуклеотидов дНК. В настоящее время известно, что микросателлитная нестабильность - это независимый прогностический фактор, определяющий степень злокачественности рака толстой кишки. Использование иммуногистохимии для исследования системы репарации неспаренных нуклеотидов имеет свои особенности и ограничения. Материал и методы. В исследование вошло 39 больных аденокарциномой толстой кишки из них умереннодифференцированная аденокарцинома - 28 (72 %), высокодифференцированная аденокарцинома - 3 (8 %), низкодифференцированная аденокарцинома - 5 (12 %), муцинозная аденокарцинома - 3 (8 %) случая. Иммуногистохимически по стандартному протоколу исследовались белки генов MSH2, MSH6, PMS2, MLH1. Результаты. Из 39 исследованных случаев в 6 (15 %) наблюдениях было выявлено выпадение экспрессии как минимум одного из исследованных маркеров. Из 6 полученных случаев с косвенными признаками MSI-H три аденокарциномы были низкодифференцированными, 1 - муцинозной, 2 - умереннодифференцированными. Заключение. Иммуногистохимическое исследование генов репарации дНК может быть использовано для определения степени злокачественности аденокарциномы толстой кишки совместно с оценкой гистологической дифференцировки опухоли. При использовании только гистологической дифференцировки для определения степени злокачественности аденокарциномы толстой кишки в 10 % случаев она будет оценена неверно.
Микросателлитная нестабильность, аденокарцинома толстой кишки
Короткий адрес: https://sciup.org/14056584
IDR: 14056584 | УДК: 616.345-006.66-076:575.113
Текст научной статьи Иммуногистохимическое исследование MSH2, MSH6, PMS2, MLH1 в определении степени злокачественности аденокарциномы толстой кишки
Использование иммуногистохимических методов для исследования системы репарации неспаренных нуклеотидов имеет свои особенности и ограничения. В основном мутация MMR-генов сопровождается деградацией соответствующего белка и отрицательной иммуногистохимической реакцией. Иммуногистохимия, однако, не способна дифференцировать белок с миссенс-мутацией от дикого типа белка. Около 30 % случаев мутаций в MLH1 носят миссенс-характер, которые приводят к потере его функции, но сохраняют антигенные свойства [9]. Однако MMR-протеины функционируют в виде гетеродимеров [4]. MSH2 димеризуется с MSH6, образуя функциональный комплекс MutSα38, а MLH1 димеризуется с PMS2, формируя MutLα [3]. MLH1 – облигатный партнер PMS2, соответственно, нарушение структуры MLH1 приводит к разрушению димера и потере экспрессии второго белка. Однако мутации PMS2 и MSH6 не обязательно приводят к деградации их партнеров, потому что MLH1 и MSH2 могут альтернативно связываться с MSH3, MLH3 и PMS1. Тем не менее иммуногистохимическое исследование PMS2 позволяет выявлять миссенс-мутации MLH1, даже в условиях его антигенной сохранности [10]. Мутации же данных генов во всех исследованных случаях сопровождаются выпадением экспрессии исследованных генов, но не наоборот. Это связано с тем, что в ряде случаев негативная иммуногистохимическая реакция является отражением гиперметилирования исследованного гена.
Микросателлитная нестабильность связана с нарушением функций генов MSH2, MLH1, PMS2 и MSH6, которые в норме осуществляют репарацию неспаренных нуклеотидов ДНК [5–7]. В наших предыдущих исследованиях во всех случаях с негативной реакцией хотя бы на один из исследованных маркеров (MLH1, PMS2, MSH2, MSH6) наблюдалась микросателлитная нестабильность [1]. В настоящее время известно, что микро-сателлитная нестабильность – это независимый прогностический фактор, определяющий степень злокачественности рака толстой кишки [2].
Таблица 1
Характеристика антител к белкам генов репарации неспаренных нуклеотидов ДНК
|
Антитело |
Характеристика |
Разведение |
Фирма-производитель |
|
MSH6 |
Кроличье, клон EPR3945 |
1:200 |
Abcam |
|
MSH2 |
Мышиное, клон 25D12 |
1:20 |
DBS |
|
PMS2 |
Мышиное, клон MOR4G |
1:40 |
Novocastra Leica |
|
MLH1 |
Мышиное, клон ES05 |
1:25 |
Novocastra Leica |
Материал и методы
В исследование вошли 39 больных аденокарциномой толстой кишки, из них 26 женщин и 13 мужчин. Средний возраст составил 59 лет. Распределение по гистологической дифференцировке: умереннодифференцированная аденокарцинома – 28 (72 %), высокодифференцированная аденокарцинома – 3 (8 %), низкодифференцированная аденокарцинома – 5 (12 %), муцинозная аденокарцинома – 3 (8 %) случая.
Иммуногистохимическое исследование проводилось по стандартному протоколу: срезы с парафиновых блоков наносились на поли-L-лизиновые стекла с последующей инкубацией их при температуре 35–37°С в условиях термостата с целью плотного их прикрепления. Затем выполнялась депарафинизация материала в ксилоле, отмывка в 96 % и 70 % этиловых спиртах, дистиллированной воде. После этого проводилась демаскировка антигенов при температуре 96°С в буфере Antigen Retrieval Solution (DAKO), pH 9,0. Последовательно выполнялись ингибирование эндогенной пероксидазы 3 % перекисью водорода, инкубация первых антител к MSH2, MSH6, PMS2, MLH1 (табл. 1); выявление комплекса антиген – антитело осуществлялось при помощи системы визуализации DakoEnVision и диаминобензидина в качестве хромогена.
Окрашивание ядер осуществлялось при помощи гематоксилина Майера (инкубация была уменьшена в сравнении со стандартным протоколом). Оценивалась только ядерная реакция. Внутренним контролем была нормальная слизистая оболочка, прилежащая к аденокарциноме. Экспрессия считалась утраченной в случае, если более 50 % раковых клеток демонстрировали негативную реакцию. Отдельно отмечались случаи со сниженной экспрессией (менее 90 % клеток с позитивной реакцией).
Результаты исследования и обсуждение
Из 39 исследованных случаев в 6 (15 %) наблюдениях было выявлено выпадение экспрессии как минимум одного из исследованных маркеров (MSH2, MSH6, PMS2, MLH1) (рис. 1). В 4 случаях наблюдалась отрицательная иммуногистохимическая реакция на MLH1 и PMS2, а в 2 наблюдениях – на MSH6 и MSH2. Данный результат показывает, что 15 % изученных аденокарцином толстой кишки можно считать сцепленными с микросателлитной нестабильностью высокой степени (MSI-H). По данным N.M. Lindor et al. [8], при проведении исследования MSI и MMR с использованием иммуногистохимии и ПЦР потеря экспрессии MSH2 и MLH1 в 100 % случаев сопровождается микро-сателлитной нестабильностью высокой степени. В наших предыдущих исследованиях мы получили аналогичные результаты [1]. Это особенно важно, потому что, согласно современной классификации ВОЗ, считается, что аденокарцинома толстой кишки с MSI-H имеет низкую степень злокачественности, независимо от ее гистологической дифференцировки [2]. В наших наблюдениях из 6
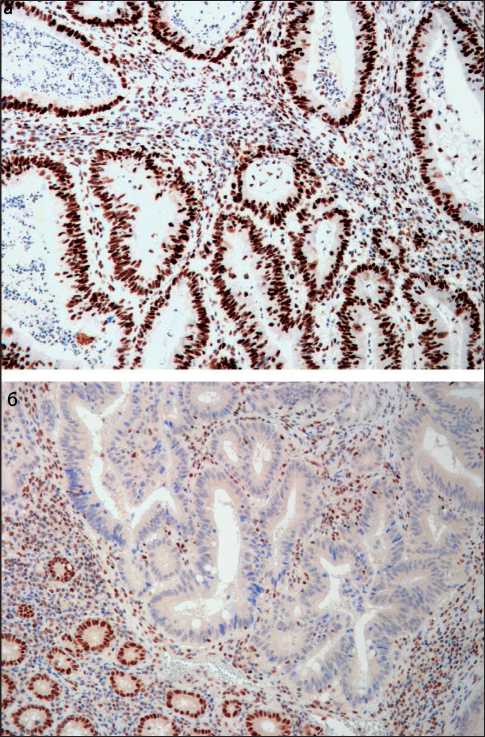
Рис. 1. Иммуногистохимическое исследование MSH6, MLH1 в аденокарциноме толстой кишки: а) интенсивная ядерная реакция на MSH6 в клетках аденокарциномы; б) выпадение экспрессии MLH1 в аденокарциноме (верхняя часть фотографии) в сравнении с сохранной ядерной реакцией в нормальной слизистой оболочке (нижняя часть снимка). ×200
Таблица 2
Распределение изученных случаев аденокарциномы толстой кишки по степени злокачественности в зависимости от использования критерия микросателлитной нестабильности
Заключение
Иммуногистохимическое исследование генов репарации ДНК совместно с оценкой гистологической дифференцировки опухоли может быть использовано для определения степени злокачественности аденокарциномы толстой кишки. Если использовать для определения степени злокачественности данной опухоли только гистологическую дифференцировку, то в 10 % случаев она будет оценена неверно.
Список литературы Иммуногистохимическое исследование MSH2, MSH6, PMS2, MLH1 в определении степени злокачественности аденокарциномы толстой кишки
- Раскин Г.А., Янус Г.А., Корнилов А.В., Орлова Р.В., Петров С.В., Протасова А.Э., Пожарисский К.М., Имянитов Е.Н. Иммуногистохимическое исследование MSH2, PMS2, MLH1, MSH6 в сопоставлении с анализом микросателлитной нестабильности в аденокарциноме толстой кишки//Вопросы онкологии. 2014. Т. 60, № 2. С. 47-50
- Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumors the digestive system. Lyon: IARC Press, 2010. 417 p
- Harfe B.D., Minesinger B.K., Jinks-Robertson S. Discrete in vivo roles for the MutL homologs MIh2p and MIh3p in the removal of frameshift intermediates in budding yeast//Curr. Biol. 2000.Vol. 10 (3). P. 145-148
- Kadyrov F.A., Dzantiev L., Constantin N., Modrich P. Endonucleolytic function of MutLalpha in human mismatch repair//Cell. 2006. Vol. 126 (2). P. 297-308
- Kamat N., Khidhir M.A., Alashari M.M., Rannug U. Microsatellite instability and loss of heterozygosity detected in middle-aged patients with sporadic colon cancer: A retrospective study//Oncol. Lett. 2013. Vol. 6 (5). P. 1413-1420
- Kheirelseid E.A., Miller N., Chang K.H., Curran C., Hennessey E., Sheehan M., Kerin M.J. Mismatch repair protein expression in colorectal cancer//J. Gastrointest. Oncol. 2013. Vol. 4. P. 397-408. doi: 10.3978/j. issn.2078-6891.2013.021
- Kinzler K.W., Vogelstein B. Lessons from hereditary colorectal cancer//Cell. 1996. Vol. 87 (2). P. 159-170
- Lindor N.M., Burgart L.J., Leontovich O., Goldberg R.M., Cunningham J.M., Sargent D.J., Walsh-Vockley C., Petersen G.M., Walsh M.D., Leggett B.A., Young J.P., Barker M.A., Jass J.R., Hopper J., Gallinger S., Bapat B., Redston M., Thibodeau S.N. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors//J. Clin. Oncol. 2002. Vol. 20 (4). P. 1043-1048
- Peltomaki P., Vasen H. Mutations associated with HNPCC predisposition -Update of ICG-HNPCC/INSiGHT mutation database//Dis. Markers. 2004. Vol. 20 (4-5). P. 269-276
- Shia J. Immunohistochemistry versus Microsatellite Instability Testing For Screening Colorectal Cancer Patients at Risk for Hereditary Nonpolyposis Colorectal Cancer Syndrome. Part I. The Utility of Immunohistochemistry//J. Mol. Diagn. 2008. Vol. 10 (4). P. 293-300 DOI: 10.2353/jmoldx.2008.080031


