Иммуногистохимическое исследование mTOR+-фибробластов в динамике развития и старения кожи человека
Автор: Голубцова Н.Н., Прокопьева Т.Н.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.32, 2024 года.
Бесплатный доступ
Путь мишени рапамицина у млекопитающих (mTOR) является важным клеточным сигнальным путем, участвующим в ряде важных физиологических функций, включая рост клеток, пролиферацию, метаболизм, синтез белка и аутофагию в ответ на различные внешние стимулы. Сигнальный путь mTOR существенно влияет на процессы старения в организме, регулируя клеточные функции и адаптацию к стрессовым условиям, но его значение для развития и физиологического старения кожи человека остается недостаточно изученным и открывает перспективы для дальнейших исследований. Цель исследования - изучение динамики изменений доли mTOR+-фибробластов в дерме человека в процессе развития и старения кожи и определение возможной роли mTOR в регуляции численности и пролиферативной активности фибробластов в процессе ее возрастных изменений. В качестве материала для исследования использованы 114 препаратов кожи случаев аутопсий различного возраста. Образцы кожи представляли собой аутоптаты нижней части передней поверхности шеи, полученные у плодов, начиная с 20 недели беременности, и людей, от рождения до 85 лет. MTOR+-, PCNA+- и виментин+-фибробласты изучали на фиксированных формалином срезах иммуногистохимическим методом. Полученные результаты позволяют заключить, что в коже плодов достоверно больше mTOR+-фибробластов, по сравнению с кожей людей от рождения до 85 лет. Доля фибробластов экспрессирующих mTOR в дерме человека статистически достоверно уменьшается с 20-недельного возраста до 60 лет с 95% до 78%, что доказывает значение фактора возраста в содержании mTOR+-фибробластов в дерме человека. В постнатальный период наблюдается постепенное уменьшение доли mTOR+-фибробластов. Отрицательная динамика возрастных изменений доли mTOR+-фибробластов в дерме начиная с фетального периода развития до 60 лет однонаправлена с возрастной динамикой общего числа и пролиферативной активности фибробластов. Таким образом, получены доказательства возрастной специфики участия mTOR в регуляции пролиферации фибробластов в дерме кожи человека.
Кожа, фибробласты, виментин, старение
Короткий адрес: https://sciup.org/143184757
IDR: 143184757 | DOI: 10.20340/mv-mn.2024.32(4).915
Текст научной статьи Иммуногистохимическое исследование mTOR+-фибробластов в динамике развития и старения кожи человека
Голубцова Н.Н., Прокопьева Т.Н. Иммуногистохимическое исследование MTOR+-фибробластов в динамике развития и старения кожи человека. Морфологические ведомости. 2024;32(4):915. (4).915
Golubtsova NN, Prokop'eva TN. Immunohistochemical study of MTOR+-fibroblasts in the human skin development and aging dynamics. Morfolo-gicheskie Vedomosti – Morphological newsletter. 2024;32(4):915. (4).915
Введение. Мишень рапамицина млекопитающих (далее mTOR, от англ. «mammalian target of rapamycin») принадлежит к семейству киназ, связанных с фосфатидилинозитол-3-киназой. Входными сигналами для этой серинтреониновой протеинкиназы служат факторы роста, уровень питательных веществ, энергетический статус клетки и стрессовые условия окружающей среды [1-2]. Являясь центральным регулятором клеточного гомеостаза, сигнальный путь mTOR позволяет клеткам адаптироваться к изменениям окружающей среды, влияя на метаболизм клеток и их пролиферацию. При этом активация mTOR ведет к синтезу белков, липидов, нуклеотидов и к росту клеток, тогда как ингибирование mTOR может приводить к аутофагии и снижению синтеза этих компонентов [3]. Однако, молекулярные механизмы посредством которых реализуются эти процессы с участием mTOR пока малоизуче-ны.
Регулирующие влияния mTOR осуществляются через два белковых комплекса: mTORC1 и mTORC2, которые отличаются структурой и внутриклеточной функцией [4]. mTORC1 (от англ. «mammalian target of rapamycin complex 1») представляет собой клеточный комплекс, состоящий из нескольких ключевых компонентов. Основным белком комплекса является mTOR [5-6]. К этому белку присоединяется Raptor (от англ. «regulatory-associated protein of mTOR»), который помогает mTOR распознавать и фосфорилировать специфические субстраты и таким образом участвовать в активации комплекса [5-6]. Также в состав mTORC1 входит белок mLST8 (от англ. «mammalian lethal with sec13 protein 8»), который стабилизирует комплекс и поддерживает его активное состояние. Следующим компонентом комплекса является PRAS40 (от англ. «proline-rich akt substrate of 40 kDa»), который регулирует активность mTORC1 и может действовать как ингибитор. Еще один компонент -Deptor (от англ. «DEP domain-containing mTOR-interacting protein»), выступает в качестве отрицательного регулятора mTOR и способен подавлять его активность.
mTORC1 характеризуется полифункциональностью в отношении клеточных процессов. Одна из его активностей направлена на регуляцию синтеза белка. mTORC1 также регулирует метаболизм аминокислот и уровень энергии в клетке, активируясь при наличии питательных веществ и отвечая на уровень клеточной энергии, что позволяет клетке адаптироваться к изменениям в ее окружении. Важной функцией mTORC1 является подавление аутофагии, что позволяет клеткам сохранять компоненты, предотвращая разрушение клеточных структур [7-8].
Второй белковый комплекс, названный mTORC2 (от англ. «mammalian target of rapamycin complex 2») состоит из mTOR, который является центральным элементом комплекса и действует как серин-треониновая киназа. Вторым важным компонентом является Rictor (от англ. «rapamycin-insensitive companion of mTOR), который связывается с mTOR и способствует формированию активной структуры комплекса, обеспечивает регуляцию активности mTORC2 и его взаимодействие с другими молекулами. Еще одним структурным элементом комплекса является mLST8, его активность стабилизирует и поддерживает активность комплекса mTORC2. SIN1 (от англ. «SAPK-interacting protein1»), выступает в роли адаптерного белка и взаимодействует с mTOR и Rictor, способствуя их функциональной активности [4-5]. Также в состав mTORC2 входит Protor (от англ. «protein target of rapamycin») – это адаптерный белок, помогающий в стабилизации структуры mTORC2 и участвующий в передаче сигналов в различные клеточные пути.
Комплекс mTORC2 активно влияет на организацию актинового цитоскелета, что важно для клеточной подвижности, морфологии и способности клеток к миграции. Эта регуляция осуществляется через активацию молекул, которые модифицируют структуру и динамику актиновых филаментов. Другой важной функцией mTORC2 является активизация протеинкиназы В (Akt). Активация Akt способствует клеточной выживаемости, росту и метаболическим процессам, регулируя такие ключевые аспекты, как клеточная пролиферация и апоптоз. Кроме того, mTORC2 активирует и другие молекулы, включая серин-треонин протеин-киназу 1 и протеинкиназу C. По данным некоторых авторов, эти молекулы участвуют в различных клеточных сигнальных путях, которые не вовлечены в mTORC1, предоставляя mTORC2 уникальную способность управлять различными аспектами клеточных функций [9]. Комплекс mTORC2 менее чувствителен к рапами-цину, но его активность также может быть косвенно подавлена длительным применением этого препарата [10].
На основании исследований последних лет, mTOR не только регулирует важные онтогенетические процессы, но и оказывает значительное влияние на пролиферацию клеток в различных патологических состояниях, таких как опухолевые заболевания и старение. Ингибирование активности mТОR индуцирует продление жизни у дрожжей, червей, мух и мышей [11-12]. Согласно результатам ранее проведенных нами исследований, процесс старения кожи человека во многом обусловлен уменьшением численности фибробластов в дерме, которое отчасти связано со снижением их пролиферативной активности [13]. Учитывая данные мировой литературы, мы выдвинули гипотезу о возможном участии mTOR в регуляции антенатального развития и постнатальных возрастных изменений в коже человека. Следует отметить, что к настоящему времени данные по локализации и содержанию mTOR в коже человека в возрастном аспекте отсутствуют.
Цель исследования: изучение динамики изменений доли mTOR+ фибробластов в дерме человека в процессе развития и старения кожи и определение возможной роли mTOR в регуляции численности и пролиферативной активности фибробластов в дерме человека в процессе возрастных изменений.
Материалы и методы исследования. Исследование проводили в широком возрастном диапазоне, начиная с 20 недель пренатального развития и закан- чивая 85 годами постнатального. Проведение исследования одобрено локальным этическим комитетом Чувашского государственного университета имени И.Н. Ульянова (протокол № 4 от 15.11.2021). Материалом исследования были 114 аутопсий кожи человека (верхний угол стандартного разреза кожи при патологоанатомическом исследовании). Формалин-фиксированные образцы кожи проходили гистологическую проводку и заливку в парафин по стандартному протоколу. Далее из них изготавливали поперечные срезы в направлении эпидермис-дерма толщиной 5 мкм с помощью ротационного микротома Thermo Scientific.
Все гистологические срезы кожи окрашивали гематоксилином-эозином и применяли иммуногистохимический метод окрашивания с целью выявления кожных структур с экспрессией mTOR, PCNA и виментина. Поликлональные кроличьи антитела к mTOR (NBP1-02454, Novus Biologicals Inc., США) в разведении 1:50, кроличьи поликлональные антитела против PCNA (AHP1419, AbD Serotec, Великобритания) в разведении 1:100, кроличьи поликлональные антитела к виментину (GTX100619, GeneTex, США) в разведении 1:50 применяли в качестве первичных антител [14]. Кроличью полимерную визуализирующую систему, конъюгированную с пероксидазой (GTX83399, GeneTex, США) использовали в качестве вторичных антител. Активность пероксидазы выявляли с помощью перекиси водорода и диаминобензидина (Sigma Chemical Co., США). Структуры, имеющие иммунопозитивную реакцию, имели коричневый цвет. Нормальную кроличью сыворотку в концентрации 1% использовали для контроля специфичности окрашивания Количественный и качественный морфологический анализ окрашенных препаратов проводили с помощью микроскопа Nikon Eclipse 200 и камеры DS-Ri2. Каждый срез фотографировали при 400-кратном увеличении микроскопа как минимум в 3-х случайно выбранных полях зрения. Далее с помощью программы NIS-Elements Br («Nikon», Япония) в каждом из 342 случаев определяли площадь анализируемых участков срезов, подсчитывали в них об- щее число положительно окрашенных на виментин фибробластов и вычисляли число виментин+-фибробластов на 1 мм2 ткани дермы. Подсчитывая численность фибробластов дермы на 1 мм2 ткани дермы негативных и позитивных к mTOR и PCNA, вычисляли долю фибробластов с положительным окрашиванием к этим маркерам.
Все образы разделили на пять групп по возрасту (табл. 1). В настоящем исследовании мы не учитывали половую принадлежность используемых образцов при формировании групп, предварительный анализ с учетом биологического пола показал отсутствие значимого (p<0,05) влияния данного фактора на изменение доли mTOR+-, PCNA+- и виментин+-фибробластов в дерме кожи человека.
Таблица 1 Распределение исследованных групп по возрасту
|
Наименование |
Возраст |
Число образцов, шт. |
|
Группа 1 |
20 – 40 недель |
17 |
|
Группа 2 |
0 - 20 лет |
23 |
|
Группа 3 |
21 - 40 лет |
26 |
|
Группа 4 |
41 - 60 лет |
23 |
|
Группа 5 |
61 - 85 лет |
25 |
Рис. 1. Микрофото гистологического препарата кожи плода 27 недель разыития. mTOR+-фибробласты. Окр.: см. в тексте. Ув.: х400.
По каждой группе данных рассчитывали средние доли (P) и ошибки долей (p m ), среднюю арифметическую (M) и стандартную ошибку (m). Достоверность влияния возраста или пола на исследуемые параметры кожи оценивали с помощью однофакторного дисперсионного анализа для соответствующих величин. Достоверность отличий между содержанием mTOR+-фибробластов на мм2 в разных возрастных группах оценивали по t-критерию Стюдента. Достоверными считали отличия при р<0,05.
Результаты и обсуждение. Полученные результаты позволяют заключить, что положительную экспрессию mTOR имели кератиноциты, фибробласты, эпителиоциты концевых отделов желез кожи и эндотелиоциты кровеносных сосудов во все изученные возрастные периоды (рис. 1-3).
Рис. 2. Микрофото гистологического препарата кожи мужчины 17 лет. mTOR+-фибробласты. Окр.: см. в тексте. Ув.: х400.
Рис. 3. Микрофото гистологического препарата кожи женщины 55 лет. mTOR+-фибробласты. Окр.: см. в тексте. Ув.: х400
Количественная оценка показала, что 95,1±0,78% фибробластов дермы в 1-й группе плодов 20-40 недель развития были mTOR+ (рис. 4). Таким образом, в антенатальный период, соответствующий гистогенезу кожи человека, преобладающее число фибробластов дермы экспрессируют mTOR. Полученные результаты свидетельствует о значительной роли данного белка в процессе пренатального онтогенеза и согласуются с ключевой ролью mTOR в выживании клеток [2, 8]. Доля фибробластов дермы экспрессирующих mTOR во 2-й возрастной группе, объединяющей аутопсии кожи от рождения до 20 лет, составила 86,4±1,42% (рис. 4). Изменения в численности фибробластов, имеющих положительное окрашивание к mTOR между 1-й и 2-й группами имели статистическую достоверность (p<0,05).
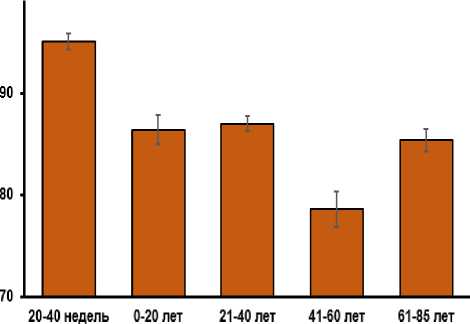
беременности
Рис. 4. Диаграмма долей mTOR+-фибробластов по отношению к общему числу фибробластов в дерме плодов человека и людей разного возраста
В возрастном интервале от 21 до 40 лет (3-я группа) доля фибробластов с положительной окраской к mTOR не имела отличий по сравнению с предыдущим возрастным периодом от 0 до 20 лет (2-я группа) и составила 86,9±0,72% (p>0,05, рис. 4). Доля фибробластов c положительным окрашиванием к mTOR в дерме кожи людей 4-й группы от 41 до 60 лет уменьшилась и составила 78,6±1,75% (рис. 4). Данное значение было статистически достоверным по отношению к 3-й группе 2140 лет (p<0,05). Таким образом, сразу после рождения и до 60 лет мы наблюдали негативную динамику в содержании mTOR+ фибробластов по отношению к общему числу фибробластов в дерме кожи человека. После достижения 60-летнего возраста и до 85 лет содержание mTOR+-фибробластов в дерме человека достоверно увеличилось до 85,4±1,09% (рис. 4), что статистически достоверно превышает параметры характерные для 4-й группы (p<0,05). Результаты дисперсионного анализа подтвердили достоверное влияние возраста на изменение доли mTOR+-фибробластов в дерме человека.
Мы провели подсчет количества клеток с характерным морфологическим строением фибробластов на 1 мм2 дермы имеющих положительное окрашивание к виментину - маркеру промежуточных филаментов соединительнотканных клеток. Количественная оценка доказала постепенное и неуклонное снижение содержания дермальных фибробластов с увеличением возраста. В постнатальном онтогенезе можно выделить два периода: первый, сразу после рождения и до 40 лет, когда происходит наиболее существенное снижение численности фибробластов в дерме и количество клеток фибробластического ряда уменьшается в 3,4 раза по сравнению с фетальным периодом. Второй, начинается после 41 года и продолжается до 85 лет, когда общее число фибробластов в дерме уменьшается незначительно [13]. Достоверное влияние возраста на численность фибробластов в дерме подтверждено дисперсионным анализом.
Некоторыми авторами были получены доказательства уменьшения количества пролиферирующих фибробластов с возрастом [13]. Нами также была подсчитана доля пролиферирующих фибробластов, экспрессирующих PCNA, по отношению к общему числу фибробластов дермы. В возрасте до 40 лет мы наблюдали наибольшее снижение PCNA+-фибробластов в дерме. После 41 года доля фибробластов с экспрессией ядерного антигена пролиферирующих клеток изменялась на уровне тенденции. Влияние возраста на изменение количества имму-нопозитивных к PCNA фибробластов в дерме было статистически значимо по данным дисперсионного анализа (p<0,001).
Подводя итог, можно сделать заключение о том, что доля mTOR+-фибробластов в дерме человека уменьшается с 20 недель беременности до 60 лет. Также мы наблюдали то, что с внутриутробного периода до 85 лет прогрессивно уменьшается общее число фибробластов и доля фибробластов иммунопозитивных к PCNA. Таким образом, динамика изменений содержания mTOR+- фибробластов в период с 20 недель развития до 85 лет частично согласуется с изменениями общего содержания фибробластов и доли PCNA + -фибробластов. В связи с этим можно предположить, что механизм потенциального участия mTOR в регуляции пролиферативной активности дермальных фибробластов зависит от возраста.
Ключевая роль mTOR в клеточном старении связывает старение клеток и организма с возрастными изменениями [15]. Усиленная передача сигналов PI3K/Akt индуцирует клеточное старение через p53-зависимый путь, переводя его в состояние покоя [1, 11]. В этих, склонных к покою, клетках р53 ингибирует путь mTOR, который участвует в программе возрастных изменений [16]. mTOR активирует S6K (ген старения) и подавляет функцию 4E-BP (ген долголетия).
Известно, что mTOR обладает способностью как стимулировать, так и тормозить пролиферацию фибробластов разных локализаций при патологии, включая фибробласты дермы [5], причем экспрессия mTOR, PI3K/Akt в фибробластах при патологических процессах значительно выше, чем в нормальной ткани кожи [17]. В антенатальный период онтогенеза mTOR контролирует накопление биомассы и метаболизм, модулируя ключевые клеточные процессы, включая синтез белка и аутофагию [8]. Вероятно, сразу после рождения включаются механизмы, которые не позволяют далее сохранять повышенный уровень mTOR для поддерживания пролиферации фибробластов. В результате уровень mTOR снижается и продолжает снижаться пролиферативная активность и общее число фибробластов в дерме.
Эффекты mTOR по ингибированию пролиферации фибробластов могут опосредовать ламинин а5 [9], PCNA, TGF-в1 [19]. Сигнальный путь mTOR может опосредовать аутофагию и апоптоз [11]. На примере старения дермы было показано, что активация аутофагии способствует ингибированию фотостарения посредством ингибирования сигнализации PI3K/AKT/mTORC1 [18-19]. Напротив, подавление аутофагии или усиление регуляции mTOR способствует фотостарению [18-20]. Следовательно, можно предположить, что снижение пролиферативной активности фибробластов дермы, наблюдаемое с внутриутробного периода, приводит к компенсаторному снижению содержания mTOR, в том числе в результате уменьшения общей функциональной активности фибробластов. Возможно, mTOR не может реализовать свои эффекты по стимулированию пролиферации с возрастом из-за нарушения в работе вспомогательных белков RAPTOR и RICTOR [1, 14] или есть влияние других регуляторных систем. Однако точные механизмы возрастных изменений доли mTOR позитивных фибробластов и значение mTOR для возрастной регуляции пролиферации клеток дермы остаются неизвестными и требуют дальнейшего изучения.
Заключение. Доля фибробластов экспрессирующих mTOR в дерме человека статистически достоверно уменьшается с 20 недель пренатального развития до 60 лет с 95% до 78%, что доказывает значение возрастного критерия для содержания mTOR-позитивных фибробластов в дерме человека. В постнатальный период наблюдается постепенное уменьшение доли mTOR+-фибробластов. Отрицательная динамика возрастных изменений доли mTOR+-фибробластов в дерме от внутриутробного фетального периода до 60 лет однонаправлена с возрастной динамикой общего числа и пролиферативной активности фибробластов. Таким образом, получены доказательства возрастной специфики участия mTOR в регуляции пролиферации фибробластов в дерме кожи человека.


