Иммунологические и морфологические аспекты диагностики инфекции Helicobacter pylori и вирусов семейства Herpesviridae
Автор: Дудаева Н.Г., Гречушников В.Б., Бугаева И.О., Тарасова Г.Н., Головачева Т.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.6, 2010 года.
Бесплатный доступ
Обследованы 100 пациентов с воспалительными заболеваниями желудочно-кишечного тракта (ЖКТ). Методом полимеразной цепной реакции (ПЦР) определяли микробную составляющую воспалительного процесса: исследовали мононуклеарные клетки (МНК) периферической крови на наличие этиологического микробного фактора. Обнаружено микстинфицирование слизистой оболочки ЖКТ H.pylori и Herpesviridae при заболеваниях гастро-дуоденальной зоны и наличие фрагментов генома этих микроорганизмов в МНК периферической крови, что может иметь существенное значение в патогенезе заболеваний ЖКТ и является основанием для дальнейшего изучения
Мононуклеарные клетки периферической крови, патология жкт
Короткий адрес: https://sciup.org/14917078
IDR: 14917078
Текст научной статьи Иммунологические и морфологические аспекты диагностики инфекции Helicobacter pylori и вирусов семейства Herpesviridae
Согласно рекомендациям Американской коллегии гастроэнтерологов (2005) и Европейской группы по изучению H.pylori («Маастрихт-3», 2005г.) диагноз инфекции H.p. должен устанавли в аться преимущественно неинвазивными методами диагностики [1].
Несмотря на значительные достижения в диагностике и лечении Н.р.-ассоциированных заболеваний сохраняются проблемы верификации бактерии. Нередко выявление Н.р.-инфекции проводится лишь одним из лабораторных методов. Наиболее популярными являются иммуноферментный анализ (ИФА) и полимеразная цепная реакция (ПЦР). Однако они не являются абсолютными, дающими максимально объективные результаты.
Достоверная и своевременная диагностика H.p. позволяет избежать необоснованного назначения антибактериальных препаратов, а также адекватно контролировать проводимую антихеликобактерную терапию. Несмотря на большое количество методов определения H.p-инфекции постоянно идет поиск и модификация неинвазивных или малоинвазивных способов диагностики этой инфекции [2, 3].
ткани, ассоциированной со слизистой (MALT), в сочетании с H.p. и в неповрежденной СО [7]. Есть данные о том, что варицелла зостер вирус (ВЗВ) может быть причиной развития необъясненной патологии органов пищеварения, в том числе и гастритов [8].
Не так давно идентифицированы новые вирусы группы герпеса: вирус герпеса 6 типа (ВГЧ-6), – 7 типа (ВГЧ-7) и 8 типа (ВГЧ-8). Роль этих вирусов в патологии человека обсуждается. Однако уже известно, что они играют определенную роль в усилении пролиферативных процессов. Эти вирусы так же обнаруживаются в СО ЖКТ как при патологии, так и в неизмененной ткани [9].
Интересными представляются данные о «вне-желудочных проявлениях», обусловленных инфекцией H.p. Опубликованы результаты клинических и экспериментальных работ, в которых показано присутствие фрагментов генома H.p. в атеросклеротических бляшках кровеносных сосудов [10]. В этой связи представляет определенный интерес изучение вопроса о присутствии фрагментов ДНК H.p. в моно-нуклеарных клетках (МНК).
В связи с вышеизложенным, целью нашего исследования явилось изучение вирусов группы герпеса в СО гастродуоденальной области, а также определение фрагментов ДНК H.p. в МНК периферической крови у пациентов с верифицированной инфекцией H.p.
Присутствие микроорганизма в СОЖ определяли в биопсийном материале методом полимеразной цепной реакции (ПЦР) с использованием коммерческих наборов «Хеликопол», НПФ «Литех» (Россия) на наличие участков генома H.р.. (ure С, cag A-, vac A-генов). В клеточных суспензиях методом ПЦР определяли фрагменты генома (ure C, vac m1, ice a1, bab a1), кодирующие факторы патогенности микроорганизма (использование тест-систем производства НПФ «Литех»). Ферментативную активность Н.р. в биоптате определяли с помощью уреазного теста «H.pylori Quick Test» (Финляндия).
Для определения иммуноглобулинов в периферической крови, специфических к Н.pylori, использовали ИФА тест-системы Euroimmune ( I g A , IgG) , Германия, и «Хелико-Бест антитела» (суммарные антитела к Cag A белку). Кроме того, методом ПЦР исследовали МНК периферической крови на носительство ДНК Н.рylori с использованием указанных наборов для ПЦР. МНК периферической крови, выделяли на градиенте плотности фиколл-урографин (с=1,077) и разделяли на субпопуляции CD4, CD8, CD25 методом иммуномагнитной сепарации, реактивами фирмы «Dynal» (Норвегия).
Для обнаружения вирусов – ВЗВ, ЭБВ, ЦМВ, вирусов герпеса человека 6,-7,-8 типов (ВГЧ-6,-7,-8) использовали готовые наборы фирм-производителей: «Амплисенс», «Биоком», «Литех», «ДНК-технология» (Москва); «Вектор-Бест» (Новосибирск). Амплификацию проводили на амплификаторах «Терцик» («ДНК-технология», Москва).
Статистический анализ результатов исследования проводили с использованием общепринятых методов. Достоверность различий определяли с использованием критерия Краскелла-Уоллеса. Коэффициент корреляции определяли по методу ранговой корреляции Спирмена.
Результаты. При определении специфических антител к H.p. было получено, что группа больных с деструктивными поражениями СОЖ достоверно отличалась от группы с поверхностными изменениями СОЖ по суммарным антителам к Cag A белку (средний индекс позитивности по группам составил 9,4 и 7,5 соответственно, р<0,05). По IgA и IgG отмечалось достоверное различие в зависимости от вида повреждения СОЖ (р< 0,01).
Определение ДНК Н.p в МНК периферической крови дало положительные результаты в 1 группе больных в 20% случаев и во 2 группе – в 49,5 %. При этом, частота определения генов cag A была выше при поверхностном воспалении, а ген vac Аs 1 и vac As2 чаще определялся в группе с деструктивными изменениями (рис. 1).
В МНК периферической крови, полученных от пациентов с различной степенью деструкции (эрозивные и язвенные изменения) СО гастро – дуоденальной зоны, фрагменты генома ure C, ice a1 и bab a1 в общей популяции МНК были обнаружены у всех пациентов. В субпопуляции CD4 фраг м енты ice a1 обнаружены у 42,9%, bab a1 – у 57,1%. В клетк а х с фенотипом CD8 обнаружили фрагмент ice a1 у 42,9%, причем одновременное нахождение этого гена в CD4 и CD8 клет к ах было только в 28,6% случаев. В суспензии клеток с фенотипом CD25 обнаруживали только фрагмент bab a1 у 47,6% пациентов. Одновременное присутствие фрагментов ice a1 и bab a1 в CD4, CD8 и CD25 наблюдалось у 60% пациентов (рис. 2).
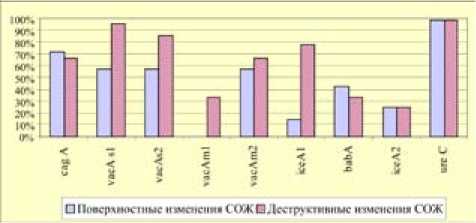
Рис. 1 . Частота встречаемости генов патогенности H.p. в МНК периферической крови
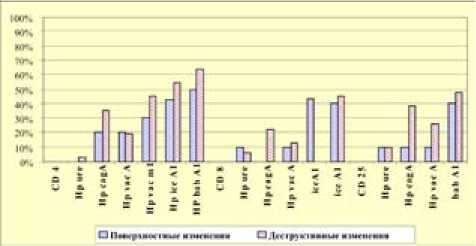
Рис. 2. Частота встречаемости фрагментов генома H.p. в субпопуляциях МНК периферической крови

Результаты ПЦР в биоптатах и Quick Test полностью совпадали. Во всех случаях обнаружения H.p. в СО присутствовал фрагмент генома, кодирующий С-субъединицу уреазы (ure C) .
При деструктивных воспалительных процессах (2 группа) наиболее часто определяли наличие более агрессивных штаммов Н.р ( cagA+vacA+). При этом частота обнаружения агрессивных штаммов инфекции имела четкую положительную корреляцию со степенью повреждения СО (r = 0,8). У пациентов с деструкцией СО H.p. был обнаружен у 95% пациентов, из них в 80% случаев определяли ульцероген-ный (cagA+vacA+) штамм. В группе с поверхностным гастритом (1 группа) инфицирование СО H.pylori было обнаружено у 64 % пациентов, однако из них у 35,7 % обнаружили cagA- vacA- штамм Н.р., а cagA-vacA+ и cagA+vacA+ в 13,8 % и 14,5 % соответственно (рис. 3).
Положительные результаты ИФА при отрицательных данных на Н.р., при исследовании биоптата методом ПЦР и Quick Test, были получены у 5 па ц иентов из первой группы (11%) и у 6 – из второй (17,6%), что можно было объяснить следовыми реакциями на ранее перенесенную Н.р. инфекцию.
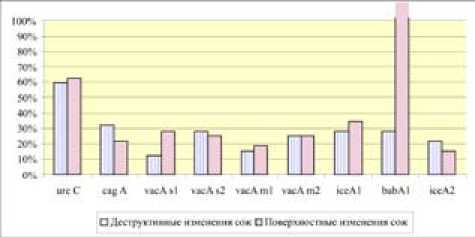
Рис. 4. Частота встречаемости генов патогенности H.p. в биоптате СОЖ
0Н!»1« В1ИЧ' > О АВ П(ЧЧ* В11ГЧ ? BlU'M QILMK
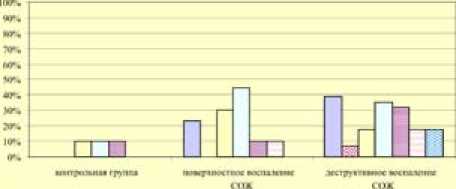
Рис. 5. Частота обнаружения вирусов Herpesviridae в СОЖ
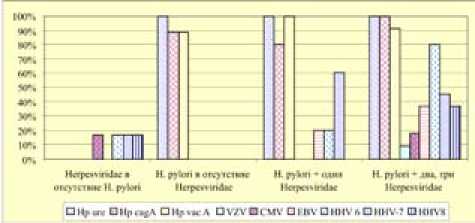
Рис. 6. Частота обнаружения микроорганизмов при различных типах инфицирования СОЖ
Изучение генов патогенности H.p. в биоптатах показало различную частоту их встречаемости при поверхностных и деструктивных изменениях СОЖ (рис. 4).
При исследовании биопсийного материала, полученного при гастроскопии, методом ПЦР ВПГ-1 и ВПГ-2 ни у одного пациента обнаружено не было. Вероятно, это объясняется небольшим объемом выборки. Частота обнаружения других представителей вирусов герпеса была следующая. У пациентов при отсутствии жалоб со стороны ЖКТ и без изменений СО по данным эндоскопии и гистологических изменений (контрольная группа) были обнаружены только ВЭБ – 10% случаев, а также вирусы герпеса человека 6 типа (ВГЧ-6) и 7 типа (ВГЧ-7) в 10% случаев каждый. При поверхностном воспалении ВЭБ обнаруживали в 30% случаев, ВГЧ-6 в 44,4% случаев, а вирусы герпеса человека 7 и 8 типов (ВГЧ-7, -8) в 10% случаев соответственно. При деструктивных изменениях СО частота встречаемости составила: ВЗВ – 7,1%, ВЭБ – 17,6%, ЦМВ – 14,3%, ВГЧ-6 – 35,3%. ВГЧ-7 – 32,4%, ВГЧ-8 – 17,5% (рис. 5).
При изучении типа инфицирования СО вирусами герпеса и H.p. были выявлены различные сочетания бактериально-вирусной контаминации и частоты встречаемости микроорганизмов: моноинфицирова- ние H.p., моноинфицирование вирусами герпеса и микст-инфицирование H.p. и одним или несколькими представителям Herpesviridae (рис. 6).
Обсуждение. Данные исследования подтверждают, что ведущий вклад в развитие хронических воспалительных заболеваний гастродуоденальной области, безусловно, вносит H. p и, в первую очередь, ее патогенные штаммы. Частота их выявления, а так же уровни специфических антител прямо связаны с характером и глубиной поражения СО.
Имеет место несовпадение результатов серологической диагностики хеликобактериоза методом ИФА и исследований биопсийного материала этих же пациентов методами ПЦР и быстрым уреазным тестом (Quick Test). Вероятно, это явление связано со следовыми реакциями на ранее перенесенную Н.р.-инфекцию.
Несомненно, что вирусы герпеса не только принимают участие в патологическом процессе, но и развивают его по провоспалительному типу. Неэффективность традиционных схем эрадикации H.p. в большинстве случаев и достаточно частые рецидивы заболевания могут быть, обусловлены присутствием вирусов в очаге воспаления, которые направляют и развивают воспалительный процесс «по замкнутому кругу», создавая условия, благоприятные для длительной персистенции H.р. и других патогенных микроорганизмов.
Наличие в МНК фрагментов генома H.p., в частности генов, кодирующих экспрессию цитотоксических и адгезивных белков микроорганизма, в настоящее время объяснить достаточно сложно. Тем не менее, этот факт, вероятно, свидетельствует о вовлечении в инфекционный процесс при хеликобактериозе организма в целом, а не ограничивается только поражением СО ЖКТ.
Поскольку известна роль вирусов, в частности вирусов группы герпеса, в патологии ЖКТ и их совместной персистенции с H.p. на СО логично предположение, что вирусы могут являться вектором доставки генетического материала H.p. в мигрирующие иммунокомпетентные клетки. С другой стороны, H.p. может локализоваться на поверхности клеток посредством молекул адгезии ICAM-1, относящегося к суперсемейству иммуноглобулинов и служащего лигандом для в2-интегринов (LFA-1, Mac-1). Известно, что последние экспрессируются на лейкоцитах, эндотелии сосудов, фибробластах, эпителии [9].
Заключение.
-
1. Данные исследования подтвержда ю т, что ведущий вклад в развитие хронических воспалительных заболеваний гастродуоденальной области, безусловно, вносит H. p. и, в первую очередь, ее пато г енные штаммы. Частота их выявления, а так же уровни специфических антител прямо связаны с характером и глубиной поражения СО.
-
2. Несовпадение результатов серологической диагностики хеликобактериоза методом ИФА, ПЦР и быстрым уреазным тестом (Quick Test) связано
-
3. Нефагоцитирующие клетки (CD4+, CD8+) могут являться носителями участков генома H.p. При этом часть из них является активированными клетками, экспрессирющими рецептор к интерлейкину-2 (CD25+). Аналогичные д анные получены в суспензиях клеток, выделенных из биопсийного материала.
-
4. H.р. и герпесвирусная инфекция приводят к прогрессирующей деструкции СО гастродуоденальной области, создавая условия, благоприятные для длительной персистенции H.р. и других патогенных микроорганизмов.
-
5. Вирусы группы герпеса, вероятно, принимают непосредственное участие в патогенезе развития гастритов и язвенной болезни ЖКТ. Чем глубже степень повреждения СО, тем чаще и в более разнообразном сочетании определяются представители Herpesviri-dae и патогенные штаммы H. р.
со следовыми реакциями на ранее перенесенную Н.рylori инфекцию. Обнаружение фрагментов генома H.p. в МНК возможно отражает системную реакцию организма на H.p.
Список литературы Иммунологические и морфологические аспекты диагностики инфекции Helicobacter pylori и вирусов семейства Herpesviridae
- Исаков В.А. Маастрихт-3 -2005: Флорентийская мозаика противоречий и компромиссов//Экспер. и клин. гастро-энтерол. 2006. № 1. С. 78-83.
- Баранская Е.К., Ивашкин В.Т., Лапшин А.В. и др. Диагностическое значение лазерного 13 С-уреазного дыхательного теста при различных Helicobacterpylori ассоциированных заболеваниях//Клин. мед. 2006. № 8. С. 47.
- Губергриц Н.Б., Синяченко О.В., Белоконь Т.М. и др. Новые неинвазивные тесты для диагностики инфекции Helicobacterpylori//Сучасна гастроентерологя. 2004. № 2. С. 24-32
- Tsamakidis К., Panotopoulou Е., DimitroulopoulosD. etal. Herpessimplexvirustype 1 inpepticulcerdisease: aninverseassociationwithHelicobacterpylori//WorldJGastroenterol. 2005. №11 (42). Р. 6644-6649.
- Yokose N., Tanabe Y.E. An et al. Acute gastric mucosal lesions associated with cytomegalovirus infection in a non-immu-nocompromised host//Intern Med. 1995. № 34 (9). Р.883-5.
- Leimola-Virtanen R., Happonen P., Syrjnen S. Cytomegalovirus (CMV) and Helicobacter pylori (HP) found in oral mucosal ulcers//J.Oral Pathol. Med. 1995. №1. Р. 14-17.
- Luo B., Wang Y., Wang X.F. et al. Correlation of Epstein-Barr virus and its encoded proteins with Helicobacter pylori and expression of c-met and c-myc in gastric carcinoma//World J Gastroenterol. 2006. № 12. Р. 1842-8.
- Stratman E. Visceral zoster as the presenting feature of disseminated herpes zoster//J Am Acad Dermatol. 2002. № 46 (5). Р. 771-4.
- Halme L., Arola J., H^kerstedt К., Lautenschlager I. Human herpesvirus 6 infection of the gastroduodenal mucosa//Clin Infect Dis. 2008. №46 (3). Р. 434-9.
- Kowalski M. Helicobacter pylori (H. pylori) infection in coronary artery disease: influence of H. pylori eradication on coronary artery lumen after percutaneous transluminal coronary angioplasty. The detection of H. pylori specific DNA in human coronary atherosclerotic plaque//J. Physiol. Pharmacol. 2001.№ 52 (1). Р. 3-31.


